Журнал "Медицинский совет" №17/2021
DOI: 10.21518/2079-701X-2021-17-272-281
И.Л. Никитина, А.М. Тодиева, А.С. Лискина
А.О. Плаксина, Н.А. Петрова, И.А. Леонова
Е.К. Кудряшова, А.А. Костарева, Ю.И. Васильева
Национальный медицинский исследовательский центр имени В.А. Алмазова; 197371, Россия, Санкт-Петербург, ул. Аккуратова, д. 2
Введение. Гиперинсулинемические гипогликемии у детей наиболее часто обусловлены врожденным гиперинсулинизмом. В случаях когда гиперинсулинемия сопровождается гипогликемиями натощак и гипергликемиями постпрандиально, следует заподозрить редкие синдромы врожденной инсулинорезистентности, к которым относится синдром Рабсона – Менденхолла. В статье проведен аналитический обзор современных данных об этой редкой генетической патологии, а также представлен клинический случай ранее неописанного сочетания синдрома Рабсона – Менденхолла с мутациями в гене рецептора инсулина INSR в компаунд-гетерозиготном состоянии с множественными врожденными аномалиями других органов.
Клинический случай. Пациент Н., мальчик, возраст 5,5 мес., с подозрением на врожденный гиперинсулинизм в связи с эпизодами частых тяжелых гипогликемий начиная с первых суток жизни. В возрасте 5 мес. на приеме у детского эндокринолога зарегистрирован эпизод гипогликемии до 2,2 ммоль/л. Назначено обследование, при котором установлено, что на фоне снижения глюкозы крови до 1,9 ммоль/л уровень С-пептида >5000 нг/мл, уровень инсулина >300 МЕ/л, кортизол – 971 нмоль/л, ТТГ –3,88 мкМЕ/мл, Т4св – 10,53 пмоль/л (10–23,2).
Сделан акцент на важности ранней диагностики врожденной инсулинорезистентности для предупреждения нарушений развития у детей. Отдельного внимания в данном клиническом случае требовал вопрос организации многократного эффективного мониторинга гликемии у пациента. Из-за особенностей метаболизма у детей раннего возраста отказались от систем флеш-мониторинга глюкозы, а применяли в качестве надежного средства контроля гликемии современный глюкометр с программой интегрирования с мобильным приложением и возможностью формирования отчетов для последующего анализа.
Выводы. На основании полученных результатов генетического исследования в ассоциации с клиническим фенотипом, возрастом дебюта пациенту был установлен клинический диагноз «синдром Рабсона – Менденхолла».
Обсуждение. Парадоксальный характер колебаний гликемии (тяжелые гипогликемии натощак и диабетические гипергликемии прандиально) является достаточно типичным для синдрома врожденной инсулинорезистентности и должен обязательно обращать внимание осведомленного врача первичного звена.
Заключение. Необходимо внимательное отношение к симптомам гипогликемии, особенно с дебютом в периоде новорожденности, повторяющимся эпизодам, выраженности снижения уровня гликемии крови. В случае определения нормального или повышенного уровня инсулина и С-пептида на фоне гипогликемии в первую очередь следует думать о врожденном гиперинсулинизме.
Для цитирования: Никитина И.Л., Тодиева А.М., Лискина А.С., Плаксина А.О., Петрова Н.А., Леонова И.А., Кудряшова Е.К., Костарева А.А., Васильева Ю.И. Врожденная резистентность к инсулину в практике педиатра и детского эндокринолога – путь к диагнозу. Медицинский совет. 2021;(17):272–281. https://doi.org/10.21518/2079-701X-2021-17-272-281.
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Congenital insulin resistance in the practice of the pediatrician and pediatric endocrinologist – path to diagnosis
Irina L. Nikitina, Anastasia М. Todieva, Anastasia S. Liskina
Аnna О. Plaksina, Natalya А. Petrova, Irina А. Leonova
Еlena К. Kudryashova, Аnna А. Kostareva, Julia I. Vasilyeva
Almazov National Medical Research Center; 2, Akkuratov St., St Petersburg, 197341, Russia
Introduction. Hyperinsulinemic hypoglycemia in children is most commonly due to congenital hyperinsulinism. When hyperinsulinemia is accompanied by fasting hypoglycemia and postprandial hyperglycemia, rare syndromes of severe insulin resistance, which include Rabson – Mendenhall syndrome, should be suspected. This article provides an analytical review of current data on this rare genetic pathology and presents a clinical case of a previously undescribed combination of Rabson-Mendenhall syndrome with mutations in the insulin receptor gene INSR in the compound heterozygous state with multiple congenital anomalies of other organs.
Clinical case. Patient N, 5.5 months old boy, with suspected congenital hyperinsulinism due to episodes of frequent severe hypoglycemia from the first day of life. At the age of 5 months, an episode of hypoglycemia up to 2.2 mmol/L was registered at an appointment with a pediatric endocrinologist. An examination was ordered, which found that against a background decrease in blood glucose to 1.9 mmol/L, C-Peptide level >5000 ng/mL, insulin level >300 IU/mL, cortisol – 971 nmol/L, TSH -3.88 mIU/L, free T4 – 10.53 pmol/L (10–23.2).
The importance of early diagnosis of severe insulin resistance to prevent developmental disorders in children is emphasized. The issue of organizing multiple effective monitoring of a patient’s glycemia required special attention in this clinical case. Due to the features of metabolism in young children, we abandoned flash glucose monitoring systems and used a modern glucose meter with an integration program with a mobile application and the ability to generate reports for subsequent analysis as a reliable means of glycemic control.
Summary. Based on the results of the genetic study in association with the clinical phenotype, age of debut, the patient was clinically diagnosed with Rabson-Mendenhall syndrome.
Discussion. The paradoxical nature of glycemic fluctuations (severe fasting hypoglycemia and postprandial diabetic hyperglycemia) is quite typical for syndromes of severe insulin resistance and should draw the attention of an informed primary care physician.
Conclusion. Careful attention to the symptoms of hypoglycemia, especially with a debut in the neonatal period, recurrent episodes, and the severity of the decrease in blood glycemia. If normal or elevated levels of insulin and C-peptide are detected against the background of hypoglycemia, the first thing to think about is congenital hyperinsulinism.
For citation: Nikitina I.L., Todieva A.M., Liskina A.S., Plaksina A.O., Petrova N.A., Leonova I.A., Kudryashova E.K., Kostareva A.A., Vasilyeva Ju.I. Congenital insulin resistance in the practice of the pediatrician and pediatric endocrinologist – path to diagnosis. Meditsinskiy sovet = Medical Council. 2021;(17):272–281. (In Russ.) https://doi.org/10.21518/2079-701X-2021-17-272-281.
Conflict of interest: the authors declare no conflict of interest.
Введение
Болезни, связанные с врожденными нарушениями секреции инсулина и чувствительности к нему, можно отнести к числу редчайшей орфанной патологии, угрожающей жизни и ментальному здоровью вследствие эпизодов тяжелой гипогликемии, сокращающей продолжительность жизни из-за гипергликемических микрои макроангиопатий. В настоящее время достаточно хорошо отработана диагностика сахарного диабета у детей как заболевания, характеризующегося гипергликемией на фоне снижения секреции инсулина. Совершенствуется диагностика врожденного гиперинсулинизма как заболевания, характеризующегося тяжелыми гипогликемиями на фоне нормальной или повышенной секреции инсулина. Однако клинические ситуации, в которых у пациентов, чаще младенческого возраста, регистрируются как тяжелые гипогликемии, так и гипергликемии, сопровождающиеся выраженной гиперинсулинемией, часто с поражениями других органов и систем, маскирующими метаболические нарушения, могут оказаться сложными для своевременной диагностики и тем самым повлиять на качество оказания помощи, носящей у большинства пациентов ургентный характер. Учитывая редкость синдромов врожденной резистентности к инсулину, разнообразие клинических проявлений, особенности лечения и диспансерного наблюдения, представляется полезным обсуждение круга вопросов, касающихся современных представлений об этой патологии, месте ее в практике детского врача амбулаторного звена и стационара, а также возможность поделиться собственным опытом в данной области.
Согласно классификации, предлагаемой в последней версии рекомендаций Международного общества сахарного диабета у детей и подростков (ISPAD, 2018), синдромы тяжелой врожденной инсулинорезистентности представлены тремя основными группами: связанные с нарушением инсулинового сигналинга вследствие мутаций в гене рецептора инсулина (INSR); связанные с нарушением развития жировой ткани (моногенное ожирение и врожденная парциальная или тотальная липодистрофия), а также группой генетических синдромов (синдромы Альстрема, Барде – Бидля и др.) (табл. 1) [1].
Таблица 1. Классификация синдромов тяжелой врожденной инсулинорезистентности [1]
| Первичные нарушения инсулинового сигналинга | Рецепторный дефект | INSR (AД/AР)* | Снижен | Нормальный или повышен | Нет дислипидемии и стеатоза печени |
| Пострецепторный дефект | AKT2, TBC1D4 (АД) | Повышение триглицеридов натощак, ЛПНП**, стеатоз печени, диабет | |||
| Нарушения развития жировой ткани | Моногенное ожирение | MC4R (АД) LEP, LEPR, POMC (AР), другие | Повышен (снижен при LEP) | Высокорослость (MC4R) Гипогонадизм (LEP) Гипокортицизм (POMC) | |
| Врожденная тотальная липодистрофия | AGPAT2, BSCL2 (AР), другие | Снижен | Снижен | Тяжелая дислипидемия (высокие триглицериды, снижены ЛПВП***, стеатоз печени | |
| Парциальная врожденная липодистрофия | LMNA, PPARG, PIK3R1 (AД), другие | Варьирует | Миопатия, кардиомиопатия (LMNA) Псевдоакромегалия (PPARG) SHORT-синдром, диабет (PIK3R1) |
* АД – аутосомно-доминантный; АР – аутосомно-рецессивный тип наследования; ** ЛПНП – липопротеиды низкой плотности; *** ЛПВП – липопротеиды высокой плотности.
В группе врожденных нарушений инсулинового сигналинга вследствие мутаций в гене INSR, в свою очередь, выделяют три клинических варианта: инсулинорезистентность типа А, лепречаунизм (синдром Донохью) и синдром Рабсона – Менденхолла. Инсулинорезистентность типа А диагностируется у девочек-подростков без ожирения, с выраженным acantosis nigricans (черным акантозом), гиперандрогенией, синдромом поликистозных яичников, наследуется как аутосомно-доминантно, так и аутосомно-рецессивно. Лепречаунизм и синдром Рабсона – Менденхолла возникают вследствие наличия патологических вариантов в обоих аллелях гена INSR и имеют более выраженную клиническую презентацию с развитием жизнеугрожающих состояний вследствие печеночной недостаточности при лепречаунизме, тяжелых гипогликемий натощак и гипергликемий постпрандиально, сопровождающихся задержкой роста и развития, клинических симптомов выраженного гиперинсулинизма – черного акантоза, увеличения мягких тканей, или псевдоакромегалии, гипертрихоза, утолщения и шершавости кожи, получившей название «вельветовой кожи» [1–4]. Несмотря на известные генетические причины, касающиеся нарушения сигналинга в гене рецептора инсулина, при описании немногочисленных клинических наблюдений авторы отмечают большое разнообразие фенотипов. Так, в работе Y. Kuroda et al. 2015 г. описаны 2 случая дебюта гипернсулинемической гипогликемии с дебютом во взрослом возрасте, что явилось основанием рекомендовать исследование гена INSR в случаях гиперинсулинемической гипогликемии у взрослых при исключении опухолевого генеза (инсулиномы). N. Longo et al. в 1999 г. описали случай внезапной сердечной смерти у ребенка 7 лет с синдромом Рабсона – Менденхолла, который произошел через 3 нед. после лечения по поводу диабетического кетоацидоза. Особенностью случая авторы отметили наличие частых парадоксальных гиперинсулинемических гипогликемий натощак у ребенка с сахарным диабетом вследствие врожденной резистентности к инсулину. Причина смерти не прокомментирована авторами, т.к. аутопсия не проводилась [5]. В публикации Р.А. Атанесян, Л.Я. Климова и др. в 2015 г. дано описание лабильного течения сахарного диабета с эпизодами кетоацидоза у подростка с синдромом Рабсона – Менденхолла, имеющего задержку роста и развития [6]. Одновременно в литературе есть указания, что клинические проявления синдромов врожденной инсулинорезистентности могут быть стертыми или даже отсутствовать, проявляясь в определенных возрастных группах или физиологических состояниях, например, маскируя гестационный сахарный диабет во время беременности у ранее считавшихся здоровыми женщин. Исследователи объясняют это разной экспрессивностью гена INSR, а также различной пенетрантностью проявлений генетической информации в поколениях [1, 2, 7]. Таким образом, следует подчеркнуть, что данная группа врожденных синдромов относится к числу редких даже среди орфанных болезней, которые в силу разнообразия клинических проявлений и недостатка данных длительного наблюдения пациентов могут представлять определенные трудности в диагностике и лечении. Так, синдром Рабсона – Менденхолла был описан в 1956 г. учеными, чьи имена впоследствии были закреплены за данным заболеванием, а частота его окончательно неизвестна [8]. По данным Национальной медицинской библиотеки США 2020 г., распространенность синдрома Рабсона – Менденхолла составляет менее 1 на миллион человек. Небольшое количество клинических случаев было описано в медицинской литературе1. Лечение синдромов врожденной инсулинорезистентности также представляет большую сложность. Характерные нарушения углеводного обмена в виде гипогликемий натощак и гипергликемий постпрандиально обусловливают необходимость немедикаментозной терапии – тщательной коррекции питания и регламентированной физической активности. Что касается медикаментозных вмешательств, то возможности лекарственной терапии ограничены в связи с применением препаратов «off-label» у детей младших возрастных групп, отсутствием регистрации части медикаментов в РФ, а также в целом отсутствием длительного наблюдения за эффективностью и безопасностью рекомендуемых в настоящее время лекарственных средств в терапии врожденной инсулинорезистентности. Среди последних в научной литературе рекомендуются сенситайзеры инсулина (метформин, пиоглитазон). С целью сохранения функционального потенциала бета-клеток в последние годы появились рекомендации применения антагонистов дипептидилпептидазы (ДПП) и некоторых других. Также в качестве экспериментальной терапии есть описания использования препаратов рекомбинантного лептина и инсулиноподобного фактора роста 1 (ИФР-1). Несмотря на регистрацию позитивных эффектов, некоторые авторы рекомендуют применение комбинации препаратов, а не каждого в отдельности, а также предостерегают, что отсутствует длительный период наблюдения за пациентами, что ограничивает возможность окончательной оценки эффективности медикаментозной терапии [1, 9–11].
Таким образом, врожденная инсулинорезистентность может манифестировать в разном возрасте, клинически проявляться разнонаправленными нарушениями углеводного обмена (гипо- и гипергликемиями), способными достигать у некоторых пациентов критических значений, сопровождаться неврологическими и соматическими расстройствами. Данная патология имеет потенциально жизнеугрожающий характер и высокий риск необратимых инвалидизирующих осложнений, что обусловливает важность своевременной диагностики и квалифицированной помощи на всех этапах медицинского сопровождения. Ниже приводится описание клинического случая – ребенка с синдромом Рабсона – Менденхолла с дебютом в раннем возрасте и ассоциацией с другими мультисистемными поражениями.
Клинический случай
Пациент Н., мальчик, был впервые обследован в клинике ФГБУ «НМИЦ им. В.А. Алмазова» в возрасте 5,5 мес. по направлению районного детского эндокринолога, заподозрившего у ребенка врожденный гиперинсулинизм (ВГИ) в связи с эпизодами частых тяжелых гипогликемий. Анамнез жизни: ребенок родился от 1-й беременности, протекавшей на фоне угрозы прерывания на 23/24 нед., гестационного сахарного диабета, ОРВИ в III триместре. Роды срочные, масса при рождении 2 380 г (z-sсore -2,2); длина 49 см (z-sсore -0,47), оценен по шкале АПГАР 8/9 баллов. Естественное вскармливание до 2 мес.
Наследственный анамнез: отец мальчика в возрасте 12 лет был госпитализирован с диагнозом «сахарный диабет», но на фоне старта инсулинотерапии произошло развитие гипогликемической комы. Терапия инсулином была отменена, рекомендована диетотерапия, снижение веса. В настоящее время диеты не придерживается, не имеет избытка веса, гликемию не контролирует.
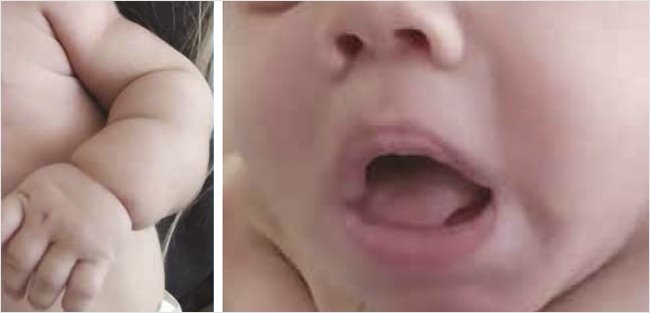
Анамнез заболевания: в первые сутки жизни зарегистрирован эпизод гипогликемии 1,8 ммоль/л, срыгивания «застойным» содержимым желудка, вздутие живота, по поводу чего пациент был переведен в хирургический стационар, где диагноз острой кишечной непроходимости не подтвердился. В течение первых 9 дней жизни проводилась инфузионная терапия раствором глюкозы, был выписан на 21-е сутки жизни. В течение следующих 5 мес. были неоднократно зарегистрированы эпизоды гипогликемии, чаще натощак, а также несколько эпизодов гипергликемии до 14 ммоль/л. В анализах мочи неоднократно определялась микрогематурия, микропротеинурия, глюкозурия, в связи с чем проведено обследование в нефрологическом стационаре. Был выписан с диагнозом: «Дисплазия почек (глюкозурия). Пиелоэктазия справа. ПН0. Асимметрическая гипертрофическая кардиомиопатия с динамической обструкцией». Тогда же была диагностирована умеренная гепатомегалия с повышением уровня трансаминаз в 2–3 раза. После выписки пациент регулярно осматривался специалистами: неврологом, отоларингологом, генетиком. Проведено генетическое обследование: кариотип: 46 XY – нормальный, мужской, исключены лизосомальные болезни накопления (Гоше, Фабри, Ниманна – Пика А/Б, Помпе, Краббе, мукополисахаридоз 1-го типа), синдром Прадера – Вилли, по данным тандемной масс-спектрометрии отчетливой патологии установлено не было. С возраста 1 мес. у пациента отмечалось затрудненное шумное дыхание, что на начальном этапе было расценено как затяжной ринит, аденоидит. Было проведено вирусологическое и бактериологическое исследование, исключен ряд инфекционных заболеваний (цитомегаловирусная инфекция, герпес 1-го и 6-го типов, вирус Эпштейна – Барр и др.). С 4 мес. у пациента стали все более отчетливо проявляться задержка психомоторного развития, диффузная гипотония мышц, задержка темпов физического развития. В возрасте 5 мес. на приеме у детского эндокринолога зарегистрирован эпизод гипогликемии до 2,2 ммоль/л. Назначено обследование, при котором установлено, что на фоне снижения глюкозы крови до 1,9 ммоль/л уровень С-пептида >5000 нг/мл, уровень инсулина >300 МЕ/л, кортизол – 971 нмоль/л, ТТГ – 3,88 мкМЕ/мл, Т4св – 10,53 пмоль/л (10–23,2). С подозрением на ВГИ пациент был направлен на госпитализацию в клинику Центра им. В.А. Алмазова. В клиническом фенотипе при первичном осмотре отмечены задержка физического и психомоторного развития ребенка: вес 5,55 кг (<-3SDS), рост 63 см (-1,35 SDS); мальчик плохо удерживал голову, отмечалась сниженная двигательная активность, диффузная мышечная гипотония, не сидел, эмоциональность снижена. Множественные стигмы дизэмбриогенеза: лицевой диморфизм, грубые черты лица, толстые губы, увеличение языка, запавшее переносье, увеличение расстояния между глазами, широкие ноздри, низко посаженные уши, долихоцефалический череп. Знаки инсулинорезистентности: гипертрихоз, черный акантоз, утолщенная сухая «шершавая» кожа, истончение подкожно-жировой клетчатки; спланхномегалия: гепатоспленомегалия, увеличение мягких тканей лица, кистей и стоп, половых органов (псевдоакромегалия). Нарушение механики дыхания: шумное дыхание, рот полуоткрыт, на вдохе участие вспомогательной мускулатуры, «парадоксальный» тип дыхания, вдох «ступенчатый», ЧДД 38 в мин., дыхание пуэрильное, хрипы проводного характера, во время сна постоянный храп (рис. 1, 2).
Рисунок 1. Синдром Рабсона – Менденхолла. Гипертрихоз. Псевдоакромегалия. Утолщенная кожа
Рисунок 2. Синдром Рабсона – Менденхолла. «Толстые» губы, язык. Широкое переносье. Приоткрытый рот
Проведена дифференциальная диагностика гипогликемии. В пробе с голоданием: гипогликемия – 1,58 ммоль/л, С-пептид – 15,70 ng/ml (0,79–5,19), инсулин – 9122,8 пмоль/л (17,8–173). Уровни других гормонов в норме: кортизол – 177,10 нмоль/л (101 – 535,7), ТТГ – 1,533 мМЕ/л (0,35–4,940), Т4св – 11,2 пмоль/л, СТГ – 1,00 нг/мл (0,09–6,29), в отсутствие кетоза, ацидоза уровень лактата нормальный. Но через 1 ч после еды гипергликемия – 13,2 ммоль/л, С-пептид – 126,82 нг/мл, инсулин – 36266,5 пмоль/л. Проба с глюкагоном – положительная (стимулированный прирост гликемии: 2,4–5,3 ммоль/л). Таким образом, получены данные о высоком уровне инсулина при гипогликемии и его значительном возрастании на фоне прандиальной гипергликемии (рис. 3).
Рисунок 3. Многосуточное мониторирование гликемии (CGMS) до терапии
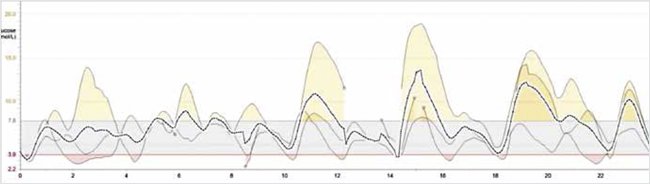
Высокие (до 15–17 ммоль/л) пики гликемии постпрандиально (max через 1 ч после еды). Гипогликемия натощак и через 1,5–2,5 ч после еды
High (up to 15-17 mmol/l) postprandial glycemic peaks (max 1 h after a meal). Hypoglycemia on an empty stomach and 1.5-2.5 hours after a meal
Диагноз «ВГИ» был подвергнут сомнению, и проведена проба с одномоментным определением уровня гликемии, инсулина, С-пептида. Констатирована постоянная гиперинсулинемия, которая имела тенденцию к нарастанию на фоне прандиальной нагрузки с последующей рикошетной гипогликемией. Максимальный уровень инсулина был зарегистрирован при максимальном подъеме гликемии (табл. 2).
Таблица 2. Проба с одномоментным определением уровня гликемии, инсулина, С-пептида
| 0 (натощак) | 1,34 | 1171 | 2,57 |
| Кормление | Каша + фруктовое пюре 120 г, смесь 40 мл | ||
| 30 мин | 10,45 | 13890 | 45,2 |
| 60 мин | 11,47 | 625 | 38,51 |
| 90 мин | 8,37 | - | 25,9 |
| 120 мин | 4,05 | 6732 | 10,26 |
| 150 мин | 2,31 | - | 4,26 |
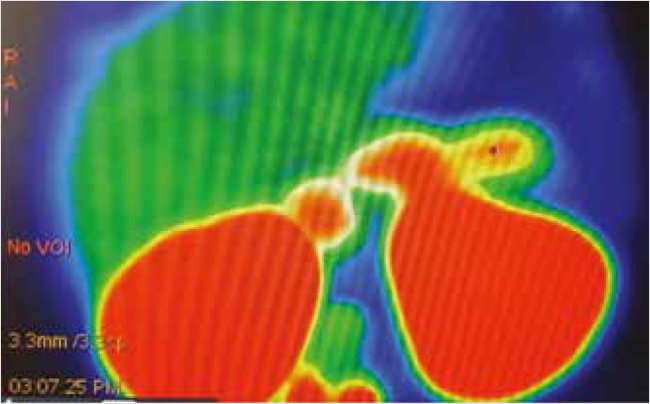
Для оценки функциональнеой активности поджелудочной железы у ребенка с выраженной гиперинсулинемией была проведена позитронно-эмиссионная компьютерная томография (ПЭТ-КТ) с радиофармпрепаратом 18F-DOPA. На серии ПЭТ-томограмм органов брюшной полости и забрюшинного пространства был описан «пятнистый» паттерн гиперфиксации 18F-DOPA в паренхиме железы с областью максимального накопления радиофармпрепарата (РФП) в теле поджелудочной железы и панкреатическим индексом (SUV) на 10-минутном скане, выполненном через 50 мин после инъекции РФП, равным 1,09. Данный вариант захвата РФП свидетельствует о диффузном повышенном накоплении 18F-DOPA бета-клетками поджелудочной железы (рис. 4).
Рисунок 4. ПЭТ-КТ с 18F-DOFA. Архив профессора Д.В. Рыжковой
На основании полученных клинико-лабораторных и инструментальных данных было установлено, что у пациента с клиническими признаками инсулинорезистентности имели место гиперинсулинемические гипогликемии натощак с гипергликемиями, с нарастанием уровня инсулина постпрандиально, что не характерно для ВГИ и, напротив, типично для синдрома врожденной инсулинорезистентности с вторичным гиперинсулинизмом. Методом секвенирования нового поколения (NGS) с применением целевых панелей обогащения на приборе Illumina MiSeq было проведено генетическое исследование генов, ассоциированных с развитием генетически обусловленных заболеваний эндокринной системы, а также с другими наследственными заболеваниями со сходными фенотипическими проявлениями, с последующей верификацией результата секвенированием по Сэнгеру. В исследуемом образце ДНК выявлены варианты нуклеотидной последовательности в гене INSR (chr19:7132201, NM_000208:exon14:c.C2810T:p.T937M) и INSR (chr19:7267652, rs1347473020, NM_000208:exon2:c. C356T:p.A119V) в компаунд-гетерозиготном состоянии. Вариант в гене INSR (chr19:7267652, rs1347473020, NM_000208:exon2:c.C356T:p.A119V) отсутствовал у обоих родителей пациента (de novo-вариант). Данный вариант в соответствии с критериями ACMG рассматривается как вариант с неопределенным значением. Вариант в гене INSR (chr19:7132201, NM_000208:exon14:c.C2810T:p. T937M) в гетерозиготном состоянии обнаружен также у отца пациента. Данный вариант в гене INSR (chr19:7132201, NM_000208:exon14:c.C2810T:p.T937M), в соответствии с критериями ACMG, рассматривается как вероятно патогенный.
Результаты
Выявленные варианты нуклеотидной последовательности в гене INSR (chr19:7132201, NM_000208:exon14:c. C2810T:p.T937M) и INSR (chr19:7267652, rs1347473020, NM_000208:exon2:c.C356T:p.A119V) в компаунд-гетерозиготном состоянии могут являться вероятной причиной заболевания (рис. 5, 6).
Рисунок 5. Молекулярно-генетическое исследование. Варианты нуклеотидной последовательности в гене рецептора инсулина INSR в компаунд-гетерозиготном состоянии
(исследование проведено д.м.н. А.А. Костаревой)
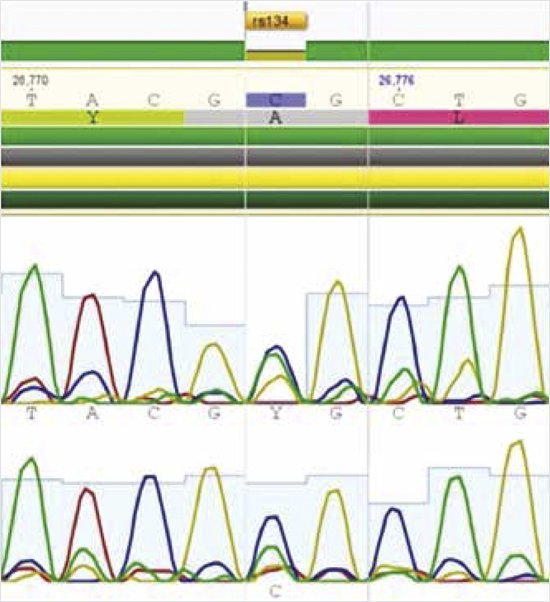
Рисунок 6. Многосуточное мониторирование гликемии (CGMS) на фоне терапии (диета, регламентация режима)
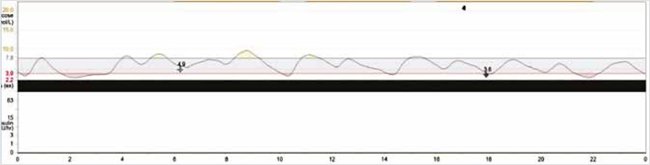
Значительное снижение вариабельности гликемии в течение суток. Снижены пики постпрандиальной гипергликемии. Купированы гипогликемии натощак
Significant decrease in the variability of glycemia during the day. Reduced peaks of postprandial hyperglycemia. Hypoglycemia on an empty stomach is cured
На основании полученных результатов генетического исследования в ассоциации с клиническим фенотипом, возрастом дебюта пациенту был установлен клинический диагноз «синдром Рабсона – Менденхолла». В дальнейшем пациент еще дважды был госпитализирован в клинику Центра им. В.А. Алмазова, где наблюдается до настоящего момента (возраст 1 год). В тактике, с учетом возраста пациента, была назначена немедикаментозная терапия. Основываясь на частом мониторинге гликемии, проведена коррекция диеты. Было рекомендовано избегать продуктов с высоким гликемическим индексом. Ребенок переведен на протертый стол, введены последовательно прикормы. Рекомендованы частые приемы пищи (через 2–2,5 ч); в ночные часы введен кисель с крахмалом. Через 40–60 мин после приема пищи – контроль гликемии, при тенденции к снижению после «пика» гипергликемии – прием углеводов для купирования гипогликемии. Результат: достигнута целевая гликемия 4,0–8,0 ммоль/л (рис. 7).
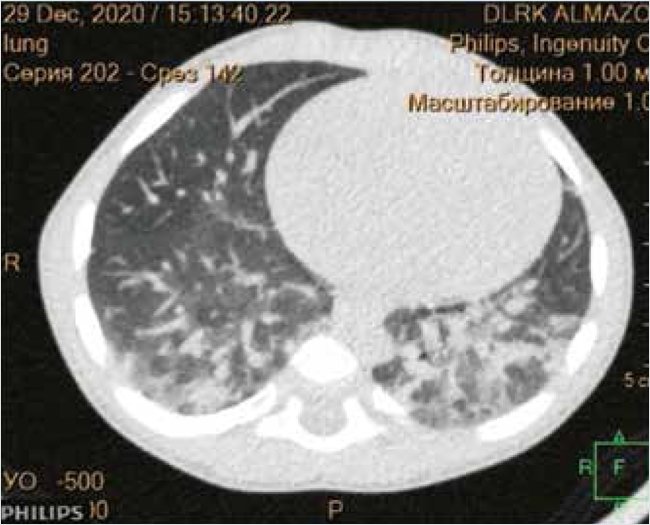
Рисунок 7. Компьютерная томография легких. Артериальная фаза контрастирования (исследование проведено заврентгенологическим отделением ДЛРК Центра В.А. Алмазова А.Ю. Скрипником)
Отдельного внимания в данном клиническом случае требовал вопрос организации многократного эффективного мониторинга гликемии у пациента. Это связано с тем, что, с одной стороны, требовались частые и точные измерения сахара крови, а с другой – применение классической системы непрерывного многосуточного мониторирования гликемии (НМГ) не было достаточно эффективным и информативным. Известно, что системы НМГ, или CGM, предназначены в первую очередь для определения глюкозы у больных сахарным диабетом. Это означает, что порог принятия данных значительно высок для гипергликемии и существенно ограничен в отношении гипогликемических состояний, когда уровень глюкозы ниже 2,2 ммоль/л практически не определяется. Именно это ограничивает применение данных систем у пациентов с частыми и тяжелыми гипогликемиями, что имело место у нашего пациента. Использование же современных систем флэшмониторинга глюкозы (ФМГ) рекомендуется использовать с возраста 4 лет, что связано с особенностями метаболизма у детей раннего возраста. Описанные причины явились основанием для рекомендации глюкометра в качестве надежного средства контроля гликемии. Мы рекомендовали применение глюкометра CONTOUR PLUS ONE, основываясь на ряде его характеристик и прежде всего точности прибора, соответствующего требованиям действующего международного стандарта ISO 15197:2013 [12]. Интегрирование с мобильным приложением Contour Diabetes (Контур Диабитис) дает возможность формирования отчетов для последующего анализа, т. к. в приложении и связанном с ним «облаке» сохраняется неограниченное количество результатов измерений, а также дополнительная информация по питанию, физической нагрузке, лекарственным препаратам. Кроме этого, важна функция «Второй шанс», которая позволяет провести повторное измерение уровня глюкозы в течение 1 мин при недостаточности предыдущего образца крови, не меняя тест-полоску. А световая индикация, отображающая диапазон уровня глюкозы, своевременно предупреждает о показателях: выше или ниже целевого значения (желтая и красная подсветка).
Удобство, точность и простота использования глюкометра CONTOUR PLUS ONE позволили проводить анализ уровня глюкозы в разное время суток и принимать решения о диетической коррекции нецелевых значений гликемии.
Таким образом, в итоге проведенного обследования была установлена причина тяжелых нарушений углеводного обмена и осуществлена их коррекция. Однако с раннего возраста у пациента имели место симптомы поражения других органов и систем, требовавшие специализированной оценки. Наибольшее беспокойство вызывали нарушения дыхания, длительное время оцениваемые как следствие затяжного воспалительного процесса верхних дыхательных путей. Однако при первой же встрече с пациентом стала очевидной необходимость углубленного обследования в данном направлении. Родители отмечали шумное дыхание, громкий, постоянный храп во время сна. Сон прерывистый; ребенок засыпал быстро, ночью через 2–3 ч сна бодрствовал около 3 ч, затем вновь засыпал. При осмотре во время сна: ротовое дыхание, постоянный храп, парадоксальный тип дыхания, западение надключичной ямки на вдохе. Вынужденное положение с запрокидыванием головы. Аускультативно выслушивалось пуэрильное дыхание над всеми легочными полями, хрипы проводного характера, ЧДД 36 в мин. Пульсоксиметрия: SpO2 во сне 75–85% (до 65%). ЧСС 130–150 в мин. При обследовании органов дыхания по данным кардиореспираторного скринингового исследования был выявлен синдром обструктивного апноэ/гипопноэ тяжелой степени (средняя SpO2 81,8%, минимальная – 65%). По результату бронхоскопии: ларинготрахеомаляция, нарушение строения хрящевого каркаса бронхиального дерева, при вдохе спадение надгортанника и черпаловидных хрящей, значительно перекрывая просвет, в трахее не визуализируются хрящевые кольца, просвет на 1/3 спадается. По результату компьтерной томографии (КТ) визуализировались множественные ателектазы в обоих легких, а также КТ-признаки интерстициальных изменений в легких. Таким образом, у пациента была диагностирована врожденная аномалия дыхательных путей – ларинготрахеомаляция, в связи с чем запланировано хирургическое лечение в специализированном лор-стационаре. Ребенку был проведен подбор респираторной поддержки, включая режим nCPAP, однако в результате, в связи с низкой адаптацией к лицевой маске, было рекомендовано проведение оксигенации во время сна через неплотную лицевую маску малым потоком, на этом фоне достигнуты значения SpO2 в пределах 90–95%, единичные эпизоды десатурации купировались позиционными изменениями.
Что касается обследования других систем, то с целью исключения пороков развития мочеполовой системы проведена внутривенная урография, по результатам которой был подтвержден ранее установленный диагноз дисплазии почек. За время наблюдения на фоне достижения целевой гликемии мочевой синдром и синдром цитолиза купированы.
Учитывая ассиметрическую гипертрофическую кардиомиопатию, выявленную в возрасте 3 мес., пациенту проводилась динамическая оценка анатомо-функциональных параметров сердечно-сосудистой системы. По данным ЭхоКГ за период наблюдения до 1 года – без отрицательной динамики: в возрасте 11 мес. регистрировался максимальный размер межжелудочковой перегородки – 6,9–7,3 мм (z-score 3,35), нижний базальный сегмент – 5,7 мм (z-score 1,76), ускорение кровотока на клапане легочной артерии до 1,7 м/с; при контроле в 1 год – размер межжелудочковой перегородки – 6,7 мм, нижний базальный сегмент – 5 мм (z-score 2,8). Пациент консультирован кардиологом, решение вопроса о терапии β-блокаторами отложено до нормализации функции дыхания. В целом, учитывая позитивную динамику гипертрофии миокарда и обратное развитие динамической обструкции выходного тракта левого желудочка, изменения в миокарде расценены как следствие выраженного гиперинсулинизма в период декомпенсации углеводного обмена.
В целом, анализируя результаты проведенного лечения, к возрасту 1 года было достигнуто следующее. Гликемия в течение суток колебалась в пределах целевого диапазона 4,0–8,0 ммоль/л; на фоне позиционного контроля, пульсоксиметрии, ингаляций бронхолитиков и топических глюкокортикостероидов (ГКС) достигнут контроль десатурации во время сна, SpO2 > 94%. Динамика развития: вес 7 300 г, рост 70 см. Повысилась двигательная активность. Сидит, стоит в кровати, активно двигается. Эмоциональный фон позитивный. Больше бодрствует днем, не просыпается ночью. Купированы мочевой синдром, синдром цитолиза, отмечено обратное развитие функциональной динамической обструкции левого желудочка сердца.
Обсуждение
Анализируя представленное клиническое наблюдение, следует отметить чрезвычайно ранний, с периода новорожденности, дебют мультиорганной врожденной патологии, в клинической презентации которой по крайней мере две группы расстройств – метаболические и гипоксические – носили жизнеугрожающий характер и оставались недооцененными с этой точки зрения в течение первых месяцев жизни, несмотря на регулярность медицинского наблюдения. Парадоксальный характер колебаний гликемии (тяжелые гипогликемии натощак и диабетические гипергликемии прандиально) является достаточно типичным для синдрома врожденной инсулинорезистентности и должен обязательно обращать внимание осведомленного врача первичного звена. Причины метаболических нарушений при данных синдромах остаются недостаточно ясными. Предполагается связь с изменениями лиганд-рецепторных взаимодействий в инсулиновом рецепторе INSR в условиях критически высокого гиперинсулинизма. INSR относится к группе трансмембранных тирозинфосфокиназных рецепторов, имеющих в качестве лигандов инсулин и инсулиноподобные факторы роста 1, 2 (ИФР-1, ИФР-2). В физиологических условиях лиганд связывается с α-цепями эктодомена INSR, приводя к структурным изменениям в рецепторе, аутофосфорилированию во внутриклеточном домене β-цепи, активации тирозинкиназ и внутриклеточных субстратов для действия инсулина (IRS-1, IRS-2,3,4), обеспечивающего трансмембранный транспорт глюкозы посредством транспортного белка GLUD-4 [5]. Обе субъединицы INSR кодируются одним геном, локализованным на коротком плече 19-й хромосомы. Инактивирующие мутации гена INSR ведут к нарушению функции рецептора, гипергликемии и гиперинсулинемии, клинически проявляющимся сахарным диабетом. Однако, согласно гипотезе Y. Kuroda et al. в 2015 г., изучивших функцию INSR у пациентов с врожденной инсулинорезистентностью, при очень высоком уровне инсулина β-субъединица способна «ускользнуть» от редукции аутофосфорилирования и связаться с лигандом – инсулином, что приводит к частичному восстановлению функции рецептора и, учитывая значимо повышенный уровень инсулина, ведет к развитию тяжелой гипогликемии [2]. N. Longo et al. в 1999 г. в качестве причин кетоацидоза и гипогликемии при синдроме Рабсона – Менденхолла рассматривали быстрое истощение депо гликогена в печени при выраженной инсулинорезистентности [5].
Возвращаясь к приведенному выше клиническому наблюдению пациента с синдромом Рабсона – Менденхолла, следует отметить, что у пациента имело место сочетание с другими мультисистемными поражениями – ларинготрахеомаляцией, ренальной дисплазией, поражением сердечно-сосудистой системы, которые ранее не были описаны в научной литературе в ассоциации с данным синдромом.
Заключение
Необходимо еще раз сделать акцент на важности внимательного отношения к симптомам гипогликемии, особенно с дебютом в периоде новорожденности, повторяющимся эпизодам, выраженности снижения уровня гликемии крови. В случае определения нормального или повышенного уровня инсулина и С-пептида на фоне гипогликемии в первую очередь следует думать о врожденном гиперинсулинизме. Однако клинические симптомы инсулинорезистентности (черный акантоз, увеличение мягких тканей по типу псевдоакромегалии, гипертрихоз, «вельветовая» кожа, спланхномегалия), наряду с гипергликемическими эпизодами на фоне приемов пищи, являются основанием для включения в дифференциальный ряд синдромов врожденной инсулинорезистентности, которые, несмотря на редкость, в случае поздней диагностики ведут к метаболическому поражению мозга, необратимой задержке развития и даже, при критической гипогликемии, могут носить жизнеугрожающий характер. В то же время своевременная корректная диагностика и персонифицированная относительно каждого пациента тактика оказания помощи ведет к стабилизации состояния метаболизма и предупреждает инвалидизирующие осложнения, о чем должны знать и помнить врачи, осуществляющие первую линию диагностики редких болезней, – педиатры и детские эндокринологи.
1 Rabson-Mendenhall syndrome. U.S. National Library of Medicine. Available at: https://medlineplus.gov/.
Список литературы / References
- Hattersley A.T., Greeley S.A.W., Polak M., Rubio-Cabezas O., Njølstad P.R., Mlynarski W. et al. ISPAD Clinical Practice Consensus Guidelines 2018: The diagnosis and management of monogenic diabetes in children and adolescents. Pediatr Diabetes. 2018;19(27):47–63. doi: 10.1111/pedi.12772.
- Kuroda Y., Iwahashi H., Mineo I., Fukui K., Fukuhara A., Iwamoto R. et al. Hyperinsulinemic hypoglycemia syndrome associated with mutations in the human insulin receptor gene: Report of two cases. Endocr J. 2015;62(4):353–362. doi: 10.1507/endocrj.EJ14-0547.
- Højlund K., Hansen T., Lajer M., Henriksen J.E., Levin K., Lindholm J. et al. A novel syndrome of autosomal-dominant hyperinsulinemic hypoglycemia linked to a mutation in the human insulin receptor gene. Diabetes. 2004;53(6):1592–1598. doi: 10.2337/diabetes.53.6.1592.
- Huang Z., Li Y., Tang T., Xu W., Liao Z., Yao B. et al. Hyperinsulinaemic hypoglycaemia associated with a heterozygous missense mutation of R1174W in the insulin receptor (IR) gene. Clin Endocrinol. 2009;71(5):659–665. doi: 10.1111/j.1365-2265.2009.03525.x.
- Longo N., Wang Y., Pasquali M. Progressive Decline in Insulin Levels in Rabson-Mendenhall Syndrome. J Clin Endocrinol Metab. 1999;84(8):2623–2630. doi: 10.1210/jcem.84.8.5902.
- Атанесян Р.А., Климов Л.Я., Вдовина Т.М., Углова Т.А., Курьянинова В.А., Алавердян Л.С. и др. Случай синдрома Рабсона – Менденхолла у ребенка 13 лет. Сахарный диабет. 2015;(1):110–114. doi: 10.14341/DM20151110-114. / Atanesyan R.A., Klimov L.Ya., Vdovina T.M., Uglova T.A., Kuryaninova V.A., Alaverdyan L.S. et al. Rabson-Mendenhall syndrome in a 13 y.o. child (clinical case). Sakharnyy diabet = Diabetes Mellitus. 2015;18(1):110–114. (In Russ.) doi: 10.14341/DM20151110-114.
- Никитина И.Л., Конопля И.С., Полянская А.А., Лискина А.С., Попова П.В. Характеристика физического и психомоторного развития детей, рожденных от матерей с гестационным сахарным диабетом. Медицинский cовет. 2017;(9):14–20. doi: 10.21518/2079-701X-2017-9-14-20. / Nikitina I.L., Konoplya I.S., Polyanskaya A.A., Liskina A.S., Popova P.V. Characterization of psychological and physical development in children of gestation diabetes pregnancies. Meditsinskiy sovet = Medical Council. 2017;(9):14–20. (In Russ.) doi: 10.21518/2079-701X-2017-9-14-20.
- Rabson S.M., Mendenhall E.N. Familial hypertrophy of pineal body, hyperplasia of adrenal cortex and diabetes mellitus; report of 3 cases. Am J Clin Pathol. 1956;26(3):283–290. doi: 10.1093/ajcp/26.3.283.
- Moreira R.O., Zagury R.L., Nascimento T.S., Zagury L. Multidrug therapy in a patient with Rabson–Mendenhall syndrome. Diabetologia. 2010;53(11):2454–2455. doi: 10.1007/s00125-010-1879-5.
- Regan F.M., Williams R.M., McDonald A., Umpleby A.M., Acerini C.L., O’Rahilly S. et al. Treatment with recombinant human insulin-like growth factor (rhIGF)-I/rhIGF binding protein-3 complex improves metabolic control in subjects with severe insulin resistance. J Clin Endocrinol Metab. 2010;95(5):2113–2122. doi: 10.1210/jc.2009-2088.
- Carmody D., Ladsaria S.S., Buikema R.K., Semple R.K., Greeley S.A. Successful rhIGF1 treatment for over 5 years in a patient with severe insulin resistance due to homozygous insulin receptor mutation. Diabet Med. 2016;33(3):e8–e12. doi: 10.1111/dme.12884.
- Bailey T.S., Wallace J.F., Pardo S., Warchal-Windham M.E., Harrison B., Morin R., Christiansen M. Accuracy and User Performance Evaluation of a New, Wireless-Enabled
Blood Glucose Monitoring System that Links to a Smart Mobile Device. J Diabetes Sci Technol. 2017;11(4):736–743. doi: 10.1177/1932296816680829.



 1
1 2
2 3
3 4
4


Комментарии (0)