Журнал "Стационарозамещающие технологии: Амбулаторная хирургия" №3–4/2020
DOI: 10.21518/1995-1477-2020-3-4-95-100
М.В. Абрицова, ORCID: 0000-0001-7393-5817, Н.Р. Торчуа, ORCID: 0000-0002-5834-8873
Клиника «Первая хирургия»; 123182, Россия, Москва, ул. Щукинская, д. 2
Анальная трещина занимает одно из ведущих мест в структуре болезней прямой кишки, заболеваемость составляет 20–23 случая на 1 тыс. человек взрослого населения. Большинство острых анальных трещин заживают спонтанно, но часть может переходить в хроническое течение, для которого характерно наличие двух из ниже приведенных критериев: боль после дефекации, длящаяся более 3 мес., наличие сторожевого бугорка, обнажение волокон внутреннего сфинктера в дне дефекта анодермы.
Ведущим патогенетическим механизмом в развитии хронической анальной трещины является спазм внутреннего сфинктера, который приводит к нарушению кровоснабжения анодермы и появлению длительно не заживающего дефекта. Таким образом, методики лечения анальной трещины должны в первую очередь быть направлены на ликвидацию спазма внутреннего сфинктера, а затем на устранение уже собственно дефекта анодермы.
В настоящее время все большую популярность набирает использование ботулотоксина типа А в лечении хронических анальных трещин в качестве неинвазивного метода ликвидации спазма внутреннего сфинктера. Исследования ботулотоксина в качестве лекарственного средства начались с конца 1960-х гг. Спустя более чем 40 лет клиническая сфера применения ботулотоксина типа А широка и ежегодно регистрируются новые показания для применения данного препарата, в т. ч. и для лечения проктологических заболеваний.
Ботулотоксин способствует релаксации внутреннего сфинктера, и за счет этого создаются оптимальные условия для заживления хронической трещины. При этом его введение не сопряжено с серьезными осложнениями, а явления инконтиненции носят транзиторный характер.
В данном обзоре представлен опыт применения ботулотоксина типа А в лечении хронической анальной трещины.
Для цитирования: Абрицова М.В., Торчуа Н.Р. Применение ботулотоксина типа А в терапии хронической анальной трещины. Амбулаторная хирургия. 2020;(3-4):95-100. https://doi.org/10.21518/1995-1477-2020-3-4-95-100
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Botulinum toxin type A injections for treatment of chronic anal fissures
Mariana V. Abritsova, ORCID: 0000-0001-7393-5817, Nina R. Torchua, ORCID: 0000-0002-5834-8873
Clinic “First Surgery”; 2, Schukinskaya St., Moscow, 123182, Russia
An anal fissure is one of the most common diseases of the anal canal with the incident rate of 20–23 cases per 1000 citizens. Most of acute anal fissures are healed spontaneously but a few of them can become chronic process. Chronic anal fissures are characterized by any two of the criteria: pain after defecation lasts longer than 3 months, sentinel pile is present, fibers of internal sphincter at the base of the anoderm.
The spasm of the internal sphincter is a guiding pathogenetic mechanism in the development of chronic anal fissures. It leads to circulatory disorder in the anoderm and non-healing wounds. Therefore, the treatment of anal fissures primarily must be focus on eliminating of internal sphincter spasms and then excising of fissures. Recently, botulinum toxin type A injection in treatment of chronic anal fissures has become popular as a noninvasive method of eliminating internal sphincter spasms.
Botulinum toxin as a medical agent has been studied since the late 1960s. Botulinum toxin type A has been used to treat of various pathologies including coloproctology diseases for more than 40 years. The botulinum toxin injections make the internal sphincter relax, and as a result create optimal conditions for healing chronic anal fissures.
Using of botulinum toxin type A does not cause dangerous complication. Fecal incontinence after using botulinum toxin is transitory. The review describes the use of botulinum toxin type A injections to treat chronic anal fissures.
For citation: Abritsova M.V., Torchua N.R. Botulinum toxin type A injections for treatment of chronic anal fissures. Ambulatornaya khirurgiya = Ambulatory Surgery (Russia). 2020;(3-4):95-100. (In Russ.) https://doi.org/10.21518/1995-1477-2020-3-4-95-100
Conflict of interest: the authors declare no conflict of interest.
Введение
В настоящее время, как и десятилетия назад, анальная трещина занимает одно из ведущих мест в структуре болезней прямой кишки, заболеваемость которой составляет 20–23 случая на 1 тыс. человек взрослого населения [1]. Анальная трещина представляет собой спонтанно возникающий линейный или элипсовидный дефект анодермы анального канала. Главными жалобами пациентов с анальными трещинами являются боль, которая может длиться до нескольких часов после дефекации, и выделение крови из прямой кишки [2]. Большинство острых анальных трещин заживают спонтанно, но часть может переходить в хроническое течение, для которого характерно наличие двух из нижеприведенных критериев: боль после дефекации, длящаяся более 3 мес., наличие сторожевого бугорка, обнажение волокон внутреннего сфинктера в дне дефекта анодермы [2–4]. Ведущим патогенетическим механизмом в развитии хронической анальной трещины является спазм внутреннего сфинктера, который приводит к нарушению кровоснабжения анодермы и появлению длительно не заживающего дефекта [5, 6]. Таким образом, методики лечения анальной трещины должны в первую очередь быть направлены на ликвидацию спазма внутреннего сфинктера, а затем на устранение уже собственно дефекта анодермы. В настоящее время все большую популярность набирает использование ботулотоксина типа А в лечении хронических анальных трещин в качестве неинвазивного метода ликвидации спазма внутреннего сфинктера.
Историческая справка
Немецкий врач Ю. Кернер в своих работах 1817– 1822 гг. систематически описывал случаи отравления, как он называл, «колбасным ядом». Ученый точно описал все желудочно-кишечные и нервно-мышечные симптомы, которые, по данным современной медицины, присуще ботулизму, в частности диарея, рвота, сухость во рту, снижение секреции слезных и потовых желез, атония пищевода, желудка, кишечника и мочевого пузыря, расширение зрачков и паралич аккомодации, птоз, паралич глотки, гортани, дыхательных мышц. Но в ходе своих исследований ему не удалось выделить возбудитель. Тем не менее именно Кернеру принадлежит идея о возможности использования небольших доз токсина в лечебных целях [7].
Через 18 лет после работ Ю. Кернера, в 1895 г., профессор бактериологии университета Гента Эмиль Пьер ван Эрмингем открыл анаэробный микроорганизм Bacillus botulinus, позднее названный Clostridium botulinum. Вопреки распространенному мнению, бактерия получила такое название не в связи со своей формой, а из-за патологической ассоциации с колбасами (латинское обозначение колбасы – botulus). Именно Эрмингему принадлежит открытие токсина, вырабатываемого этим микроорганизмом, – ботулотоксина типа А [8].
В последующем C. Lamanna в 1946 г. впервые выделил токсин типа А в кристаллической форме, а в 1949 г. А. Burgen описал основной механизм его действия, заключающийся в блокаде нейромышечной передачи [9]. В 50-х гг. V. Brooks показал, как это происходит: при введении в гиперактивную мышцу ботулотоксин типа А блокирует высвобождение ацетилхолина из нервных окончаний моторного нейрона, что вызывает расслабление мышцы [10]. Исследования ботулотоксина в качестве лекарственного средства начались с конца 1960-х гг. Первым врачом, применившим его в лечебных целях в 80-х гг. ХХ столетия, был офтальмолог А. Scott при лечении косоглазия и блефароспазма [11].
В настоящий момент, спустя более чем 40 лет после первого использования в лечебных целях, клиническая сфера применения ботулотоксина типа А достаточно широка: гемифациальный спазм, паралитическая форма косоглазия, блефароспазм, спастическая кривошея, тики, детский церебральный паралич, ахалазия кардии, гипергидроз, мигрень и т.д. [12, 13]. Наряду с этим, ежегодно регистрируются новые показания для применения данного препарата.
Ботулотоксин в лечение хронической трещины
Приступая к лечению хронической анальной трещины важно иметь четкое представление о строении запирательного аппарата прямой кишки. По данным Т.С. Одарюк и соавт., запирательный аппарат включает в себя непроизвольный внутренний сфинктер и произвольную наружную часть (рис.) [14, c. 42–43].
Рисунок. Строение стенок аноректум (натуральный препарат аноректум, фронтальный срез)
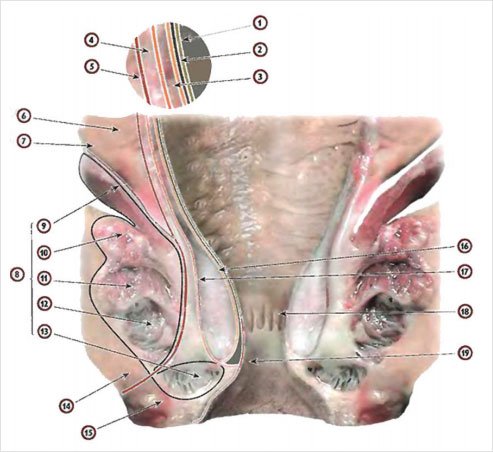
1) слизистая оболочка, 2) подслизистый слой, 3) циркулярный слой мышечной оболочки, 4) продольный слой мышечной оболочки, 5) адвентиция, 6) mesorectum, 7) fascia visceralis, 8) запирательный аппарат прямой кишки, 9) m. levator ani (мышца, поднимающая задний проход), 10) m. puborectalis (пуборектальная мышца), 11) pars profundus m. sphincter am ext. (глубокая часть наружного сфинктера), 12) pars superficialis m. sphincter ani ext. (поверхностная часть наружного сфинктера), 13) pars subcutaneus m sphincter ani ext. (подкожная часть наружного сфинктера), 14) fossa ischioanalis, 15) m. corrugator cutis ani, 16) m. sphincter ani internus (наружный сфинктер), 17) m. longitudinalis, 18) linea pectinata, 19) linea anocutanea [14]
Внутренний сфинктер построен из гладкомышечной ткани и представляет собой усиление циркулярного мышечного слоя дистального отдела прямой кишки в виде бобовидного утолщения длиной 2–3,5 см и толщиной 5–9 мм. Он находится в постоянном тоническом напряжении, реагирует на возрастание внутрибрюшного давления, находится под тормозящим и возбуждающим контролем вегетативной нервной системы, его расслабление не зависит от приходящей перистальтической волны. Наружная часть запирательного аппарата включает: наружный сфинктер (поверхностную, подкожную и глубокую порции), лобково-прямокишечную мышцу и мышцу, поднимающую задний проход. Эти мышцы построены из поперечно-полосатой мышечной ткани и отвечают за обеспечения осознанного контроля за дефекацией. Согласно данным А.М. Шестакова и соавт., замыкающую функцию прямой кишки обеспечивает совокупность мышц: глубокая часть наружного сфинктера, лобково-прямокишечная мышца, продольный слой мышечной оболочки прямой кишки и внутренний сфинктер. В целом сфинктерный аппарат прямой кишки, действуя согласованно, формирует единое мышечное кольцо, удерживающее анальное отверстие в тоническом сжатии, и обеспечивает опорожнение кишки от ее содержимого [15, c. 4–62].
«Золотым стандартом» ликвидации спазма сфинктера при хронической анальной трещине в настоящий момент, считается боковая подкожная сфинктеротомия [16, 17]. У этой методики, согласно данным научной литературы, большое количество неоспоримых достоинств, таких как:
высокая частота заживления послеоперационных ран,
стойкая ликвидация спазма внутреннего сфинктера,
низкая частота рецидивов.
Наряду с преимуществами имеется и весьма существенный недостаток – высокая частота анальной инконтиненции, которая из-за необратимого повреждения внутреннего сфинктера может сохранится на всю жизнь [17, 18].
В связи с этим проводится поиск других методов ликвидации спазма внутреннего сфинктера. Одной из быстро набирающих популярность методик является введение ботулотоксина типа А, который способствует релаксации внутреннего сфинктера и за счет этого создает оптимальные условия для заживления хронической трещины. При этом его введение не сопряжено с серьезными осложнениями, а явления инконтиненции носят транзиторный характер [19].
Несмотря на то что ботулотоксина типа А для лечения хронической анальной трещины применяют уже больше четверти века, у данной метода остается еще много необозначенных моментов [20]. Так, нет четкого понимания, как ботулотоксин воздействует на гладкомышечные волокна, но по имеющимся публикациям его воздействие принципиально не отличается от воздействия на скелетную мускулатуру [21, 22]. В обоих случаях ботулотоксин препятствует экзоцитозу медиаторов в нервных окончаниях. После введения в ткани молекула нейротоксина, состоящая из легкой и тяжелой цепей, связывается со специфическим рецептором на поверхности нервного окончания.
Далее, путем эндоцитоза она проникает внутрь клетки, где находится в полости везикулы. Затем происходит разделение тяжелой и легкой цепей, с выходом легкой цепи в цитозоль клетки, где она гидролизует один из протеинов транспортного комплекса SNARE, предотвращая его образование. В результате этого не происходит экзоцитоза медиатора в синаптическую щель и, как следствие, нарушается сократительная способность мышечных волокон. Но каким бы ни был механизм действия ботулотоксина, в подавляющем большинстве исследований in vivo сообщается о снижении тонуса внутреннего сфинктера.
По данным разных авторов, эффективность лечения хронической анальной трещины при введении ботулинического токсина типа А вариабельна.
В ретроспективном исследовании A. Dat et al. через 3 мес. после введения от 20 до 50 ЕД ботулинического токсина типа A полное заживление хронической анальной трещины наблюдалось у 68/101 (67%) респондента [23].
В проспективном исследовании M. Asim et al. приизолированном введении ботулотоксина во внутренний сфинктер в дозировке 20 ЕД заживление наблюдалось у 12/21 (57%) пациента. По данным систематического обзора E. Yiannakopoulou, частота заживления хронических анальных трещин после введения препаратов ботулотоксина составляет от 32 до 98% [19].
С чем же могут быть связаны такие различия?
Только в России зарегистрировано 6 препаратов, содержащих ботулотоксин типа А:
Ботокс (Ирландия).
Ботулакс (Корея).
Диспорт (Великобритания).
Ксеомин (Германия).
Лантокс (Китай).
Релатокс (Россия).
Миотокс (Россия).
Данные препараты неэквивалентны между собой, они различаются по единицам активности, молекулярной массе и вспомогательным веществам, в связи с этим у них отмечается разное время развития эффекта при введении в мышцу. Также нет крупных сравнительных исследований по эффективности разных препаратов ботулотоксина А. Следовательно, имеющиеся данные только эмпирические.
С другой стороны, не разработаны алгоритмы введения препарата, не обозначены дозировки и нет однозначного понимания, в какие конкретно зоны запирательного аппарата его следует вводить.
В первом опубликованном опыте лечения хронической анальной трещины ботулотоксином типа А было введено 2,5 ЕД Ботокса в наружный сфинктер с двух сторон от трещины. Через 12 нед. трещина полностью зажила, а показатели давления внутреннего сфинктера находились в пределах нормы [20]. В последующих публикациях инъекции ботулотоксина выполнялись в основном во внутренний сфинктер, хотя имеются данные о введении препарата и в наружный сфинктер. При этом стоит отметить, что по результатам опубликованного в 2016 г. A. Bobkiewicz et al. метаанализа не была выявлена разница в скорости заживления хронической анальной трещины в зависимости от места инъекции ботулотоксина типа А [24]. Из тридцати четырех проанализированных исследований в шести публикациях ботулотоксин вводился в наружный сфинктер, в остальных – во внутренний. В четырех исследованиях применялся препарат Диспорт, в остальных – Ботокс, несмотря на существенный разброс в количестве введенных единиц препарата (от 5 до 80 ЕД для Ботокса и от 10 до 150 ЕД для Диспорта), анализ не выявил различий в эффективности лечения и частоте развития осложнений в зависимости от дозы введенного препарата и его торгового названия.
В российских и европейских рекомендациях по лечению хронической анальной трещины упоминается возможность применения ботулотоксина типа А, но данные не конкретизированы: сообщается о введении препарата в дозе от 10 до 100 ЕД с указанием того, что единой точки зрения на локализацию места инъекции и необходимой дозировки нет [25; 26, c. 12–29]. Следует отметить, что в начале 2020 г. были опубликованы непосредственные результаты комплексного лечения хронической анальной трещины с применением ботулотоксина типа А [27]. После иссечения анальной трещины пациентам основной группы выполнялась инъекция ботулинического токсина типа А на 3 и 9 ч условного циферблата по 5 ЕД во внутренний сфинктер. Таким образом, суммарное количество введенных единиц препарата составило 10 ЕД. Пациентам контрольной группы проводилась пневмодивульсия анального сфинктера после иссечения трещины. Контроль функции запирательного аппарата прямой кишки осуществлялся с помощью профилометрии и шкалы Векснера до операции, на 7-е и 60-е сут. после нее. Транзиторное ослабление функции анального сфинктера отметили 3 (10,7%) пациента основной группы и 10 (41%) оперированных в контрольной (p = 0,02). Оценка по шкале Векснера составила 3 после применения ботулотоксина типа А и 2,5 после пневмодивульсии (p = 0,01). Кроме того, было отмечено, что послеоперационная слабость запирательного аппарата напрямую зависит от методики релаксации анального сфинктера. Шансы ее развития у больных, перенесших иссечение анальной трещины с пневмодивульсией, на 30-й день в 11 раз выше, чем после введения ботулотоксина типа А (p = 0,0002), а на 60-й день – в 6 раз (p = 0,015).
Заключение
Использование ботулотоксина типа А позволяет устранить спазм анального сфинктера, что способствует заживлению хронических анальных трещин и не приводит к необратимой инконтиненции в отличие от сфинктеротомии. Применение ботулотоксина оказывает менее выраженное воздействие на функцию анального сфинктера по сравнению с пневмодивульсией. Однако методика медикаментозной релаксации внутреннего сфинктера не стандартизирована и требуется проведение дальнейших исследований с целью повышения эффективности ее применения.
Список литературы / References
- Милитарев Ю.М., Врублевский В.А. Распространенность болезней прямой и ободочной кишок у взрослого населения Москвы. Проблемы проктологии. 1983;(4):6-10.
- Lund J.N., Scholefield J.H. Aetiology and treatment of anal fissure. Br J Surg. 1996;83(10):1335-1344. https://doi.org/10.1002/bjs.1800831006.
- Hall G. Jr., Kann B.R. Anal Fissure. In: Zutshi M. (ed.) Anorectal Disease: Contemporary Management. Springer; 2016, pp. 95-126. Available at: https://springer.com/gp/book/9783319231464.
- Kocher H.M., Steward M., Leather A.J.M., Cullen P.T. Randomized clinical trial assessing the side-effects of glyceryl trinitrate and diltiazem hydrochloride in the treatment of chronic anal fissure. Br J Sur. 2002;89(4):413-417. https://doi.org/10.1046/j.0007-1323.2001.02042.x.
- Jonas M., Scholefield J.H. Anal Fissure. Gastroenterol Clin North Am. 2001;30(1):167-181. https://doi.org/10.1016/s0889-8553(05)70172-2.
- Van Outryve M. Physiopathology of the anal fissure. Acta Chir Belg. 2006;106(5):517-518. https://doi.org/10.1080/00015458.2006.11679942.
- Erbguth F.J. Historical notes on botulism, Clostridium botulinum, botulinum toxin, and the idea of the therapeutic use of the toxin. Mov Disord. 2004;19(S8):2-6. https://doi.org/10.1002/mds.20003.
- Van Ermengem E. Classics in infectious diseases. A new anaerobic bacillus and its relation to botulism. E. van Ermengem. Originally published as “Ueber einen neuen anaëroben Bacillus und seine Beziehungen zum Botulismus” in Zeitschrift für Hygiene und Infektionskrankheiten. 1897;26:1-56. Rev Infect Dis. 1979;1(4):701-719. Available at: https://pubmed.ncbi.nlm.nih.gov/399378
- Burgen A.S.V., Dickens F., Zatman L.J. The action of botulinum toxin on the neuro-muscular junction. J Physiol. 1949;109(1-2):10-24. https://doi.org/10.1113/jphysiol.1949.sp004364.
- Squire L.R. (ed.) The History of Neuroscience in Autobiography. New York: Academic Press; 2001. 592 p.
- Scott A.B. Botulinum toxin injection into extraocular muscles as an alternative to strabismus surgery. Ophthalmology. 1980;87(10):1044-1049. https://doi.org/10.1016/s0161-6420(80)35127-0.
- Stavropoulos S.N., Friedel D., Modayil R., Iqbal S., Grendell J.H. Endoscopic approaches to treatment of achalasia. Therap Adv Gastroenterol. 2013;6(2):115-135. https://doi.org/10.1177/1756283X12468039.
- Safarpour Y., Jabbari B. Botulinum Toxin Treatment of Movement Disorders. Curr Treat Options Neurol. 2018;20(2):4. https://doi.org/10.1007/s11940-018-0488-3.
- Одарюк Т.С., Воробьев Г.И., Шелыгин Ю.А. Хирургия рака прямой кишки. М.: Дедалус; 2005. 256 c. Режим доступа: http://endosurgery.od.ua/uploaded/site317_Odaruk_Hirurgiya_raka_pryamoi_kishki.PDF.
- Шестаков А.М., Сапин М.Р. Прямая кишка и заднепроходный канал. М.: ГЭОТАР-Медиа; 2011. 128 c. Режим доступа: https://medknigaservis.ru/wp-content/uploads/2019/07/Q0116462.pdf.
- Abcarian H. Surgical correction of chronic anal fissure: Results of lateral internal sphincterotomy vs. Fissurectomy - Midline sphincterotomy. Dis Colon Rectum. 1980;23(1):31-36. https://doi.org/10.1007/BF02587197.
- Chen H.L., Woo X.B., Wang H.S., Lin Y.J., Luo H.X., Chen Y.H. et al. Botulinum toxin injection versus lateral internal sphincterotomy for chronic anal fissure: a meta-analysis of randomized control trials. Tech Coloproctol. 2014;18(8):693-698. https://doi.org/10.1007/s10151-014-1121-4.
- Nyam D.C., Pemberton J.H. Long-term results of lateral internal sphincterotomy for chronic anal fissure with particular reference to incidence of fecal incontinence. Dis Colon Rectum. 1999;42(10):1306-1310. https://doi.org/10.1007/BF02234220.
- Yiannakopoulou E. Botulinum toxin and anal fissure: efficacy and safety systematic review. Int J Colorectal Dis. 2012;27(1):1-9. https://doi.org/10.1007/s00384-011-1286-5.
- Jost W.H., Schimrigk K. Use of botulinum toxin in anal fissure. Dis Colon Rectum. 1993;36(10):974. https://doi.org/10.1007/BF02050639.
- W ollina U. Botulinum ToxIn: Non-cosmetic Indications and Possible Mechanisms of Action. J Cutan Aesthet Surg. 2008;1(1):3-6. Available at: https://jcasonline.com/text.asp?2008/1/1/3/41148.
- MacKenzie I., Burnstock G., Dolly J.O. The effects of purified botulinum neurotoxin type A on cholinergic, adrenergic and non-adrenergic, atropine-resistant autonomic neuromuscular transmission. Neuroscience. 1982;7(4):997-1006. https://doi.org/10.1016/0306-4522(82)90056-2.
- Dat A., Chin M., Skinner S., Farmer C., Wale R., Carne P. et al. Botulinum toxin therapy for chronic anal fissures: where are we at currently? ANZ J Surg. 2017;87(9):E70-E73. https://doi.org/10.1111/ans.13329.
- Bobkiewicz A., Francuzik W., Krokowicz L., Studniarek A., Ledwosiński W., Paszkowski J. et al. Botulinum Toxin Injection for Treatment of Chronic Anal Fissure: Is There Any Dose-Dependent Efficiency? A Meta-Analysis. World J Surg. 2016;40(12):3064-3072. https://doi.org/10.1007/s00268-016-3693-9.
- Arroyo A., Montes E., Calderón T., Blesa I., Elía M., Salgado G. et al. Treatment Algorithm for Anal Fissure. Consensus Document of the Spanish Association of Coloproctology and the Coloproctology Division of the Spanish Association of Surgeons. Cir Esp. 2018;96(5):260-267. https://doi.org/10.1016/j.ciresp.2018.02.007.
- Шелыгин Ю.А. (ред.) Колопроктология. Клинические рекомендации. М.: ГЭОТАР-Медиа; 2015. 528 c. Режим доступа: http://proto.rosmedlib.ru/book/ISBN9785970434239.html.
- Ткалич О.В., Пономаренко А.А., Фоменко О.Ю., Арсланбекова К.И., Хрюкин Р.Ю., Мисиков В.К. и др. Непосредственные результаты комплексного лечения хронической анальной трещины с применением ботулотоксина типа А (ISRCTN97413456). Колопроктология. 2020;19(1):80-99. https://doi.org/10.33878/2073-7556-2020-19-1-80-99.




 1
1 2
2 3
3 4
4


Комментарии (0)