Журнал "Медицинский совет" №4/2021
DOI: 10.21518/2079-701X-2021-4-78-87
А.А. Кулеш1, ORCID: 0000-0001-6061-8118
Д.А. Демин2, ORCID: 0000-0003-2670-4172
О.И. Виноградов3, ORCID: 0000-0002-3847-9366
1 Пермский государственный медицинский университет имени академика Е.А. Вагнера; 614000, Россия, Пермь, ул. Петропавловская, д. 26
2 Федеральный центр сердечно-сосудистой хирургии (Астрахань); 414011, Россия, Астрахань, ул. Покровская Роща, д. 4
3 Национальный медико-хирургический центр имени Н.И. Пирогова; 105203, Россия, Москва, ул. Нижняя Первомайская, д. 70
В статье обсуждаются концепция эмболического инсульта из неустановленного источника и роль аортоартериальной эмболии в его развитии. Подробно рассмотрены такие потенциальные причины эмболического криптогенного инсульта, как атероматоз аорты, нестенозирующий атеросклероз цервикальных артерий, каротидная сеть и интракраниальный атеросклероз. В рамках обсуждения каждой причины освещены вопросы эпидемиологии, патогенеза, а также современные подходы к диагностике и вторичной профилактике. Диагностический поиск представлен в виде алгоритма. Для выявления аорто-артериальных источников эмболии и определения их клинический значимости требуется развернутое обследование, включающее КТ-ангиографию с прицельной оценкой дуги аорты, чреспищеводную эхокардиографию, МРТ артериальной стенки и транскраниальную микроэмболодетекцию. При выполнении механической тромбэктомии целесообразно проводить гистологическое исследование тромбоэмбола. С учетом того что атеросклероз, как правило, имеет системный характер, поиск возможной причины аорто-артериальной эмболии должен быть приоритетным направлением диагностики у пациентов с криптогенным инсультом и поражением других артерий (коронарных, нижних конечностей). В отношении вторичной профилактики криптогенного инсульта при наличии потенциальных источников аортоартериальной эмболии применим принцип «чем эмбологеннее источник, тем агрессивнее профилактика». В арсенал вторичной профилактики входят такие стратегии, как строгий контроль сосудистых факторов риска, достижение целевого артериального давления, краткои среднесрочная двой ная антитромбоцитарная терапия, а также интенсивная гиполипидемическая терапия. При развитии инсульта на фоне каротидной сети оправдана хирургическая профилактика, эффективность которой при нестенозирующем атеросклерозе требует скорейшей оценки в рандомизированных исследованиях. Каждая рассмотренная потенциальная причина криптогенного инсульта проиллюстрирована клиническим примером.
Для цитирования: Кулеш А.А., Демин Д.А., Виноградов О.И. Криптогенный инсульт. Часть 1: аорто-артериальная эмболия. Медицинский совет. 2021;(4):78–87. doi: 10.21518/2079-701X-2021-4-78-87.
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Cryptogenic stroke. Part 1: Aorto-arterial embolism
Aleksey A. Kulesh1, ORCID: 0000-0001-6061-8118
Dmitry A. Demin2, ORCID: 0000-0003-2670-4172
Oleg I. Vinogradov3, ORCID: 0000-0002-3847-9366
1 Vagner Perm State Medical University; 26, Petropavlovskaya St., Perm, 614990, Russia
2 Federal Center for Cardiovascular Surgery (Astrakhan); 4, Pokrovskaya Roscha St., Astrakhan, 414011, Russia
3 National Medical and Surgical Center named after N.I. Pirogov; 70, Nizhnyaya Pervomayskaya St., Moscow, 105203, Russia
The article discusses the concept of embolic stroke from an unspecified source and the role of aorto-arterial embolism in its development. Potential causes of embolic cryptogenic stroke such as aortic atheromatosis, non-stenotic atherosclerosis of the cervical arteries, carotid web and intracranial atherosclerosis are discussed in detail. The discussion of each cause covers epidemiology, pathogenesis, and current approaches to diagnosis and secondary prevention. The diagnostic search is presented in the form of an algorithm. To identify aorto-arterial sources of embolism and to determine their clinical significance, a comprehensive examination including CT angiography with targeted assessment of the aortic arch, transesophageal echocardiography, MRI of the arterial wall and transcranial Doppler is required. When mechanical thrombectomy is performed, histological examination of the thromboembolus is advisable. Given that atherosclerosis is usually systemic, the search for a possible cause of aorto-arterial embolism should be a diagnostic priority in patients with cryptogenic stroke and other arterial (coronary, lower extremity) lesions. With regard to secondary prevention of cryptogenic stroke in the presence of potential sources of aorto-arterial embolism, the principle ‘the more embologenic the source, the more aggressive the prevention’ applies. The arsenal of secondary prevention includes strategies such as strict control of vascular risk factors, achieving target blood pressure, short- and medium-term dual antiplatelet therapy, and intensive hypolipidemic therapy. Surgical prophylaxis is warranted for stroke against a carotid background, the efficacy of which in non-stenotic atherosclerosis requires early evaluation in randomised trials. Each potential cause of cryptogenic stroke considered is illustrated by a clinical example.
For citation: Kulesh A.A., Demin D.A., Vinogradov O.I. Cryptogenic stroke. Part 1: Aorto-arterial embolism. Meditsinskiy sovet = Medical Council. 2021;(4):78–87. (In Russ.) doi: 10.21518/2079-701X-2021-4-78-87.
Conflict of interest: the authors declare no conflict of interest.
ВВЕДЕНИЕ
Криптогенный инсульт (КИ) диагностируется в ситуации, когда этиология мозговой катастрофы осталась неизвестной, несмотря на проведение достаточного обследования [1], что имеет место у каждого 3–4-го пациента с ишемическим инсультом (ИИ) [2, 3]. Существенная гетерогенность подгруппы пациентов с КИ обусловлена отсутствием единых алгоритмов обследования и различной информативностью диагностических методов, доступных тому или иному медицинскому учреждению. Результаты исследований, проведенных в рамках концепции эмболического КИ, позволяют предположить, что простой алгоритмизации диагностического процесса недостаточно для выявления причины инсульта, и во многом успешность обследования определяется диагностической мощностью используемых методов [4]. В то же время подходы к вторичной профилактике при ИИ начинают все больше отвечать требованиям персонифицированной медицины и включают достаточно широкий спектр перспективных направлений, в числе которых эндоваскулярная окклюзия открытого овального окна [5], высокодозная гиполипидемическая терапия [6], использование двой ной антитромбоцитарной и комбинированной антитромботической терапии [7, 8]. В рамках настоящей статьи мы задались целью осветить спектр потенциальных причин КИ, связанных с аортоартериальным (супракардиальным) атеросклерозом и предоставить современную информацию по их диагностике и вторичной профилактике.
КОНЦЕПЦИЯ ESUS
В 2014 г. была сформулирована концепция эмболического инсульта из неустановленного источника (Embolic Stroke of Undetermined Source (ESUS)) для пациентов с нелакунарными КИ, при которых эмболия являлась наиболее вероятным механизмом острого нарушения мозгового кровообращения [9]. Частота встречаемости ESUS колеблется от 9 до 25% и в среднем составляет 17% [10– 12]. Для ESUS характерны: относительно молодой возраст (в среднем 65 лет), мужской пол, более редкая встречаемость сосудистых факторов риска (по сравнению с неESUS пациентами), легкий неврологический дефицит (в среднем 5 баллов по шкале NIHSS) и высокий риск рецидива инсульта (в среднем 4,5% в год) [13–15]. Диагноз эмболического инсульта из неустановленного источника констатируют на основании следующих критериев:
1) наличие нелакунарного ишемического очага на КТ или МРТ (неподкорковый инфаркт ≤ 1,5 см (≤ 2,0 см на DWI) в бассейне перфорантных артерий);
2) отсутствие экстра- или интракраниального инсультсвязанного стеноза церебральной артерии (с сужением просвета ≥ 50%);
3) отсутствие кардиальных источников высокого риска: фибрилляция предсердий, внутрисердечный тромб, протез клапана, опухоль сердца, митральный стеноз, недавний (< 4 нед.) инфаркт миокарда, фракция выброса левого желудочка < 30% или инфекционный эндокардит;
4) отсутствие иных причин инсульта: артериит, диссекция, мигрень/вазоспазм, злоупотребление наркотиками [16].
Потенциальными причинами ESUS являются пароксизмальная форма фибрилляции предсердий, предсердная кардиомиопатия (не связанная с фибрилляцией предсердий), эмбологенные атеросклеротические бляшки (АБ) с сужением просвета артерии менее 50%, атерома дуги аорты (АДА) и открытое овальное окно [4].
РОЛЬ АОРТО-АРТЕРИАЛЬНОЙ ЭМБОЛИИ В РАЗВИТИИ КРИПТОГЕННОГО ИНСУЛЬТА
Супракардиальный атеросклероз рассматривается в качестве важного источника эмболии у пациентов с ESUS. Эмбологенными могут быть: АДА (имеет место у 29% пациентов с ESUS), экстракраниальные каротидные (40%) и вертебральные (4%) нестенозирующие АБ, а также интракраниальный атеросклероз (ИКА) (13%) [17].
АТЕРОМАТОЗ АОРТЫ
АДА – важная потенциальная причина инсульта и маркер системного атеросклероза. В метаанализе X. Cui et al. (2014) атероматоз аорты повышал риск инсульта почти в 4 раза (ОР = 3,93), а наличие осложненной бляшки (толщиной ≥ 4 мм, с изъязвлением или мобильным компонентом) было ассоциировано с наиболее высокими рисками (ОР = 5,90) [18]. При этом частота АДА ≥ 4–5 мм по данным чреспищеводной эхокардиографии (ЧП-ЭхоКГ) среди пациентов с КИ составляет 4,6–25,2%, что объясняет необходимость оценки аорты при поиске причин инсульта [19, 20].
Основной механизм развития ишемических событий у таких пациентов – аортоартериальная эмболия (разрыв бляшки с тромбоэмболией или пассаж фрагментов атеромы). При этом источником эмболии могут быть не только восходящая аорта и дуга, но и проксимальный отдел нисходящей аорты из-за ретроградного кровотока во время диастолы (особенно при митральной недостаточности), что доказано при проведении 4D flow МРТ [21, 22]. Важно отметить, что инсульты при АДА могут возникать не только спонтанно, но и во время медицинских манипуляций (кардиохирургические операции, чрескожные коронарные вмешательства и др.). Помимо инсульта и транзиторной ишемической атаки (ТИА) возможна системная эмболизация в артерии конечностей и висцеральных органов, что наряду с паттерном МРТ-изменений (поражение разных сосудистых бассейнов) сближает этот подтип инсульта с кардиоэмболией. Из-за этого фенотипического сходства в классификации CCS был выделен объединенный кардиоаортальный источник эмболии [23].
Традиционно золотым стандартом выявления АДА является ЧП-ЭхоКГ, однако к существенным недостаткам исследования относятся участок слепой зоны от воздуха в трахее, полуинвазивность метода и частая необходимость седации [24]. Мы считаем КТ-ангиографию (КТА) оптимальным методом диагностики атером аорты, так как это исследование позволяет верифицировать значимый супракардиальный атеросклероз на экстраи интракраниальном уровнях (из недостатков – артефакты пульсации в восходящей аорте при отсутствии ЭКГсинхронизации). Реже для выявления АДА выполняется МРТ-исследование аорты. В случае кардиохирургических операций возможно применение эпиаортального УЗИ [25] (рис. 1).
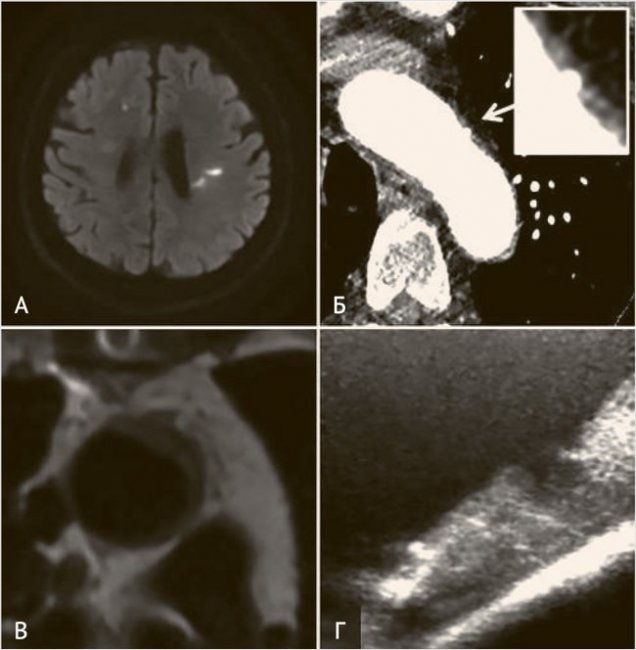
Рисунок 1. Атероматоз аорты
Пример паттерна острых инфарктов на DWI МРТ (А) у пациента с атеромой дуги аорты, выявленной при проведении КТ-аортографии (Б). Пример атеромы дуги аорты на МРТ аорты с ЭКГ-синхронизацией (В) и интраоперационном эпиаортальном УЗИ (Г) при выполнении кардиохирургической операции.
К МР-особенностям инсультов на фоне осложненных АДА относятся мультитерриториальные инфаркты, частота которых в исследовании NAVIGATE-ESUS составила 21% (у пациентов без АДА – 13%). В случае одиночных инфарктов чаще вовлекается левый каротидный бассейн (54% против 32% в правой гемисфере), что связано с частым расположением атером дистальнее брахиоцефального ствола [26].
Оптимальная антитромботическая терапия у пациентов с AДA не определена, так как испытания нескольких стратегий (аспирин, двой ная антитромбоцитарная терапия, варфарин) не выявили преимуществ какой-либо из них из-за недостаточной мощности исследований [27, 28]. Согласно текущим рекомендациям AHA/ ASA (2014) по вторичной профилактике инсульта, пациентам с АДА рекомендовано назначение антиагрегантов и статинов [29]. В исследовании ARCH не было продемонстрировано преимуществ комбинации аспирина и клопидогрела над варфарином, однако авторы предположили целесообразность краткосрочной (3 мес.) двой ной антиагрегантной терапии с переходом на монотерапию клопидогрелем (табл.) [28].
Таблица. Основные направления вторичной профилактики
| Антитромботическая терапия | 1. Аспирин + клопидогрел при малом ишемическом инсульте (NIHSS ≤ 3) или ТИА высокого риска (ABCD2 ≥ 4) длительностью до 3 мес. 2. Аспирин + тикагрелор при малом ишемическом инсульте (NIHSS ≤ 5) или ТИА высокого риска (ABCD2 ≥ 6) длительностью до 1 мес. 3. Аспирин или клопидогрел длительно | Аспирин + клопидогрел в течение 3 мес. с дальнейшим приемом одного антиагреганта длительно | |
| Целевое АД | < 140/90 мм рт. ст. и < 130/80 мм рт. ст. при сахарном диабете и/или сопутствующей церебральной микроангиопатии | ||
| Гиполипидемическая терапия | Концентрация липопротеинов низкой плотности < 1,4 ммоль/л и снижение не менее чем на 50% от исходного уровня, триглицериды < 1,7 ммоль/л | ||
| Контроль сахарного диабета | HbA1C < 7% для большинства пациентов | ||
| Немедикаментозная профилактика | Мультимодальная модификация образа жизни и факторов риска: физическая активность (3,5–7 ч умеренной физической активности в неделю или 30–60 мин. ежедневно), здоровое питание, контроль веса, отказ от курения и злоупотребления алкоголем | ||
| Хирургическая профилактика | Роль хирургических методов не определена (протезирование восходящей аорты, эндартерэктомия, имплантация стент-графта) | Хирургическое лечение (каротидная эндартерэктомия или стентирование) может быть рассмотрено при доказательстве эмбологенности атеросклеротической бляшки и рецидиве инсульта на фоне оптимальной медикаментозной терапии | Стентирование может быть рассмотрено при рецидиве ишемического инсульта, несмотря на оптимальную медикаментозную терапию, особенно при преобладании гипоперфузионного механизма развития инсульта |
Основные источники: Исследования: ECST, NASCET, VA309, WASID, SAMMPRIS, CHANCE, POINT, THALES, NAVIGATE-ESUS, RESPECT-ESUS
Рекомендации: AHA/ASA (2014), AHA/ASA (2019), ESC/EAS (2019), ESVS (2017), ESC/ESH (2018), ESC/EASD (2019)
НЕСТЕНОЗИРУЮЩИЙ АТЕРОСКЛЕРОЗ ЦЕРВИКАЛЬНЫХ АРТЕРИЙ
Согласно критериям TOAST, причинным фактором атеротромботического инсульта является стеноз экстра-, интракраниальных артерий ≥ 50% [1]. Однако интенсивно накапливаются данные, свидетельствующие, что причиной ESUS может быть стеноз < 50% при наличии АБ высокого риска – симптомный нестенотический (субстенотический) атеросклероз (СНСА). Так, в метаанализе J. KamtchumTatuene et al. (2020) частота нестенотического атеросклероза с бляшками высокого риска составила 32,5% на ипсилатеральной по отношению к инсульту стороне и 4,6% – с противоположной стороны (ОШ – 5,5) [30]. В исследовании INTERRSeCT (2020) у пациентов с ESUS нестенотические АБ в сонной артерии также наблюдались достоверно чаще на ипсилатеральной стороне (29% против 18,7%) [31]. В анализе исследования CAPIAS (2020) при КИ выявлена более высокая частота осложненных бляшек на стороне инфаркта головного мозга по сравнению с противоположной (31% против 12%) [32]. Таким образом, около 30% пациентов с ESUS имеют СНСА как вероятную причину ишемического события. Дополнительным поддерживающим фактором являются данные патогистологии тромбоэмболов, полученных при механической тромбэктомии (рис. 2), хотя результаты исследований противоречивы. Так, в регистре STRIP атеротромботический инсульт и КИ имели одинаковую долю богатых тромбоцитами тромбоэмболов (55,0% против 50,0%), что позволило предположить высокую распространенность СНСА как причины ESUS [33]. Однако в работе T. BoeckhBehrens et al. показано, что состав тромбов при КИ более схож с таковым при кардиоэмболическом, чем при некардиоэмболическом инсульте [34].
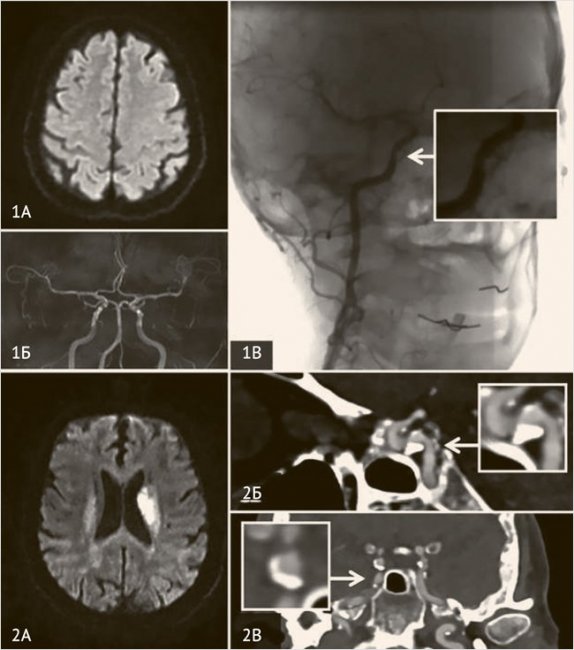
Рисунок 2. Нестенозирующий атеросклероз сонных артерий
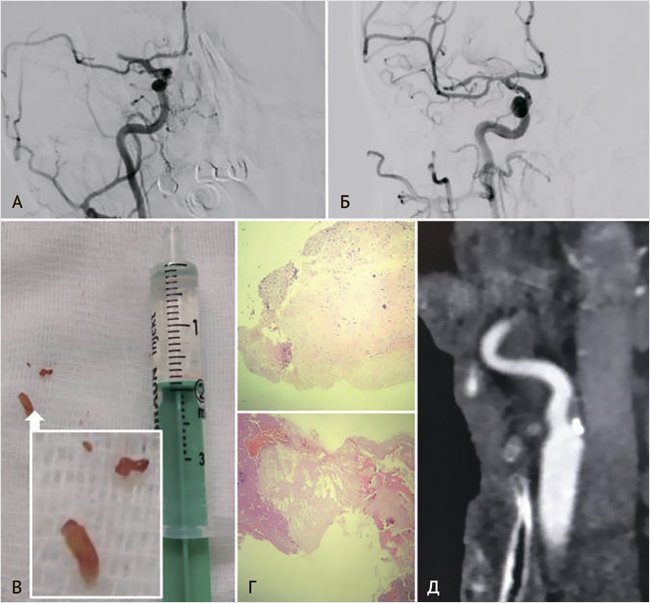
Мужчина, 70 лет, перенес ESUS с эмболией сегмента М2 правой средней мозговой артерии (А) в период подготовки к плановому коронарному шунтированию. В результате тромбоэкстракции восстановлен кровоток TICI III (Б), получен эмболический материал (В). Неврологический дефицит полностью регрессировал. Патогистологическое исследование эмбола позволило верифицировать фрагмент бляшки с тромбом (Г). Таким образом, ипсилатеральный стеноз внутренней сонной артерии 40% (Д) был признан симптомным, так как бляшек в восходящей аорте и интракраниальном русле выявлено не было.
На 6-е сутки после тромбоэкстракции пациенту проведена симультанная операция – каротидная эндартерэктомия и коронарное шунтирование на работающем сердце. Наблюдение в течение двух лет не выявило повторных ишемических событий.
Важно выявить не только факт наличия субстенотической АБ, но и определить признаки ее повышенного риска (уязвимости), к которым относятся: изъязвление (МРТ, КТА, УЗИ), кровоизлияния в бляшку (МРТ), разрыв фиброзной капсулы (МРТ, УЗИ), толщина АБ > 3 мм (МРТ, КТА, УЗИ), эхопрозрачная структура бляшки (УЗИ), богатое липидами ядро (МРТ), микроэмболические сигналы (транскраниальная микроэмболодетекция), неоваскуляризация (УЗИ с контрастом) и воспаление (ПЭТ) [35, 36]. Риск инсульта в зависимости от структуры субстенотической АБ продемонстрирован в метаанализе N. Singh et al. (2020), в котором частота повторного инсульта / ТИА при СНСА составила 2,6/100 пациенто-лет, однако при наличии внутрибляшечного кровоизлияния этот показатель возрастал до 4,9/100 пациентолет [37]. Таким образом, парадигма значимости степени стеноза стала сдвигаться к парадигме тромбои эмбологенного потенциала конкретной бляшки, что стало возможным благодаря развитию методов визуализации. Согласно классификации CCS, наличие стеноза < 50% при изъязвлении/тромбозе АБ является критерием достоверного атеротромботического инсульта, а в классификации ASCOD рубрика А2 включает ипсилатеральный стеноз 30–50% в экстраили интракраниальной артерии, кровоснабжающей зону ишемии [23, 38].
В случае верификации СНСА перед врачом встает сложный вопрос вторичной профилактики инсульта. Первостепенное значение имеет оптимальное медикаментозное лечение. К вариантам антитромботической терапии относятся: краткосрочная двой ная антиагрегантная терапия при малом инсульте / ТИА (исследования CHANCE, POINT, THALES), аспирин в комбинации с ривароксабаном 2,5 мг 2 р/день (исследование COMPASS, однако недавний инсульт (< 1 мес.) являлся критерием исключения) и монотерапия антиагрегантом [17]. Преимуществ в долгосрочном применении прямых оральных антикоагулянтов (ПОАК) перед аспирином не выявлено (субанализ исследования NAVIGATE-ESUS) [39]. Также пациентам показана высокоинтенсивная терапия статинами, достижение целевого значения АД < 130/80 мм рт. ст., модификация образа жизни [39]. Текущие рекомендации AHA/ASA (2014) и ESVS (2017) не поддерживают каротидную реваскуляризацию при СНСА, так как объединенный анализ исследований ECST, NASCET и VA309 не выявил пользу каротидной эндартерэктомии (КЭАЭ) у пациентов с инсультом и стенозом менее 50% [29, 40, 41]. Однако очевидна необходимость дальнейших исследований для определения потенциальной пользы КЭАЭ или стентирования уязвимых бляшек, при которых риск повторных ишемических событий остается высоким. Так, в исследовании N. Altaf et al. у 4 из 22 пациентов (18%) с СНСА и кровоизлияниями в бляшку наблюдались повторные инсульты / ТИА при сроке наблюдения 2 года, несмотря на антиагрегантную терапию [42]. При этом в исследовании D. Kashiwazaki et al. (2019) продемонстрирован результат персонифицированного хирургического подхода, основанного на выявлении бляшек высокого риска. В группе из 16 пациентов с СНСА (в 12 случаях инсульт/ТИА развились на фоне антитромбоцитарной терапии) была выполнена КЭАЭ. Интраоперационно все АБ имели большое некротическое ядро или кровоизлияние с изъязвлением или разрывом фиброзной капсулы. За период наблюдения 38,5 ± 13,3 мес. новых ишемических событий зарегистрировано не было, у 1 пациента (6,3%) произошел периоперационный ИИ с полным регрессом симптомов в течение 30 дней [43]. Таким образом, хирургическое лечение СНСА требует дальнейшего изучения (табл.).
КАРОТИДНАЯ СЕТЬ
Каротидная сеть (Carotid Web, КС) представляет собой тонкую мембраноподобную полочку, расположенную на задней стенке луковицы внутренней сонной артерии [44]. Аномалия рассматривается в качестве интимального варианта фиброзномышечной дисплазии [45]. Она не относится к каротидному атеросклерозу, но недостаточная осведомленность о данной проблеме и необходимость дифференциации с АБ побудили нас осветить данную патологию. Недооценка клинической значимости КС может быть связана с тем, что она вызывает стеноз < 50%, который традиционно не рассматривается в качестве причины инсульта [46].
КС наблюдается в 2,5–9% случаев на стороне инсульта или ТИА и в 5–10 раз реже с противоположной стороны [47, 48]. Она встречается у 9–37% молодых пациентов с КИ [44, 49, 50] и считается независимым фактором риска ИИ [51]. Тромбогенность КС обусловлена стазом крови дистальнее аномалии, способствующим образованию тромба и его эмболизации [45]. У пациентов с КС-ассоциированным ИИ часто наблюдается проксимальная окклюзия внутренней сонной артерии, что свидетельствует о высоком тромо- и эмбологенном потенциале аномалии [51].
Основным методом визуализации КС служит КТА. КС можно наблюдать в виде тонкого дефекта контрастирования вдоль задней стенки луковицы сонной артерии на косых сагиттальных срезах и, что наиболее важно, в виде перегородки на аксиальном срезе (рис. 3). КС следует отличать от одиночных мелких соединительнотканных выступов в проксимальной внутренней сонной артерии, незаметных в аксиальной проекции и наблюдаемых при КИ в 2,4% случаев. Хотя КС имеет уникальный радиологический паттерн, ее морфология (длина, толщина и угол наклона) вариабельны. КС может быть принята за диссекцию и АБ [45, 51, 52].
Рисунок 3. Каротидная сеть
КТ-ангиография, демонстрирующая тромбированную КС (А, Б, В) у пациентки 47 лет с ишемическим инсультом в бассейне левой средней мозговой артерии (Г). Ввиду увеличения размеров тромба и его истончения у основания выполнено стентирование внутренней сонной артерии.
Оптимальная вторичная профилактика ИИ при КС неизвестна. Если механизм формирования тромба в зоне КС схож с таковым в ушке левого предсердия, могут быть эффективны антикоагулянты [44]. Пациенты с КС характеризуются высокой частотой рецидивов ИИ: 67% в течение 3 мес. [53] и 32% в течение 12 мес., несмотря на антитромботическую терапию, что свидетельствует о целесообразности хирургических методов вторичной профилактики (стентирование или каротидная эндартерэктомия) [54, 55].
ИНТРАКРАНИАЛЬНЫЙ АТЕРОСКЛЕРОЗ
Несмотря на то что наличие ИКА служит критерием исключения для постановки ESUS, на практике нестенозирующие АБ внутримозговых артерий могут не диагностироваться при использовании рутинных методов ангиовизуализации. Проходимость внутримозговых артерий, согласно критериям ESUS, определяется на основании селективной, МРТ/КТ-ангиографии или транскраниальной допплерографии [9].
Основными факторами риска ИКА выступают: пожилой возраст, артериальная гипертензия, сахарный диабет 2-го типа и метаболический синдром [56]. В Oxford Vascular Study показано, что у пациентов с ТИА или малым ИИ симптомный ИКА со стенозом 50–99% наблюдается в 17,6% случаев, варьируясь от 4,9% у пациентов моложе 70 лет до 19,6% в возрасте старше 90 лет [57]. Обычно ИКА сосуществует с атеросклерозом других локализаций (экстракраниальные артерии, аорта, бедренные и коронарные артерии) и другими причинами ИИ (кардиоэмболические источники и церебральная микроангиопатия), однако может наблюдаться изолированно [58].
Роль стенозирующего (> 50%) ИКА в развитии ИИ и его рецидивов достаточно изучена. ИКА служит непосредственной причиной каждого десятого ишемического инсульта у представителей белой расы [59]. Основные механизмы развития ИИ на фоне ИКА включают артериоартериальную эмболию, гипоперфузию и атероматоз перфорантов (Branch Atheromatous Disease), а также in situ тромбоз/окклюзию и нарушение вымывания эмболов из гипоперфузированной ткани [56, 60–62]. При этом у большинства больных имеют место изолированная гипоперфузия (35%) и комбинация гипоперфузии с артериоартериальной эмболией (37%) [63]. Клиническая картина включает как корковые симптомы (у половины больных), так и один из лакунарных синдромов [56]. Риск повторных цереброваскулярных событий при ИКА варьирует от 4 до 40% в год [60]. Бессимптомный ИКА является предиктором дальнейших сосудистых и цереброваскулярных событий, отражая тяжесть течения системного атеросклероза [64].
Роль нестенозирующего ИКА в развитии ИИ только начинает исследоваться. Известно, что у пациентов с КИ более выраженная кальцификация интракраниального отдела ВСА по данным КТ наблюдается на стороне инфаркта [65]. При этом данные аутопсии свидетельствуют, что до 27% фатальных ИИ могут быть связаны с интракраниальными АБ с 30–75%-м стенозом. Нестенозирующие АБ встречаются у 2,4–17,4% пациентов в зависимости от локализации, и каждая третья АБ в средней мозговой артерии приводит к развитию стеноза < 30% [66]. АБ во внутримозговых артериях с нулевым или малым стенозом встречаются чаще, чем предполагалось ранее. Так, распространенность АБ во внутримозговых артериях, по данным Vessel Wall Imaging МРТ (VWI МРТ), среди пациентов с острым/подострым ИИ без стенозов по МРА составляет 51%. «Виновные» АБ наблюдаются у половины пациентов с ИИ и ИКА со стенозом по МРА < 50%. Накопление стенкой контраста, позитивное ремоделирование, внутрибляшечное кровоизлияние, локализация АБ и ее эксцентричность ассоциированы с острым инсультом, прогрессированием двигательных нарушений и неблагоприятным функциональным исходом [67].
Важной причиной недооценки АБ при использовании классических (основанных на оценке просвета) методов ангиовизуализации выступает феномен позитивного ремоделирования: рост АБ приводит к компенсаторному увеличению наружного диаметра артерии с менее значимым сужением диаметра просвета или вовсе без него [68]. Позитивное ремоделирование предшествует появлению стеноза и ассоциировано с развитием ИИ [69].
Основными методами диагностики ИКА служат транскраниальная допплерография, контрастная и бесконтрастная (3D-TOF) МР-ангиография, КТ-ангиография и селективная дигитальная ангиография [56, 60] (рис. 4). При интерпретации результатов ангиовизуализации (дифференциация с неатеросклеротическими ангиопатиями: васкулит, диссекция, синдром мойя-мойя и др.) необходимо учитывать наличие сердечнососудистых факторов риска и атеросклероза другой локализации (особенно у молодых пациентов). Так как стеноз или окклюзия могут быть обусловлены эмболией или локальным тромбозом, иногда требуется проведение повторной ангиовизуализации через 5–7 дней [56].
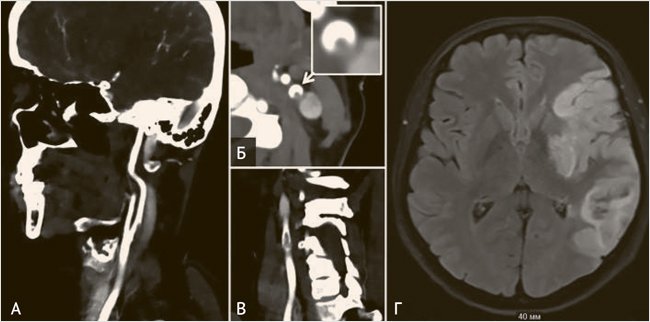
Рисунок 4. Интракраниальный атеросклероз
Пациентка, 58 лет, поступила в клинику с левосторонним гемипарезом. Проведен внутривенный тромболизис с положительным клиническим эффектом, очаг инфаркта на DWI МРТ (1А) не сформировался. 3D-TOf МРангиография (1Б) в норме, другие большие источники эмболии исключены. По результатам селективной дигитальной ангиографии выявлен стеноз сегмента С6 правой внутренней сонной артерии 30% по методу WASID (1В), расцененный как симптомный. Пациент, 62 года, перенес ишемический инсульт в бассейне левой средней мозговой артерии (2А). По данным КТ-ангиографии выявлена бляшка сегмента С5 внутренней сонной артерии слева (2Б, 2В), которая из-за феномена позитивного ремоделирования стенозирует просвет артерии на 40% (WASID); других больших источников эмболии выявлено не было.
Особой методикой МРТ для детализации сосудистой стенки является VWI, в частности в режиме Black Blood (черная кровь), которая при симптомном ИКА позволяет оценить распространение АБ, ее морфологию, ремоделирование сосудистой стенки, кровоизлияние и накопление контраста [70]. Характеристики интракраниальной АБ при VWI МРТ ассоциированы с ее нестабильностью и риском ИИ [71]. Показано, что проведение VWI приводит к изменению этиологии ИИ или ТИА у 55% пациентов преимущественно за счет увеличения доли ИКА с 23 до 57% [72]. Методика позволяет также дифференцировать ИКА от артериальной диссекции, посттромбэктомических изменений, васкулита, синдрома обратимой церебральной вазоконстрикции и болезни мойя-мойя [70].
ИКА не имеет специфического МРТ-паттерна очагов. Характер очагов зависит от подлежащего механизма и при выраженном ИКА включает 4 основных варианта: подкорковый очаг в зоне перфорантов (23–25%), территориальный (24–51%), в зоне смежного кровообращения (9–52%) и смешанный [61, 73]. Лакунарные инфаркты обнаруживаются у 10–19% пациентов и наиболее часто локализуются в варолиевом мосту, лучистом венце или полуовальном центре [56].
Вторичная профилактика инсульта на фоне ИКА остается нерешенной проблемой. В исследовании WarfarinAspirin Symptomatic Intracranial Disease (WASID) показано, что у пациентов с симптомным ИКА со стенозом 50–99% варфарин (целевое МНО 2.0–3.0) не превосходит аспирин (1 300 мг/сут) в предотвращении повторного инсульта, но ассоциирован с повышением числа кровотечений и летальности [74]. В исследовании Stenting and Aggressive Medical Therapy for Preventing Recurrent Stroke in Intracranial Stenosis (SAMMPRIS) агрессивная медикаментозная терапия превзошла по эффективности стентирование (стент Wingspan) у пациентов с симптомным ИКА со стенозом 70–99% [75]. Консервативное лечение осуществлялось в рамках программы по изменению образа жизни и включало двой ную антитромбоцитарную терапию в течение 3 мес., строгий контроль АД, гиполипидемическую терапию и нивелирование вторичных факторов риска (сахарный диабет, курение, избыточный вес, физическая активность). Примечательно, что целевые значения АД и липопротеинов низкой плотности были достигнуты только у половины пациентов, что свидетельствует о значительно большем терапевтическом потенциале оптимальной медикаментозной терапии [76]. Другие исследования (VAST, VISSIT, VIST) также не смогли доказать преимуществ стентирования перед медикаментозной терапией. Однако эндоваскулярное лечение может быть целесообразно при рецидивировании острых нарушений мозгового кровообращения, несмотря на оптимальную медикаментозную терапию или при наличии выраженного дистального дефицита перфузии [77] (табл.).
ДИАГНОСТИЧЕСКИЙ АЛГОРИТМ
Ввиду ограниченности ресурсов в первые дни КИ целесообразно выбрать приоритетное направление диагностического поиска. Известно, что аортоаортальный атеросклероз и предсердная кардиопатия относятся к разным фенотипам КИ: по данным субанализа исследования NAVIGATE-ESUS, у 5,9% пациентов с ESUS имеется увеличение левого предсердия, у 24% больных ипсилатеральная АБ, однако сочетаются данные причины только у 2,4% пациентов [78]. Показано, что среди пациентов без ипсилатеральных нестенозирующих АБ частота выявления фибрилляции предсердий при дальнейшем 10-летнем наблюдении составляет 19%, тогда как у пациентов с нестенозирующими АБ – 8,5% [79]. Известно также, что атеросклероз часто имеет системный характер и поражает одновременно церебральные, прецеребральные, коронарные, почечные артерии и сосуды нижних конечностей [80]. Таким образом, поиск аортоартериальных источников эмболии должен в первую очередь выполняться у пациентов с атеросклерозом других локализаций (например, при наличии ишемической болезни сердца), а также в отсутствие признаков предсердной кардиопатии (например, при диаметре левого предсердия менее 40 мм). Структурированный подход к верификации причин КИ, связанных с аортоартериальным атеросклерозом, представлен на рис. 5.
Рисунок 5. Алгоритм обследования при ESUS
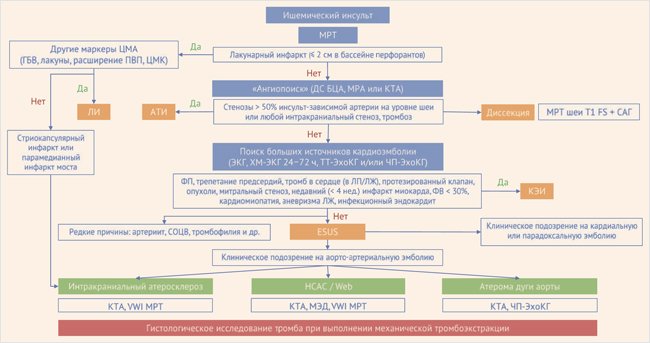
ЦМА – церебральная микроангиопатия, ГБВ – гиперинтенсивность белого вещества, ЦМК – церебральные микрокровоизлияния, ПВП – периваскулярные пространства, ЛИ – лакунарный инсульт, АТИ – атеротромботический инсульт, ДС БЦА – дуплексное сканирование брахиоцефальных артерий, МРА – МРТ-ангиография, КТА – КТ-ангиография, FS (Fat Suppressed Imaging) – МРТ-последовательность с подавлением сигнала от жировой ткани, САГ – селективная дигитальная ангиография, ТТ-ЭхоКГ – трансторакальная ЭхоКГ, ЧП-ЭхоКГ – чреспищеводная эхокардиография, ЛП – левое предсердие, ЛЖ – левый желудочек, ФВ – фракция выброса, СОЦВ – синдром обратимой церебральной вазоконстрикции, VWI–Vessel Wall Imaging, МЭД – микроэмболодетекция.
ЗАКЛЮЧЕНИЕ
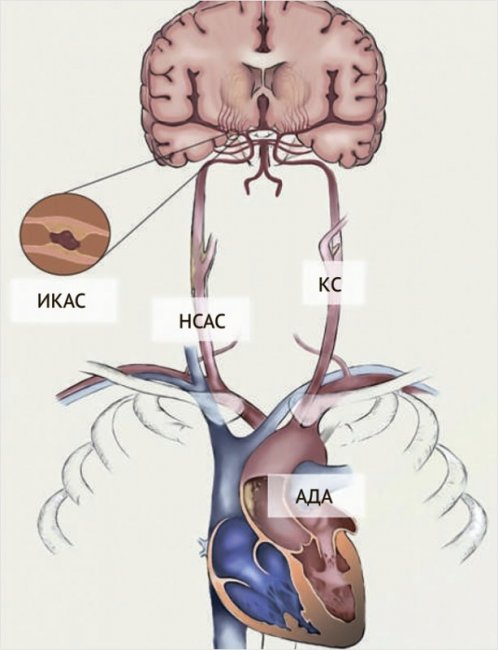
Таким образом, аортоартериальная эмболия на фоне атероматоза аорты, нестенозирующих атеросклеротических бляшек экстраи интракраниальных артерий, а также локальной интимальной дисплазии внутренней сонной артерии (кародитная сеть) служит важной потенциальной причиной КИ (рис. 6).
Рисунок 6. Схематичное изображение основных причин криптогенного инсульта, обусловленного супракардиальным атеросклерозом и каротидной сетью
Для выявления аортоартериальных источников эмболии и определения их клинический значимости требуется развернутое обследование, включающее КТ-ангиографию с прицельной оценкой дуги аорты, ЧП-ЭхоКГ, VWI МРТ и транскраниальную микроэмболодетекцию. При выполнении механической тромбэктомии целесообразно проводить гистологическое исследование тромбоэмбола. С учетом того что атеросклероз, как правило, имеет системный характер, ангиопоиск должен быть приоритетным направлением диагностики у пациентов с КИ и поражением других артерий (коронарных, нижних конечностей). В отношении вторичной профилактики КИ при наличии потенциальных источников аортоартериальной эмболии можно сформулировать принцип «чем эмбологеннее источник, тем агрессивнее профилактика»: активность патологического субстрата такова, что даже при недостижении общепринятых границ клинической значимости (степень стеноза 50%), он способен привести к развитию мозговой катастрофы. Поэтому в арсенал вторичной профилактики КИ у данных пациентов должны входить агрессивные стратегии: строгий контроль сосудистых факторов риска, достижение целевого АД, краткои среднесрочная двой ная антитромбоцитарная, а также интенсивная гиполипидемическая терапия. При развитии инсульта на фоне каротидной сети оправдана хирургическая профилактика, эффективность которой при нестенозирующем атеросклерозе требует скорейшей оценки в рандомизированных исследованиях.
Список литературы / References
- Adams H.P. Jr, Bendixen B.H., Kappelle L.J., Biller J., Love B.B., Gordon D.L., Marsh E.E. 3rd. Classification of Subtype of Acute Ischemic Stroke. Definitions for Use in a Multicenter Clinical Trial. TOAST. Trial of Org 10172 in Acute Stroke Treatment. Stroke. 1993;24(1):35–41. doi: 10.1161/01.str.24.1.35.
- Nouh A., Hussain M., Mehta T., Yaghi S. Embolic Strokes of Unknown Source and Cryptogenic Stroke: Implications in Clinical Practice. Front Neurol. 2016;7:37. doi: 10.3389/fneur.2016.00037.
- Kulesh A.A., Drobakha V.E., Shestakov V.V. Cryptogenic Stroke. Nevrologiya, neyropsikhiatriya, psikhosomatika = Neurology, Neuropsychiatry, Psychosomatics.
2019;11(4):14–21. doi: 10.14412/2074-2711-2019-4-14-21. - Ntaios G. Embolic Stroke of Undetermined Source: JACC Review Topic of the Week. J Am Coll Cardiol. 2020;75(3):333–340. doi: 10.1016/j.jacc.2019.11.024.
- Pristipino C., Sievert H., D’Ascenzo F., Louis Mas J., Meier B., Scacciatella P. et al. European Position Paper on the Management of Patients with Patent Foramen Ovale. General Approach and Left Circulation Thromboembolism. Eur Heart J. 2019;40(38):3182–3195. doi: 10.1093/eurheartj/ehy649.
- Giugliano R.P., Pedersen T.R., Saver J.L., Sever P.S., Keech A.C., Bohula E.A. et al. Stroke Prevention With the PCSK9 (Proprotein Convertase Subtilisin- Kexin Type 9) Inhibitor Evolocumab Added to Statin in High- Risk Patients With Stable Atherosclerosis. Stroke. 2020;51(5):1546–1554. doi: 10.1161/STROKEAHA.119.027759.
- Johnston S.C., Amarenco P., Denison H., Evans S.R., Himmelmann A., James S. et al. Ticagrelor and Aspirin or Aspirin Alone in Acute Ischemic Stroke or TIA. N Engl J Med. 2020;383(3):207–217. doi: 10.1056/NEJMoa1916870.
- Sharma M., Hart R.G., Connolly S.J., Bosch J., Shestakovska O., Ng K.K.H. et al. Stroke Outcomes in the COMPASS Trial. Circulation. 2019;139(9):1134–1145. doi: 10.1161/CIRCULATIONAHA.118.035864.
- Hart R.G., Diener H.C., Coutts S.B., Easton J.D., Granger C.B., O’Donnell M.J. et al. Embolic Strokes of Undetermined Source: The Case for a New Clinical Construct. Lancet Neurol. 2014;13(4):429–438. doi: 10.1016/S1474-4422(13)70310-7.
- Masina M., Cicognani A., Lofiego C., Malservisi S., Parlangeli R., Lombardi A. Embolic Stroke of Undetermined Source: A Retrospective Analysis from an Italian Stroke Unit. Italian J Med. 2016;10(3):202–206. doi: 10.4081/itjm.2016.690.
- Ntaios G., Papavasileiou V., Milionis H., Makaritsis K., Manios E., Spengos K. et al. Embolic Strokes of Undetermined Source in the Athens Stroke Registry: A Descriptive Analysis. Stroke. 2015;46(1):176–181. doi: 10.1161/STROKEAHA.114.007240.
- Perera K.S., Vanassche T., Bosch J., Giruparajah M., Swaminathan B., Mattina K.R. et al. Embolic Strokes of Undetermined Source: Prevalence and Patient Features in the ESUS Global Registry. Int J Stroke. 2016;11(5):526–533. doi: 10.1177/1747493016641967.
- Li L., Yiin G.S., Geraghty O.C., Schulz U.G., Kuker W., Mehta Z., Rothwell P.M. Incidence, Outcome, Risk Factors, and Long- Term Prognosis of Cryptogenic Transient Ischaemic Attack and Ischaemic Stroke: A Population-Based Study. Lancet Neurol. 2015;14(9):903–913. doi: 10.1016/S1474-4422(15)00132-5.
- Putaala J., Nieminen T., Haapaniemi E., Meretoja A., Rantanen K., Heikkinen N. et al. Undetermined Stroke with an Embolic Pattern – a Common Phenotype with High Early Recurrence Risk. Ann Med. 2015;47(5):406–413. doi: 10.3109/07853890.2015.1057612.
- Ntaios G., Papavasileiou V., Milionis H., Makaritsis K., Vemmou A., Koroboki E. et al. Embolic Strokes of Undetermined Source in the Athens Stroke Registry: An Outcome Analysis. Stroke. 2015;46(8):2087–2093. doi: 10.1161/STROKEAHA.115.009334.
- Hart R.G., Catanese L., Perera K.S., Ntaios G., Connolly S.J. Embolic Stroke of Undetermined Source: A Systematic Review and Clinical Update. Stroke. 2017;48(4):867–872. doi: 10.1161/STROKEAHA.116.016414.
- Ntaios G., Wintermark M., Michel P. Supracardiac Atherosclerosis in Embolic Stroke of Undetermined Source: The Underestimated Source. Eur Heart J. 2020;ehaa218. doi: 10.1093/eurheartj/ehaa218.
- Cui X., Li Y., Liu J., He S., Liu M. Aortic Arch Atheroma and the Risk of Stroke: A Meta- Analysis. J Evid Based Med. 2014;7(3):185–191. doi: 10.1111/jebm.12113.
- Censori B., Colombo F., Valsecchi M.G., Clivati L., Zonca A., Camerlingo M. et al. Early Transoesophageal Echocardiography in Cryptogenic and Lacunar Stroke and Transient Ischaemic Attack. J Neurol Neurosurg Psychiatry. 1998;64(5):624–627. doi: 10.1136/jnnp.64.5.624.
- Gu X., He Y., Li Z., Kontos M.C., Paulsen W.H., Arrowood J.A., Nixon J.V. Comparison of Frequencies of Patent Foramen Ovale and Thoracic Aortic Atherosclerosis in Patients with Cryptogenic Ischemic Stroke Undergoing Transesophageal Echocardiography. Am J Cardiol. 2011;108(12):1815–1819. doi: 10.1016/j.amjcard.2011.07.058.
- Harloff A., Simon J., Brendecke S., Assefa D., Helbing T., Frydrychowicz A. et al. Complex Plaques in the Proximal Descending Aorta: An Underestimated Embolic Source of Stroke. Stroke. 2010;41(6):1145–1150. doi: 10.1161/STROKEAHA.109.577775.
- Wehrum T., Dragonu I., Strecker C., Schuchardt F., Hennemuth A., Drexl J. et al. Aortic Atheroma as a Source of Stroke – Assessment of Embolization Risk Using 3D CMR in Stroke Patients and Controls. J Cardiovasc Magn Reson. 2017;19(1):67. doi: 10.1186/s12968-017-0379-x.
- Ay H., Benner T., Arsava E.M., Furie K.L., Singhal A.B., Jensen M.B. et al. A Computerized Algorithm for Etiologic Classification of Ischemic Stroke: The Causative Classification of Stroke System. Stroke. 2007;38(11):2979–2984. doi: 10.1161/STROKEAHA.107.490896.
- Amarenco P., Cohen A., Tzourio C., Bertrand B., Hommel M., Besson G. et al. Atherosclerotic Disease of the Aortic Arch and the Risk of Ischemic stroke. N Engl J Med. 1994;331(22):1474–1479. doi: 10.1056/NEJM199412013312202.
- Kronzon I., Tunick P.A. Aortic Atherosclerotic Disease and Stroke. Circulation. 2006;114(1):63–75. doi: 10.1161/CIRCULATIONAHA.105.593418.
- Ntaios G., Pearce L.A., Meseguer E., Endres M., Amarenco P., Ozturk S. et al. Aortic Arch Atherosclerosis in Patients With Embolic Stroke of Undetermined Source: An Exploratory Analysis of the NAVIGATE ESUS Trial. Stroke. 2019;50(11):3184–3190. doi: 10.1161/STROKEAHA.119.025813.
- Di Tullio M.R., Russo C., Jin Z., Sacco R.L., Mohr J.P., Homma S. Aortic Arch Plaques
and Risk of Recurrent Stroke and Death. Circulation. 2009;119(17):2376–2382. doi: 10.1161/CIRCULATIONAHA.108.811935. - Amarenco P., Davis S., Jones E.F., Cohen A.A., Heiss W.D., Kaste M. et al. Clopidogrel Plus Aspirin versus Warfarin in Patients with Stroke and Aortic Arch Plaques. Stroke. 2014;45(5):1248–1257. doi: 10.1161/STROKEAHA.113.004251.
- Kernan W.N., Ovbiagele B., Black H.R., Bravata D.M., Chimowitz M.I., Ezekowitz M.D. et al. Guidelines for the Prevention of Stroke in Patients with Stroke and Transient Ischemic Attack: A Guideline for Healthcare Professionals from the American Heart Association/American Stroke Association. Stroke. 2014;45(7):2160–2236. doi: 10.1161/STR.0000000000000024.
- Kamtchum- Tatuene J., Wilman A., Saqqur M., Shuaib A., Jickling G.C. Carotid Plaque With High- Risk Features in Embolic Stroke of Undetermined Source: Systematic Review and Meta- Analysis. Stroke. 2020;51(1):311–314. doi: 10.1161/STROKEAHA.119.027272.
- Ospel J.M., Singh N., Marko M., Almekhlafi M., Dowlatshahi D., Puig J. et al. Prevalence of Ipsilateral Nonstenotic Carotid Plaques on Computed Tomography Angiography in Embolic Stroke of Undetermined Source. Stroke. 2020;51(6):1743–1749. doi: 10.1161/STROKEAHA.120.029404.
- Kopczak A., Schindler A., Bayer- Karpinska A., Koch M.L., Sepp D., Zeller J. et al. Complicated Carotid Artery Plaques as a Cause of Cryptogenic Stroke. J Am Coll Cardiol. 2020;76(19):2212–2222. doi: 10.1016/j.jacc.2020.09.532.
- Fitzgerald S., Dai D., Wang S., Douglas A., Kadirvel R., Layton K.F. et al. Platelet-
Rich Emboli in Cerebral Large Vessel Occlusion Are Associated With a Large Artery Atherosclerosis Source. Stroke. 2019;50(7):1907–1910. doi: 10.1161/STROKEAHA.118.024543. - Boeckh- Behrens T., Kleine J.F., Zimmer C., Neff F., Scheipl F., Pelisek J. et al. Thrombus Histology Suggests Cardioembolic Cause in Cryptogenic Stroke. Stroke. 2016;47(7):1864–1871. doi: 10.1161/STROKEAHA.116.013105.
- Goyal M., Singh N., Marko M., Hill M.D., Menon B.K., Demchuk A. et al. Embolic Stroke of Undetermined Source and Symptomatic Nonstenotic Carotid Disease. Stroke. 2020;51(4):1321–1325. doi: 10.1161/STROKEAHA.119.028853.
- Paraskevas K.I., Veith F.J., Spence J.D. How to Identify Which Patients with Asymptomatic Carotid Stenosis Could Benefit from Endarterectomy or Stenting. Stroke Vasc Neurol. 2018;3(2):92–100. doi: 10.1136/svn-2017-000129.
- Singh N., Marko M., Ospel J.M., Goyal M., Almekhlafi M. The Risk of Stroke and TIA in Nonstenotic Carotid Plaques: A Systematic Review and Meta-Analysis. AJNR Am J Neuroradiol. 2020;41(8):1453–1459. doi: 10.3174/ajnr.A6613.
- Amarenco P., Bogousslavsky J., Caplan L.R., Donnan G.A., Wolf M.E., Hennerici M.G. The ASCOD Phenotyping of Ischemic Stroke (Updated ASCO Phenotyping). Cerebrovasc Dis. 2013;36(1):1–5. doi: 10.1159/000352050.
- Ntaios G., Swaminathan B., Berkowitz S.D., Gagliardi R.J., Lang W., Siegler J.E. et al. Efficacy and Safety of Rivaroxaban Versus Aspirin in Embolic Stroke of Undetermined Source and Carotid Atherosclerosis. Stroke. 2019;50(9):2477–2485. doi: 10.1161/STROKEAHA.119.025168.
- Rothwell P.M., Eliasziw M., Gutnikov S.A., Fox A.J., Taylor D.W., Mayberg M.R. et al. Analysis of Pooled Data from the Randomised Controlled Trials of Endarterectomy for Symptomatic Carotid Stenosis. Lancet. 2003;361(9352):107–116. doi: 10.1016/s0140-6736(03)12228-3.
- Naylor A.R., Ricco J.B., de Borst G.J., Debus S., de Haro J., Halliday A. et al. Editor’s
Choice – Management of Atherosclerotic Carotid and Vertebral Artery Disease: 2017 Clinical Practice Guidelines of the European Society for Vascular Surgery (ESVS). Eur J Vasc Endovasc Surg. 2018;55(1):3–81. doi: 10.1016/j.ejvs.2017.06.021. - Altaf N., Daniels L., Morgan P.S., Auer D., MacSweeney S.T., Moody A.R., Gladman J.R. Detection of Intraplaque Hemorrhage by Magnetic Resonance Imaging in Symptomatic Patients with Mild to Moderate Carotid Stenosis Predicts Recurrent Neurological Events. J Vasc Surg. 2008;47(2):337–342. doi: 10.1016/j.jvs.2007.09.064.
- Kashiwazaki D., Shiraishi K., Yamamoto S., Kamo T., Uchino H., Saito H. et al. Efficacy of Carotid Endarterectomy for Mild (<50%) Symptomatic Carotid Stenosis with Unstable Plaque. World Neurosurg. 2019;121:e60–e69. doi: 10.1016/j.wneu.2018.09.013.
- Coutinho J.M., Derkatch S., Potvin A.R., Tomlinson G., Casaubon L.K., Silver F.L., Mandell D.M. Carotid Artery Web and Ischemic Stroke: A Case-Control Study. Neurology. 2017;88(1):65–69. doi: 10.1212/WNL.0000000000003464.
- Choi P.M., Singh D., Trivedi A., Qazi E., George D., Wong J. et al. Carotid Webs and Recurrent Ischemic Strokes in the Era of CT Angiography. AJNR Am J Neuroradiol. 2015;36(11):2134–2139. doi: 10.3174/ajnr.A4431.
- Wojcik K., Milburn J., Vidal G., Tarsia J., Steven A. Survey of Current Management Practices for Carotid Webs. Ochsner J. 2019;19(4):296–302. doi: 10.31486/toj.18.0114.
- Compagne K.C.J., van Es A.C.G.M., Berkhemer O.A., Borst J., Roos Y.B.W.E.M., van Oostenbrugge R.J. et al. Prevalence of Carotid Web in Patients with Acute Intracranial Stroke Due to Intracranial Large Vessel Occlusion. Radiology. 2018;286(3):1000–1007. doi: 10.1148/radiol.2017170094.
- Hu H., Zhang X., Zhao J., Li Y., Zhao Y. Transient Ischemic Attack and Carotid Web. AJNR Am J Neuroradiol. 2019;40(2):313–318. doi: 10.3174/ajnr.A5946.
- Joux J., Boulanger M., Jeannin S., Chausson N., Hennequin J.L., Molinié V. et al. Association between Carotid Bulb Diaphragm and Ischemic Stroke in Young Afro-Caribbean Patients: A Population-Based Case-Control Study. Stroke. 2016;47(10):2641–2644. doi: 10.1161/STROKEAHA.116.013918.
- Sajedi P.I., Gonzalez J.N., Cronin C.A., Kouo T., Steven A., Zhuo J. et al. Carotid Bulb
Webs as a Cause of “Cryptogenic” Ischemic Stroke. AJNR Am J Neuroradiol. 2017;38(7):1399–1404. doi: 10.3174/ajnr.A5208. - Kim S.J., Allen J.W., Bouslama M., Nahab F., Frankel M.R., Nogueira R.G., Haussen D.C.
Carotid Webs in Cryptogenic Ischemic Strokes: A Matched Case- Control Study. J Stroke Cerebrovasc Dis. 2019;28(12):104402. doi: 10.1016/j.jstrokecerebrovasdis.2019.104402. - Madaelil T.P., Grossberg J.A., Nogueira R.G., Anderson A., Barreira C., Frankel M., Haussen D.C. Multimodality Imaging in Carotid Web. Front Neurol. 2019;10:220. doi: 10.3389/fneur.2019.00220.
- Luo X., Li Z. Ultrasonic Risk Stratification of Carotid Web. Echocardiography. 2019;36(11):2103–2107. doi: 10.1111/echo.14521.
- Haussen D.C., Grossberg J.A., Bouslama M., Pradilla G., Belagaje S., Bianchi N. et al. Carotid Web (Intimal Fibromuscular Dysplasia) Has High Stroke Recurrence Risk and Is Amenable to Stenting. Stroke. 2017;48(11):3134–3137. doi: 10.1161/STROKEAHA.117.019020.
- Phair J., Trestman E.B., Yean C., Lipsitz E.C. Endarterectomy for a Symptomatic Carotid Web. Vascular. 2017;25(5):553–556. doi: 10.1177/1708538116684940.
- Qureshi A.I., Caplan L.R. Intracranial Atherosclerosis. Lancet. 2014;383(9921):984–998. doi: 10.1016/S0140-6736(13)61088-0.
- Hurford R., Wolters F.J., Li L., Lau K.K., Küker W., Rothwell P.M. Prevalence, Predictors, and Prognosis of Symptomatic Intracranial Stenosis in Patients with Transient Ischaemic Attack or Minor Stroke: A Population- Based Cohort Study. Lancet Neurol. 2020;19(5):413–421. doi: 10.1016/S1474-4422(20)30079-X.
- Hoshino T., Sissani L., Labreuche J., Ducrocq G., Lavallée P.C., Meseguer E. et al. Prevalence of Systemic Atherosclerosis Burdens and Overlapping Stroke Etiologies and Their Associations With Long-Term Vascular Prognosis in Stroke With Intracranial Atherosclerotic Disease. JAMA Neurol. 2018;75(2):203–211. doi: 10.1001/jamaneurol.2017.3960.
- Mazighi M., Labreuche J., Gongora-Rivera F., Duyckaerts C., Hauw J.J., Amarenco P. Autopsy Prevalence of Intracranial Atherosclerosis in Patients with Fatal Stroke. Stroke. 2008;39(4):1142–1147. doi: 10.1161/STROKEAHA.107.496513.
- Krasteva M.P., Lau K.K., Mordasini P., Tsang A.C.O., Heldner M.R. Intracranial Atherosclerotic Stenoses: Pathophysiology, Epidemiology, Risk Factors and Current Therapy Options. Adv Ther. 2020;37(5):1829–1865. doi: 10.1007/s12325-020-01291-4.
- Al Kasab S., Derdeyn C.P., Guerrero W.R., Limaye K., Shaban A., Adams H.P. Jr. Intracranial Large and Medium Artery Atherosclerotic Disease and Stroke. J Stroke Cerebrovasc Dis. 2018;27(7):1723–1732. doi: 10.1016/j.jstrokecerebrovasdis.2018.02.050.
- Petrone L., Nannoni S., Del Bene A., Palumbo V., Inzitari D. Branch Atheromatous Disease: A Clinically Meaningful, Yet Unproven Concept. Cerebrovasc Dis. 2016;41(1–2):87–95. doi: 10.1159/000442577.
- Feng X., Chan K.L., Lan L., Abrigo J., Liu J., Fang H. et al. Stroke Mechanisms in Symptomatic Intracranial Atherosclerotic Disease: Classification and Clinical Implications. Stroke. 2019;50(10):2692–2699. doi: 10.1161/STROKEAHA.119.025732.
- Planas- Ballvé A., Crespo A.M., Aguilar L.M., Hernández-Pérez M., Canento T., Dorado L. et al. The Barcelona- Asymptomatic Intracranial Atherosclerosis study: Subclinical Intracranial Atherosclerosis as Predictor of Long- Term Vascular Events. Atherosclerosis. 2019;282:132–136. doi: 10.1016/j.atherosclerosis.2019.01.022.
- Kamel H., Gialdini G., Baradaran H., Giambrone A.E., Navi B.B., Lerario M.P. et al. Cryptogenic Stroke and Nonstenosing Intracranial Calcified Atherosclerosis. J Stroke Cerebrovasc Dis. 2017;26(4):863–870. doi: 10.1016/j.jstrokecerebrovasdis.2016.10.035.
- Amarenco P. Underlying Pathology of Stroke of Unknown Cause (Cryptogenic Stroke). Cerebrovasc Dis. 2009;27(Suppl 1):97–103. doi: 10.1159/000200446.
- Wang Y., Liu X., Wu X., Degnan A.J., Malhotra A., Zhu C. Culprit Intracranial Plaque
without Substantial Stenosis in Acute Ischemic Stroke on Vessel Wall MRI: A Systematic Review. Atherosclerosis. 2019;287:112–121. doi: 10.1016/j.atherosclerosis.2019.06.907. - Bodle J.D., Feldmann E., Swartz R.H., Rumboldt Z., Brown T., Turan T.N. High-Resolution Magnetic Resonance Imaging: An Emerging Tool for Evaluating Intracranial Arterial Disease. Stroke. 2013;44(1):287–292. doi: 10.1161/STROKEAHA.112.664680.
- Zhang D.F., Chen Y.C., Chen H., Zhang W.D., Sun J., Mao C.N. et al. A High-Resolution MRI Study of Relationship between Remodeling Patterns and Ischemic Stroke in Patients with Atherosclerotic Middle Cerebral Artery Stenosis. Front Aging Neurosci. 2017;9:140. doi: 10.3389/fnagi.2017.00140.
- Leao D.J., Agarwal A., Mohan S., Bathla G. Intracranial Vessel Wall Imaging: Applications, Interpretation, and Pitfalls. Clin Radiol. 2020;75(10):730–739. doi: 10.1016/j.crad.2020.02.006.
- Lee H.N., Ryu C.W., Yun S.J. Vessel- Wall Magnetic Resonance Imaging of Intracranial Atherosclerotic Plaque and Ischemic Stroke: A Systematic Review and Meta-Analysis. Front Neurol. 2018;9:1032. doi: 10.3389/fneur.2018.01032.
- Schaafsma J.D., Rawal S., Coutinho J.M., Rasheedi J., Mikulis D.J., Jaigobin C. et al.
Diagnostic Impact of Intracranial Vessel Wall MRI in 205 Patients with Ischemic Stroke or TIA. AJNR Am J Neuroradiol. 2019;40(10):1701–1706. doi: 10.3174/ajnr.A6202. - Banerjee C., Chimowitz M.I. Stroke Caused by Atherosclerosis of the Major Intracranial Arteries. Circ Res. 2017;120(3):502–513. doi: 10.1161/CIRCRESAHA.116.308441.
- Chimowitz M.I., Lynn M.J., Howlett- Smith H., Stern B.J., Hertzberg V.S., Frankel M.R. et al. Comparison of Warfarin and Aspirin for Symptomatic Intracranial Arterial Stenosis. N Engl J Med. 2005;352(13):1305–1316. doi: 10.1056/NEJMoa043033.
- Derdeyn C.P., Chimowitz M.I., Lynn M.J., Fiorella D., Turan T.N., Janis L.S. et al. Aggressive Medical Treatment with or without Stenting in High-Risk Patients with Intracranial Artery Stenosis (SAMMPRIS): The Final Results of a Randomised Trial. Lancet. 2014;383(9914):333–341. doi: 10.1016/S0140-6736(13)62038-3.
- Turan T.N., Nizam A., Lynn M.J., Egan B.M., Le N.A., Lopes- Virella M.F. et al. Relationship between Risk Factor Control and Vascular Events in the SAMMPRIS Trial. Neurology. 2017;88(4):379–385. doi: 10.1212/WNL.0000000000003534.
- Waters M.F., Hoh B.L., Lynn M.J., Kwon H.M., Turan T.N., Derdeyn C.P. et al. Factors Associated With Recurrent Ischemic Stroke in the Medical Group of the SAMMPRIS Trial. JAMA Neurol. 2016;73(3):308–315. doi: 10.1001/jamaneurol.2015.4315.
- Kamel H., Pearce L.A., Ntaios G., Gladstone D.J., Perera K., Roine R.O. et al. Atrial Cardiopathy and Nonstenosing Large Artery Plaque in Patients With Embolic Stroke of Undetermined Source. Stroke. 2020;51(3):938–943. doi: 10.1161/strokeaha.119.028154.
- Ntaios G., Perlepe K., Sirimarco G., Strambo D., Eskandari A., Karagkiozi E. et al. Carotid Plaques and Detection of Atrial Fibrillation in Embolic Stroke of Undetermined Source. Neurology. 2019;92(23):e2644–e2652. doi: 10.1212/WNL.0000000000007611.
- Imori Y., Akasaka T., Ochiai T., Oyama K., Tobita K., Shishido K. et al. Co-Existence of Carotid Artery Disease, Renal Artery Stenosis, and Lower Extremity Peripheral Arterial Disease in Patients with Coronary Artery Disease. Am J Cardiol. 2014;113(1):30–35. doi: 10.1016/j.amjcard.2013.09.015.



 1
1 2
2 3
3 4
4


Комментарии (0)