Журнал "Медицинский совет" №11/2021
DOI: 10.21518/2079-701X-2021-11-78-86
А.В. Камаев, ORCID: 0000-0001-9654-3429
О.В. Трусова, ORCID: 0000-0002-0854-1536
И.А. Камаева
Первый Санкт-Петербургский государственный медицинский университет имени академика И.П. Павлова; 197022, Россия, Санкт-Петербург, ул. Льва Толстого, д. 6–8
Основной группой высокого риска постановки диагноза «бронхиальная астма» (БА) являются дети с рецидивирующими обструктивными бронхитами, осложненной формой широко распространенных острых респираторных вирусных инфекций. Базисная терапия БА направлена на подавление воспаления бронхиальной стенки. Кроме ингаляционных глюкокортикостероидов доказанным противовоспалительным действием обладает и антилейкотриеновый препарат монтелукаст. В статье обсуждаются опубликованные работы по влиянию монтелукаста на биомаркеры воспаления в реальной клинической практике и ремоделирование бронхиальной стенки в эксперименте. Приведены сравнительные исследования клинической эффективности антилейкотриенового препарата и ингаляционных глюкокортикостероидов у пациентов разных возрастных групп и фенотипов астмы. Обсуждено использование монтелукаста у детей группы высокого риска формирования БА, по показанию аллергический ринит. Представлены актуальные сведения о риске психиатрических нежелательных явлений на фоне применения антилейкотриенового препарата. Литературный обзор проиллюстрирован собственным наблюдением: на базе диспансерной группы городского аллергокабинета Детской городской поликлиники №44 Санкт-Петербурга в 2018 г. сформирована когорта из 127 пациентов, проведено проспективное наблюдение, которое продолжалось 2 года. Критериями включения были: возраст от 5 лет до 5 лет 11 месяцев (5 ± 0,5 года) и установленный диагноз легкой формы БА. За пациентами на протяжении 2 лет велись наблюдения с оценкой смены базисной терапии, контроля над заболеванием и функциональных показателей, достигнутых на терапии оригинальным препаратом монтелукаста. Приведенное наблюдение показало высокую клиническую эффективность монотерапии БА монтелукастом в группе пациентов дошкольного возраста, что выражалось значительной долей пациентов, не испытывавших обострений БА на протяжении года, высоким баллом по опроснику-тесту по контролю над астмой (Asthma Control Test), статистически не значимым приростом объема формированного выдоха за 1 с после бронхолитика. На сегодняшний день монтелукаст является безопасным, эффективным и широко назначаемым компонентом терапевтической схемы у пациентов с разной степенью тяжести бронхиальной астмы в возрасте старше 2 лет.
Для цитирования:Камаев А.В., Трусова О.В., Камаева И.А. Возрастная эволюция бронхиальной астмы в педиатрической практике и подходы к улучшению прогноза заболевания. Медицинский совет. 2021;(11):78–86. https://doi.org/10.21518/2079-701X-2021-11-78-86.
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Age-related evolution of bronchial asthma in pediatric practice and approaches to improving prognosis
Andrey V. Kamaev, ORCID: 0000-0001-9654-3429
Irina А. Kamaeva,
Оlga V. Trusova, ORCID: 0000-0002-0854-1536
Pavlov First Saint Petersburg State Medical University; 6–8, Lev Tolstoy St., St Petersburg, 197022, Russia
The main high-risk group for a diagnosis of bronchial asthma (BA) are children with recurrent obstructive bronchitis, complicated by a widespread form of acute respiratory viral infections. Basic therapy of BA is aimed at suppressing inflammation of the bronchial wall. In addition to inhaled glucocorticosteroids, the antileukotriene drug montelukast has a proven anti-inflammatory effect. This article discusses published work on the effect of montelukast on inflammation biomarkers in real clinical practice and remodeling of the bronchial wall in the experiment. A comparative study of the clinical efficacy of an antileukotriene drug and inhaled glucocorticosteroids in patients of different age groups and asthma phenotypes is presented. The use of montelukast in children at high risk of developing BA, with an indication for allergic rhinitis, is discussed. Presented current information on the risk of psychiatric AE against the background of using an antileukotriene drug. Literature review is illustrated by our own observation: a cohort of 127 patients was formed on the basis of the dispensary group of the City Allergy Cabinet of the Children’s City Polyclinic No. 44 in St. Petersburg in 2018, a prospective observation was conducted, which lasted 2 years. The inclusion criteria were age of 5 years to 5 years 11 months (5 ± 0.5 years) and an established diagnosis of mild BA. The patients were followed up for 2 years with evaluation of the change of basic therapy, control of the disease and functional indices achieved with therapy with the original drug montelukast. This observation showed high clinical efficacy of montelukast monotherapy in the group of preschool-age patients, which was expressed by a significant proportion of patients who had no exacerbations of BA for a year, a high score on the Asthma Control Test, statistically insignificant increase in forсed expiratory volume in 1 second after bronchodilator. Today Montelukast is a safe, effective and widely prescribed component of therapeutic regimen in patients with varying degrees of severity of bronchial asthma over the age of 2 years.
For citation: Kamaev A.V., Trusova О.V., Kamaeva I.А. Аge-related evolution of bronchial asthma in pediatric practice and approaches to improving prognosis. Meditsinskiy sovet = Medical Council. 2021;(11):78-86. (In Russ.) https://doi.org/10.21518/2079-701X-2021-11-78-86.
Conflict of interest: the authors declare no conflict of interest.
Введение
В основе современных представлений о патогенезе бронхиальной астмы (БА) независимо от возраста дебюта заболевания лежит концепция персистирующего воспаления бронхиальной стенки1 [1]. Основной группой высокого риска постановки диагноза БА являются дети с рецидивирующими обструктивными бронхитами, осложненной формой широко распространенных острых респираторных вирусных инфекций (ОРВИ) [2]. В то же время распространенность обструктивных осложнений ОРВИ выше, чем распространенность БА, у части детей рецидивирующие обструкции могут быть только проявлением возрастных особенностей поствирусной гиперреактивности дыхательной стенки [3]. Согласно опубликованным данным, среди всех зарегистрированных бронхитов у педиатрических пациентов на долю обструктивных приходится не менее трети, при этом среди пациентов первых 6 лет жизни доля бронхитов, осложненных обструкциями, вырастает до 47%, а в возрасте от нуля до 3 лет жизни – до 58% [4].
Экстренная помощь при бронхиальной обструкции аналогична терапии приступа БА у детей и в большинстве случаев не представляет трудностей для практикующего врача [2, 5]. Отметим, что в случае именно обструктивного бронхита, в отличие от приступа астмы, назначения нередко выходят за пределы утвержденных инструкций по применению лекарственных препаратов (off-label), однако разумной альтернативы в настоящее время нет.
Не менее 25% пациентов испытывают рецидивирующие (более трех эпизодов в течение календарного года) обструктивные осложнения ОРВИ [2, 4, 6]. В зависимости от возраста дебютной обструкции, ответа на экстренную терапию и анамнестических маркеров необходимо оценивать риск формирования БА у этих пациентов и, следовательно, планировать начало стартовой профилактической терапии. Ингаляционные глюкокортикостероиды (иГКС), несмотря на высокую эффективность в достижении контроля установленной БА согласно имеющимся данным метаанализов и клинических рекомендаций, в плане профилактики развития астмы оказываются недостаточно эффективными [7, 8].
Ключевым диагностическим критерием БА остается атопический фенотип, т.е. наследственная отягощенность по аллергическим заболеваниями (астме, атопическому дерматиту или аллергическому риниту – АР), личные про- явления атопии (атопический дерматит и/или АР), а также случаи несомненных реакций обструкции на контакт с ингаляционными аллергенами (домашними животными, плесневыми грибками или домашней пылью) [2, 5]. Именно БА является наиболее распространенной причиной рецидивирования обструктивных эпизодов, в то время как на альтернативные хронические пульмонологические заболевания (муковисцидоз, первичная цилиарная дискинезия, туберкулез легких, первичные иммунодефициты, хронический облитерирующий бронхиолит, опухоли или пороки развития бронхов и легких, бронхо-легочная дисплазия и др.) приходится не более 5% случаев рецидивов обструкций бронхов у детей [2, 9].
В реальной клинической практике нужно рационально планировать персонализированный диагностический поиск у пациента с рецидивами обструктивных бронхитов, учитывая данные клиники и анамнеза, однако среди прочих манипуляций необходимы оценка рентгенограммы органов грудной клетки (по показаниям – компьютерной томографии), показателей физического развития в динамике (выраженное отставание характерно для тканевой гипоксии и круга наследственных заболеваний, таких как муковисцидоз/первичная цилиарная дискинезия), показателей насыщения периферической крови кислородом и гемограммы в динамике, а также фиксация объективного ответа (аускультация) на бронхолитическую терапию в медицинских документах врачом [2, 6].
Проведение функциональных тестов, фиксирующих выраженность и обратимость обструкции, для целевой группы высокого риска БА (дошкольники в возрасте 2–5 лет) представляет определенные трудности. Классическая спирометрия рекомендована к использованию и имеет утвержденные нормативы только для пациентов старше 5 лет; метод импульсной осциллометрии стандартизован для пациентов в возрасте 4 лет и старше, однако аппараты для его выполнения не очень широко распространены [10]. Даже у пациентов раннего возраста возможна оценка проходимости бронхов с помощью компьютерной бронхофонографии, но практическое применение этого исследования ограничено риском артефактов [11]. Независимо от метода объектив- ной регистрации обструкции для диагностики БА принципиально выполнение теста с бронхолитиком [1, 5].
У пациентов младшего возраста (2–5 лет) из группы высокого риска БА обоснованным и широко используемым лечебно-диагностическим методом является проведение курса пробной противовоспалительной терапии. Такой подход обоснован, в частности, современным пониманием сохранения воспаления в бронхиальной стенке и вне периода яркой клинической манифестации, в ремиссию2 [12]. Оценка эффективности пробного курса противовоспалительной терапии включает в себя и часто- ту ОРВИ, и частоту обструктивных осложнений, и объем экстренной фармакотерапии, потребовавшийся для купирования каждого из эпизодов обструкции. Актуальные клинические рекомендации не регламентируют практический алгоритм назначения противоастматических препаратов до постановки диагноза БА [1]. Теоретически такая манипуляция требует представления ребенка на врачебную комиссию и получения информированного согласия родителей, что не всегда реализуется в практическом здравоохранении.
Монтелукаст обладает доказанной противовоспалительной активностью в отношении аллергического воспаления в дыхательных путях. При этом его противовоспалительная эффективность может быть сравнима с иГКС у пациентов с легким течением БА. Так, в японском исследовании представлены данные по биомаркерам воспаления (оксид азота выдыхаемого воздуха, FeNO; эозинофилы мокроты и гиперреактивность бронхов в тесте с метахолином) у пациентов с впервые зарегистрированной ранее нелеченной легкой БА до начала терапии и в ходе 6 мес. лечения либо монтелукастом в возрастной дозе, либо будесонидом 400 мкг/сут. Показано не только отсутствие клинических различий (по дневным/ночным симптомам БА, потребности в экстренных препаратах), но и статистически не различающееся влияние на средние в группах показатели FeNO, эозинофилов мокроты и порога чувствительности в тесте с метахолином после полугода лечения монтелукастом в сравнении с низкой дозой иГКС [13].
В экспериментальном исследовании на модели астмы на мышах сравнивали группы, у которых первое воздействие аллергена пришлось на незрелый возраст (аналог педиатрической популяции) и на зрелый возраст (аналог терапевтической популяции). Изучали наличие воспали- тельных клеток в жидкости бронхоальвеолярного лаважа, а также признаки ремоделирования: толщину гладкомышечного слоя бронхов, наличие фиброза и сократимость бронхиальной стенки в тесте с метахолином. Параллельно такие же группы животных получали аллергенные провокации вместе с лечением монтелукастом. Показано, что воздействие аллергена в более раннем возрасте приводило к более выраженным признакам ремоделирования бронхиальной стенки; при этом монтелукаст статистически значимо снижал количество эозинофилов в бронхоальвеолярном лаваже и степень утолщения гладкомышечного слоя в бронхиальной стенке. Авторы сделали вывод о значимом положительном профилактическом воздействии долгосрочной терапии монтелукастом в отношении бронхиального ремоделирования, особенно в педиатрической практике [14].
Исходя из представленных выше данных, особенную важность имеет раннее назначение противовоспалительной терапии, в том числе при легком интермиттирующем течении БА, а у части пациентов атопического фенотипа из группы высокого риска – при подозрении на диагноз астмы, до его верификации, при наличии установленного диагноза АР (в педиатрической практике его коморбидность астме превышает 90% пациентов). Раздел показаний в инструкции к применению лекарственного препарата оригинального монтелукаста, Сингуляра, содержит пункт «облегчение дневных и ночных симптомов аллергического ринита». Принимая во внимание концепцию единства воспалительного процесса в дыхательных путях, а также эпидемиологические данные о высокой (более 90% пациентов) распространенности АР, коморбидного и нередко предшествующего БА у детей, можно рекомендовать специалистам активный поиск и целенаправленную диагностику этого заболевания у детей с рецидива- ми обструктивных бронхитов [1, 2, 15]. Установление диагноза АР открывает врачу практического здравоохранения возможность рутинного назначения противовоспалительного препарата (Сингуляра) в соответствии с инструкцией для лечения аллергического воспаления как верхних, так и нижних дыхательных путей. Начало именно противовоспалительной, а не симптоматической (бронходилатационной) терапии положительно сказывается на частоте рецидивов обструктивных осложнений ОРВИ, сохранении социализации ребенка и возможности посещения детского дошкольного учреждения, снижении лекарственной нагрузки во время ОРВИ. При этом у большинства пациентов с рецидивирующими обструктивны- ми бронхитами, которым впоследствии был установлен диагноз БА, присутствовал АР [2, 6, 15].
В опубликованном в 2006 г. двойном слепом плацебо-контролируемом рандомизированном исследовании было показано значимое снижение риска обострений БА, связанных с пиком респираторных инфекций, регистрируемых при возвращении детей в коллективы после лет- них каникул. Исследование включило 194 пациента разного возраста, монтелукаст или соответствующее ему плацебо назначались как в монотерапии, так и в дополнение к базисному лечению иГКС. Отметим выраженную возрастную зависимость эффективности разных режимов монтелукаста, зафиксированную в этой публикации: наибольшей эффективности в монотерапии Сингуляр достиг в группе пациентов 2–5 лет, в то время как при добавлении к иГКС значимые различия с плацебо получены толь- ко для группы пациентов 10–14 лет [16].
Важность персонализированного назначения монтелукаста с учетом не только возраста, но и степени тяжести астмы подчеркивается в публикации японских авторов 2013 г. В двойном слепом плацебо-контролируемом рандомизированном исследовании, включившем более 420 пациентов с астмой, не было получено значимых различий между группами по частоте обострений БА на фоне ОРВИ, хотя зафиксирован тренд положительного влияния монтелукаста. При этом статистически значимо реже в группе активной терапии встречались обострения БА, не связанные с ОРВИ (вызванные контактами с аллергенами или физической нагрузкой), а также легкие обострения астмы (не получено различий для обострений средней тяжести) [17]. плацебо-контролируемых рандомизированных исследований, включивших 4689 пациентов, показал, что Сингуляр в сравнении с плацебо статистически значимо снижал частоту обострений БА, увеличивал показатели спирометрии, в частности объем форсированного выдоха за первую секунду, а также снижал потребность в препаратах экстренной помощи и частоту дневных симптомов БА. Рассматривались как протоколы монотерапии монтелукастом, так и исследования у пациентов с большей тяжестью БА, где препарат добавлялся к терапии иГКС [18].
В случае проведения пробного противовоспалительного курса лечения (до постановки диагноза БА у пациентов с верифицированным АР) для принятия диагностического решения о наличии у ребенка БА большое значение имеет применение оригинального препарата монтелукаста, Сингуляра. В противном случае отсутствие клинического ответа может быть связано не только с неэффективностью лекарственного вещества, но и с изменениями всасывания и других фармакокинетических параметров монтелукаста [19]. Эти проблемы ограничивают практикующего врача в принятии клинического решения о продолжении противовоспалительной терапии, могут быть причиной госпитализаций и увеличения лекарственной нагрузки на ребенка. Также неактивные компоненты основы могут быть причиной аллергических или токсико-аллергических реакций у пациента атопического фенотипа. Крупные международные многоцентровые исследования, в том числе цитируемые в настоящей публикации, выполнены с использованием оригинального препарат монтелукаста – Сингуляра компании «Мерк, Шарп и Доум».
В марте 2020 г., после публикации предупреждения со стороны Управления по контролю пищевых продуктов и лекарств в США (FDA), вновь стала актуальной тема безопасности антилейкотриеновых препаратов3. Отметим, что в выпущенном сообщении говорится только об ограничении использования монтелукаста в качестве монотерапии при АР и не поднимается вопрос о его использовании при БА. Документ рекомендует практикующим врачам обращать внимание на анамнез пациентов в отношении нервно-психиатрических событий и рисков, а также избегать назначения монтелукаста пациентам, ранее проявлявшим суицидальное поведение и/или другие психиатрические отклонения, например выраженную депрессию. Очевидно, что такие предупреждения мало меняют круг кандидатов на терапию монтелукастом в педиатрической практике.
Кроме того, уже в 2021 г. опубликован анализ крупной американской базы данных пациентов, содержащей сообщения о различных нежелательных явлениях (НЯ), Sentinel [20]. Исследованы сообщения о НЯ за период с 2000 по 2015 г., полученные от 457 377 пациентов с БА старше 6 лет, которые получали лечение либо монтелукастом, либо иГКС, либо сочетанием этих лекарственных средств. Показатели относительного риска (и 95% доверительного интервала) для пациентов, получавших монтелукаст, в сравнении с группой иГКС в отношении таких событий, как «депрессия», «депрессия, потребовавшая госпитализации» и «самоповреждение», составили 0,91 [0,89; 0,93], 1,06 [0,9; 1,24] и 0,92 [0,69; 1,21] соответственно. Таким образом, статистически значимых различий между различными режимами противовоспалительной терапии БА не получено, а абсолютные частоты, например суицидальных попыток, были крайне низкими и не различались между группами.
Опираясь на собственный положительный клинический опыт и имеющиеся международные руководства, ведущие российские эксперты опубликовали в 2020 г. критический анализ предупреждения американского регулятора [21]. Подчеркивая важность тщательного учета любых НЯ, развивших в ходе использования противоастматических лекарственных средств, авторы отмечают, что описательный характер имеющихся сообщений не позволяет сделать уверенный вывод о взаимосвязи приема монтелукаста и развития психиатрических НЯ. Этот вывод подтверждается и оригинальным исследованием тайваньских авторов, изучавших связь между использованием монтелукаста и наиболее распространенной формой психиатрических нарушений у детей – синдромом дефицита внимания с гиперактивностью (СДВГ). В национальном регистре, содержащем более 1 млн медицинских записей, отобраны 54 487 случая БА у детей 12 лет и младше; далее из этой группы сформированы 2 выборки (получавших и не получавших монтелукаст) по 12 806 детей, сопоставимые по возрасту, коморбидным атопическому дерматиту АР и частоте экстренных госпитализаций в обострении БА. Частота регистрации СДВГ составила 634 (М+) и 610 (М-) случаев, показатель относительного риска (95% доверительный интервал) составил 1,04 [0,93; 1,17]. Авторы подчеркивают, что в группе монтелукаста удлинение сроков терапии не приводило к увеличению риска СДВГ [22].
Профессиональные ассоциации врачей разных специальностей, работающих с пациентами с БА, опубликовали свои комментарии в связи с предупреждением FDA, вошедшим также в свежую редакцию Глобальной инициативы по БА (GINA-2020). В заключении экспертов Российской ассоциации аллергологов и клинических иммунологов подчеркивается достаточность имеющихся данных международных исследований и реальной клинической практики применения монтелукаста для сохранения его в арсенале практикующих врачей. Также авторы отмечают важность наличия альтернативы иГКС среди противовоспалительных противоастматических препаратов для обеспечения персонализации базисной терапии БА. Описаны отдельные фенотипы астмы, при которых добавление монтелукаста в базисную терапию может быть особенно эффективным. Многие из них высоко актуальны для педиатрической практики: воз- действие табачного дыма (пассивное курение), вирус- индуцированная БА и реакции бронхоспазмом на физическую нагрузку [23].
Проиллюстрируем описанные положения собственным наблюдением. На базе диспансерной группы городского аллергокабинета Детской городской поликлиники №44 Санкт-Петербурга в 2018 г. сформирована когорта из 127 пациентов, проспективное наблюдение которой продолжалось 2 года. Критериями включения были: возраст от 5 лет до 5 лет 11 месяцев (5 ± 0,5 года) и установленный диагноз легкой формы БА. Критериями исключения были наличие госпитализаций в отделения реанимации и интенсивной терапии в приступе БА в анамнезе, выраженное (менее 25 перцентиля) отставание в показателях роста и веса ребенка от возрастных нормативов, наличие дома животного при подтвержденной (специфические IgE или кожные аллергопробы) сенсибилизации, изолированная пыльцевая сенсибилизация, неконтролируемое течение БА.
При включении, учитывая характер текущей базисной терапии, сформированы 3 группы пациентов: низкие дозы иГКС, постоянный прием (32 ребенка); низкие/средние дозы иГКС, курсовой прием (2–4 нед.) при обострениях БА (43 пациента) и группа Сингуляра (52 ребенка). Основные клинико-анамнестические характеристики включенных пациентов представлены в табл. 1.
Таблица 1. Клинико-анамнестические характеристики включенных пациентов
Мальчики, n (%) | 25 (78,1) | 33 (76,7) | 34 (65,4) |
АР, n (%) | 28 (87,5) | 34 (79,1) | 52 (100) |
Полисенсибилизация*, n (%) | 22 (68,7) | 25 (58,1) | 38 (73,1) |
Средняя длительность обострений БА за прошедший год, недели, М ± σ | 9,2 ± 2,1 | 11,4 ± 3,6 | 7,9 ± 1,8 |
Средний срок от первого обструктивного бронхита до постановки диагноза БА, годы, М ± σ | 1,4 ± 0,6 | 1,9 ± 0,4 | 0,9 ± 0,7 |
* Сенсибилизация более чем к одной группе ингаляционных аллергенов: бытовые (клещи домашней пыли, книжная/домашняя пыль), эпидермальные (кошки, собаки, грызуны), грибковые или пыльцевые.
Из сведений анамнеза отметим, что в группе Сингуляра интервал от первого эпизода обструкции до постановки диагноза БА был несколько короче; кроме того, нередко практикующие врачи начинали терапию Сингуляром до постановки диагноза БА, по показанию АР. Интересно, что при распределении по специальности наблюдающего врача до постановки диагноза БА в группе Сингуляра преобладали аллергологи, а в группе интермиттирующей терапии иГКС – участковые педиатры. Также для пациентов, получавших Сингуляр, характерно тотальное выявление коморбидного БА АР и широкий спектр сенсибилизации к аэроаллергенам. Возможно, это связано с длительным наблюдением аллергологами пациентов, формирующих астму в структуре «атопического марша», и более ранним назначением противовоспалительной базисной терапии врачами этой специальности.
В рамках диспансерного наблюдения проводили два плановых визита в год (октябрь и апрель), где учитывали число и длительность эпизодов ОРВИ, потребность в экстренной терапии (фенотерол/ипратропий ± будесонид) и длительность ее использования, НЯ, наличие госпитализаций по поводу обострений БА, выполняли спирометрию с пробой с сальбутамолом, родители заполняли опросник-тест по контролю над астмой (Asthma Control Test – АСТ), учитывали случаи отказа от лечения или перерывов в базисной терапии по немедицинским при- чинам (некомплаентность). Работа носила описательно- регистрационный характер, назначения базисной терапии выполнялись согласно актуальным руководствам [1, 5] по ведению БА у детей, при наличии показаний объем базисной терапии уменьшали или увеличивали.
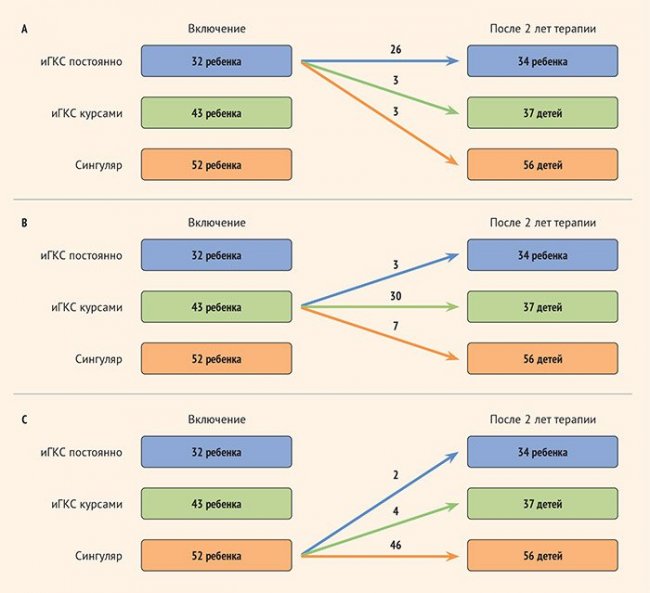
По результатам 2 лет наблюдения не отмечено случаев НЯ, потребовавших отмены терапии Сингуляром, в том числе психиатрических НЯ и/или эмоциональных реакций. В группе постоянного приема иГКС основным НЯ был кандидоз слизистой полости рта (3 пациента), который купировался использованием спейсера и коррекцией техники ингаляции. Из группы 1 (постоянные иГКС) сохранили терапию без изменений 26 (81,5%) детей, при этом трех пациентов перевели в группу интермиттирующих иГКС и трех – в группу Сингуляра (рис. А).
Из группы 2 (интермиттирующие иГКС) сохранили терапию без изменений 30 (69,8%) детей, при этом трех пациентов перевели в группу постоянных иГКС и семерых – в группу Сингуляра (рис. В). В группе 3 (Сингуляр) самая большая доля пациентов сохранила базисную терапию – 46 (88,5%) детей; трое детей потребовали постоянных иГКС и четверо – интермиттирующих курсов иГКС (рис. С).
Рисунок. Переходы пациентов между группами терапии по результатам 2 лет наблюдения
После завершения 2-летнего наблюдения у каждого из пациентов оценивали показатели, характеризующие контроль за воспалительным процессом бронхов, функциональное состояние дыхательной системы и течение обострений БА. Средние групповые значения основных показателей приведены в табл. 2.
Таблица 2. Характеристики контроля астмы, средние значения в группах по данным завершающего года наблюдения
Доля пациентов, не имевших обострений БА, n (%) | 25 (78,1) | 33 (76,7) | 34 (65,4) |
Средняя длительность применения КДБА за год, недель, М ± σ | 28 (87,5) | 34 (79,1) | 52 (100) |
Применение интраназальных ГКС пациентами с АР, месяцев в год, М ± σ | 22 (68,7) | 25 (58,1) | 38 (73,1) |
* Доля пациентов с исходным ОФВ1 более 100% от табличной нормы, n (%) | 9,2 ± 2,1 | 11,4 ± 3,6 | 7,9 ± 1,8 |
Прирост ОФВ1, % от исходного, %, М ± σ | 1,4 ± 0,6 | 1,9 ± 0,4 | 0,9 ± 0,7 |
Результаты АСТ, баллы, М ± σ | 22,5 ± 3,1 | 20,8 ± 3,6 | 23,1 ± 1,8 |
Комплайенс к базисной терапии, %, М ± σ | 73,4 ± 11,5 | 94,1 ± 6,9 | 90,7 ± 7,5 |
* На завершающем визите.
Приведенное наблюдение показало клиническую эффективность монотерапии Сингуляром в группе пациентов дошкольного возраста, что проявлялось значительной долей пациентов, не испытывавших обострений БА на протяжении года, высоким баллом опросника АСТ, статистически не значимым приростом объема формированного выдоха за 1 с (ОФВ1) после бронхолитика. По этим показателям результаты группы Сингуляра (3) незначительно уступили группе постоянной терапии иГКС (1) и существенно превзошли группу пациентов, получавших иГКС в интермиттирующем режиме (2). Очевидно, что последний режим, хоть и поддерживался большинством пациентов с высоким уровнем приверженности, не обеспечивал достаточного контроля воспаления на продолжительных временных интервалах. У группы пациентов, получавших Сингуляр, также был зафиксирован высокий уровень комплайенса, значительно превосходящий уровень комплайенса пациентов, получавших иГКС постоянно. Важным преимуществом Сингуляра явилось и снижение лекарственной нагрузки у пациентов с коморбидным БА АР – продолжительность использования интраназальных стероидов более чем в 2 раза ниже, чем в обеих группах иГКС.
Заключение
Во всех актуальных российских и международных руководствах по лечению и профилактике БА присутствует монтелукаст. Для педиатрических пациентов принципиально важно его доказанное противовоспалительное действие, возможность назначения пациентам группы высокого риска формирования БА с профилактической целью, по показанию АР. После верификации диагноза астмы именно раннее начало эффективной базисной терапии прямо положительно влияет на прогноз течения БА, длительное сохранение функции легких, возможность заниматься спортом и вести образ жизни, неотличимый от сверстников без БА. Для пациентов разных возрастных групп применение оригинального препарата монтелукаста, Сингуляра, привлекательно пероральной формой приема, отсутствием рисков ошибок в технике ингаляции, удобством контроля за ежедневным использованием лекарственного препарата со стороны родителей. Длительный опыт практического применения в терапии респираторной аллергии, возможность одновременного контроля иммунологического воспаления как верхних, так и нижних дыхательных путей, применение как в моно- терапии, так и в виде усиления препаратов иГКС обеспечивают большое доверие к Сингуляру со стороны практикующих врачей.
1 Gobal Initiative for Asthma. Global Strategy for Asthma Management and Prevention, 2020. Available from: https://ginasthma.org/wp-content/uploads/2020/04/GINA-2020-full-report-final-wms.pdf.
2 Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention, 2020. Available from: https://ginasthma.org/wp-content/uploads/2020/04/GINA-2020-full-report-final-wms.pdf.
3 FDA requires Boxed Warning about serious mental health side effects for asthma and allergy drug montelukast (Singulair); advises restricting use for allergic rhinitis. Available at: https:// www.fda.gov/drugs/drug-safety-and-availability/fda-requires-boxed-warning-about-serious-mental-healt.
Список литературы / References
- Чучалин А.Г., Авдеев С.Н., Айсанов З.Р., Белевский А.С., Васильева О.С., Геппе Н.А. и др. Бронхиальная астма: федеральные клинические рекомендации. Режим доступа: https://spulmo.ru/download/asthma2018.pdf.
- Малахов А.Б. и др. Бронхиальная обструкция на фоне острой респираторной инфекции у детей дошкольного возраста: диагностика, дифференциальная диагностика, терапия и профилактика. М.: МедКомПро; 2019. 200 с. Режим доступа: https://expo-books.ru/category/book?id=13603.
- Granell R., Henderson A.J., Sterne J.A. Associations of wheezing phenotypes with late asthma outcomes in the Avon Longitudinal Study of Parents and Children: A population-based birth cohort. J Allergy Clin Immunol. 2016;138(4):1060–1070. https://doi.org/10.1016/j.jaci.2016.01.046.
- Блохин Б.М. (ред.). Детская пульмонология: национальное руководство. М.: ГЭОТАР-Медиа; 2021. 960 с. Режим доступа: https://www.rosmedlib.ru/book/ISBN9785970458570.html.
- Чучалин А.Г., Геппе Н.А., Колосова Н.Г., Кондюрина Е.Г., Малахов А.Б., Мизерницкий Ю.Л., Ревякина В.А. (ред.). Национальная программа «Бронхиальная астма у детей. Стратегия лечения и профилактика». 5-е изд. М.: Оригинал-макет; 2017. 160 с. Режим доступа: http://astgmu.ru/wp-content/uploads/2018/10/Natsionalnaya-programma-BA-u-detej.-Strategiya-lecheniya-i-profilaktika.pdf.
- Локшина Э.Э., Зайцева О.В. Рекуррентные (повторные) эпизоды бронхиальной обструкции у детей: дебют хронических заболеваний органов дыхания у взрослых? Вопросы практической педиатрии. 2020;15(6):79–89.
https://doi.org/10.20953/1817-7646-2020-6-79-89. - Cloutier M.M., Baptist A.P., Blake K.V., Brooks E.G., Bryant-Stephens T., DiMango E. et al. 2020 focused updates to the asthma management guidelines: a report from the National Asthma Education and prevention program coordinating committee expert panel working group. J Allergy Clin Immunol. 2020;146(6):1217–1270. https://doi.org/10.1016/j.
jaci.2020.10.003. - Abrams E.M., Szefler S.J., Becker A.B. Does inhaled steroid therapy help emerging asthma in early childhood? Lancet Respir Med. 2017;5(10): 827–834. https://doi.org/10.1016/S2213-2600(17)30295-3.
- Fainardi V., Santoro A., Caffarelli C. Preschool Wheezing: Trajectories and Long-Term Treatment. Front Pediatr. 2020;8:240. https://doi.org/10.3389/fped.2020.00240.
- Дьякова С.Э., Мизерницкий Ю.Л. Новые возможности исследования функции внешнего дыхания у детей. Российский вестник перинатологии и педиатрии. 2018;63(4):79–83. https://doi.org/10.21508/1027-4065-
2018-63-4-79-83. - Малышев В.С., Мельникова И.М., Мизерницкий Ю.Л., Доровская Н.Л., Павленко В.А., Павликов А.А., Удальцова Е.В. Опыт использования компьютерной бронхофонографии в педиатрической практике. Медицинский совет.
2019;(2):188–193. https://doi.org/10.21518/2079-701X-2019-2-188-193. - Hallas H.W., Chawes B.L., Rasmussen M.A., Arianto L., Stokholm J., Bønnelykke K., Bisgaard H. Airway obstruction and bronchial reactivity from age 1 month until 13 years in children with asthma: A prospective birth cohort study. PLoS Med. 2019;16(1):e1002722. https://doi.org/10.1371/journal.pmed.1002722.
- Shimoda T., Obase Y., Matsuse H., Kishikawa R., Shoji S., Nishima S. A Study of the Usefulness of Anti-inflammatory Treatment for Mild Intermittent Asthma (Step 1): Budesonide vs. Montelukast. Allergology International.
2005;54(1):123–130. https://doi.org/10.2332/allergolint.54.123. - Debelleix S., Siao-Him Fa V., Begueret H., Berger P., Kamaev A., Ousova O. et al. Montelukast reverses airway remodeling in actively sensitized young mice. Pediatr Pulmonol. 2018;53(6):701–709. https://doi.org/10.1002/ppul.23980.
- Иванова Н.А. Рецидивирующая обструкция бронхов и бронхиальная астма у детей первых пяти лет жизни. Российский вестник перинатологии и педиатрии. 2016;61(5):64–69. https://doi.org/10.21508/1027-4065-
2016-61-5-64-69. - Johnston N.W., Mandhane P.J., Dai J., Duncan J.M., Greene J.M., Lambert K., Sears M.R. Attenuation of the September Epidemic of Asthma Exacerbations in Children: A Randomized, Controlled Trial of Montelukast Added to Usual Therapy. Pediatrics. 2007;120(3):e702–714. https://doi.org/10.1542/peds.2006-3317.
- Matsuse H., Tsuchida T., Fukahori S., Kawano T., Tomari S., Matsuo N. et al.
Retrospective cohort study of leukotriene receptor antagonist therapy
for preventing upper respiratory infection-induced acute asthma exacerbations. Allergy Rhinol (Providence). 2013;4(3):e127–e131. https://doi.org/10.2500/ar.2013.4.0062. - Miligkos M., Bannuru R.R., Alkofide H., Kher S.R., Schmid C.H., Balk E.M. Leukotriene-receptor antagonists versus placebo in the treatment of asthma in adults and adolescents, a systematic review and meta-analysis. Ann
Intern Med. 2015;163(10):756–767. https://doi.org/10.7326/M15-1059. - Давыдова К.С. Оригинальные и воспроизведенные лекарственные средства – реалии современного фармацевтического рынка. Ремедиум. 2011;(2):73–74. Режим доступа: https://cyberleninka.ru/article/n/originalnye-
i-vosproizvedennye-lekarstvennye-sredstva-realii-sovremennogo-farmatsevticheskogo-rynka/viewer. - Sansing-Foster V., Haug N., Mosholder A., Cocoros N.M., Bradley M., Ma Y. et al. Risk of Psychiatric Adverse Events Among Montelukast Users. J Allergy Clin Immunol Pract. 2021;9(1):385–393. https://doi.org/10.1016/j.
jaip.2020.07.052. - Бродская О.Н., Макарова М.А., Белевский А.С. Монтелукаст: опасения нуждаются в доказательствах. Практическая пульмонология. 2020;(1): 107–116. Режим доступа: https://www.elibrary.ru/item.asp?id=43863896.
- Huang P.Y., Yang Y.H., Huang Y.H., Kuo H.C., Wang L.J., Chien S.J., Chang L.S. Montelukast does not increase the risk of attention-deficit/hyperactivity disorder in pediatric asthma patients: A nationwide population-based
matched cohort study. J Formos Med Assoc. 2021;120(6):1369–1376. https://doi.org/10.1016/j.jfma.2020.10.018. - Ильина Н.И., Курбачёва О.М., Ненашева Н.М., Астафьева Н.Г., Бельтюков Е.К., Демко И.В. и др. Безопасность и эффективность антилейкотриеновых препаратов: актуальные данные. Заключение экспертов РААКИ. Российский аллергологический журнал. 2020;17(3):121–129. https://doi.org/10.36691/RJA1395.




 1
1 2
2 3
3 4
4


Комментарии (0)