Журнал "Медицинский совет" №1/2022
DOI: 10.21518/2079-701X-2022-16-1-243-249
Ю.Ю. Соколов1, С.В. Стоногин2
С.А. Коровин1, Е.Е. Бибикова1
А.В. Дзядчик2, Е.А. Таширова2
Ж.Р. Омарова3
1 Российская медицинская академия непрерывного профессионального образования; 125993, Россия, Москва, ул. Баррикадная, д. 2/1, стр. 1
2 Детская городская клиническая больница имени З.А. Башляевой; 125373, Россия, Москва, ул. Героев Панфиловцев, д. 28
3 Детская городская клиническая больница имени Святого Владимира; 107014, Россия, Москва, ул. Рубцовско-Дворцовая, д. 1/3
Лимфатические мальформации – доброкачественные новообразования, формирующиеся в результате нарушения формирования эмбриональных лимфатических мешочков в процессе эмбриогенеза. Внутренняя локализация лимфангиом и лимфгемангиом (висцеральные формы) наблюдается редко, она не превышает 8–15% от всех наблюдаемых лимфангиом у детей. Из висцеральных форм чаще в процесс вовлекаются кишечник, брыжейка, селезенка, сальник, печень, реже – лимфатические сосуды и лимфоузлы средостения и забрюшинная клетчатка. Клиника лимфатических мальформаций многообразная и зависит от их локализации, возраста больных, развития осложнений. При осложнениях клиника «острого живота» диктует необходимость проведения экстренного хирургического вмешательства, в ходе которого уточняется диагноз и объем оперативного пособия. В статье представлено редкое клиническое наблюдение абдоминальной стеблевидной перекрученной некротизированной сосудистой мальформации у мальчика 14 лет, поступившего в инфекционное отделение с жалобами на повышение температуры, слабость, боли в животе, боль в горле, разжиженный стул. В ходе выполнения лапароскопической аппендэктомии выявлено объемное образование, исходящее из брыжейки восходящей ободочной кишки и перекрученное вокруг сосудистой ножки на три оборота. Данное образование удалено лапароскопически. При гистологическом и иммуногистохимическом исследовании подтвержден диагноз лимфатико-венозной мальформации. Признаков малигнизации лимфатической мальформации в литературе не описано. Однако, несмотря на доброкачественный характер, лимфатические мальформации обладают склонностью к инфильтративному росту, нередко рецидивируют, порой подвергаются инфицированию. В доступной литературе нет должного освещения и анализа результатов лечения интраабдоминальных лимфатических мальформаций с использованием эндовидеотехнологий. Трансабдоминальный доступ обеспечивает наилучший оперативный простор, свободу движений и четкость анатомических ориентиров. Основными преимуществами перед открытым доступом являются минимальная травма передней брюшной стенки и быстрая реабилитация больных.
Для цитирования: Соколов Ю.Ю., Стоногин С.В., Коровин С.А., Бибикова Е.Е., Дзядчик А.В., Таширова Е.А., Омарова Ж.Р. Клиническое наблюдение абдоминальной стеблевидной перекрученной некротизированной сосудистой мальформации
у мальчика 14 лет. Медицинский совет. 2022;16(1):243–249. https://doi.org/10.21518/2079-701X-2022-16-1-243-249.
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Laparoscopic removal of twisted necrotic pedunculate vascular malformation of the ascending colon in a 14-year-old boy
Yuri Yu. Sokolov1, Sergey V. Stonogin2
Sergey A. Korovin1, Elizaveta E. Bibikova1
Alexander V. Dzyadchik2, Ekaterina A. Tashirova2
Zhanna R. Omarova3
1 Russian Medical Academy of Continuous Professional Education; 2/1, Bldg. 1, Barrikadnaya St., Moscow, 125993, Russia
2 Bashlyaeva City Children’s Clinical Hospital; 28, Geroev Panfilovtsev St., Moscow, 125373, Russia
3 Moscow Clinical Municipal Children Hospital St. Vladimir; 1/3, Rubtsovsko-Dvortsovaya St., Moscow, 107014, Russia
Lymphatic malformations are benign neoplasms that form as a result of impaired formation of embryonic lymphatic sacs during embryogenesis. Lymphangiomas and lymphgemangiomas (visceral forms) rarely develop in the intra-abdomen, such localization does not exceed 8–15% of all observed lymphangiomas in children. Among the visceral forms are more common the forms that involve intestines, mesentery, spleen, omentum, liver in the pathological process, less often the lymphatic vessels and lymph nodes of the mediastinum, and retroperitoneal tissue. The clinical presentation of lymphatic malformations is multivaried and depends on their localization, the patient age, and the development of complications. In case of complications, the clinic manifestation of “acute abdomen” requires emergency surgical intervention, during which the diagnosis and scope of surgical treatment are specified. a 14-year-old boy was admitted to the department of infectious diseases with complaints of fever, weakness, abdominal pain, sore throat and loose stools. Previously, the patient had complaints of abdominal pain for a year; ultrasound examination of the abdominal cavity was performed repeatedly, in which no pathological changes were detected. The patient underwent laparoscopic appendectomy; During the revision of the abdominal cavity, a space-occupying lesion emerging from the mesentery of the ascending colon and twisted around the vascular pedicle by 3 turns was revealed. Education removed. Histological and immunohistochemical examination confirmed the diagnosis of lymphatic-venous malformation. No signs of malignancy of lymphatic malformations are described in the literature. However, though lymphatic malformations are benign in nature, they tend to have an infiltrative growth pattern, often relapse, and sometimes become infected. The available literature doesn’t provide a proper description and analysis of the results of treatment of intra-abdominal lymphatic malformations using endovideo technologies. Transabdominal access provides the best exposure of the complete surgical field, freedom of movement and clarity of anatomical landmarks. The main advantages over open abdominal surgery are minimal trauma to the anterior abdominal wall and rapid rehabilitation of patients.
For citation: Sokolov Yu.Yu., Stonogin S.V., Korovin S.A., Bibikova E.E., Dzyadchik A.V., Tashirova E.A., Omarova Zh.R. Laparoscopic removal of twisted necrotic pedunculate vascular malformation of the ascending colon in a 14-year-old boy. Meditsinskiy sovet = Medical Council. 2022;16(1):243–249. (In Russ.) https://doi.org/10.21518/2079-701X-2022-16-1-243-249.
Conflict of interest: the authors declare no conflict of interest.
Введение
Лимфатические мальформации (ЛМ) – доброкачественные новообразования, формирующиеся из лимфатических сосудов в результате дизэмбриогенеза начиная с 6-й нед. перинатального периода [1]. Данная патология обычно диагностируется при рождении, но может выявляться в любом возрасте, в т.ч. пренатально при ультразвуковом исследовании плода. Ранняя диагностика данной патологии у детей старшего возраста довольно трудна. Распространенность данных образований у новорожденных и детей раннего возраста составляет 1 на 60 000, в то время как для старших детей и взрослых характерна гораздо более низкая встречаемость – 1/200 000–250 000; соотношение мальчиков и девочек среди пациентов с ЛМ составляет 3:1 [2]. Несмотря на доброкачественный характер, ЛМ обладают склонностью к инфильтративному росту, нередко рецидивируют, порой подвергаются инфицированию. Клинические проявления варьируют от бессимптомного течения до симптомов «острого живота».
Представляем вашему вниманию чрезвычайно редкое клиническое наблюдение абдоминальной стеблевидной перекрученной некротизированной сосудистой мальформации у мальчика 14 лет.
Клинический случай
Мальчик 14 лет поступил в инфекционное отделение с жалобами на повышение температуры, слабость, боли в животе, боль в горле, разжиженный стул. Со слов мальчика, в течение года он наблюдался в другом лечебном учреждении по поводу периодической боли в животе. Неоднократно выполнялось УЗИ брюшной полости, при котором объемных образований не выявляли.
Общее состояние средней тяжести. Температура тела 37 ºС. Аппетит снижен. Правильного телосложения, повышенного питания. Зев гиперемирован. Миндалины гипертрофированы, отечны, с двух сторон сероватые наложения в лакунах. Живот правильной формы, не вздут, при пальпации мягкий, болезненный в правой подвздошной области.
В анализе крови лейкоцитоз 10,6 × 109/л. При УЗИ брюшной полости сосудистый рисунок печени значительно усилен. В верхнем отделе латерального канала ретроцекально определяется тубулярная, аперистальтическая структура со слоистыми стенками диаметром до 20 мм, окруженная эхогенными тканями. Петли кишечника в правой половине брюшной полости инфильтрированы, отечны, стенки их утолщены. Перистальтика в измененных отделах ослаблена. Свободная жидкость – над мочевым пузырем скоплением 86 х 39 мм.
Заключение: эхопризнаки острого аппендицита.
Пациенту выполнена экстренная лапароскопия. При ревизии обнаружено, что в печеночном углу ободочной кишки большой сальник окутывает округлое образование (рис. 1).
Рисунок 1. Интраоперационное фото – стеблевидной формы объемное образование темного цвета. Видна длинная ножка объемного образования, исходящая из большого сальника, вокруг которой оно было перекручено
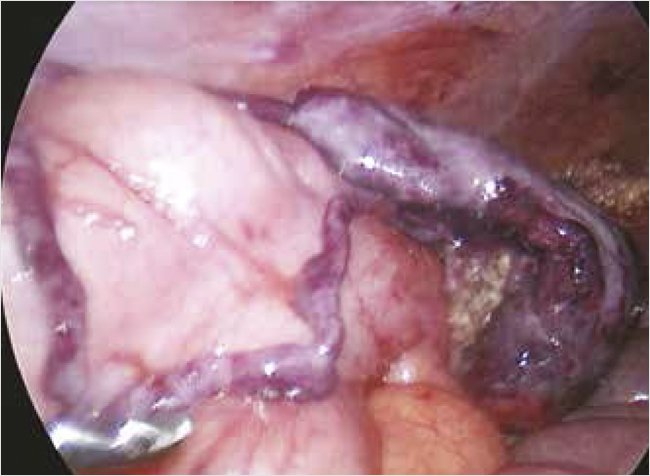
Большой сальник отделен мягким зажимом. При ревизии обнаружено, что округлое объемное образование размером 5 х 4 х 3 см темного цвета хрящевидной плотности перекручено на три оборота вокруг тонкой ножки длиной 5 см и диаметром 4 мм, идущей к пряди большого сальника сверху, а с другой стороны вокруг тонкой ножки длиной З см и диаметром 4 мм, идущей в брыжеечный край восходящей ободочной кишки на расстоянии 25 см от илеоцекального угла (рис. 2).
Рисунок 2. Интраоперационное фото – видна короткая ножка кистозного образования в области брыжеечного края восходящей ободочной кишки
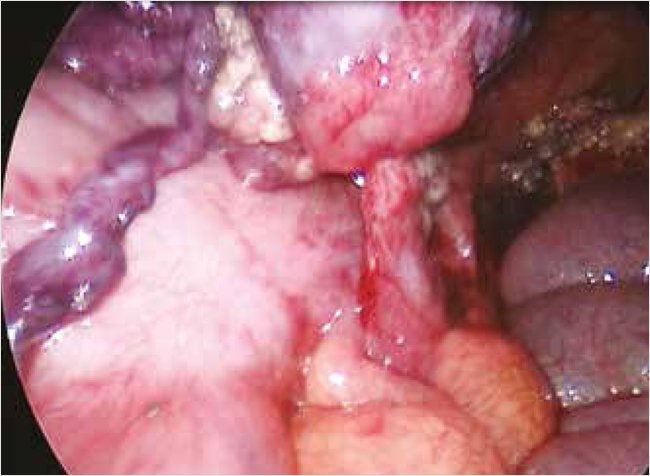
На тонкую ножку, идущую в брыжеечный край ободочной кишки, наложена петля Редера (нить Полигликолид 3,5), ножка отсечена электрокоагулятором. Выполнена резекция фрагмента большого сальника электрокоагулятором. Объемное образование извлечено из брюшной полости единым блоком через 20-мм троакар.
При ревизии червеобразный отросток расположен в малом тазу, утолщен до 10 мм, ригидный, гиперемированный, длиной 10 см. В малом тазу умеренное количество прозрачного выпота. В корне брыжейки увеличены до 15 мм и гиперемированы лимфоузлы. Заключение – острый аппендицит. Мезаденит. Выполнена лапароскопическая аппендэктомия. При гистологическом исследовании признаки острого аппендицита.
В послеоперационном периоде проводилась антибактериальная, противовирусная терапия, учитывая обнаружение у ребенка признаков инфекционного мононуклеоза. Атипичные мононуклеары – 14%; ПЦР слюны на герпес-вирусы от 05.07 – обнаружен вирус Эпштейна – Барр. Раны зажили первичным натяжением. Швы сняты на 7-е сут. Пациент выписан домой в удовлетворительном состоянии.
Объемное образование вскрыто, размером 6,0 x 5,0 x 4,0 см с отходящей трубчатой структурой длиной 11,0 см. Внутренняя и наружная поверхность красно-коричневого цвета. Толщина стенки 0,2–0,8 см. Участок сальника размером 3,5 x 3,0 см, желто-коричневого цвета, с полнокровными сосудами (рис. 3а).
Учитывая частичный некроз объемного образования, обширные кровоизлияния и отсутствие специфических структур, однозначно высказаться о патологическом процессе невозможно, однако вышеописанная гистологическая картина может наблюдаться при сосудистой мальформации с вторичными изменениями (рис. 3б). При иммуногистохимическом исследовании образование состоит из многочисленных сосудов различного калибра венозного и лимфатического типов, выстланных эндотелием без атипии. Определяются участки с полнокровными сосудами, полями кровоизлияний, некрозов; рассасыванием и формированием кистозных полостей. Стенка объемного образования частично некротизирована, представлена грануляционой и фиброзной тканью с многочисленными разнокалиберными сосудами с утолщенной стенкой с дистрофическим обызвествлением, обширными кровоизлияниями, с инфильтрацией лимфоцитами, гистиоцитами, эозинофильными и нейтрофильными лейкоцитами, плазматическими клетками. Снаружи частично покрыта мезотелием, внутренняя выстилка достоверно не определяется. Элементы стенки кишки не обнаружены (рис. 3в). В участке сальника полнокровные сосуды, стазы, отек, кровоизлияния, мелкоочаговая лимфоцитарная инфильтрация. При иммунофенотипировании эндотелий сосудов окрашивается CD34 и Vimentin, ki67 – низкий (менее 1%) (рис. 3г).
Рисунок 3. Методы исследования удаленного образования
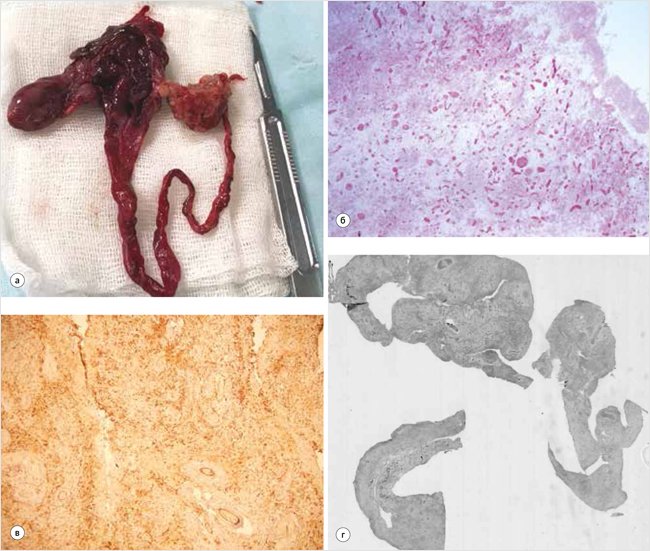
а – макропрепарат удаленного объемного образования с фрагментом сальника; б – гистологическое исследование. Микрофотография; в – иммунофенотипирование. Эндотелий сосудов окрашивается CD34 и Vimentin. Морфологическая картина соответствует лимфатико-венозной мальформации; г – иммунофенотипирование. Эндотелий сосудов окрашивается ki67 – низкий (менее 1%)
Обсуждение
ЛМ относятся к зрелым доброкачественным опухолям мезенхимального происхождения и составляют примерно 9–10% от всех доброкачественных новообразований в онкопедиатрии [3].
Признаков малигнизации этого вида новообразований в литературе не описано. Однако, несмотря на доброкачественный характер, ЛМ обладают склонностью к инфильтративному росту, нередко рецидивируют, порой подвергаются инфицированию. Вследствие генетического сродства ЛМ к кровеносным сосудам, в частности к венозной системе, представляет определенные трудности их радикальное удаление, когда они близко располагаются к магистральным сосудам и остающаяся на крупных сосудистых стволах лимфангиоматозная ткань служит источником рецидивов опухоли, что отмечается в 6–7% случаев ЛМ [4].
Ряд авторов предполагает ассоциирование ЛМ с некоторыми синдромными патологиями, такими как синдром Клиппеля – Треноне, болезнь Нонне – Милроя и т.д. [5].
По локализации ЛМ подразделяются на поверхностные (ЛМ шеи, конечностей, тела) и внутренние [6]. Внутренняя локализация лимфангиом и лимфгемангиом (висцеральные формы) наблюдается редко, не превышает 8–15% от всех наблюдаемых лимфангиом у детей. Среди висцеральных форм чаще в процесс вовлекаются кишечник и его брыжейка, селезенка, сальник, печень, реже – лимфатические сосуды и лимфоузлы средостения и забрюшинная клетчатка. Наиболее частая локализация кист – брыжейка тонкой кишки (70%), из них чаще всего ЛМ располагаются в брыжейке подвздошной кишки (50–60%) [3].
Описан случай распространения лимфангиомы в паховые каналы и мошонку. Другими авторами приведен случай лечения ребенка с ЛМ мочевого пузыря. Описаны редкие случаи лимфатической мальформации печени, проявляющиеся болевым синдромом, билиарной обструкцией или синдромом нижней полой вены [6–8].
По ранее применявшейся классификации различали 4 типа лимфангиом: капиллярную (простую), кистозную, кавернозную и смешанную – сочетание с гемангиомой [9, 10]; в настоящее время используется классификация ISSVА.
В диагностике применяют сочетание ультразвукового исследования (УЗИ) и компьютерной/магнитно-резонансной томографии (КТ/МРТ), в затруднительных случаях необходимо выполнение мини-инвазивных оперативных вмешательств с диагностической целью. Окончательным методом диагностики является иммуногистохимическое исследование [2]. При иммуногистохимическом исследовании эндотелиальные клетки имеют положительную реакцию с антителом к подопланину (Podoplanin; D2–40), а также вариабельную экспрессию с антителами к FVIII-rAg, CD31 и CD34 [2].
При анализе клинических проявлений по ряду характерных признаков выделяют три группы больных. Первую группу составляют дети с синдромом пальпируемого образования в брюшной полости. Вторую – больные, поступившие с клиникой «острого живота» или кишечной непроходимости. К третьей группе относятся дети с бессимптомным течением заболевания [4, 11, 12].
Течение лимфангиом относительно благоприятное, что, по мнению большинства авторов, связано с их медленным ростом. Клиническая картина при лимфангиомах брыжейки тонкой и толстой кишки многообразна и зависит от размера, локализации, количества лимфатических кист, взаимоотношения с кишкой и смежными органами, характера присоединившихся осложнений [9].
Однако следует иметь в виду осложнения, которые могут наблюдаться в клиническом течении опухоли. К наиболее частым из них относится воспаление. Инфицирование, как правило, происходит лимфогенным путем [9]. Воспаление с нагноением содержимого лимфангиомы сопровождается резким ухудшением общего состояния ребенка, гипертермией и интоксикацией. Отмечаются увеличение и болезненность регионарных лимфатических узлов, при поверхностном расположении образования – явления лимфангиита. Через несколько месяцев после купирования воспалительного процесса могут наблюдаться рецидивы. В литературе описан редкий случай инфицирования ЛМ корня брыжейки тонкой кишки [9].
В другом исследовании осложнения наблюдались у 33,3% пациентов, среди них инфекционные – у 6,3%, лимфорея – у 27,1%. Для купирования инфекционных осложнений применялась антибактериальная, дезинтоксикационная терапия. При лимфорее использовали выжидательную тактику до 4 дней, при этом лимфорея прекратилась самостоятельно в срок до 5 дней у 53,8% пациентов, для остальных детей было принято решение о переводе на полное парентеральное питание, в результате чего в срок от 4 до 9 дней лимфорея прекратилась во всех случаях [2].
В литературе авторами описаны два случая мезентериальной лимфатической мальформации в сочетании с мальротацией. В обоих представленных случаях мальформации располагались вблизи дуоденоеюнального перехода. Подобная локализация мальформации позволила авторам предположить, что брыжеечная лимфангиома в этих случаях могла развиться как редкий приобретенный вариант этой аномалии вследствие хронического заворота [10]. Аналогичный случай заворота тонкой кишки с частичной кишечной непроходимостью на фоне лимфатической мальформации описан W. Suthiwartnarueput et al. Явления инфекционного гастроэнтерита у данного пациента могли быть результатом вторичного воспалительного процесса, связанного с заворотом, в т.ч. геморрагического инфаркта [13].
На сегодняшний день в литературе нет единого мнения о преимуществах и показаниях консервативного или хирургического лечения.
Авторы, изучающие возможности терапевтического воздействия на ткани лимфангиом, в большинстве случаев используют такие препараты, как бета-адреноблокаторы, глюкокортикостероиды, моноклональные антитела, против васкулоэндотелиального фактора роста (VEGF): бевацизумаб, препараты интерферона, пропранолол. Продолжают появляться новые методы лечения лимфатических пороков развития, учитывая частую заболеваемость этими поражениями и отсутствие терапевтических возможностей при осложненных или рецидивирующих лимфатических пороках развития. В последнее время начинают применяться другие современные препараты, наиболее перспективными из которых считаются силденафил, пропранолол и сиролимус, однако сведений о способности этих препаратов существенно уменьшать размеры опухоли в литературе не встречается.
При выжидательной тактике или консервативном ведении пациентов увеличивается риск развития таких осложнений, как воспаление, нагноение, перфорация, сдавление опухолью соседних органов и тканей, лимфорея [3, 5].
По данным литературы, отсутствует общепринятая оптимальная тактика оперативного лечения. Различные авторы описывают как малоинвазивные органосохраняющие методы лечения, так и радикальные способы. Рассматривается применение комбинированных мини-инвазивных оперативных вмешательств: чрескожной пункции, дренирования с селективной артериальной эмболизацией сосудов, питавших стенку образования, чрескожной пункции кисты и деэпителизации 95%-ным этиловым спиртом, лапароскопической деруфизации кисты с деэпителизацией высокотемпературной плазмой (система Plasma Jet). При расположении кисты в труднодоступном для лапароскопических манипуляций сегменте в одном случае авторами выполнена пункция кисты под УЗ-навигацией [2].
После одномоментной чрескожной пункции – дренирования образования с деэпителизацией в 4,1% наблюдений авторами отмечено инфицирование остаточной полости кисты, что повлекло за собой повторные хирургические вмешательства. При наблюдении в катамнезе рецидивы выявлены у 6,2% детей. У части детей с частичным удалением новообразования рецидивы лимфангиом наблюдались в связи с прорастанием опухоли через крупные сосудисто-нервные пучки. В этих случаях проводилась щадящая коагуляция поверхности опухоли с последующим дренированием области операции [5]. У одного ребенка, которому была проведена пункция – деэпителизация полости кисты, лечение оказалось неэффективным [14].
Склеротерапия, исходя из ряда публикаций, эффективна при лечении и устранении макрокистозных лимфатических пороков с гораздо меньшей эффективностью при микрокистозных лимфатических пороках [5, 15]. В качестве склерозантов, как правило, применяют пицибанил (OK-432), доксициклин, блеомицин, этанол, тетрадецилсульфат натрия, уксусную кислоту и гипертонический раствор хлорида натрия. Авторами из Китая применялось с хорошими результатами внутриутробное склерозирование ЛМ у плодов, правда, при поверхностных ЛМ [16].
Чрескожная пункция с дренированием и этапным склерозированием, выполняемая под лапароскопическим контролем, также может быть безопасным способом лечения кист селезенки и выполняться повторно, однако не исключает риск рецидива образования [11].
Несмотря на то что примеры хирургического удаления висцеральных лимфангиом регулярно обсуждаются в литературе и различными авторами озвучивается недопустимость агрессивной хирургической тактики, включающей обширную резекцию прилежащих тканей и органов, явной тенденции к переходу на мини-инвазивные видеоэндоскопические технологии в лечении таких пациентов пока не просматривается. Отчасти причина заключается в большой редкости таких наблюдений [17].
При выборе метода хирургической техники большинство авторов отталкивается от размеров и локализации образования. По мнению Т. Шароева и соавт., крупные спонгиозные опухоли целесообразно и необходимо удалять из срединных лапаротомных разрезов, через которые возможна адекватная ревизия брюшной полости с оценкой состояния проходимости кишечной трубки, а также ее кровоснабжения [3]. Пациентам младшей возрастной группы возможно выполнение поперечных широких лапаротомных доступов. При кистозных образованиях и образованиях малого размера возможно применение лапароскопической техники [3].
Большинство авторов сходится на том, что при выборе тактики оперативного вмешательства следует основываться на результатах многофакторного анализа, включая размер, локализацию кисты и возраст пациента. Следует стремиться к лапароскопическому иссечению стенок кистозной полости с сохранением мезентериальных сосудов и предлежащего сегмента кишки [18]. Однако, если требуется резекция участка кишки при инвазивном росте опухоли с формированием анастомоза, не следует отвергать классический лапаротомный доступ [19].
В доступной литературе нет должного освещения и анализа результатов лечения интраабдоминальных лимфатических мальформаций с использованием эндовидеотехнологий. Наибольшие трудности обусловлены анатомическими особенностями опухоли, однако многократное увеличение, которое обеспечивает современная эндоскопическая аппаратура и камеры высокого разрешения, позволяет выполнять мобилизацию тканей на микрохирургическом уровне. Трансабдоминальный доступ обеспечивает наилучший оперативный простор, свободу движений и четкость анатомических ориентиров. Основными преимуществами перед открытым доступом являются минимальная травма передней брюшной стенки и быстрая реабилитация больных [18]. Тотальное лапароскопическое иссечение ЛМ – наилучший метод лечения при наличии необходимого оснащения, по мнению ряда второв [11, 20].
Результаты
Данное наблюдение демонстрирует чрезвычайно редко встречающуюся патологию у детей, перекрученную, некротизированную интраабдоминальную лимфатическую мальформацию. Лапароскопическое вмешательство позволило устранить патологию у больного с минимальной операционной травмой.
Заключение
На сегодняшний день экстренная лапароскопия является наиболее достоверным методом диагностики патологии органов брюшной полости у детей. В ходе лапароскопии возможно диагностировать редкие осложненные пороки развития – перекрученную некротизированную лимфатическую мальформацию.
Список литературы / References
- Chen J., Du L., Dao-Rong W. Experience in the diagnosis and treatment of mesenteric lymphangioma in adults: a case report and review of literature. World Journal Gastrointest Oncol. 2018;10(12):522–527. doi: 10.4251/wjgo.v10.i12.522.
- Поддубный И.В., Рябов А.Б., Абрамян М.А., Трунов В.О., Козлов М.Ю., Топилин О.Г. и др. Хирургическое лечение лимфангиом у детей: описание серии случаев. Онкопедиатрия. 2019;6(1):53–64. Режим доступа: https://cyberleninka.ru/. / Poddubnyi I.V., Ryabov A.B., Abramyan M.A., Trunov V.O., Kozlov M.Yu., Topilin O.G. et al. Surgical treatment of lymphangiom in children: case series. Oncopediatria. 2019;6(1):53–64. (In Russ.) Available at: https://cyberleninka.ru/.
- Шароев Т.А., Бурков И.В., Ковалев Д.В., Климчук О.В., Бондаренко С.Б., Илларионов Ю.В. Лимфангиомы брыжейки тонкой кишки у детей (обзор литературы и собственные клинические наблюдения). Российский вестник детской хирургии, анестезиологии и реаниматологии. 2012;2(2):58–63. Режим доступа: https://cyberleninka.ru/. / Sharoev T.A., Burkov I.V., Kovalev D.V., Klimchuk O.V., Bondarenko S.B.,
Illarionov Yu.V. Lymphangioma of mesentery in children (literature review and own clinical supervision). Russian Journal of Pediatric Surgery, Anesthesia and Intensive Care. 2012;2(2):58–63. (In Russ.) Available at: https://cyberleninka.ru/. - Ангархаева Л.В., Стальмахович В.Н., Кайгородова И.Н., Перловская В.В., Ли И.Б. Первый опыт эндоскопического удаления обширных забрюшинных лимфангиом у детей. Сибирский медицинский журнал (Иркутск). 2015;135(4):98–100. Режим доступа: https://cyberleninka.ru/. / Angarhaeva L.V., Stalmahovich V.N., Kaygorodova I.N., Perlovskaya V.V., Li I.B. The first experience of endoscopic removal of largeretroperitoneal lymphangiomas in children. Siberian Medical Journal (Irkutsk). 2015;135(4):98–100. (In Russ.) Available at: https://cyberleninka.ru/.
- Алтыев Б.К., Мирзакулов А.Г., Мадиев Р.З., Вервекина Т.А., Хакимов А.Т. Лимфангиома брыжейки тонкой кишки. Вестник экстренной медицины. 2017;(1):69–73. Режим доступа: https://www.ems-journal.uz/. / Altyev B.K., Mirzakulov A.G., Madiev R.Z., Vervekina T.A., Khakimov A.T. Lymphangioma of mesentery. Vestnik Ekstrennoy Meditsiny. 2017;(1):69–73. (In Russ.) Available at: https://www.ems-journal.uz/.
- Батаев С.М., Афаунов М.В., Игнатьев Р.О., Зурбаев Н.Т., Федоров А.К., Богданов А.М. и др. Эндохирургическое лечение детей с лимфангиомами редкой локализации. Российский вестник детской хирургии, анестезиологии и реаниматологии. 2017;7(2):68–72. Режим доступа: https://cyberleninka.ru/. / Bataev S.M., Afaunov M.V., Ignatyev R.O., Zurbaev N.T., Fedorov A.K., Bogdanov A.M. et al. Endochirurgical treatment of children with lymphangomas of rare localization. Russian Journal of Pediatric Surgery, Anesthesia and Intensive Care. 2017;7(2):68–72. (In Russ.) Available at: https://cyberleninka.ru/.
- Литовка В.К., Журило И.П., Веселый С.В., Латышов К.В. Обширная кистозная лимфгемангиома забрюшинного пространства и малого таза с распространением в паховые каналы и мошонку. Здоровье ребенка. 2012;(7):127–129. Режим доступа: http://www.mif-ua.com/. / Litovka V.K., Zhurilo I.P., Vesely S.V., Latyshov K.V. Giant cystic lymphohemangioma of retroperitoneal pelvic with extension to inguinal canal and scrotum. Child`s Health. 2012;(7):127–129. (In Russ.) Available at: http://www.mif-ua.com/.
- Suthiwartnarueput W., Kiatipunsodsai S., Kwankua A., Chaumrattanakul U. Lymphangioma of the small bowel mesentery: a case report and review of the literature. World J Gastroenterol. 2012;18(43):6328–6332. doi: 10.3748/wjg.v18.i43.6328.
- Бабич И.И., Шилов Г.Л. Осложнение лимфангиомы корня брыжейки у ребенка 12 лет. Российский вестник детской хирургии, анестезиологии и реаниматологии. 2015;5(2):75–76. Режим доступа: https://www.rps-journal.ru/. / Babich I.I., Shilov G.L. Complication of mesenteric root lymphangioma in a 12 year old. Russian Journal of Pediatric Surgery, Anesthesia and Intensive Care. 2015;5(2):75–78. (In Russ.) Available at: https://www.rps-journal.ru/.
- Ousmane T., Papa M., Abdou N., Mohamadou Y.S., Gueyeb L., Sarr I.S. et al. Cystic mesenteric lymphangioma: a case report. Inter J Sur Case Repor. 2019;61:318–321. doi: 10.1016/j.ijscr.2019.07.051.
- Gunadi, Kashogi G., Prasetya D., Fauzia A.R., Daryantoc E., Dwihantoroa A. Pediatric patients with mesenteric cystic lymphangioma: a case series. Inter J Sur Case Repor. 2019;64:89–93. doi: 10.1016/j.ijscr.2019.09.034.
- Soo-Hong K., Hyun-Young K., Cheol L., Min H.S., Jung S.-E. Clinical features of mesenteric lymphatic malformation in children. J Ped Sur. 2016;51(4):582–587. doi: 10.1016/j.jpedsurg.2015.11.021.
- Capasso R., Rossi E., Zeccolini M., Rotondo A. Lymphangioma of the small bowel mesentery in a 7-year-old girl: a report of a case investigated with ultrasonography, elastosonography and computed tomography. J Ultrasound. 2015;18:297–300. doi: 10.1007/s40477-014-0079-4.
- Батаев Х.М., Беляева О.А., Беляева А.В., Игнатьев Р.О., Мусаев Г.Х., Поляев Ю.А., Розинов В.М. Органосохраняющие вмешательства у детей с непаразитарными кистами селезенки. Российский вестник детской хирургии, анестезиологии и реаниматологии. 2017;7(Прил.):34–35. Режим доступа: https://cyberleninka.ru/. / Bataev Kh.M., Belyaeva O.A., Belyaeva A.V., Ignat’ev R.O., Musaev G.Kh., Polyaev Yu.A., Rozinov V.M. Organ-preserving interventions in children with non-parasitic splenic cysts. Russian Journal of Pediatric Surgery, Anesthesia and Intensive Care. 2017;7(Suppl.):34–35. (In Russ.) Available at: https://cyberleninka.ru/.
- Weeda V.B., Booij K.A., Aronson D.C. Mesenteric cystic lym-phangioma: a congenital and an acquired anomaly? Two cases and a review of the literature. J Ped Sur. 2008;43:1206–1208. doi: 10.1016/j.jpedsurg.2008.01.075.
- Аксельров М.А., Евдокимов В.Н., Свазян В.В., Аксельров А.М., Сергиенко Т.В., Емельянова В.А., Меркель А.В. Два случая оперативного лечения лимфангиомы брыжейки тонкой кишки у новорожденных. Детская хирургия. 2017;21(5):277–279. Режим доступа: https://cyberleninka.ru/. / Aksel’rov M.A., Evdokimov V.N., Svazyan V.V., Aksel’rov A.M., Sergienko T.V., Emel’yanova V.A., Merkel A.V. Surgical treatment of mesenterial lymphadenopathy in newborn babies. Russian Journal of Pediatric Surgery. 2017;21(5):277–279. (In Russ.) Available at: https://cyberleninka.ru/.
- Chen J., Du L., Dao-Rong W. Experience in the diagnosis and treatment of mesenteric lymphangioma in adults: a case report and review of literature. World J Gastr Onc. 2018;10(12):522–527. doi: 10.4251/wjgo.v10.i12.522.
- Соколов Ю.Ю., Донской Д.В., Вилесов А.В., Шувалов М.Э., Дзядчик А.В., Самсиков Г.А. Хирургические вмешательства у детей с интраабдоминальными лимфангиомами. Российский вестник детской хирургии, анестезиологии и реаниматологии. 2014;4(1):20–24. Режим доступа: https://cyberleninka.ru/. / Sokolov J.J., Donskoy D.V., Vilesov A.V., Shuvalov M.E., Dzyadchik A.V., Samsikov G.A. Surgical intervention in children with intraabdominal lymphangioma. Russian Journal of Pediatric Surgery, Anesthesia and Intensive Care. 2014;4(1):20–24. (In Russ.) Available at: https://cyberleninka.ru/.
- Морозов Д.А., Горемыкин И.В., Турковский В.Б., Напольников Ф.К., Погосян К.Л., Лукьяненко Е.А. Кистозные образования селезенки у детей. Саратовский научно-медицинский журнал. 2011;7(3):724–726. Режим доступа: https://ssmj.ru/. / Morozov D.A., Goremykin I.V., Turkovsky V.B., Napolnikov F.К., Pogosyan K.L., Lukyanenko E.A. Cystic growths of spleen in children. Saratov Journal of Medical Scientific Research. 2011;7(3):724–726. (In Russ.) Available at: https://ssmj.ru/.
- Jiao-ling L., Hai-ying W., Liu J.-R., Qiu-ming H., Chen K.-S., Yang J., Qian F. Fetal Lymphangioma: Prenatal Diagnosis on Ultrasound, Treatment, and Prognosis. Eur J Obst and Gynecol. 2018;231;268–273. doi: 10.1016/j.ejogrb.2018.10.018.




 1
1 2
2 3
3 4
4


Комментарии (0)