Журнал "Медицинский совет" №10/2025
Фото: mybox/FOTODOM/Shutterstoсk
DOI: 10.21518/ms2025-194
Е.В. Ледин1, https://orcid.org/0000-0002-1834-0981
В.И. Столяров1, https://orcid.org/0000-0003-1032-3818
Е.О. Чуйкова2, https://orcid.org/0000-0003-3200-6426
1 Клиническая больница МЕДСИ; 125284, Россия, Москва, 2-й Боткинский проезд, д. 5, корп. 4
2 Первый Московский государственный медицинский университет имени И.М. Сеченова (Сеченовский Университет); 119048, Россия, Москва, ул. Трубецкая, д. 8, стр. 2
Введение. Опухоли билиарного тракта (ОБТ) представляют собой агрессивные злокачественные новообразования с ограниченными терапевтическими возможностями и низкой общей выживаемостью. В последние годы внедрение иммунотерапии изменило парадигму лечения ОБТ, особенно в сочетании с химиотерапией. В настоящей работе приводится подробный анализ современных данных, а также оценивается эффективность химиоиммунотерапии у пациентов с нерезектабельной и/или метастатической холангиокарциномой в условиях реальной клинической практики.
Цель. Оценить клинические исходы применения комбинированной химиоиммунотерапии (GemCis + дурвалумаб/пембролизумаб) у пациентов с ОБТ в российской практике, включая показатели общей выживаемости (ОВ), выживаемости без прогрессирования (ВБП), частоты объективного ответа (ЧОО) и токсичности.
Материалы и методы. В ретроспективный анализ включены 23 пациента с подтвержденной холангиокарциномой, получившие лечение в трех центрах АО «ГК «МЕДСИ» с 2020 по 2024 г. Основной режим терапии включал гемцитабин, цисплатин и ингибитор PD-1/PD-L1 с последующей поддерживающей иммунотерапией. Оценка эффективности проводилась по критериям RECIST v1.1, статистический анализ выполнялся методом Каплана – Мейера.
Результаты. Медиана ВБП составила 8,0 мес. (95% ДИ: 6,6–9,3), медиана ОВ – 14,0 мес. (95% ДИ: 8,4–19,5). ЧОО составила 25% (5 частичных ответов, полные ответы отсутствовали), частота контроля заболевания – 68,5%. Осложнения 3–4-й степени зарегистрированы у 39% пациентов, включая гематологическую токсичность и редкие иммуноопосредованные реакции.
Выводы. Результаты настоящего анализа подтверждают эффективность химиоиммунотерапии в реальной клинической практике и коррелируют с данными крупных международных исследований. Включение ингибиторов PD-1/PD-L1 в схему первой линии терапии ОБТ демонстрирует клинически значимое улучшение показателей выживаемости и контроля заболевания, особенно у пациентов с благоприятным ответом на терапию.
Для цитирования: Ледин ЕВ, Столяров ВИ, Чуйкова ЕО. Роль иммунотерапии в лечении опухолей билиарного тракта: обзор современных данных и собственный опыт. Медицинский Совет. 2025;(10):20-30. https://doi.org/10.21518/ms2025-194
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Role of the immunotherapy in the treatment of biliary tract cancers: Review of current clinical trials and retrospective analysis
Evgeniy V. Ledin1, https://orcid.org/0000-0002-1834-0981
Vladimir I. Stolyarov1,2, https://orcid.org/0000-0003-1032-3818
Elizaveta О. Chuykova3, https://orcid.org/0000-0003-3200-6426
1 MEDSI Clinical Hospital; 5, Bldg. 4, 2nd Botkin Proezd, Moscow, 125284, Russia
2 State Scientific Center of the Russian Federation – Federal Medical Biophysical Center named after A.I. Burnazyan; 23, Marshal Novikov St., Moscow, 123098, Russia
3 Sechenov First Moscow State Medical University (Sechenov University); 8, Bldg. 2, Trubetskaya St., Moscow, 119991, Russia
Introduction. Biliary tract cancers (BTC) are aggressive malignancies with limited therapeutic options and poor overall survival. In recent years, the introduction of immunotherapy has shifted the treatment paradigm for BTC, particularly in combination with chemotherapy. This study presents a detailed analysis of current clinical data and evaluates the efficacy of chemoimmunotherapy in patients with unresectable and/or metastatic cholangiocarcinoma in routine clinical practice.
Aim. To assess the clinical outcomes of combined chemoimmunotherapy (GemCis + durvalumab/pembrolizumab) in patients with BTC in Russian clinical settings, including overall survival (OS), progression-free survival (PFS), objective response rate (ORR), and toxicity profiles.
Materials and Methods. This retrospective analysis included 23 patients with histologically confirmed cholangiocarcinoma treated between 2020 and 2024 at three centers of JSC “MEDSI Group”. The standard treatment regimen consisted of gemcitabine, cisplatin, and a PD-1/PD-L1 inhibitor followed by maintenance immunotherapy. Treatment efficacy was evaluated according to RECIST v1.1 criteria, and survival analysis was performed using the Kaplan–Meier method.
Results. The median PFS was 8.0 months (95% CI: 6.6–9.3), and the median OS was 14.0 months (95% CI: 8.4–19.5). The ORR was 25%, with five partial responses and no complete responses; the disease control rate was 68.5%. Grade 3–4 adverse events occurred in 39% of patients, including hematologic toxicity and rare immune-related adverse events.
Conclusion. The findings of this analysis support the real-world efficacy of chemoimmunotherapy and are consistent with data from large international trials. Incorporation of PD-1/PD-L1 inhibitors into first-line treatment regimens for BTC provides a clinically meaningful improvement in survival outcomes and disease control, particularly among patients demonstrating favorable responses to therapy.
For citation: Ledin EV, Stolyarov VI, Chuykova EO. Role of the immunotherapy in the treatment of biliary tract cancers: Review of current clinical trials and retrospective analysis. Meditsinskiy sovet = Medical Council. 2025;(10):20-30. (In Russ.) https://doi.org/10.21518/ms2025-194
Conflict of interest: the authors declare no conflict of interest.
Введение
Аденокарцинома желчевыводящих путей, или
опухоли билиарного тракта (ОБТ), – это группа агрессивных опухолей с
неблагоприятным прогнозом, которая произрастает из эпителия желчных протоков. Данные
опухоли плохо поддаются диагностике на ранних этапах развития, поэтому на
момент постановки диагноза около 60% пациентов не способны перенести
специфическую противоопухолевую терапию и получают только симптоматическое
лечение [1]. Классически ОБТ имеют анатомическую классификацию и делятся на
внутрипеченочные и внепеченочные, которые, в свою очередь, подразделяется на
опухоли ворот печени (Клацкина), опухоли внепеченочных желчных путей и опухоли
желчного пузыря.
Радикальное хирургическое лечение ОБТ
возможно только в 10–30% случаев заболевания [2, 3]. В случае
нерезектабельной/метастатической формы заболевания 5-летняя выживаемость в
среднем не превышает 2–7% [4, 5].
Несменяемым стандартом терапии первой
линии распространенных ОБТ с 2010 г. является цитостатический дуплет – комбинация
гемцитабина и цисплатина (GemCis),
при применении которого, по данным исследования АВС-02, продемонстрирована
медиана выживаемости 11,7 мес. в сравнении с 8,1 мес. при монотерапии
гемцитабином [6]. Впервые существенно обновить парадигму лечения аденокарцином
желчного тракта в первой линии лечения стало возможным благодаря добавлению
иммунотерапии к цитостатической терапии. Результаты исследований TOPAZ-1 [7] и KEYNOTE-966 [8] показали
улучшение медианы общей выживаемости при добавлении к GemCis ингибитора
PD-L1 дурвалумаба и ингибитора PD-1 пембролизумаба соответственно.
Иммуногенность
и характеристика микроокружения опухолей билиарного тракта
В эпоху иммунотерапии, основываясь на характеристиках
опухолевого микроокружения и степени его инфильтрации иммунными клетками, принято
подразделять опухолевые процессы на иммунологически «горячие» и «холодные» [9].
Можно выделить следующие важные характеристики микроокружения аденокарциномы
желчных путей: данная форма рака ассоциируется выраженной десмопластической
стромой, а клеточная среда обогащена опухоль-ассоциированными фибробластами, макрофагами
и Т-регуляторными лимфоцитами. Перечисленные клетки в совокупности создают иммуносупрессивную
среду, а также в силу своего влияния на микроокружение обуславливают условия
для раннего метастазирования холангиокарциномы [10, 11]. В свою очередь, такие
клетки иммунного ответа, как CD-8-цитотоксические лимфоциты и NK-клетки,
отвечающие за противоопухолевый иммунный ответ, слабо инфильтрируют опухолевую
ткань [12]. В совокупности данные факторы обуславливают биологию
холангиокарциномы как иммунологически «холодной» опухоли.
Однако в настоящий момент накоплены данные,
что трансформация опухоли в иммунологически «горячую» возможна. Одной из таких
стратегий является проведение одномоментной химиоиммунотерапии, которая
позволяет преодолеть первичную иммунологическую резистентность опухоли [13].
Лизис клеток, обусловленный цитотоксическим эффектом химиотерапии,
сопровождается высвобождением опухолевых неоантигенов, что позволяет повысить
степень инфильтрации опухоли Т-лимфоцитами и повысить эффективность применения
иммуноонкологических препаратов [14]. Также дополнительно были получены данные
на популяции клеток холангиокарциномы, что гемцитабин потенцирует эффект
цитотоксических Т-лимфоцитов, а применение комбинированной схемы GemCis может
приводить к повышению иммуногенности ряда опухолей [15, 16].
Исследовательской группой M.A.
Martin-Serrano et al. была разработана новая иммунологическая классификация холангиокарциномы. Так, с
помощью виртуальной деконволюции транскриптомных данных более чем 900 образцов
было предложено несколько классов, основанных на характеристиках
микроокружения. Данная классификация выделяет пять типов холангиокарциномы, все
они делятся на «воспалительные» (35%) и «невоспалительные» (65%). «Воспалительные»,
в свою очередь, подразделяются на «классические иммунные» (10%), которые
характеризуются высоким содержанием CD8+ Т-клеток и гамма-дельта Т-клеток, а
также на «имеющие воспалительную строму» (25%), в которых наблюдалось обилие
десмопластических реакций с депозитами внеклеточного матрикса. «Невоспалительные»
включают «пустынный» класс (20%), который характеризуется самой низкой иммунной
инфильтрацией с большим количеством регуляторных Т-клеток; класс
«печеночно-стволовых клеток» (35%), обогащенный «M2-подобными» макрофагами, с
наличием мутаций в IDH1/2 и BAP1, а также фузиями FGFR2. Еще один класс – «классический
опухолевый» (10%), характеризуется наличием избыточного количества мутаций,
активирующих клеточный цикл. Характеристики разных классов микроокружения
суммированы на рис. 1 [17].
Рисунок 1. Классификация опухолевого микроокружения
холангиоцеллюлярной аденокарциномы с точки зрения иммуногенности (адаптировано
из [17])
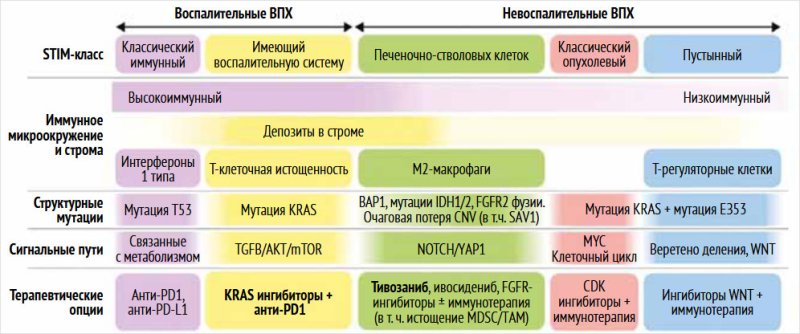
Примечание.
Представлены основные иммунные, стромальные и опухолевые характеристики пяти
классов STIM.
Терапевтические опции (нижняя строка) рекомендуются на основании: данных,
представленных в данном исследовании (выделены жирным шрифтом), или
молекулярных и иммунных характеристик каждого класса. ВПХ – внутрипеченочная
холангиокарцинома, STIM
– строма, опухоль, иммунное микроокружение.
Предложенная классификация дает представление
о рациональной разработке новых терапевтических стратегий, направленных как на
клетки опухоли, так и на опухолевое микроокружение. Авторами сделан вывод, что
пациенты классического иммунного класса могут иметь повышенную чувствительность
к терапии ингибиторами иммунных контрольных точек, в то время как пациенты с воспалительной
стромой могут иметь перспективу применения ингибиторов иммунных контрольных
точек в комбинации с таргетными препаратами. Для проведения успешной
иммунотерапии у пациентов с невоспалительными классами потребуется
комбинированная химиоиммунотерапия, которая позволит преодолеть первичную
иммунорезистентность опухоли [17].
Исследования,
посвященные иммунотерапии опухолей билиарного тракта
Моноиммунотерапия
анти-PD-1-/анти-PD-L1-ингибиторами
Эффективность моноиммунотерапии анти-PD-1-/анти PD-L1-ингибиторов оценивалась в
нескольких исследованиях I/II фазы (табл. 1).
В исследование I фазы KEYNOTE-028 были включены 23
пациента с предлеченной ОБТ. В данной работе оценивалась эффективность и
безопасность пембролизумаба в терапии рефрактерных солидных опухолей с
экспрессией PD-L1-клетками опухоли > 1%. Среди ОБТ
частота объективного ответа (ЧОО) составила 13%, а частота контроля заболевания
(ЧКЗ) – 26% [18].
В исследовании II фазы KEYNOTE-158 с дизайном «корзины»
исследовалась эффективность пембролизумаба в различных опухолях в независимости
от биомаркера. В популяции из 104 пациентов с предлеченными ОБТ, ЧОО составила
5,8%, медиана выживаемости без прогрессирования (ВБП) – 2,0 мес. Также
исследовалась когорта пациентов с наличием MSI-H-/dMMR-статуса, в которую было включено 22
пациента. Достигнута ЧОО в 40,9% (2 полных ответа, 7 частичных ответов),
медиана продолжительности ответа при медиане наблюдения – 13,4 мес. (диапазон
0,4–34,2 мес.) достигнута не была. Медиана выживаемости без прогрессирования
составила 4,2 мес., медиана общей выживаемости – 24,3 мес. [19]. Стоит
отметить, что dMMR-/MSI-H-статус в опухолях желчных путей
встречается сравнительно редко – менее чем в 5% случаев [20, 21].
Позже был выполнен post-hoc-анализ объединенных когорт KEYNOTE-028/KEYNOTE-158 с анализом влияния опухолевой
мутационной нагрузки (TMB)
на эффективность терапии пембролизумабом. В подгруппе пациентов с ТМВ > 10
мут/мб ЧОО составила 29%, в сравнении с 6% при ТМВ < 10 мут/мб [22].
Монотерапия ниволумабом также исследовалась
среди пациентов с предлеченными ОБТ (n = 54) в исследовании II фазы. Получена ЧОО в 11%, ЧКЗ – 50%.
Медианы БРВ и ОВ составили 3,6 и 14,2 мес. соответственно [23].
Комбинированная
иммунотерапия анти-PD-1/PD-L1 + анти-CTLA-4
Исследование II фазы
типа «корзины» СА 209-538 исследовало комбинированную иммунотерапию при редких
химиорезистетных опухолях, в т. ч. в него была включена когорта из 39 пациентов
с предлеченными ОБТ. Использовалась комбинация анти-PD-1- ингибитора ниволумаба в дозе 3
мг/кг и анти-CTLA-4-ингибитора ипилимумаба в дозе 1 мг/кг в объеме 4 курсов, с циклом в 21 день с последующей
поддерживающей терапией ниволумабом 3 мг/кг каждые 2 нед. ЧОО составила 24%,
ЧКЗ – 45%, мВБП – 2,9 мес., мОВ – 5,7 мес. [24].
В исследовании I фазы, проведенном на азиатской
популяции, исследовалась моноиммунотерапия анти-PD-1-ингибитором дурвалумабом в
дозировке 10 мг/кг, цикл 2 нед. (n
=
42) и комбинированная иммунотерапия дурвалумабом 20 мг/кг + ингибитор CTLA-4 тремелимумаб 1 мг/кг, цикл 4 нед.
(n =
65). У 5% пациентов отмечен частичный ответ в группе дурвалумаба и у 11% – в
группе комбинации. Медианы общей выживаемости составили 8,1 и 10,1 мес.
соответственно [25].
иммунотерапии анти-PD-1/PD-L1 с таргетной терапией/ингибиторами
тирозинкиназ
Комбинация мультитирозинкиназного
ингибитора ленватиниба (12 мг/сут) и анти-PD-L1- ингибитора пембролизумаба 200 мг
раз в 21 день у пациентов с предлеченными ОБТ (2-я и более линия) впервые была
исследована в китайском исследовании II фазы (n
=
32). Были получены данные о достижении ЧОО в 25%, ЧКЗ – 78,1%, мВБП – 4,9 мес.,
мОВ – 11,0 мес. Нежелательные явления (НЯ) 3-й степени были зафиксированы у 59%
пациентов [26].
Также
получены результаты применения данной схемы в когорте пациентов с ОБТ (n =
31) из исследования LEAP-005.
В отличие от китайского исследования все пациенты получали эту схему во второй
линии терапии, и доза ленватиниба была больше – 20 мг/сут. ЧОО составила 10%,
ЧКЗ – 68%, медиана продолжительности ответа – 5,3 мес., мВБП – 6,1 мес., мОВ –
8,6 мес. НЯ 3–4-й степени зафиксированы у 48% пациентов [27]. Полученные
удовлетворительные результаты позволили исследователям расширить когорту
пациентов до 100 человек, результаты ожидаются.
В исследование типа «корзина» I/II фазы REGOMUNE, в котором исследовалась
комбинация регорафениба 160 мг/сут 1–21 день, цикл 28 дней, и анти PD-L1-ингибитора авелумаба 10 мг/кг, цикл
14 дней, вошла когорта пациентов с предлеченным холангиоцеллюлярным раком (n =
34). ЧОО составила 13,8%, ЧКЗ – 51,7%, мВБП – 2,5 мес., мОВ – 11,9 мес.
Модификация дозы или отмена лечения из-за НЯ потребовалась у 85% пациентов [28].
В другом исследовании II фазы научная группа M. Yarchoan et al. изучали моноиммунотерапию анти-PD-1-ингибитором атезолизумабом и
комбинацию атезолизумаба и МЕК-ингибитора кобиметениба у пациентов с
предлеченной холангиокарциномой. В группе моноиммунотерапии атезолизумабом (n =
39) ЧОО составила 3,3%, ЧКЗ – 33%, мВБП – 1,8 мес.; в рукаве комбинированной
терапии (n
=
38) ЧОО составила 2,8%, ЧКЗ – 45%, мВБП – 3,6 мес. [29].
Известны промежуточные результаты
исследования II фазы по изучению комбинации пембролизумаба и олапариба у пациентов с
предлеченными ОБП. Набор в исследование пока не завершен, однако уже
опубликованы результаты применения данной комбинации у 12 пациентов, среди
которых у одного получен частичный ответ (-50%), 4 пациента – со стабилизацией
заболевания и 7 случаев – прогрессирования заболевания. Исследование
продолжается [30].
Исследования
I–II фазы комбинации иммунотерапии анти-PD-1-/PD-L1-ингибиторами и химиотерапии
В июне 2022 г. опубликованы результаты
одноцентрового рандомизированного исследования II фазы D.-Y. Oh et al., проходившего в Сеульском
национальном университетском госпитале, в котором исследовалось добавление
дурвалумаба (Д) + тремелимумаба (Т) к дуплету GemCis в первой линии терапии ОБТ.
Одной из гипотез исследования являлась способность химиотерапии индуцировать
иммунный ответ. Исходя из этого, первой группе пациентов стартовый курс терапии
проводился только цитостатическим блоком GemCis, а комбинация «Д + Т»
добавлялась ко второму и последующим курсам GemCis (n = 30); во второй группе
терапия «GemCis + Д» проводилась с первого курса (n = 47); третьей группе с
первого курса проводилась терапия «GemCis + Д + Т» (n = 47). Были получены
следующие результаты: в первой группе ЧОО составила 50%, мВБП – 12,8 мес., мОВ –
15,0 мес., во второй группе ЧОО – 72%, мВБП – 11,8 мес., мОВ – 18,1 мес., и в
третьей группе ЧОО 70%, мВБП 12,3 и мОВ 20,7 мес. [31].
Комбинация химиоиммунотерапии «GemCis + ниволумаб» использовалась в 1-й
линии терапии в японском исследовании I-й
фазы M. Ueno et
al.,
в которое было включено 39 пациентов. Получена ЧОО в 36,7%, мВБП – 4,2 мес.,
мОВ – 15,4 мес. [32].
Анти-PD-1-ингибитор торипалимаб в комбинации
с цисплатином и таблетированным фторпиримидином S-1 изучался в китайском исследовании II фазы W. Li et al., комбинация продемонстрировала ЧОО
в 27,1%, мВБП – 7,0 мес., мОВ – 16,0 мес. [33].
Двойное слепое плацебо-контролируемое исследование IMBrave151 было посвящено изучению комбинации «GemCis + атезолизумаб + бевацизумаб» по сравнению с комбинацией «GemCis + атезолизумаб + плацебо», n=162. Первичной конечной точкой исследования была выбрана выживаемость без
прогрессирования. Формально исследование оказалось позитивным, однако найденная
разница признана авторами клинически малозначительной. Медиана ВБП в группе «атезолизумаб
+ бевацизумаб» составила 8,3 мес., в группе «атезолизумаб + плацебо» – 7,9 мес.,
ОР – 0,67 [95% ДИ: 0,46–0,95]. Медианы ОВ составили 14,9 мес. и 14,6 мес.
соответственно, ОР – 0,97 [95% ДИ: 0,64–1,47]. ЧОО также не была улучшена при
добавлении бевацизумаба и составила 26,6% и 26,5% соотвественно. Однако
длительность объективных ответов в группе бевацизумаба была больше, процент
сохранения объективного ответа через 1 год составил 47,8% в группе бевацизумаба
и 9,6% – в группе плацебо, медианы длительности объективного ответа 10,3 против
6,2, ОР – 0,32 [95% ДИ: 0,13–0,75]. При сравнении длительности, достигнутых стабилизацией
опухолевого заболевания, отличий в группах найдено не было – ОР 0,95 [95% ДИ: 0,59–1,53].
Частота НЯ 3–4-й степени составила 74% в обеих группах. По результатам
подгруппового анализа высокая частота экспрессии гена VEGFA была связана с улучшением ВБП, ОР – 0,44 [95% ДИ: 0,23–0,83]
[34].
Исследования III фазы комбинации иммунотерапии анти-PD-1-/PD-L1-ингибиторами и химиотерапии
TOPAZ-1 – первое мультицентровое двойное слепое плацебо-контролируемое исследование III фазы по исследованию комбинированной химиоиммунотерапии 1-й линии c
платиновым дуплетом и PD-L1-ингибитором дурвалумабом в лечении
неоперабельного (13,9%) или метастатического (86%) рака желчевыводящих путей. В
исследование включено 684 пациента, из них большая часть (55,9%) страдала внутрипеченочной
холангиокарциномой, 19,1% – внепеченочными опухолями и 25% – раком желчного
пузыря. Рандомизация в группах «GemCis + дурвалумаб» и «GemCis + плацебо» производилась в соотношении 1:1. В качестве первичной конечной точки исследования
была избрана ОВ, вторичными конечными точками – ВБП, ЧОО, продолжительность
ответа (ПО) и эффективность в зависимости от уровня экспрессии PD-L1. По данным
последнего обновления анализа выживаемости, представленном на конгрессе ESMO в
сентябре 2022 г., по достижении медианы наблюдения 23,4 мес. и 22,4 мес. в
группах дурвалумаба и плацебо медианы выживаемости составили 12,9 мес. и 11,3
мес. соответственно (ОР 0,76 [0,64–0,91]). Явное изменение кривых выживаемости
наблюдалось после 6 мес. терапии. Данные 12, 18, 24-месячной выживаемости в
группах дурвалумаба и плацебо составили 54,1%, 48%, 35,1% и 25,6%, 24,9%, 10,4%
соответственно. Медиана ВБП в группе дурвалумаба составила 7,2 мес., в группе
плацебо – 5,7 мес. Применение химиоиммунотерапии позволило повысить ЧОО до
26,7% в сравнении с 18,7% в группе плацебо. Медианы продолжительности ответа
оказались равными 6,4 мес. и 6,2 мес., однако в группе дурвалумаба отмечено
большее количество продолжительных ответов, сохраняющихся более 12 мес. – 26,1%
против 15,0% в группе плацебо. По данным поданилиза общей выживаемости, глубина
объективного ответа является хорошим предиктивным маркером. Среди пациентов,
достигших ПО/ЧО, медианы выживаемости составили 19,5 мес. и 15,7 мес., при
стабилизации заболевания 13,6 мес. и 11,5 мес., при прогрессировании 5,7 мес. и
6,7 мес. в группах дурвалумаба и плацебо соответственно. Экспрессия PD-L1 TAP ≥ 1 в первоначальной публикации
оказалась на границе влияния на общую выживаемость (ОР 0,79 (0,61–1,00), однако
в обновленном анализе оказала значимое влияние на общую выживаемость – ОР 0,75
(0,60–0,93) [35].
Таблица 1. Исследования, посвященные разным модальностям иммунотерапии в лечении холангиокарциномы
| Исследование | Фаза | n | Линия терапии | Схема | ORR, % | мВБП, мес. | мОВ, мес. |
Моноиммунотерапия анти PD-1/PD-L1 | |||||||
KEYNOTE-028 [18] | 1 | 23 | 2 и более | Пембролизумаб | 13 | 1,8 | 5,7 |
KEYNOTE-158 [19] | 2 | 104 | 2 и более | Пембролизумаб | 5,8 | 2,0 | 7,4 |
KEYNOTE-158 (MSI-H/dMMR) [20] | 2 | 22 | 2 | Пембролизумаб | 40,9 | 4,2 | 24,3 |
NCT02829918 [21] | 2 | 54 | 2 и более | Ниволумаб | 11 | 4,0 | 14,2 |
NCT0193861 [22] | 1 | 42 | 2 и более | Дурвалумаб | 4,7 | 1,5 | 8,1 |
NCT03201458 [23] | 2 | 39 | 2-3 | Атезолизумаб | 3,3 | 1,8 | - |
Комбинация «анти-PD-1/PD-L1 + анти-CTLA-4» | |||||||
CA209-538 [24] | 2 | 39 | 2 и более | Ниволумаб + ипилимумаб | 24 | 2,9 | 5,7 |
NCT01938612 [25] | 1 | 65 | 2 и более | Дурвалумаб + тремелимумаб | 10,7 | 1,6 | 10,1 |
Иммунотерапии анти-PD-1/PD-L1 + таргетная терапия/ингибиторы тирозинкиназы | |||||||
NCT03895970 [26] | 2 | 32 | 2 и более | Пембролизумаб + ленватиниб | 25 | 4,9 | 11,0 |
LEAP-005 [27] | 2 | 31 | 2 | Пембролизумаб + ленватиниб | 10 | 6,1 | 8,6 |
REGOMUNE [28] | 1/2 | 29 | 2 и более | Регорафениб + авелумаб | 13,8 | 2,5 | 11,9 |
NCT03201458 [29] | 2 | 38 | 2-3 | Атезолизумаб + кобиметениб | 3,2 | 3,7 | - |
NCT04306367 [30] | 2 | 12 | 2 и более | Пембролизумаб + олапариб | 8,3 | - | - |
Химиоиммунотерапия | |||||||
NCT03046862 [31] | 1 | 45 | 1 | GemCis + дурвалумаб | 73,4 | 11,0 | 18,1 |
NCT03046862 [31] | 1 | 46 | 1 | GemCis + дурвалумаб + тремелимумаб | 73,3 | 11,9 | 20,7 |
JapiCCTI-153098 [32] | 1 | 39 | 1 | GemCis + ниволумаб | 36,7 | 4,2 | 15,4 |
NCT03796429 [33] | 2 | 50 | 1 | Цисплатин + S-1 + торипалимаб | 27,1 | 7,0 | 16,0 |
IMBrave151 [34] | 2 | 162 | 1 | GemCis + атезолизумаб + бевацизумаб | 26,6 | 8,3 | 14,9 |
TOPAZ-1 [35] | 3 | 341 | 1 | GemCis + дурвалумаб | 27 | 7,2 | 12,8 |
KEYNOTE-966 [8] | 3 | 533 | 1 | GemCis + пембролизумаб | 29 | 6,5 | 12,7 |
KEYNOTE-966
– хронологически второе исследование III фазы по применению комбинированной химиоиммунотерапии
при лечении ОБП. В данной работе исследовалось добавление анти-PD-1-ингибитора пембролизумаба к схеме GemCis в сравнении с плацебо в терапии 1-й
линии нерезектабельной (11%) или метастатической (89%) внутрипеченочной
холангиокарциномы (60%), внепеченочной холангиокарциномы (18%) или
холангиокарциномы желчного пузыря (22%). Первичной конечной точкой исследования
являлась ОВ, вторичными конечными точками были избраны ВБП, ЧОО и
продолжительность ответа. Исследование достигло своей первичной точки – исследуемая
комбинация «GemCis
+
пембролизумаб» продемонстрировала медиану общей выживаемости 12,7 мес. (95% ДИ:
11,5–13,6) в сравнении с 10,9 мес. (95% ДИ: 9,9–11,6), ОР = 0,83 (95% ДИ: 0,72–0,95),
p =
0,0034. Частота объективного ответа в группах иммунотерапии и плацебо оказалась
одинаковой – 29%, медиана достижения ответа также была равной 2,8 мес., однако
в группе иммунотерапии медиана продолжительности ответа оказалась выше и
составила 9,7 мес., в сравнении с 6,9 мес. в группе плацебо. Сохранение ответа
более 12 мес. зафиксировано у 41% (95% ДИ: 30–51) пациентов в группе иммунотерапии
и у 28% (95% ДИ: 19–39) – в группе плацебо. Уровень экспрессии PD-L1 CPS ≥
1, так же как и в первоначальном анализе TOPAZ-1, оказался на границе влияния на
общую выживаемость – ОР 0,85 (0,72–1,00) [8].
При сравнении исследований TOPAZ-1 и KEYNOTE-966 необходимо отметить,
что исследуемые группы пациентов были сопоставимы по таким ключевым параметрам,
как анатомическое расположение опухоли, клинический сценарий
(нерезектабельные/метастатические ОБП), медиана возраста, ECOG-статус, расовая принадлежность (1:1
азиатская и неазиатская популяции) и уровень экспрессии PD-L1 (TAP ≥ 1 = 58% и CPS ≥
1 = 68% соответственно). Ключевые результаты в виде выживаемости без
прогрессирования и общей выживаемости в двух исследованиях также являются
сопоставимыми. Из важных отличий можно выделить более высокую ЧОО в группе «GemCis + плацебо» в KEYNOTE –
966, а также большую долю пациентов с устойчивым ответом более 12 мес. в группе
иммунотерапии (26% против 41% соответственно) (табл. 2). Возможно,
большая частота продолжительных ответов в KEYNOTE-966 была достигнута
из-за применения поддерживающей терапии гемцитабином вместе с поддерживающей
иммунотерапией.
Таблица 2. Сравнение ключевых показателей в исследованиях TOPAZ-1
и KEYNOTE-966
Показатель | GemCis + плацебо (TOPAZ) | GemCis + дурвалумаб | GemCis + пембролизумаб | GemCis + плацебо (KN-966) |
ЧОО | 18,7% | 27% | 29% | 29% |
HR OS в сравнении с плацебо | 0,8 (mOS 12,8) | 0,83 (mOS 12,7) | ||
HR PFS в сравнении с плацебо | 0,75 (mPFS 7,2) | 0,86 (mPFS 6,5) | ||
Медиана продолжительности ответа | 6,2 мес. | 6,4 мес. | 9,7 мес. | 6,9 мес. |
Доля пациентов с сохраняющимся ответом: | ||||
более 3 мес. | 89% | 89% | 93% | 91% |
более 6 мес. | 54,2% | 59% | 67% | 56% |
более 12 мес. | 15,0% | 26% | 41% | 28% |
Медиана до достижения ответа | 2,7 мес. | 1,6 мес. | 2,8 мес. | 2,8 мес. |
Доля пациентов с PD-L1 ³1% в исследуемой группе | TAP ³1% – 58% | CPS ³1% – 68% | ||
Возможность поддержки гемцитабином | нет | да |
Данные реальной клинической практики и собственный опыт применения химиоиммунотерапии в 1-й линии лечения холангиокарциномы
Цель
работы – оценить данные реальной
практики применения комбинированной химиоиммунотерапии в лечении опухолей
билиарного тракта в отношении таких параметров, как выживаемость без
прогрессирования, общая выживаемость, частота объективного ответа, токсичность
лечения.
Материалы и методы
В данный ретроспективный анализ включены
пациенты с нерезектабельной и/или метастатической гистологически подтвержденной
холангиокарциномой, получившие лечение в АО «ГК «МЕДСИ».
Применялся следующий протокол лечения:
гемцитабин 750–1250 мг/м2 в/в в 1-й, 8-й день, цисплатин 25 мг/м2
в/в в 1-й, 8-й день, дурвалумаб 1500 мг или пембролизумаб 200 мг в/в в 1-й
день, цикл 21 день в объеме 6–8 курсов. После окончания цитостатического этапа лечения
осуществлялся переход на поддерживающую иммунотерапию дурвалумабом 1500 мг в/в
цикл 28 дней или пембролизумабом 200 мг в/в цикл 21 день. Лечение проводилось
до прогрессирования и/или непереносимой токсичности. Контрольное обследование в
виде компьютерной томографии трех зон и/или магнитно-резонансной томографии
брюшной полости проводилось каждые 2–3 мес. или в случае клинических проявлений
прогрессирования заболевания. У всех пациентов перед началом лечения оценивался
ECOG-статус,
адекватность печеночной, почечной функции, полный клинический анализ крови,
профиль гормонов щитовидной железы, коагулограмма.
Статистический
анализ
Материалы исследования были подвергнуты
статистической обработке с использованием методов параметрического и
непараметрического анализа. Накопление, корректировка, систематизация исходной
информации и визуализация полученных результатов осуществлялись в электронных
таблицах Microsoft
Office Excel 2016. Статистический анализ
проводился с использованием программы IBM SPSS Statistics v.26 (разработчик – IBM Corporation). Номинальные данные
описывались с указанием абсолютных значений и процентных долей. Оценка функции
выживаемости пациентов проводилась по методу Каплана – Мейера. Оценка
выживаемости без прогрессирования и общей выживаемости производилась с момента
начала терапии по схеме «GemCis
+ дурвалумаб/пембролизумаб». В качестве события для оценки выживаемости без
прогрессирования учитывалось рентгенологически подтвержденное прогрессирование
заболевания, для общей выживаемости – смерть от любых причин.
Результаты
С сентября 2020 г. по октябрь 2024 г. в 3
центрах АО «ГК «МЕДСИ» 23 пациента с нерезектабельной/метастатической холангиокарциномой
получали терапию по схеме «GemCis
+ дурвалумаб (60%) / пембролизумаб (40%)». У 20 (87%) пациентов терапия
проводилась в 1-й линии терапии, у 3 (13%) – реиндукция платинового дуплета с
добавлением иммунотерапии. На момент среза данных (октябрь 2024 г.) 12
пациентов (52%) умерли. Клинико-демографические характеристики пациентов
приведены в табл. 3.
Таблица 3. Клинико-демографические характеристики пациентов
Характеристика | Показатель |
Возраст, средний (пределы) | 58 (31–77) |
Мужской пол | 11 (48%) |
Женский пол | 12 (52%) |
Клинический сценарий - Метастатический процесс - Местнораспространенный нерезектабельный процесс | 17 (74%) 6 (26%) |
Хирургическое лечение по поводу локализованного заболевания | 5 (22%) |
ECOG-статус - ECOG 0 - ECOG 1 - ECOG 2 - ECOG 3 | 5 (22%) 13 (56,5%) 1 (4%) 4 (17%) |
Анатомическая локализация - Внутрипеченочная - Внепеченочная - Желчный пузырь | 16 (70%) 4 (17%) 3 (13%) |
Инвазия крупных печеночных сосудов на момент постановки диагноза | 5 (22%) |
Механическая желтуха в дебюте | 5 (22%) |
Наличие вирусного гепатита | 3 (13%) |
Наличие цирроза печени | 2 (9%) |
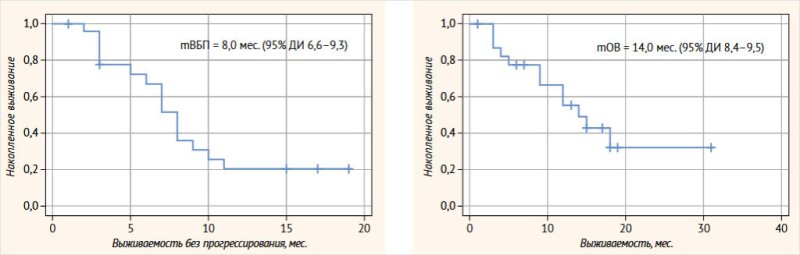
Медиана ВБП составила 8,0 мес. (95% ДИ:
6,6–9,3 мес.) (рис. 2). Медиана ОВ составила
14,0 мес. (95% ДИ: 8,4–19,5 мес.) (рис. 3).
ЧОО составила 25%, у 5 пациентов зафиксирован частичный ответ, полных ответов
не наблюдалось. У 10 (43,5%) пациентов отмечена стабилизация заболевания, у 6
(26,1%) – прогрессирование заболевания, у 2 (9%) пациентов объективный ответ
отследить не удалось. Показатель частоты контроля заболевания составил 68,5%. В
зависимости от анатомического расположения опухоли были получены следующие
объективные ответы: при внутрипеченочных холангиокарциномах (n = 16 (70%)): СЗ – 10 (62%), ЧО – 3
(18%), ПЗ – 3 (18%); при внепеченочных ОБП (n =4
(17%)): 1 ЧО (25%), 2 ПЗ (50%), 1 неизвестно (25%); при опухолях желчного
пузыря (n
=
3 (13%)): 1 ЧО (33%), 1 ПЗ (33%), 1 неизвестно (33%). Среднее количество
проведенных курсов химиоиммунотерапии составило 6 (1–8). Четырнадцать пациентов
(61%) завершили цитостатический этап лечения, среднее количество курсов осуществленной
комбинированной химиоиммунотерапии составило 6 (1–8). Количество пациентов, перешедших
на поддерживающую иммунотерапию, составило 9 человек (39%).
Осложнения лечения 3–4-й степени были
зафиксированы у 9 пациентов (39%), которые преимущественно были связаны с
гематологической токсичностью цитостатического компонента терапии. У одного
пациента было зафиксировано развитие аутоиммунного гепатита Grade 3, гипотиреоза Grade 3 и нефрита Grade 3 на фоне проведения поддерживающей
иммунотерапии.
Рисунок 2. Выживаемость без прогрессирования. Рисунок 3. Общая выживаемость
Обсуждение
К нашему сведению, это первый анализ
данных реальной практики по применению схемы GemCis в комбинации с иммуноонкологическими
препаратами в терапии первой линии метастатических/нерезектабельных ОБТ,
проведенный в РФ. Полученные результаты полностью соотносятся с данными
регистрационных исследований III
фазы TOPAZ-1 и KEYNOTE-966. Положительные результаты данных работ установили
комбинацию цитостатиков гемцитабина и цисплатина с дурвалумабом или
пембролизумабом как новый стандарт лечения, впервые продемонстрировав медиану
общей выживаемости в исследовании III фазы более 12 мес. Стоит отметить, что ОБТ
характеризуются крайне негативным прогнозом, и переход порога медианы
выживаемости в 1 год является большим достижением.
Известно, что в реальной практике пациенты
с ОБТ на момент начала лечения часто имеют скомпрометированный функциональный
статус как вследствие прямого влияния опухоли, так и вследствие сопутствующих
заболеваний в отличие от пациентов, которых обычно отбирают для участия в
крупных исследованиях. В нашей работе 56% пациентов имели ECOG 1 статус, 21% – ECOG 2–3. Поэтому полученные результаты
нашей работы представляют ценность и подтверждают положительный вклад
иммунотерапии в прогноз столь тяжелой группы пациентов.
M. Rimini et al. также опубликовали результаты
реальной практики применения схемы «GemCis + дурвалумаб» в терапии метастатических ОБТ в Италии.
В ретроспективный анализ было включено 145 пациентов из 17 центров, проходивших
лечение с февраля по ноябрь 2022 г. Достигнуты мВБП 8,9 мес., мОВ – 12,9 мес.,
ЧОО – 34,5% (ПО 4,8%, ЧО 29,6%), ЧКЗ – 87,6%. В целом полученные результаты
соотносятся как с данными TOPAZ-1,
так и с нашими данными [36].
На ASCO GI 2023 был представлен поданализ долгожителей
из TOPAZ-1.
Под определение «долгожителя» попадали пациенты, остававшиеся живыми более чем
18 мес. после рандомизации. В группе дурвалумаба таких пациентов оказалось 88
(25%), в группе плацебо – 65 (18%). Было отмечено, что пациенты с рецидивом
заболевания чаще оказывались долгожителями в отличие от de novo
метастатического заболевания независимо от группы лечения. В остальном
исследователям не удалось выделить другие определенные клинико-демографические
параметры, присущие долгожителям, в сравнении c общей популяцией исследования.
Большая доля долгожителей в группе дурвалумаба объясняется непосредственно
вкладом иммунотерапии в первой линии лечения. Среди долгожителей 58% и 81,5%
пациентов получили следующую линию терапии в группах дурвалумаба и плацебо
соответственно. В группе плацебо 18,5% пациентов в дальнейшем получили иммунотерапию
во второй и последующих линиях терапии, в группе дурвалумаба – только 3,4% [37].
В нашей работе присутствует 6 долгожителей
с общей выживаемостью большей или равной 18 мес., из них 2 (33%) имели
нерезектабельное заболевание, 4 (66%) – изначально метастатическое заболевание.
У половины из долгожителей был зафиксирован частичный ответ, у половины
наблюдалась стабилизация заболевания. В среднем данным пациентам было проведено
6 курсов терапии (3–8).
В общей популяции пациентов из нашего
анализа также в среднем было проведено 6 курсов цитостатической терапии.
Возможно, можно сделать осторожный вывод, что не всегда есть необходимость
доводить лечение до 8 курсов, особенно если лечение сопряжено с выраженными НЯ.
Четырнадцать пациентов (61%) получили
терапию 2-й линии, из них цитотоксическую терапию получили 11 (78,5%) пациентов
(6 – FOLFIRI,
2 – реиндукция GemCis,
2 – FOLFOX,
1 – наб-паклитаксел), двое (14%) получили таргетную терапию (футибатиниб и ивосидениб)
и один пациент получил иммунотерапию ниволумабом в сочетании с криоабляцией
очагов печени в клинике за рубежом. Несмотря на имеющиеся данные об
эффективности схемы FOLFOX
в сравнении с симптоматическим лечением во второй линии лечения, по данным
исследования ABC-06
[38], часто выбор в пользу схемы FOLFIRI
был обусловлен уже имеющейся полинейропатией у пациентов после терапии
цисплатином [39].
На настоящий момент известно, что в ОБТ
часто могут встречаться молекулярно-генетические альтерации. По данным литературы,
при внутрипеченочной холангиокарциноме таргетируемые молекулярно-генетические
альтерации можно найти в 40% случаев [40]. Среди проанализированных пациентов
только у 8 (35%) было выполнено расширенное молекулярно-генетическое
исследование, у 4 (50%) были найдены таргетируемые мутации (3 IDH1, 1 FGFR).
Два пациента с метастатической
внутрипеченочной холангиокарциномой получали лечение на фоне имеющегося цирроза
печени. В первом случае цирроз печени был ассоциирован с вирусом гепатита C, степень цирроза по Чайлд – Пью – А.
На момент начала противоопухолевой терапии ДНК вируса не определялась согласно
ПЦР-исследованию, ранее была проведена стандартная противовирусная терапия.
Пациенту было проведено две линии терапии – GemOx в объеме шести курсов с августа по
ноябрь 2022 г. с эффектом стабилизации в течение 6 мес. После прогрессирования
заболевания, в феврале 2023 г., было принято решение провести реиндукцию
платинового дуплета по схеме GemCis
с добавлением дурвалумаба также в объеме шести курсов, с февраля по июнь 2023 г.,
с лучшим эффектом в виде стабилизации заболевания в течение 4 мес. Лечение
пациент переносил удовлетворительно, из значимых НЯ фиксировалась
тромбоцитопения Grade
3, по поводу которой проводились редукции доз цитостатиков совместно с терапией
элтромбопагом. Помимо системного лечения, пациенту проводились множественные
сеансы стереотаксическй лучевой терапии на костные очаги с анальгезирующей
целью. На фоне роста опухолевых узлов в печени у пациента развилась портальная
гипертензия, варикозное расширение вен пищевода, опухолевый тромбоз воротной
вены.
Во втором случае цирроз печени был
ассоциирован с вирусом гепатита В, степень цирроза по Чайлд – Пью – А. С марта
по июль 2022 г. было проведено 6 курсов терапии по схеме GemOx. После прогрессирования заболевания,
в марте 2023 г., было принято решение о реиндукции дуплета по схеме GemCis с добавлением дурвалумаба, проведено
8 курсов терапии по октябрь 2023 г. с последующим переходом на поддерживающую
иммунотерапию. Лечение пациент переносил удовлетворительно, из значимых НЯ
фиксировалась тромбоцитопения Grade
2. После прогрессирования в марте 2024 г. в клинике по месту жительства было
принято решение о повторной реиндукции терапии GemCis c последующей деэскалацией до
гемцитабина. Пациент умер в октябре 2024 г. из-за кровотечения из
варикозно-расширенных вен пищевода.
Таким образом, исходя из нашего опыта, компенсированный цирроз печени не должен
быть препятствием в проведении противоопухолевой терапии при ОБТ. Однако с
прогрессированием заболевания и уменьшением объема функциональной ткани печени
из-за роста опухолевых очагов проявления портальной гипертензии могут нести
грозные проявления и иметь основную опасность для жизни пациента.
Также отдельно стоит выделить случай с
олигометастатическим течением заболевания и успешным применением нескольких
локальных методов лечения. В марте 2022 г. у пациентки N. была обнаружена внутрипеченочная
холангиокарцинома с несколькими резектабельными билобарными узлами без
вовлечения печеночных сосудов и метастатическим поражением передней брюшной
стенки. Первым этапом с целью верификации диагноза выполнено иссечение
образования передней брюшной стенки, затем выполнена билобарная
мультисегментарная резекция печени S2,
S3,
S5,
S7
c
последующей условно адъювантной терапией по схеме GemCis в объеме 6 курсов по октябрь 2022 г.
Прогрессирование заболевание зафиксировано в июне 2023 г. в виде очагов в S4, S5 правого легкого и в S3, S5, S8 – левого легкого, все очаги менее 1
см, в брюшной полости, по данным МРТ, без опухолевых признаков. При
ретроспективном сравнении некоторые из очагов уже присутствовали на момент
постановки диагноза размерами менее 2,5 мм. В торакальном центре по месту
жительства была выполнена видеоторакоскопическая атипичная резекция очагов
правого легкого в июле 2023 г., верифицировано прогрессирование
холангиокарциномы. С июля по ноябрь 2023 г. проведено 5 циклов терапии первой
линии по схеме «GemCis
+ дурвалумаб». По данным контрольного обследования, очаги в левом легком
уменьшились, продемонстрировав частичный ответ, в правом легком и брюшной
полости – без признаков прогрессирования. С декабря по январь проведен 6–7 курс
терапии, после этого в январе выполнена торакотомия слева, метастазэктомия. По
данным гистологического исследования, опухолевые очаги холангиокарциномы на 80%
состояли из фиброзной ткани. Пациентка переведена на поддерживающую
иммунотерапию. В июне 2024 г. выявлено появление новых очагов в S1/2, S8 левого легкого, по поводу которых
была проведена стереотаксическая радиохирургия. В настоящий момент пациентка
продолжает получать поддерживающую иммунотерапию. Таким образом, пациентка с
4-й стадией внутрипеченочной холангиокарциномы жива в течение 30 мес. и
продолжает получать лечение 1-й линии терапии.
Выводы
Аденокарцинома желчевыводящих путей – это
относительно редко встречающаяся опухоль, которая имеет неблагоприятный
прогноз. Внедрение иммунотерапии в первую линию лечения впервые за последние
десять лет позволило улучшить результаты лечения
метастатической/нерезектабельной холангиокарциномы. В общей популяции пациентов
вклад иммунотерапии может казаться небольшим, однако у отдельных отвечающих
пациентов иммунотерапия позволяет надежно закрепить результат цитостатического
компонента лечения и значимо продлить период контроля заболевания и общую
выживаемость.
Список литературы / References
Развернуть
- Neuzillet C, Emery C, Teissier C, Bouée S, Lièvre A. Patient healthcare trajectories of intrahepatic cholangiocarcinoma in France: A nationwide retrospective analysis. Lancet Reg Health Eur. 2022;15:100324. https://doi.org/10.1016/j.lanepe.2022.100324.
- Neumann UP, Schmeding M. Role of surgery in cholangiocarcinoma: From resection to transplantation. Best Pract Res Clin Gastroenterol. 2015;29(2):295-308. https://doi.org/10.1016/j.bpg.2015.02.007.
- Forner A, Vidili G, Rengo M, Bujanda L, Ponz-Sarvisé M, Lamarca A. Clinical presentation, diagnosis and staging of cholangiocarcinoma. Liver Int. 2019;39( Suppl. 1):98-107. https://doi.org/10.1111/liv.14086.
- Ali H, Tedder B, Waqar SH, Mohamed R, Cate EL, Ali E. Changing incidence and survival of intrahepatic cholangiocarcinoma based on Surveillance, Epidemiology, and End Results Database (2000-2017). Ann Hepatobiliary Pancreat Surg. 2022;26(3):235-243. https://doi.org/10.14701/ahbps.21-1733.
- Banales JM, Marin JJG, Lamarca A, Rodrigues PM, Khan SA, Roberts LR et al. Cholangiocarcinoma 2020: the next horizon in mechanisms and management. Nat Rev Gastroenterol Hepatol. 2020;17(9):557-588. https://doi.org/10.1038/s41575-020-0310-z.
- Valle J, Wasan H, Palmer DH, Cunningham D, Anthoney A, Maraveyas A et al. Cisplatin plus Gemcitabine versus Gemcitabine for Biliary Tract Cancer. N Engl J Med. 2010;362(14):1273-1281. https://doi.org/10.1056/NEJMoa0908721.
- Oh DY, Ruth He A, Qin S, Chen LT, Okusaka T, Vogel А et al. Durvalumab plus Gemcitabine and Cisplatin in Advanced Biliary Tract Cancer. NEJM Evid. 2022;1(8):EVIDoa2200015. https://doi.org/10.1056/EVIDoa2200015.
- Kelley RK, Ueno M, Yoo C, Finn RS, Furuse J, Ren Z et al. Pembrolizumab in combination with gemcitabine and cisplatin compared with gemcitabine and cisplatin alone for patients with advanced biliary tract cancer (KEYNOTE-966): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet. 2023;401(10391):1853-1865. https://doi.org/10.1016/S0140-6736(23)00727-4.
- Liu YT, Sun ZJ. Turning cold tumors into hot tumors by improving T-cell infiltration. Theranostics. 2021;11(11):5365-5386. https://doi.org/10.7150/thno.58390.
- Fabris L, Perugorria MJ, Mertens J, Björkström NK, Cramer T, Lleo A et al. The tumour microenvironment and immune milieu of cholangiocarcinoma. Liver Int. 2019;39(S1):63-78. https://doi.org/10.1111/liv.14098.
- Chuaysri C, Thuwajit P, Paupairoj A, Chau-In S, Suthiphongchai T, Thuwajit C. Alpha-smooth muscle actin-positive fibroblasts promote biliary cell proliferation and correlate with poor survival in cholangiocarcinoma. Oncol Rep. 2009;21(4):957-969. https://doi.org/10.3892/or_00000309.
- Loeuillard E, Conboy CB, Gores GJ, Rizvi S. Immunobiology of cholangiocarcinoma. JHEP Rep. 2019;1(4):297-311. https://doi.org/10.1016/j.jhepr.2019.06.003.
- Zhang J, Huang D, Saw PE, Song E. Turning cold tumors hot: from molecular mechanisms to clinical applications. Trends Immunol. 2022;43(7):523-545. https://doi.org/10.1016/j.it.2022.04.010.
- Galluzzi L, Humeau J, Buqué A, Zitvogel L, Kroemer G. Immunostimulation with chemotherapy in the era of immune checkpoint inhibitors. Nat Rev Clin Oncol. 2020;17(12):725-741. https://doi.org/10.1038/s41571-020-0413-z.
- Sawasdee N, Thepmalee C, Sujjitjoon J, Yongpitakwattana P, Junking M, Poungvarin N et al. Gemcitabine enhances cytotoxic activity of effector T-lymphocytes against chemo-resistant cholangiocarcinoma cells. Int Immunopharmacol. 2020;78:106006. https://doi.org/10.1016/j.intimp.2019.106006.
- Liu WM, Fowler DW, Smith P, Dalgleish AG. Pre-treatment with chemotherapy can enhance the antigenicity and immunogenicity of tumours by promoting adaptive immune responses. Br J Cancer. 2010;102(1):115-123. https://doi.org/10.1038/sj.bjc.6605465.
- Martin-Serrano MA, Kepecs B, Torres-Martin M, Bramel ER, Haber PK, Merritt E et al. Novel microenvironment-based classification of intrahepatic cholangiocarcinoma with therapeutic implications. Gut. 2023;72(4):736-748. https://doi.org/10.1136/gutjnl-2021-326514.
- Ahn S, Lee JC, Shin DW, Kim J, Hwang JH. High PD-L1 expression is associated with therapeutic response to pembrolizumab in patients with advanced biliary tract cancer. Sci Rep. 2020;10(1):12348. https://doi.org/10.1038/s41598-020-69366-4.
- Marabelle A, Le DT, Ascierto PA, Di Giacomo AM, De Jesus-Acosta A, Delord JP et al. Efficacy of Pembrolizumab in Patients With Noncolorectal High Microsatellite Instability/Mismatch Repair-Deficient Cancer: Results From the Phase II KEYNOTE-158 Study. J Clin Oncol. 2020;38(1):1-10. https://doi.org/10.1200/JCO.19.02105.
- Le DT, Durham JN, Smith KN, Wang H, Bartlett BR, Aulakh LK et al. Mismatch repair deficiency predicts response of solid tumors to PD-1 blockade. Science. 2017;357(6349):409-413. https://doi.org/10.1126/science.aan6733
- Merters J, Lamarca A. Integrating cytotoxic, targeted and immune therapies for cholangiocarcinoma. J Hepatol. 2023;78(3):652-657. https://doi.org/10.1016/j.jhep.2022.11.005.
- Marabelle A, Fakih M, Lopez J, Shah M, Shapira-Frommer R, Nakagawa K et al. Association of tumour mutational burden with outcomes in patients with advanced solid tumours treated with pembrolizumab: prospective biomarker analysis of the multicohort, open-label, phase 2 KEYNOTE-158 study. Lancet Oncol. 2020;21(10):1353-1365. https://doi.org/10.1016/S1470-2045(20)30445-9.
- Kim RD, Chung V, Alese OB, El-Rayes BF, Li D, Al-Toubah TE et al. A Phase 2 Multi-institutional Study of Nivolumab for Patients With Advanced Refractory Biliary Tract Cancer. JAMA Oncol. 2020;6(6):888-894. https://doi.org/10.1001/jamaoncol.2020.0930.
- Klein O, Kee D, Nagrial A, Markman B, Underhill C, Michael M et al. Evaluation of Combination Nivolumab and Ipilimumab Immunotherapy in Patients With Advanced Biliary Tract Cancers. JAMA Oncol. 2020;6(9):1405-1409. https://doi.org/10.1001/jamaoncol.2020.2814.
- Ioka T, Ueno M, Oh D-Y, Fujiwara Y, Chen J-S, Doki Y et al. Evaluation of safety and tolerability of durvalumab (D) with or without tremelimumab (T) in patients (pts) with biliary tract cancer (BTC). J Clin Oncol. 2019;37(Suppl. 4):387-387. https://doi.org/10.1200/JCO.2019.37.4_suppl.387.
- Lin J, Yang X, Long J, Zhao S, Mao J, Wang D et al. Pembrolizumab combined with lenvatinib as non-first-line therapy in patients with refractory biliary tract carcinoma. Hepatobiliary Surg Nutr. 2020;9(4):414-424. https://doi.org/10.21037/hbsn-20-338.
- Villanueva L, Lwin Z, Chung HC, Gomez-Roca C, Longo F, Yanez E et al. Lenvatinib plus pembrolizumab for patients with previously treated biliary tract cancers in the multicohort phase II LEAP-005 study. J Clin Oncol. 2021;39:321-321. https://doi.org/10.1200/JCO.2021.39.3_suppl.321.
- Cousin S, Bellera С, Guegan J, Valentin Т, Bahleda R, Metges J et al. Regomune: A phase II study of regorafenib + avelumab in solid tumors - Results of the biliary tract cancer (BTC) cohort. J Clin Oncol. 2024. https://ascopubs.org/doi/abs/10.1200/JCO.2021.39.15_suppl.4096.
- Yarchoan M, Cope L, Ruggieri AN, Anders RA, Noonan AM, Goff LW et al. Multicenter randomized phase II trial of atezolizumab with or without cobimetinib in biliary tract cancers. J Clin Invest. 2021;131(24):e152670. https://doi.org/10.1172/JCI152670.
- Yin Ch, Armstrong SA, Agarwal S, Wang H, Noel MS, Weinberg BA et al. Phase II study of combination pembrolizumab and olaparib in patients with advanced cholangiocarcinoma: Interim results. J Clin Oncol. 2022;40:452-452. https://doi.org/10.1200/JCO.2022.40.4_suppl.452.
- Oh DY, Lee KH, Lee DW, Yoon J, Kim TY, Bang JH et al. Gemcitabine and cisplatin plus durvalumab with or without tremelimumab in chemotherapynaive patients with advanced biliary tract cancer: an open-label, singlecentre, phase 2 study. Lancet Gastroenterol Hepatol. 2023;8(6):e5. https://doi.org/10.1016/S2468-1253(23)00115-2.
- Ueno M, Ikeda M, Morizane C, Kobayashi S, Ohno I, Kondo S et al. Nivolumab alone or in combination with cisplatin plus gemcitabine in Japanese patients with unresectable or recurrent biliary tract cancer: a non-randomised, multicentre, open-label, phase 1 study. Lancet Gastroenterol Hepatol. 2019;4(8):611-621. https://doi.org/10.1016/S2468-1253(19)30086-X.
- Li W, Yu Y, Xu X, Guo X, Wang Y, Li Q et al. Toripalimab with chemotherapy as first-line treatment for advanced biliary tract tumors: Update analytic results of an open-label phase II clinical study (JS001-ZS-BC001). J Clin Oncol. 2021;39:e16170-e16170. https://doi.org/10.1200/JCO.2021.39.15_suppl.e16170.
- Macarulla T, Ren Z, Chon HJ, Park JO, Kim JW, Pressiani T et al. Atezolizumab Plus Chemotherapy With or Without Bevacizumab in Advanced Biliary Tract Cancer: Clinical and Biomarker Data From the Randomized Phase II IMbrave151 Trial. J Clin Oncol. 2025;43(5):545-557. https://ascopubs.org/doi/10.1200/JCO.24.00337.
- Oh D-Y, He AR, Qin S, Chen L-T, Okusaka T, Vogel A et al. Corrigendum to 78P Updated overall survival (OS) from the phase III TOPAZ-1 study of durvalumab (D) or placebo (PBO) plus gemcitabine and cisplatin (+ GC) in patients (pts) with advanced biliary tract cancer (BTC). Ann Oncol. 2023;34(7):633. https://doi.org/10.1016/j.annonc.2023.02.001.
- Rimini M, Fornaro L, Lonardi S, Niger M, Lavacchi D, Pressiani T et al. Durvalumab plus gemcitabine and cisplatin in advanced biliary tract cancer: An early exploratory analysis of real-world data. Liver Int. 2023;43(8):1803-1812. https://doi.org/10.1111/liv.15641.
- Bouattour М, Valle JW, Vogel A, Kim JW, Kitano M. Characterization of longterm survivors in the TOPAZ-1 study of durvalumab or placebo plus gemcitabine and cisplatin in advanced biliary tract cancer. J Clin Oncol. 2023;41(Suppl. 4):531-531. https://doi.org/10.1200/JCO.2023.41.4_suppl.531.
- Lamarca A, Palmer DH, Wasan HS, Ross PJ, Ma YT, Arora A et al. Second-line FOLFOX chemotherapy versus active symptom control for advanced biliary tract cancer (ABC-06): a phase 3, open-label, randomised, controlled trial. Lancet Oncol. 2021;22(5):690-701. https://doi.org/10.1016/S1470-2045(21)00027-9.
- Nichetti F, Rizzato M, Bensi M, Salani F, Franza A, Piva V et al. P-275 FOLFOX versus FOLFIRI as second-line treatment after cisplatingemcitabine in patients with advanced biliary tract cancers. Ann Oncol. 2023;34(Suppl. 1):S113. https://doi.org/10.1016/j.annonc.2023.04.331.
- Vogel A, Saborowski A. Current and Future Systemic Therapies in Biliary Tract Cancer. Visc Med. 2021;37(1):32-38. https://doi.org/10.1159/000513969.



 1
1 2
2 3
3 4
4


Комментарии (0)