Журнал "Медицинский совет" №8/2021
DOI: 10.21518/2079-701X-2021-8-13-18
Е.В. Матушевская1, ORCID: 0000-0003-4583-0617
Е.В. Владимирова1, ORCID: 0000-0002-4123-4204
Ю.И. Матушевская2, ORCID: 0000-0001-5995-6689
Е.А. Авербух2, ORCID: 0000-0003-4024-1135
А.Ю. Шаталова2, ORCID: 0000-0002-7714-3902
1 Академия постдипломного образования Федерального научно-клинического центра специализированных видов медицинской помощи и медицинских технологий Федерального медико-биологического агентства; 125371, Россия, Москва,
Волоколамское шоссе, д. 91
2 Люберецкий кожно-венерологический диспансер; 140013, Россия, Люберцы, ул. Коммунистическая, д. 15
В статье представлены данные по изучению эффективности и безопасности препаратов группы топических кортикостероидов (ТГКС) при лечении псориаза в практике врача-дерматовенеролога. Рассмотрены вопросы этиологии и патогенеза псориаза, в развитии которого центральную роль занимает нарушение активации врожденного и адаптивного иммунитета.
Выделены основные направления в лечении псориаза, основанные на международных и российских клинических рекомендациях. Определено место ТГКС в терапии псориаза. Даны рекомендации по ведению больных с псориазом и выбору метода терапии в зависимости от формы и тяжести патологического процесса с применением ТГКС в качестве первой линии терапии псориаза легкой и средней степени заболевания на основании современных отечественных и зарубежных рекомендаций. Представлены данные собственных клинических наблюдений применения микронизированного препарата Акридерм СК для лечения разных форм псориаза. Представлено подробное описание тактики ведения и результатов терапии двух пациентов с псориазом. Показана высокая эффективность топического препарата Акридерм СК в моно- и комбинированной терапии в сочетании с фототерапией у больных псориазом средней и тяжелой степени заболевания.
На основании проанализированных данных зарубежных и отечественных исследований, а также собственного опыта авторов показано, что применение препарата Акридерм СК в терапии псориаза является эффективным и безопасным и соответствует требованиям современных принципов и стандартов лечения. Опыт его использования для лечения больных псориазом продемонстрировал высокую терапевтическую эффективность и низкий риск формирования нежелательных явлений.
Для цитирования: Матушевская Е.В., Владимирова Е.В., Матушевская Ю.И., Авербух Е.А., Шаталова А.Ю. Топическая терапия псориаза. Разбор клинических случаев. Медицинский совет. 2021;(8):13–18. doi: 10.21518/2079-701X-2021-8-13-18.
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Topical psoriasis therapy. Review of clinical cases
Elena V. Matushevskaya1, ORCID: 0000-0003-4583-0617
Elena V. Vladimirova1, ORCID: 0000-0002-4123-4204
Yuliya I. Matushevskaya2, ORCID: 0000-0001-5995-6689
Elena A. Averbukh2, ORCID: 0000-0003-4024-1135
Anna Yu. Shatalova2, ORCID: 0000-0002-7714-3902
1 Academy of Postgraduate Education of the Federal Scientific and Clinical Center for Specialized Medical Care and Medical Technologies of the Federal Medical and Biological Agency; 91, Volokolamskoe Shosse, Moscow, 125371, Russia
2 Luberetskiy Dermatovenerologic Dispensary; 15, Kommunisticheskaya St., Moscow 140013, Russia
The article presents the data concerning the efficacy and safety of topical corticosteroids (TCS) in psoriasis treatment in the practice of dermatovenerologist. The questions of etiology and pathogenesis of psoriasis are considered; violation of activation of innate and adaptive immunity plays the key role in its development.
The basic approaches in psoriasis treatment, based on the international and Russian clinical guidelines, are distinguished. The place of TCS in psoriasis therapy is determined. The authors give the recommendations for the management of patients with psoriasis and the choice of therapy depending on the form and severity of the pathological process with the use of TCS as the first-line therapy of mild and moderate psoriasis on the basis of the modern Russian and foreign recommendations. The article presents the data of own clinical observations of Akriderm SK micronized drug application for treatment of different forms of psoriasis. A detailed description of management tactics and results of therapy in two patients with psoriasis is presented. The high efficacy of topical Akriderm SK drug in mono- and combined therapy in combination with phototherapy in patients with moderate to severe psoriasis has been shown.
Based on the analyzed data of foreign and domestic studies, as well as the authors’ own experience, it is shown that the use of Acriderm SK in psoriasis therapy is effective and safe and meets the requirements of modern treatment principles and standards. The experience of its use for treatment of psoriasis patients demonstrated high therapeutic efficacy and low risk of adverse events.
For citation: Matushevskaya E.V., Vladimirova E.V., Matushevskaya Yu.I., Averbukh E.A., Shatalova A.Yu. Topical psoriasis therapy. Review of clinical cases. Meditsinskiy sovet = Medical Council. 2021;(8):13–18. (In Russ.) doi: 10.21518/2079-701X-2021-8-13-18.
Conflict of interest: the authors declare no conflict of interest.
ВВЕДЕНИЕ
Псориаз – это распространенное иммунноопосредованное заболевание кожи, поражающее примерно 2–3% населения во всем мире [1, 2]. Распространенность заболевания варьируется в зависимости от регионов [3]. Этот показатель в кавказских и скандинавских популяциях достигает 11%, в азиатских и некоторых африканских популяциях распространенность заболевания более низкая [4–7]. Распространенность псориаза в РФ в 2018 г. составляла 242,4 заболевания на 100 тыс. населения; заболеваемость – 66,5 на 100 тыс. населения [8].
В развитии псориаза выявлено доминирующее значение генетических факторов. Основной фактор риска, до 50% наследуемости заболевания, связан с хромосомным локусом PSORS1 (Psoriasis Susceptibility) [9]. Отмечается высокая ассоциация псориаза с различными коморбидными заболеваниями. Псориаз связан с рядом сопутствующих заболеваний, включая воспалительные артриты, кардиометаболические заболевания и депрессию. У больных псориазом наблюдается повышенная гиперлипидемия, гипертония, ишемическая болезнь сердца, сахарный диабет 2-го типа и повышенный индекс массы тела [10, 11]. При псориазе выявлено существенное снижение качества жизни пациентов. Нарушение психологического качества жизни при псориазе сравнимо с раком, инфарктом миокарда и депрессией [12].
В настоящее время в связи с новыми данными в изучении патогенеза заболевания появляются инновационные методы лечения, каждый из которых потенциально может дать пациентам улучшение качества жизни и контроль над течением псориаза.
ПАТОГЕНЕЗ ПСОРИАЗА
Патологический процесс может быть запущен в фазу инициации псориаза, возможно, вызванной травмой (феномен Кебнера), инфекцией или лекарственными препаратами [13]. Основные клинические проявления при псориазе локализуются в наружном слое кожи. Гистологическое исследование псориатических высыпаний показывает патоморфологические признаки акантоза (эпидермальная гиперплазия), паракератоза и неоваскуляризации. Однако развитие псориатической бляшки не ограничивается воспалением в эпидермальном слое, а формируется взаимодействием кератиноцитов с различными типами клеток (врожденными и адаптивными иммунными клетками, клетками сосудистой системы), находящимися в дерме. Воспалительные инфильтраты состоят из дендритных клеток кожи, макрофагов, Т-клеток и нейтрофилов. Характерной особенностью патогенеза псориаза является длительное воспаление, которое приводит к неконтролируемой пролиферации и нарушению дифференцировки кератиноцитов [13, 14].
Нарушения врожденных и адаптивных кожных иммунных реакций ответственны за развитие и поддержание псориатического воспаления [13, 15]. Активация врожденной иммунной системы, обусловленная эндогенными сигналами при повреждении кератиноцитов и цитокинами, существует одновременно с аутовоспалительными процессами у одних пациентов и Т-клеточными аутоиммунными реакциями у других, причем оба механизма потенцируют друг друга [16].
В начальных стадиях заболевания важную роль играют дендритные клетки (ДК). Одним из возможных механизмов активации ДК является распознавание антимикробных пептидов (АМП). АМП секретируются кератиноцитами в ответ на повреждение клетки и экспрессируются в коже. Хорошо изучена патогенетическая роль LL37 кателицидинов в процессе активации ДК [17]. Активированные ДК играют ключевую роль в начале развития псориатического процесса и характеризуются выработкой IFN I типа (IFN-α и IFN-β). Сигнализация IFN I типа участвует в дифференцировке и функционировании Th1 и Th17, включая продукцию IFN-γ и интерлейкина (IL)-17 соответственно [18–20]. Активация адаптивного иммунного ответа через различные подмножества Т-клеток приводит в действие поддерживающую фазу псориатического воспаления [21]. Цитокины Th17, а именно IL-17, IL-21 и IL-22, активируют пролиферацию кератиноцитов в эпидермисе. Кератиноциты также активируются LL37 и значительно увеличивают выработку IFN I типа [22]. Кроме того, кератиноциты активно участвуют в воспалительном каскаде через секрецию цитокинов (IL-1, IL-6 и TNF-α), хемокинов и АМП. Активированные ДК мигрируют в дренирующие лимфатические узлы и секретируют фактор некроза опухоли (TNF)-α, IL-23 и IL-12, причем последние два модулируют дифференцировку и пролиферацию клеточных подмножеств Th17 и Th1 соответственно. Показано, что в коже при псориазе процесс начинается с повышения экспрессии фактора некроза опухоли альфа TNF-α и постепенно приводит к продукции IL-23. Далее уже IL-23 вызывает дифференцировку Т-клеток в Th17. В настоящее время центральным сигнальным путем при псориазе является формирование Th17, выброс цитокинов и хемокинов, что приводит к активации TNF-α/IL-23/IL-17/IL-22каскада [23, 24].
ЛЕЧЕНИЕ ПСОРИАЗА
Пациенты с псориазом за счет хронического рецидивирующего течения заболевания часто требуют длительной, иногда пожизненной терапии. Выбор метода терапии определяется тяжестью псориаза, сопутствующими заболеваниями и приверженностью к лечению. Клиническая тяжесть заболевания и ответ на лечение могут быть оценены с помощью нескольких индексов, которые определяют площадь, тяжесть поражения поверхностных отделов тела и качество жизни пациента: PASI, BSA, DLQI. В зависимости от клинической тяжести поражения пациенты подразделяются на несколько групп: легкая, средняя и тяжелая форма псориаза (BSA < 5% – легкая форма, ≥5% – средняя, ≥10% – тяжелая) [25].
В настоящее время определяющей целью терапии псориаза является достижение полного очищения кожи и полного купирования симптомов: PASI 90/100 (полное или почти полное очищение кожи). Выбранный метод терапии должен обеспечивать долгосрочную ремиссию, увеличение продолжительности и качества жизни пациентов, снижение риска коморбидных заболеваний [26].
Псориаз среднетяжелой и тяжелой степени (BSA > 10, PASI > 10, DLQI > 10) требует системного лечения [27]. Наличие сопутствующих заболеваний, псориатического артрита, значительное снижение качества жизни пациента (например, вовлечение ладоней или подошв) или недостаточный ответ на местное лечение и фототерапию также влияют на выбор лечения [28].
Наружная терапия применяется как монотерапия для лечения псориаза легкой и средней степени тяжести, а также используется в сочетании с системными методами терапии при тяжелых формах заболевания. Около 80% больных псориазом страдают легкой или средней cтепенью тяжести дерматоза. Большинство этих больных получают только наружную терапию. Для пациентов с легким псориазом местные средства остаются основой лечения, и они включают местные кортикостероиды, аналоги витамина D, ингибиторы кальциневрина и кератолитики [29].
Топические кортикостероиды (ТГКС) приняты в качестве первой линии наружной терапии при легкой и средней степени псориаза. В ряде исследований показана высокая эффективность высокопотенциальных ТГКС при лечении псориаза, т. к. при двукратном ежедневном применении бетаметазона дипропионата 46–56% пациентов достигали ремиссии или значительного улучшения и 68–89% – при использовании клобетазола пропионата [30].
При тяжелых формах псориаза для повышения эффективности лечения ТГКС используются как дополнение к системной терапии или фототерапии при локализации высыпаний в проблемных областях: ладони, подошвы, волосистая часть головы, складки, гениталии и лицо [31].
Выбор ТГКС для лечения псориаза зависит от анатомического расположения высыпаний, толщины инфильтрации бляшки и возраста пациента. При инфильтрированных высыпаниях на туловище и/или конечностях, ладонно-подошвенной локализации рекомендовано применять ТГКС средней и высокой степени активности до 4 нед. ежедневного лечения [28].
Детский возраст и локализация высыпаний в области складок и лица являются показанием для использования ТГКС низкой и средней степени активности 1–2 раза в день в течение 2–4 нед., а затем один-два раза в неделю для поддерживающей терапии.
У четверти пациентов с псориазом наблюдается поражение ногтей, у половины пациентов отмечается поражение волосистой части головы [32]. При такой локализации псориатического процесса эффективна комбинация системной терапии и местное применение ТГКС. Так, при поражении околоногтевого валика возможно применение сильных и очень сильных ТГКС. При выборе ТГКС для лечения волосистой части головы предпочтительнее являются такие наружные формы ТГКС, как лосьоны и гели [28, 33].
При длительном существовании высыпаний может наступить их резкое утолщение, иногда с папилломатозными, бородавчатыми разрастаниями. При инфильтрированных бляшках (клиническая толщина > 0,75 мм) рекомендовано применение кератолитических средств, включая салициловую кислоту или мочевину, сильных местных кортикостероидов или их комбинации [34]. Эффективность салициловой кислоты для уменьшения гиперкератоза подтверждается наибольшим количеством доказательств [35]. Наружные средства, содержащие салициловую кислоту 2–5%, применяются у больных псориазом при гиперкератотических поражениях, при этом отмечается уменьшение эритемы, десквамации и зуда. Еще одним преимуществом салициловой кислоты является связанное с ее кератолитическим действием повышенное проникновение других активных местных агентов. Салициловая кислота также рекомендуется в сочетании с местными стероидами для повышения эффективности ТГКС при лечении псориаза [28, 34–36].
В последние годы для повышения эффективности и снижения частоты возникновения нежелательных эффектов при применении ТГКС стали применяться новые технологии для создания ЛС. Микронизация частиц некоторых гормональных препаратов позволяет увеличить площадь всасывания, степень проникновения препарата в сосудистое русло в десятки раз, что позволяет повысить эффективность, безопасность, комплаентность лечения псориаза с применением ТГКС [37].
В РФ зарегистрирован комбинированный топический препарат Акридерм СК, в состав которого входит микронизированный бетаметазон (БД) (размер частиц БД составляет менее 50 мкм), микронизированный бетаметазон 0,05% и салициловая кислота 3%.
КЛИНИЧЕСКИЕ НАБЛЮДЕНИЯ
Всем больным с псориазом была проведена терапия с применением наружного комбинированного препарата Акридерм СК® АО «Акрихин». Акридерм СК® выпускается в топической форме мазь, содержит микронизированный бетаметазон 0,05% + салициловую кислоту 3%. Схема назначения два раза в день в течение 3–4 нед.
Приводим несколько собственных клинических наблюдений применения препарата Акридерм СК® у больных с псориазом.
Пациентка 44 лет обратилась к дерматологу ГБУЗ МО «ЛКВД» с жалобами на наличие высыпаний на коже ладоней и стоп, сопровождающихся периодически возникающим незначительным зудом.
Впервые высыпания появились на коже стоп 1 год назад, на коже ладоней – 2 мес. назад, периодические обострения 1 раз в 2–3 мес., связывает с воздействием стрессовых факторов. Сезонность: не отмечает. К специалистам ранее не обращалась.
Из анамнеза жизни: считает себя соматически здоровой (не обследовалась). Перенесенные травмы, оперативные вмешательства отрицает. ВИЧ-инфекцию, вирусные гепатиты В, С, туберкулез, ИППП отрицает. Аллергоанамнез не отягощен. Из вредных привычек – курение. Лекарственные средства на постоянной основе не принимает. Наследственность отягощена (у матери и дедушки по материнской линии – бляшечный псориаз).
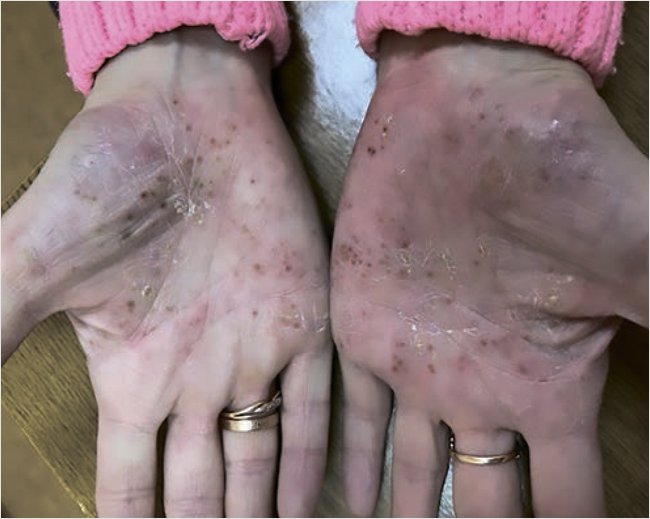
Status localis: кожный процесс носит ограниченный, подостровоспалительный, симметричный характер, локализован на всей ладонной поверхности кистей, подошвенной поверхности стоп. Представлен эритематозно-сквамозными бляшками неправильной формы с нечеткими границами на коже ладоней, четкими – на коже стоп, с умеренной инфильтрацией, серозно-гнойными корочками, местами на поверхности очагов среднепластинчатое шелушение (рис. 1). Ногтевые пластины кистей и стоп не изменены. Видимые слизистые оболочки нормальной окраски, свободные от высыпаний. Индекс PASI 9,6.
Рисунок 1. Пациентка А. до лечения
Для исключения микотической инфекции было проведено микроскопическое исследование соскоба с очагов кистей и стоп. По результатам исследования мицелия патогенных грибов в патологических очагах выявлено не было. Таким образом, по результатам клинико-лабораторного обследования был диагностирован ладонно-подошвенный псориаз. Назначена наружная терапия: мазь Акридерм СК® (бетаметазон 0,05% + салициловая кислота 3%) 2 раза в день – 10 дней.
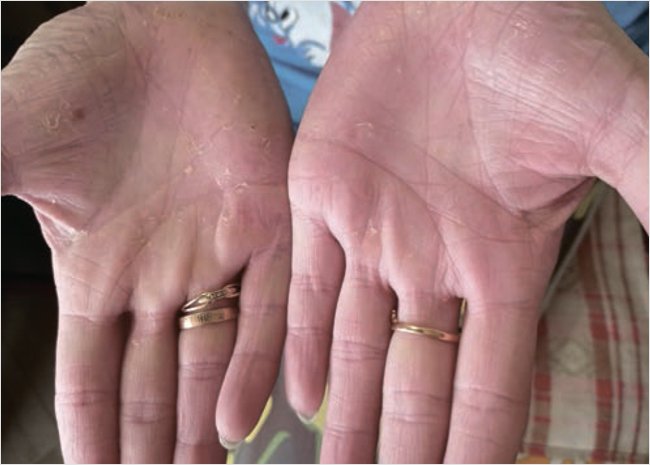
При повторном осмотре через 9 дней отмечалась положительная динамика в виде уменьшения высыпаний, инфильтрации, гиперемии, корочки частично отторглись. Появления новых элементов не отмечалось (рис. 2). На 9-й день лечения индекс PASI 6,0. Лечение было продолжено.
Рисунок 2. Пациентка А.через 9 дней после наружного лечения Акридерм СК® мазь
Пациент П. 55 лет обратился к дерматологу ФГУЗ ЦСМЧ №119 ФМБА России с жалобами на наличие множественных высыпаний на коже, сопровождающихся зудом.
Впервые высыпания появились на коже 18 лет назад. Периодические обострения 1 раз в месяц, связывает с воздействием стрессовых факторов, периодическим приемом алкоголя. Сезонность: не отмечает. К специалистам ранее не обращался. Самостоятельно использовал ТГКС без системы.
Из анамнеза жизни: считает себя соматически здоровым (не обследовался). Перенесенные травмы, оперативные вмешательства отрицает. ВИЧ-инфекцию, вирусные гепатиты В, С, туберкулез, ИППП отрицает. Аллергоанамнез не отягощен. Из вредных привычек – курение до 20 сигарет в день, 1 раз в месяц прием алкоголя. Лекарственные средства на постоянной основе не принимает. Наследственность по псориазу не отягощена.
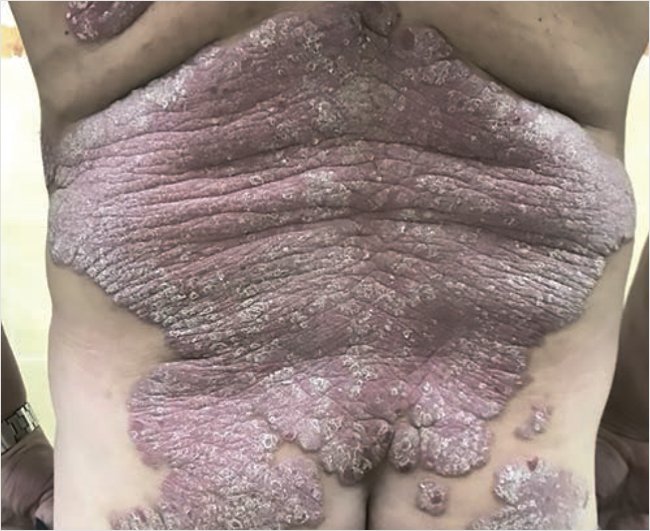
Status localis: кожный процесс носит распространенный, хронический, воспалительный, симметричный характер: локализован на коже туловища (в основном спины), верхних и нижних конечностях, преимущественно на разгибательных поверхностях, тыльной поверхности кистей и стоп. Представлен обширными (диаметр от 10 до 30 см) эритематозно-сквамозными бляшками неправильной формы с четкими границами, с выраженной инфильтрацией, красного цвета, на поверхности очагов среднепластинчатое шелушение (рис. 3). Псориатическая триада положительная, феномен Кебнера отрицательный. Ногтевые пластины кистей и стоп – онихолис.
Рисунок 3. Пациент П. до лечения
На голове по краю роста волос папулезные и бляшечные высыпания умеренной инфильтрации красного цвета с серебристыми чешуйками. Видимые слизистые оболочки нормальной окраски, свободные от высыпаний. Индекс PASI 18,1.
По результатам первичного клинического обследования был диагностирован распространенный вульгарный псориаз и назначена наружная терапия: мазь Акридерм СК® (бетаметазон 0,05% + салициловая кислота 3%) 2 раза в день – 10 дней. Далее пациент был отправлен на дополнительное клинико-лабораторное обследование для решения вопроса о системном комбинированном лечении с использованием методов фототерапии.
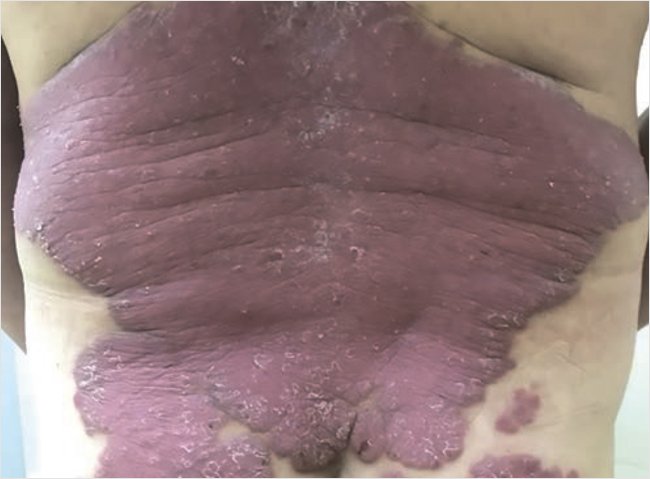
При повторном осмотре через 10 дней отмечалась положительная динамика в виде уменьшения высыпаний, инфильтрации, гиперемии. На 10-й день лечения индекс PASI 14,5 (рис. 4). Пациенту назначена терапия: комбинация фототерапии и наружного лечения с применением Акридерм СК® мазь.
Рисунок 4. Пациент П. через 10 дней после наружного лечения Акридерм СК® мазь
ЗАКЛЮЧЕНИЕ
Применение ТГКС в терапии псориаза является эффективным и безопасным и соответствует требованиям современных принципов лечения. Наружная терапия применяется как монотерапия для лечения псориаза легкой и средней степени тяжести, а также используется в сочетании с системными методами терапии при тяжелых формах заболевания. На российском фармацевтическом рынке зарегистрирован препарат Акридерм СК® (АО «Акрихин»), который производится в соответствии со стандартами общепризнанной в мире надлежащей производственной практики (GMP).
Опыт клинического применения препарата Акридерм СК® для лечения больных псориазом продемонстрировал высокую терапевтическую эффективность и низкий риск нежелательных явлений, что обусловливает целесообразность его активного применения с целью повышения качества оказания медицинской помощи для лечения псориаза. Высокая эффективность, безопасность и оптимальный фармакоэкономический индекс повышают приверженность пациентов.
Список литературы / References
- Kurd S.K., Gelfand J.M. The prevalence of previously diagnosed and undiagnosed
psoriasis in US adults: results from NHANES 2003–2004. J Am Acad Dermatol. 2009;60(2):218–224. doi: 10.1016/j.jaad.2008.09.022. - Augustin M., Reich K., Glaeske G., Schaefer I., Radtke M. Co-morbidity and agerelated prevalence of psoriasis: Analysis of health insurance data in Germany.
Acta Derm Venereol. 2010;90(2):147–151. doi: 10.2340/00015555-0770. - Christophers E. Psoriasis – epidemiology and clinical spectrum. Clin Exp Dermatol. 2001;26(4):314–320. doi: 10.1046/j.1365-2230.2001.00832.x.
- Parisi R., Symmons D.P., Griffiths C.E., Ashcroft D.M. Global epidemiology of psoriasis: a systematic review of incidence and prevalence. J Invest Dermatol. 2013;133(2):377–385. doi: 10.1038/jid.2012.339.
- Gibbs S. Skin disease and socioeconomic conditions in rural Africa: Tanzania. Int J Dermatol. 1996;35(9):633–639. doi: 10.1111/j.1365-4362.1996.tb03687.x.
- Rachakonda T.D., Schupp C.W., Armstrong A.W. Psoriasis prevalence among adults in the United States. J Am Acad Dermatol. 2014;70(3):512–516. doi: 10.1016/j.jaad.2013.11.013.
- Danielsen K., Olsen A.O., Wilsgaard T., Furberg A.S. Is the prevalence of psoriasis
increasing? A 30-year follow-up of a population-based cohort. Br J Dermatol. 2013;168(6):1303–1310. doi: 10.1111/bjd.12230. - Кубанов А.А., Бакулев А.Л., Карамова А.Э., Притуло О.А., Аршинский М.И., Знаменская Л.Ф. и др. Псориаз: клинические рекомендации. М.; 2020. 66 с. Режим доступа: https://www.rodv.ru/. / Kubanov A.A., Bakulev A.L., Karamova A.E., Pritulo O.A., Arshinskiy M.I.,
Znamenskaya L.F. et al. Psoriasis: clinical guidelines. Мoscow; 2020. 66 p. (In Russ.) Available at: https://www.rodv.ru/. - Trembath R.C., Clough R.L., Rosbotham J.L., Jones A.B., Camp R.D., Frodsham A. et al. Identification of a major susceptibility locus on chromosome 6p and evidence for further disease loci revealed by a two stage genome-wide search in psoriasis. Hum Mol Genet. 1997;6(5):813–820. doi: 10.1093/hmg/6.5.813.
- Sommer D.M., Jenisch S., Suchan M., Christophers E., Weichenthal M. Increased prevalence of the metabolic syndrome in patients with moderate to severe psoriasis. Arch Dermatol Res. 2006;298(7):321–328. doi: 10.1007/s00403-006-0703-z.
- Gerdes S., Mrowietz U., Boehncke W.H. Komorbidität bei Psoriasis vulgaris. Hautarzt (German). 2016;67(6):438–444. doi: 10.1007/s00105-016-3805-3.
- Rapp S.R., Feldman S.R., Exum M.L., Fleischer A.B. Jr, Reboussin D.M. Psoriasis
causes as much disability as other major medical diseases. J Am Acad Dermatol. 1999;41(3 Pt 1):401–407. doi: 10.1016/s0190-9622(99)70112-x. - Di Meglio P., Villanova F., Nestle F.O. Psoriasis. Cold Spring Harb Perspect Med. 2014;4(8):a015354. doi: 10.1101/cshperspect.a015354.
- Rendon A., Schäkel K. Psoriasis Pathogenesis and Treatment. Int J Mol Sci. 2019;20(6):1475. doi: 10.3390/ijms20061475.
- Harden J.L., Krueger J.G., Bowcock A.M. The immunogenetics of Psoriasis: A comprehensive review. J Autoimmun. 2015;64:66–73. doi: 10.1016/j.jaut.2015.07.008.
- Liang Y., Sarkar M.K., Tsoi L.C., Gudjonsson J.E. Psoriasis: a mixed autoimmune
and autoinflammatory disease. Curr Opin Immunol. 2017;49:1–8. doi: 10.1016/j.coi.2017.07.007. - Morizane S., Gallo R.L. Antimicrobial peptides in the pathogenesis of psoriasis.
J Dermatol. 2012;39(3):225–230. doi: 10.1111/j.1346-8138.2011.01483.x. - Nestle F.O., Conrad C., Tun-Kyi A., Homey B., Gombert M., Boyman O. et al. Plasmacytoid predendritic cells initiate psoriasis through interferon-alpha
production. J Exp Med. 2005;202(1):135–143. doi: 10.1084/jem.20050500. - Gregorio J., Meller S., Conrad C., Di Nardo A., Homey B., Lauerma A. et al. Plasmacytoid dendritic cells sense skin injury and promote wound healing through
type I interferons. J Exp Med. 2010;207(13):2921–2930. doi: 10.1084/jem.20101102. - Santini S.M., Lapenta C., Donati S., Spadaro F., Belardelli F., Ferrantini M. Interferon-α-conditioned human monocytes combine a Th1-orienting attitude
with the induction of autologous Th17 responses: role of IL-23 and IL-12. PLoS One. 2011;6(2):e17364. doi: 10.1371/journal.pone.0017364. - Hänsel A., Günther C., Ingwersen J., Starke J., Schmitz M., Bachmann M. et al.
Human slan (6-sulfo LacNAc) dendritic cells are inflammatory dermal dendritic cells in psoriasis and drive strong TH17/TH1 T-cell responses. J Allergy Clin Immunol. 2011;127(3):787–794.e1-9. doi: 10.1016/j.jaci.2010.12.009. - Morizane S., Yamasaki K., Mühleisen B., Kotol P.F., Murakami M., Aoyama Y. et al. Cathelicidin antimicrobial peptide LL-37 in psoriasis enables keratinocyte reactivity against TLR9 ligands. J Invest Dermatol. 2012;132(1):135–143. doi: 10.1038/jid.2011.259.
- Perera G.K., Di Meglio P., Nestle F.O. Psoriasis. Annu Rev Pathol. 2012;7:385–422. doi: 10.1146/annurev-pathol-011811-132448.
- Capon F. The Genetic Basis of Psoriasis. Int J Mol Sci. 2017;18(12):2526. doi: 10.3390/ijms18122526.
- Mrowietz U., Kragballe K., Reich K., Spuls P., Griffiths C.E., Nast A. et al. Definition of treatment goals for moderate to severe psoriasis: a European consensus.
Arch Dermatol Res. 2011;303(1):1–10. doi: 10.1007/s00403-010-1080-1. - Strober B.E., van der Walt J.M., Armstrong A.W., Bourcier M., Carvalho A.V.E.,
Chouela E. et al. Clinical Goals and Barriers to Effective Psoriasis Care. Dermatol Ther (Heidelb). 2019;9(1):5–18. doi: 10.1007/s13555-018-0279-5. - Nast A., Smith C., Spuls P.I., Avila Valle G., Bata-Csörgö Z., Boonen H. et al.
EuroGuiDerm Guideline on the systemic treatment of Psoriasis vulgaris – Part 1: treatment and monitoring recommendations. J Eur Acad Dermatol Venereol. 2020;34(11):2461–2498. doi: 10.1111/jdv.16915. - Ladizinski B., Lee K.C., Wilmer E., Alavi A., Mistry N., Sibbald R.G. A review
of the clinical variants and the management of psoriasis. Adv Skin Wound Care. 2013;26(6):271–284. doi: 10.1097/01.ASW.0000429778.10020.67. - Hoegler K.M., John A.M., Handler M.Z., Schwartz R.A. Generalized pustular psoriasis: a review and update on treatment. J Eur Acad Dermatol Venereol. 2018;32(10):1645–1651. doi: 10.1111/jdv.14949.
- Zweegers J., de Jong E.M., Nijsten T.E., de Bes J., te Booij M., Borgonjen R. et al. Summary of the Dutch S3-guidelines on the treatment of psoriasis 2011. Dermatol Online J. 2014;20(3). Available at: https://escholarship.org/.
- Canadian Psoriasis Guidelines Addendum Committee. 2016 Addendum to the Canadian Guidelines for the Management of Plaque Psoriasis 2009. J Cutan Med Surg. 2016;20(5):375–431. doi: 10.1177/1203475416655705.
- Merola J.F., Li T., Li W.Q., Cho E., Qureshi A.A. Prevalence of psoriasis phenotypes among men and women in the USA. Clin Exp Dermatol. 2016;41(5):486–
489. doi: 10.1111/ced.12805. - Merola J.F., Qureshi A., Husni M.E. Underdiagnosed and undertreated psoriasis:
Nuances of treating psoriasis affecting the scalp, face, intertriginous areas, genitals, hands, feet, and nails. Dermatol Ther. 2018;31(3):e12589. doi: 10.1111/dth.12589. - Jacobi A., Mayer A., Augustin M. Keratolytics and emollients and their role in the therapy of psoriasis: a systematic review. Dermatol Ther (Heidelb). 2015;5(1):1–18. doi: 10.1007/s13555-015-0068-3.
- Chiricozzi A., Pimpinelli N., Ricceri F., Bagnoni G., Bartoli L., Bellini M. et al. Treatment of psoriasis with topical agents: Recommendations from a Tuscany
Consensus. Dermatol Ther. 2017;30(6). doi: 10.1111/dth.12549. - Nast A., Boehncke W.H., Mrowietz U., Ockenfels H.M., Philipp S., Reich K. et al.
German S3-guidelines on the treatment of psoriasis vulgaris (short version). Arch Dermatol Res. 2012;304(2):87–113. doi: 10.1007/s00403-012-1214-8. - Rogers T.L., Nelsen A.C., Hu J., Brown J.N., Sarkari M., Young T.J. et al. A novel particle engineering technology to enhance dissolution of poorly water soluble drugs: spray-freezing into liquid. Eur J Pharm Biopharm. 2002;54(3):271–280. doi: 10.1016/s0939-6411(02)00063-2.



 1
1 2
2 3
3 4
4


Комментарии (0)