Журнал "Медицинский совет" №2/2022
DOI: 10.21518/2079-701X-2022-16-2-15-23
Д.Р. Хасанова1,2, https://orcid.org/0000-0002-8825-2346
Т.В. Данилова1,2*, https://orcid.org/0000-0001-6926-6155
З.К. Латыпова2 , https://orcid.org/0000-0003-1651-5554
Г.Р. Гайнетдинова1 , https://orcid.org/0000-0002-1892-3837
1 Казанский государственный медицинский университет; 420012, Россия, Республика Татарстан, Казань, ул. Бутлерова, д. 49
2 Межрегиональный клинико-диагностический центр; 420101, Россия, Республика Татарстан, Казань, ул. Карбышева, д. 12А
Введение. Сосудистые заболевания головного мозга часто ассоциируются с развитием эпилептических припадков. Было сделано предположение, что в реализации эпилептогенеза у больных с ишемическим поражением мозга может иметь значение гемодинамический фактор, а именно состояние перфузионного резерва.
Цель – провести исследование состояния цереброваскулярной реактивности (ЦВР) разных церебральных сосудистых бассейнов у больных с развитием эпилептических припадков на фоне ишемии головного мозга.
Материалы и методы. Комплексно обследовано 772 пациента с острой и хронической ишемией головного мозга: 265 больных с инсультом и 174 – с хронической ишемией головного мозга (ИГМ) с развитием эпилептических припадков, а также 203 больных с инсультом и 130 пациентов с хронической ИГМ без приступов.
Результаты. У пациентов с ишемией головного мозга превалируют фокальные приступы. У пациентов как с острой, так и хронической ИГМ преобладала корковая локализация очагов ишемии. Стенозы магистральных артерий чаще выявлялись как у пациентов с ишемическим инсультом с развитием эпилептических припадков – 218 (82,3%) по сравнению с пациентами с инсультом в группе сравнения – 151 (74,4%) больных, р < 0,05, так и у пациентов с хронической ИГМ с развитием эпилептических припадков –121 (69,5%) чел., р < 0,05, по сравнению с пациентами группы сравнения – 74 (56,9%) больных. Выявлено преобладание стенозов магистральных артерий головного мозга более 70% у пациентов с предшествовавшими инсульту эпилептическими припадками – 77 (33,5%) по сравнению с пациентами без припадков-предшественников, у которых стенозы более 70% были обнаружены лишь у 4 (11,5%) больных (χ2 = 10,1; p = 0,03). В группе сравнения пациентов достоверно значимой разницы изменения ЦВР в каротидной системе и в вертебробазилярном бассейне (ВББ) не отмечено: 30 (36,6%) и 42 (47,7%) обследованных соответственно.
Заключение. Выявленное снижение ЦВР в ВББ можно считать одним из факторов риска развития эпилепсии в условиях ишемической болезни головного мозга.
Для цитирования: Хасанова Д.Р., Данилова Т.В., Латыпова З.К., Гайнетдинова Г.Р. Состояние просвета магистральных сосудов головного мозга и системы регуляции мозгового кровообращения у больных с ишемией головного мозга с развитием эпилептических приступов. Медицинский Совет. 2022;(2):15-23. https://doi.org/10.21518/2079-701X-2022-16-2-15-23
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
The state of the lumen of the major cerebral vessels and systems of regulation of cerebral circulation in patients with cerebral ischemia with the development of epileptic seizures
Dina R. Khasanova1,2, https://orcid.org/0000-0002-8825-2346
Tatiana V. Danilova1,2*, https://orcid.org/0000-0001-6926-6155
Zarina K. Latypova2, https://orcid.org/0000-0003-1651-5554
Guzel R. Gainetdinova1, https://orcid.org/0000-0002-1892-3837
1 Kazan State Medical University; 49, Butlerov St., Kazan, Republic of Tatarstan, 420012, Russia
2 Interregional Clinical and Diagnostical Center; 12А, Karbyshev St., Kazan, Republic of Tatarstan, 420101, Russia
Introduction. Cerebrovascular diseases are often associated with the development of epileptic seizures. It was suggested that in the implementation of epileptogenesis in patients with ischemic brain damage, a hemodynamic factor, namely the state of the perfusion reserve, may be important.
Objective. The examination of the state of cerebrovascular reactivity of different cerebral vascular basins in patients with the development of epileptic seizures affected by cerebral ischemia.
Materials and methods. 772 patients with acute and chronic cerebral ischemia (265 stroke patients with epileptic seizures and 174 patients with seizures on the background of chronic cerebral ischemia and 203 patients with stroke and 130 patients with chronic cerebral ischemia without seizures) was comprehensively examined. Results. In patients with cerebral ischemia, focal seizures prevail. Cortical localization of ischemic foci prevailed in patients with both acute and chronic cerebral ischemia. Stenosis of the main arteries were more often detected as in patients with ischemic stroke with the development of epileptic seizures – 218 (82.3%) compared with patients with stroke in the comparison group – 151 (74.4%) patients, р < 0.05), and in patients with CBI (chronic brain ischemia) with the development of epileptic seizures – 121 (69.5%) people, p < 0.05) compared with patients in the comparison group – 74 (56.9%) patients. The prevalence of stenosis of the main cerebral arteries was revealed in more than 70% in patients with pre-stroke epileptic seizures – 77 (33.5%) compared with patients without precursor seizures, who have been diagnosed with stenosis of more than 70% were found in only 4 (11.5%) patients (χ2 = 10.1; p = 0.03). In the comparison group of patients, there was no significant difference in CVR (cerebrovascular reactivity) changes in the carotid system and in the VBS (vertebrobasilar system) – 30 (36.6%) and 42 (47.7%) examined, respectively.
Conclusion. The revealed decrease in cerebrovascular reactivity in the vertebrobasilar basin can be considered as one of the risk factors for the development of epilepsy in conditions of brain ischemia.
For citation: Khasanova D.R., Danilova T.V., Latypova Z.K., Gainetdinova G.R. The state of the lumen of the major cerebral vessels and systems of regulation of cerebral circulation in patients with cerebral ischemia with the development of epileptic seizures. Meditsinskiy sovet = Medical Council. 2022;(2):15-23. (In Russ.) https://doi.org/10.21518/2079-701X-2022-16-2-15-23
Conflict of interest: the authors declare no conflict of interest.
Введение
Сосудистые заболевания головного мозга часто ассоциируются с развитием эпилептических припадков [1–7]. В настоящее время проводятся многочисленные исследования по изучению эпидемиологии, патогенеза, клинических особенностей и тактики лечения эпилептических припадков, появившихся на фоне нарушений мозгового кровообращения. Однако до конца не раскрыты патогенетические механизмы развития эпилептических приступов у больных с сосудистой патологией головного мозга.
Цереброваскулярная реактивность (ЦВР) является интегративным показателем адаптационных возможностей системы мозгового кровообращения, способностью сосудов мозга реагировать на изменяющиеся условия функционирования и оптимизировать кровоток в соответствии с этими условиями.
Было сделано предположение, что в реализации эпилептогенеза у больных с ишемическим поражением мозга может иметь значение гемодинамический фактор, а именно состояние перфузионного резерва. Это определило интерес к изучению ЦВР, являющейся важным параметром функциональной оценки мозгового кровотока, в разных сосудистых бассейнах в плане изучения перфузионных характеристик.
Для оценки ЦВР проводят различные пробы. Наиболее часто применяемыми являются пробы на гиперкапнию (СО2) и фотостимуляцию.
Цель работы - исследовать состояние ЦВР разных церебральных сосудистых бассейнов у больных с развитием эпилептических припадков на фоне ишемии головного мозга.
Материалы и методы
Комплексно обследовано 772 пациента в возрасте от 31 до 91 года. В основную группу вошли 265 больных в возрасте от 31 до 89 лет (мужчин – 176, женщин – 89) с ишемическим инсультом с развитием эпилептических припадков и 174 пациента в возрасте от 44 до 83 лет (мужчин – 80, женщин – 94) с впервые возникшими эпилептическими припадками, манифестировавшими на фоне хронической ишемии головного мозга (ИГМ). Группу сравнения составили 203 пациента в возрасте от 31 до 91 года (мужчин – 126, женщин – 77) с ишемическим инсультом и 130 больных в возрасте от 39 до 82 лет (мужчин – 43, женщин – 87) с хронической ИГМ без эпилептических приступов. Пациенты группы сравнения были сопоставимы с больными основной группы по возрасту, клиническим характеристикам и представленности патогенетических подтипов инсульта.
В исследование включались пациенты с впервые возникшими эпилептическими припадками в условиях ишемического инсульта и хронической ИГМ. Критериями исключения были пациенты, у которых эпилептические припадки предшествовали развитию хронической ИГМ, пациенты с эпилептическими припадками, у которых имелось сочетание острой или хронической ИГМ с другими актуальными церебральными процессами (опухолью, травматической болезнью головного мозга, нейроинфекцией и др.).
110 (41,5%) пациентов основной и 78 (38,4%) группы сравнения перенесли ишемический инсульт в правом каротидном бассейне, 121 (45,7%) основной и 90 (44,3%) группы сравнения – в левом каротидном бассейне и у 34 (12,8%) больных основной и 35 (17,3%) группы сравнения был инсульт в вертебробазилярном бассейне (ВББ).
Обследование проводилось в условиях неврологической клиники Межрегионального клинико-диагностического центра (Казань). Неврологический осмотр проводился по общепринятой методике. Инструментальные исследования выполнялись в межприступном периоде. Визуализация структур головного мозга осуществлялась с помощью магнитно-резонансной томографии на аппарате с напряженностью 1,5 Тесла в режимах Т1, Т2, FLAIR, DWI с оценкой измеряемого коэффициента диффузии, с применением магнитно-резонансной ангиографии. Функциональное состояние больших полушарий оценивалось по электроэнцефалограммам (ЭЭГ). Кроме того, выполнялось дуплексное эстракраниальное и транскраниальное исследование сосудов головного мозга с оценкой уровня и степени стеноза и ЦВР. ЦВР в каротидных бассейнах изучалась по стандартной методике на аппарате транскраниальной допплерографии SONARA с проведением функциональных проб с оценкой индексов на гиперкапническую (Кр+) и гипокапническую нагрузку (Кр–). Для определения реактивности церебральных сосудов на гиперкапнию проводили пробу с произвольной задержкой дыхания, сосудистую реакцию оценивали через 20 сек. Гипокапнический тест выполняли с помощью форсированных дыхательных движений, реакцию церебральных сосудов также оценивали через 20 сек [8]. Исследование состояния ЦВР в ВББ выполнялось при помощи пробы на фотореактивность с оценкой изменения скорости кровотока в задней мозговой артерии в ответ на нагрузку. В качестве нагрузочного стимула использовалась фотостимуляция стробоскопической лампой с частотой блика 3–5 в сек с расстояния 0,5 м в течение 5–8 сек. В норме кровоток увеличивается на 25–50% от исходного. При оценке реактивности на гиперкапнию и фотостимуляцию были выделены 4 группы пациентов: 1-ю группу составили пациенты с нормальной ЦВР (25–50%), 2-ю – со снижением ЦВР от 20 до 24%, 3-ю – со снижением ЦВР от 10 до 19%, 4-ю – пациенты со снижением ЦВР < 10%. Цифровой материал подвергался математической обработке с использованием программ Microsoft Excel, Statistica 11.0. Попарное сравнение частот в контрольной и основной группах проводилось с помощью критерия χ2. Достоверность различий оценивали на 5%-м уровне значимости.
Результаты
Как у пациентов с ишемическим инсультом (92,5%), так и у больных с хронической ИГМ (88,5%) преобладали фокальные приступы.
Анализ нейровизуализационных данных выявил, что у больных с ишемическим инсультом с развитием эпилептических приступов превалирует корковая локализация очагов ишемии (81,1% по сравнению с 38,9% у группы сравнения, χ2 = 89,2, р < 0,001). При этом острые симптоматические приступы у больных с ишемическим инсультом развиваются при достоверно более частой локализации очага ишемии в правом полушарии с вектором направленности нейровизуализационного формирования ишемического очага в каудальном направлении (медиобазальные отделы височной доли, нижняя височная извилина, угловая извилина, кора затылочной доли); поздние приступы ассоциированы с достоверно более частой ишемией в области коры лобной, височной долей правого полушария и ишемией в проекции стыка коры теменной и затылочной долей левого полушария. Кроме того, у пациентов с острыми симптоматическими приступами на фоне ишемического инсульта отмечены более высокие значения медианы измеряемого коэффициента диффузии (ADC) (0,00058 мм2/сек ± 0,10 · 103 мм2/сек, межквартильный размах 0,0005–0,0006 мм2/сек, р < 0,05) по сравнению с больными с ишемическим инсультом без приступов (0,00048 мм2/сек ± 0.07 · 103 мм2/сек, межквартильный размах 0,00045–0,00054 мм2/сек), что свидетельствует о менее грубых структурных изменениях в очаге острой ишемии по сравнению с пациентами с ишемическим инсультом без развития приступов.
У пациентов с хронической ИГМ с развитием эпилептических приступов, как и у пациентов с острой ишемией наблюдаются более частая корковая локализация сосудистых очагов (63,8%, в группе сравнения – 22,7%, p < 0,001) и выраженность атрофических процессов в виде расширения ликворных пространств (86,5%, в группе сравнения – 61,9%, р < 0,001), бо́льшая частота выраженности поражения белого вещества (31,4% с 5–6 баллами по шкале Fazekas при отсутствии таких пациентов в группе сравнения, p < 0,001) с более значимым выявлением в теменно-затылочной локализации (89%, р < 0,01).
У пациентов и с острой, и с хронической ИГМ на ЭЭГ преобладала левосторонняя локализация очага патологической активности (55 и 59,6% соответственно от всех пациентов с зарегистрированной патологической активностью).
У всех обследованных пациентов выявлены признаки атеросклероза магистральных артерий головного мозга. При этом стенозы магистральных артерий чаще выявлялись как у пациентов с ишемическим инсультом с развитием эпилептических припадков – 218 (82,3%) по сравнению с пациентами с инсультом группы сравнения – 151 (74,4%) больных, р < 0,05, так и у пациентов с хронической ИГМ с развитием эпилептических припадков – 121 (69,5%) чел., р < 0,05, по сравнению с пациентами группы сравнения – 74 (56,9) больных.
Выявлено преобладание стенозов магистральных артерий головного мозга более 70% у пациентов с предшествовавшими инсульту эпилептическими припадками – 77 (33,5%) по сравнению с пациентами без припадков-предшественников, у которых стенозы более 70% были обнаружены лишь у 4 (11,5%) больных (χ2 = 10,1; p = 0,03).
У больных с инсультом с развитием эпилептических припадков отмечено, что очаги патологической активности на ЭЭГ чаще зарегистрированы среди пациентов со стенозами в левом каротидном бассейне – 39 (60%), чем у пациентов со стенозами в правом каротидном бассейне 33 (44,6%) и стенозами в обоих каротидных бассейнах – 35 (44,3%) больных, р < 0,05.
У пациентов со стенозированием артерий левого каротидного бассейна более 40% преобладали лица с генерализованными приступами (7 (35%) больных), билатеральными тонико-клоническими с фокальным дебютом приступами (21 (25,9%) пациентов) и полиморфными фокальными припадками (10 (23,8%) пациентов), в то время как фокальные приступы с сохраненной осознанностью встречались в 18 (19,6%) наблюдениях, фокальные приступы с измененной осознанностью – в 4 (13,3%) наблюдениях (χ2 = 18,06; p = 0,0207). У пациентов со стенозами сосудов правого каротидного бассейна подобных закономерностей не выявлено (χ2 = 22,02; p = 0,14). Вторичная генерализация приступов значительно чаще отмечалась при стенозировании магистральных артерий более 50% левого каротидного бассейна (25 (47,9%) наблюдений), чем правого (17 (27,5%) наблюдений, р < 0,05).
ЦВР служит количественной характеристикой состояния системы регуляции мозгового кровообращения и отражает состояние перфузионных резервов. В группе пациентов с инсультом с развитием эпилептических припадков ЦВР в каротидных бассейнах была оценена в 147 наблюдениях, в ВББ – в 142. В группе сравнения пациентов состояние перфузионных резервов в каротидной системе изучено у 78 пациентов, в ВББ – у 67. Во всех группах обследованных пациентов отмечались нормальные или сниженные (< 25%) показатели ЦВР. Лиц с повышением ЦВР не выявлено.
При сравнении показателей фотореактивности основной группы и группы сравнения выявлено, что снижение реактивности сосудов ВББ чаще наблюдалось у пациентов основной группы (122 (85,9%)), чем у больных группы сравнения – 48 (71,6%) (χ2 = 6,1; p = 0,01; 95% ДИ: 3,0–25,6) (рис. 1). Выявлены достоверные различия и в степени изменения фотореактивности у пациентов обследованных групп (χ2 = 11,5; p = 0,009): значительное снижение фотореактивности (< 10%) чаще замечено у пациентов основной группы (48 (33,8%) чел.), чем у пациентов группы сравнения (9 (13,4%) чел., p < 0,01) (табл. 1).
При сопоставлении показателей реактивности на гиперкапнию основной группы и группы сравнения выявлено, что сниженные показатели отмечались у 90 (61,2%) пациентов основной группы и у 53 (67,9%) группы сравнения (рис. 1). При анализе реактивности на гиперкапнию с учетом выраженности ее снижения были получены следующие результаты: незначительное снижение реактивности на гиперкапнию (до 20%) отмечалось у 27 (18,4%) пациентов основной и у 8 (10,3%) группы сравнения, при этом более грубое снижение реактивности на гиперкапнию (< 10%) отмечалось у пациентов группы сравнения – 19 (24,4%) больных по сравнению с 13 (8,8%) основной группы, p < 0,01 (табл. 2).
Выявлено, что реактивность на гиперкапнию чаще снижена у пациентов с развитием поздних припадков – 43 (70,1%) из 80 больных, чем ранних – 47 (53,8%) из 67 (χ2 = 12,1; p < 0,05).
Таблица 1. Фотореактивность в основной группе и группе сравнения у больных с ишемическим инсультом и хронической ишемией головного мозга
Группы | Фотореактивность | |||||||
> 25% | 20–24% | 10–19% | < 10% | |||||
Пациенты с ишемическим инсультом, % | Пациенты с хронической ИГМ, % | Пациенты с ишемическим инсультом, % | Пациенты с хронической ИГМ, % | Пациенты с ишемическим инсультом, % | Пациенты с хронической ИГМ, % | Пациенты с ишемическим инсультом, % | Пациенты с хронической ИГМ, % | |
Основная | 14,1 | 32,0 | 9,2 | 14,4** | 42,9 | 36,1** | 33,8** | 17,5** |
Сравнения | 28,4* | 52,3** | 10,5 | 12,5 | 49,3 | 31,8 | 13,4 | 4,6 |
* p < 0,05.
** p < 0,01.
Рисунок 1. Соотношение сниженной цереброваскулярной реактивности в разных сосудистых бассейнах у больных с ишемическим инсультом с эпилептическими припадками и без приступов
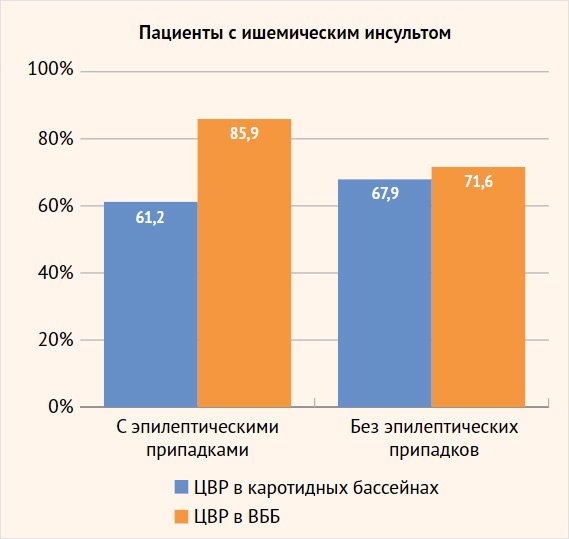
ЦВР в ВББ 85,9% 71,6% пациенты с ишемическим инсультом с эпилептическими припадками пациенты с ишемическим инсультом без эпилептических припадков
Таблица 2. Реактивность на гиперкапнию у пациентов основной группы и группы сравнения с ишемическим инсультом и хронической ишемией головного мозга
Группы | Реактивность на гиперкапнию | |||||||
> 25% | 20–24% | 10–19% | < 10% | |||||
Пациенты с ишемическим инсультом, % | Пациенты с хронической ИГМ, % | Пациенты с ишемическим инсультом, % | Пациенты с хронической ИГМ, % | Пациенты с ишемическим инсультом, % | Пациенты с хронической ИГМ, % | Пациенты с ишемическим инсультом, % | Пациенты с хронической ИГМ, % | |
Основная | 38,8 |
| 18,4 | 20,6 | 34 | 20,6 | 8,8 | 4,1 |
Сравнения | 32,1 |
| 10,3 | 13,3 | 33,3 | 16,7 | 24,4* | 8,9 |
* p < 0,01.
Сравнительный анализ ЦВР у больных, перенесших ишемический инсульт, показал, что у пациентов основной группы (122 (85,9%) больных) преобладало нарушение перфузионного резерва в ВББ по сравнению с каротидным бассейном (90 (61,2%), р < 0,001). При этом более четкие различия наблюдались среди больных с грубым снижением перфузионных резервов: снижение ЦВР < 10% в ВББ отмечалось в 48 (33,8%) наблюдениях, а в каротидном бассейне – в 13 (8,8%), р < 0,001 (табл.1, 2). У пациентов группы сравнения достоверно значимой разницы изменения ЦВР в каротидной системе и в ВББ не отмечено: 53 (67,9%) и 48 (71,6%) больных соответственно.
В группе пациентов с хронической ИГМ с развитием эпилептических припадков ЦВР в каротидных бассейнах была оценена у 97 больных, в ВББ – также у 97. В группе сравнения состояние перфузионных резервов в каротидной системе изучено у 90 пациентов, в ВББ – у 88. Во всех группах обследованных отмечались нормальные или сниженные (< 25%) показатели ЦВР. Лиц с повышением ЦВР не выявлено.
Снижение фотореактивности чаще наблюдалось у пациентов основной группы, чем у группы сравнения – 66 (68,0%) и 42 (47,7%) больных соответственно, p < 0,01, особенно у пациентов со значительным снижением фотореактивности (< 10%) – 17 (17,5%) больных в основной группе по сравнению с 4 (4,6%) пациентами группы сравнения, p<0,01 (рис. 2, табл. 1).
При сопоставлении показателей реактивности на гиперкапнию основной группы и группы сравнения выявлено, что снижение реактивности на гиперкапнию регистрировалось у 44 (45,4%) пациентов основной и у 35 (38,9%) группы сравнения с тенденцией к более частому снижению реактивности на гиперкапнию < 10% у представителей группы сравнения: 8 (8,9%) наблюдений относительно 4 (4,1%) в основной группе (рис. 2, табл. 2).
Рисунок 2. Соотношение сниженной цереброваскулярной реактивности в разных сосудистых бассейнах у больных с хронической ишемией мозга с эпилептическими припадками и без приступов
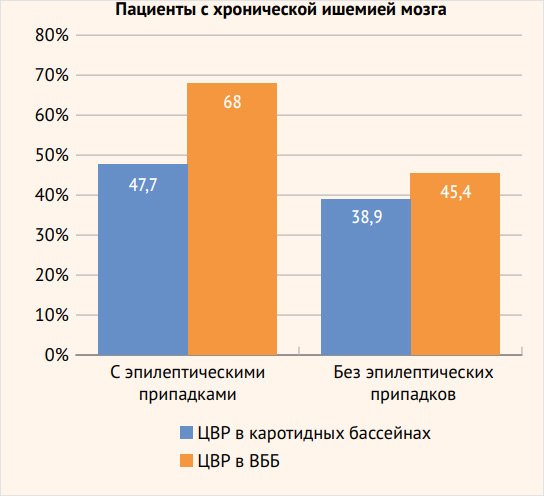
Как и у пациентов с ишемическим инсультом, в группе больных с хронической ИГМ, страдающих различными типами эпилептических припадков, снижение ЦВР превалировало в ВББ – 66 (68%) больных по сравнению с каротидным бассейном – 44 (45,4%), р < 0,01, особенно эта разница отчетливо наблюдалась среди пациентов со снижением ЦВР < 10%: 17 (17,5%) обследованных со сниженным перфузионным резервом в ВББ и 4 (4,1%) – в каротидном бассейне, р < 0,01. Достоверно значимых различий в снижении перфузионных резервов в каротидном бассейне (35 (38,9%) наблюдений и в ВББ – 42 (47,7%)) у больных группы сравнения не обнаружено.
Для подтверждения обнаруженных различий в группах сравнения был проведен субанализ по принципу case – control 260 пациентам из общего числа изучаемых больных с ишемией головного мозга. В исследование были включены 42 пациента (28 мужчин и 14 женщин) в возрасте от 43 до 81 года (средний возраст 59,7 лет) с ишемическим инсультом с развитием эпилептических припадков и 42 пациента (26 мужчин и 16 женщин) в возрасте от 38 до 78 лет (средний возраст 59,1 лет) с ишемическом инсультом без эпилептических приступов, а также 88 пациентов (39 мужчин и 49 женщин) в возрасте от 44 до 82 лет (средний возраст 62,9 лет) с хронической ИГМ без острых сосудистых событий с развитием эпилептических припадков и 88 пациентов (34 мужчин и 54 женщин) в возрасте от 39 до 82 лет (средний возраст 62,3 года) группы сравнения с хронической ИГМ без развития приступов (табл. 3).
Таблица 3. Характеристика обследованных пациентов с ишемическим инсультом и хронической ишемией головного мозга
Пациенты с острым периодом инсульта | Основная группа | Группа сравнения |
11 наблюдений | 11 наблюдений | |
Возраст (годы) | 60,5 | 54,1 |
NIHSS (среднее значение) | 3,5 | 3,3 |
Патогенетический подтип инсульта (TOAST) | ||
Атеротромботический | 7 (63,6%) | 8 (72,7%) |
Кардиоэмболический | 1 (9,1%) | 1 (9,1%) |
Лакунарный | 3 (27,3%) | 2 (18,2%) |
Инсульт неуточненной этиологии | 0 | 0 |
Пациенты с восстановительным периодом инсульта | 31 наблюдение | 31 наблюдение |
Возраст (годы) | 59,5 | 60,9 |
NIHSS (среднее значение) | 3 | 3 |
Патогенетический подтип инсульта (TOAST) | ||
Атеротромботический | 17 (54,8%) | 16 (41%) |
Кардиоэмболический | 9 (29%) | 9 (29%) |
Лакунарный | 3 (9,7%) | 4 (10,3%) |
Инсульт неуточненной этиологии | 2 (6,5%) | 2 (6,5%) |
Пациенты с хронической ишемией головного мозга | 88 наблюдений | 88 наблюдений |
Возраст (годы) | 62,9 | 62,3 |
Хроническая ишемия головного мозга | ||
I стадия | 10 наблюдений | 10 наблюдений |
II стадия | 78 наблюдений | 78 наблюдений |
Среди пациентов основной группы с ишемическим инсультом у 11 (26,2%) развивались острые симптоматические приступы (в первые 7 дней инсульта), эти пациенты обследовались в остром периоде инсульта, из них у 5 (45,5%) пациентов впоследствии развились поздние приступы. 31 (73,8%) пациент имел восстановительный период инсульта, у этих больных развивались поздние приступы, и обследование им было проведено в период от 3 нед. до 9 мес. после инсульта.
Пациенты основных групп и групп сравнения были сопоставимы по полу, возрасту, пациенты с инсультом – по представленности патогенетических подтипов инсульта, пораженному сосудистому бассейну, срокам развития инсульта, тяжести неврологического дефицита по шкале NIHSS (среднее значение по шкале NIHSS у пациентов с ишемическим инсультом с развитием эпилептических припадков составило 3 балла, у пациентов группы сравнения – 3,1 балла). Пациенты с хронической ИГМ без манифестации инсульта были сопоставимы по стадии дисциркуляторной энцефалопатии (по 10 пациентов из каждой группы имели I стадию дисциркуляторной энцефалопатии и по 78 пациентов из каждой группы страдали дисциркуляторной энцефалопатией II стадии).
21 (50%) пациент основной группы и 20 (47,6%) пациентов группы сравнения имели левополушарный инсульт, 16 (38,1%) пациентов основной и 17 (40,5%) пациентов группы сравнения имели правополушарный инсульт, 5 (11,9%) пациентов основной и 5 (11,9%) пациентов группы сравнения имели инсульт в ВББ.
Согласно классификации патогенетических подтипов инсульта TOAST, преобладали пациенты с атеротромботическим (57,1% в основной и 57,1% в группе сравнения) и кардиоэмболическим (23,8% в основной и 23,8% в группе сравнения) инсультом. Реже наблюдались больные с лакунарным инсультом (14,3 и 14,3% в основной группе и группе сравнения соответственно) и у небольшого числа пациентов генез инсульта был не уточнен (4,8% в основной группе и 4,8% в группе сравнения).
Во всех группах обследованных пациентов отмечались нормальные или сниженные показатели ЦВР (< 25%). У пациентов с ишемическим инсультом с развитием эпилептических припадков выявлено значительно более частое снижение сосудистой реактивности в ВББ: 39 (92,9%) больных по сравнению с группой сравнения – 26 (61,9%) пациентов (р < 0,01), в то время как достоверно значимых различий в изменении ЦВР в каротидной системе между основной группой – 29 (72,5%) больных и группой сравнения – 25 (60,9%) пациентов с инсультом не обнаружено (рис. 3, 4).
Кроме того, больные со значительным снижением реактивности в ВББ (< 10%) превалируют среди пациентов с инсультом, страдающих эпилептическими припадками – 22 (52,4%) наблюдения, р < 0,001, чем среди пациентов группы сравнения – 3 (7,1%). Обращает внимание и факт преобладания нарушения перфузионного резерва в ВББ: 39 (92,9%) наблюдений, р < 0,05, по сравнению с каротидным бассейном – 29 (72,5%) у пациентов с ишемическим инсультом с развитием приступов. В группе сравнения подобной разницы страдания ЦВР в разных сосудистых бассейнах не выявлено.
Рисунок 3. Состояние цереброваскулярной реактивности в каротидных бассейнах у пациентов с острой и хронической ишемией головного мозга
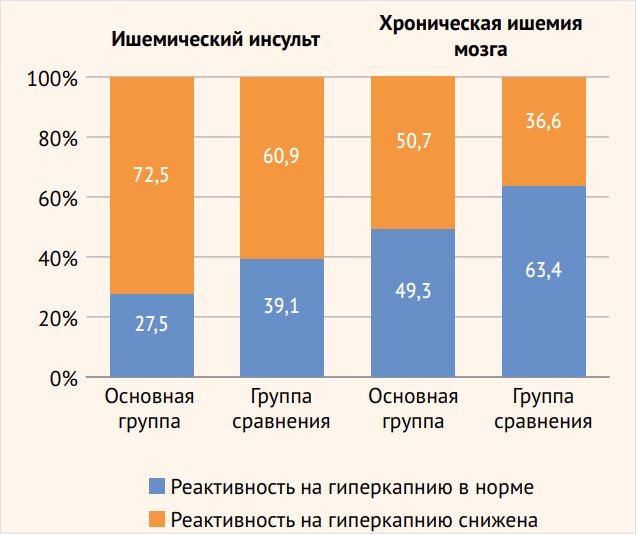
Рисунок 4. Состояние цереброваскулярной реактивности в вертебробазилярном бассейне у пациентов с острой и хронической ишемией головного мозга
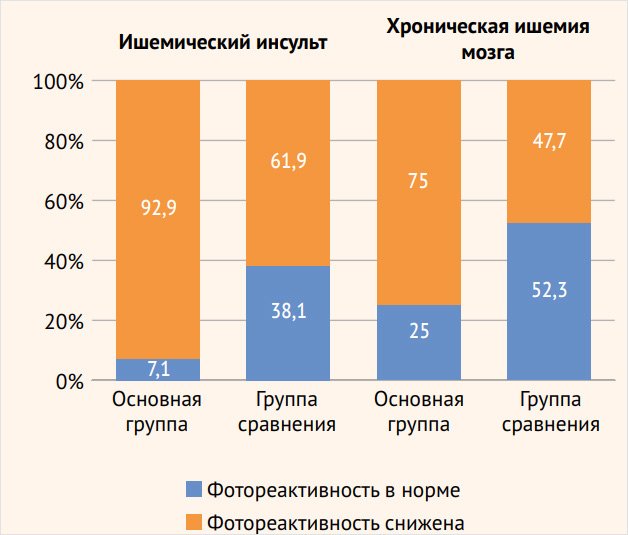
Схожие результаты получены и при анализе ЦВР у пациентов с хронической ИГМ без острых сосудистых событий. Недостаточность перфузионного резерва в ВББ превалировала у больных основной группы: 66 (75%) наблюдений, р < 0,001, по сравнению с группой сравнения – 42 (47,7%). При этом пациенты с выраженным снижением ЦВР (более 10%) чаще встречались в группе больных с эпилептическими припадками – 17 (19,3%) пациентов, р < 0,01, по сравнению с группой сравнения – 4 (4,5%) больных. В каротидных бассейнах достоверно значимых различий в снижении ЦВР в основной группе наблюдений – 38 (50,7%) и в группе сравнения – 30 (36,6%) наблюдений не зафиксировано. Как и у пациентов с ишемическим инсультом, у больных хронической ИГМ наблюдается превалирование более частого нарушения регуляторных механизмов мозгового кровообращения в системе задней циркуляции – 66 (75%) пациентов, р < 0,01, по сравнению с каротидной системой – 38 (50,7%) больных. В группе сравнения пациентов достоверно значимой разницы изменения ЦВР в каротидной системе и в ВББ не отмечено: 30 (36,6%) и 42 (47,7%) обследованных соответственно.
Обсуждение
В нашем исследовании как у пациентов с ишемическим инсультом (92,5%), так и у больных с хронической ИГМ (88,5%) преобладали фокальные приступы. Вероятно, в действительности процент фокальных приступов может быть больше, поскольку у части больных с клинической феноменологией генерализованных приступов фокальное начало может быть незамеченным, а инструментальные методы также позволяют верифицировать фокальный компонент не в 100% наблюдений.
Всем обследованным пациентам была проведена нейровизуализация. У пациентов с ишемическим инсультом с развитием острых симптоматических приступов в результате оценки измеряемого коэффициента диффузии зарегистрированы менее грубые повреждения вещества мозга в очаге ишемии по сравнению с пациентами группы сравнения без развития приступов. Можно предположить, что для появления эпилептических припадков необходима достаточная степень жизнеспособности поврежденных клеток мозга в зоне острой ишемии.
Обнаруженная в нашем исследовании у пациентов с развитием эпилептических приступов тенденция к формированию очагов острой ишемии в каудальном направлении, возможно, связана с ослаблением коллатерального кровотока в системе задней циркуляции, что стало одной из причин интереса к оценке перфузионных резервов в церебральных сосудистых бассейнах.
Как у больных с ишемическим инсультом с развитием эпилептических припадков, так и у пациентов с наличием эпилептических припадков на фоне хронической ИГМ без острых сосудистых событий выявлено превалирование корковой локализации очагов ишемии. Связь между корковой локализацией очага инфаркта с развитием эпилептических приступов показана во многих исследованиях [7, 9–16].
Выявлено преобладание стенозов разной степени выраженности у пациентов с острыми и хроническими нарушениями мозгового кровообращения с развитием эпилептических припадков (82,3 и 69,5% соответственно) по сравнению с пациентами с инсультом и хронической ИГМ без приступов (74,4 и 56,9% соответственно).
Роль стенозирующего процесса в генезе сосудистой эпилепсии обсуждается многими авторами [17–20]. А.Б. Гехт и др. (2003) установили атеросклеротическое поражение магистральных артерий у 66,7% пациентов с постинсультной эпилепсией, что несколько ниже полученных нами значений [17]. В работе В.О. Генералова (2010) при проведении ультразвукового дуплексного сканирования признаки атеросклеротического поражения сосудов головного мозга различной степени выраженности были выявлены у 81,4%, этот результат схож с нашими данными. В то же время результаты проведенного исследования пациентов с постинсультной эпилепсией пожилых позволили О.Н. Кирилловских и др. (2011) сделать вывод, что наличие выраженных нарушений церебрального кровотока на макроциркуляторном уровне с образованием гемодинамически значимых стенозов не оказывает непосредственного влияния на клинические варианты и частоту эпилептических припадков [21]. Однако исследование проводилось у небольшого числа пациентов (29 чел.).
В нашем исследовании при сопоставлении основной группы и группы сравнения по частоте встречаемости стенозирующего процесса магистральных артерий мозга разной степени выраженности достоверной разницы получено не было. Однако имеется тенденция к более частому выявлению у пациентов основной группы стенозов выше 50%, что соответствует мнению, что окклюзирующие поражения магистральных сосудов являются одной из основных причин ишемической болезни головного мозга и ведущим патогенетическим фактором развития эпилептических припадков [22–24].
В нашей работе обнаружено преобладание стенозов магистральных артерий головного мозга более 70% у пациентов с предшествовавшими инсульту эпилептическими припадками (33,5%) по сравнению с пациентами с инсультом без припадков-предшественников, у которых стенозы более 70% были обнаружены лишь у 11,5%. Это может служить подтверждением существующей теории, что припадки-предвестники развиваются на фоне длительной сосудистой недостаточности вследствие стенозирующего поражения магистральных сосудов головного мозга [13, 20, 25]. По мнению некоторых исследователей [14, 17], припадки-предвестники чаще всего фокальные и могут указать на локализацию ишемического очага. В обследованной нами группе среди больных с припадками-предвестниками 88,6% пациентов имели фокальные приступы.
Обнаружена склонность к генерализации эпилептических приступов при страдании левого каротидного бассейна, что является еще одним аргументом в пользу большей эпилептогенности левого полушария мозга.
Нами сделано предположение, что в реализации эпилепсии у больных с ишемическим поражением головного мозга имеет значение гемодинамический фактор, а именно состояние перфузионного резерва. Это определило интерес к оценке цереброваскулярной реактивности в разных сосудистых бассейнах для изучения перфузионных характеристик.
В доступных публикациях, как отечественных, так и зарубежных, можно встретить очень мало работ, посвященных исследованию церебральной гемодинамики у больных с эпилептическими припадками. В одном из таких сообщений, как и в нашем исследовании, А.Е. Дубенко и др. (2007) свидетельствуют о регистрации сниженной ЦВР на гиперкапнию у взрослых больных с эпилепсией, но более молодого (по сравнению с обследованными нами пациентами) возраста [15]. Есть мнение, что истощение цереброваскулярных резервов увеличивает чувствительность головного мозга к ишемии [16]. При этом описания исследований, подобных нашему, в доступных научных публикациях не обнаружено.
Заключение
Выявленные нарушения регуляторных механизмов мозгового кровообращения преимущественно в ВББ позволяют высказать предположение о возможной роли в реализации эпилептических приступов недостаточности антиэпилептической системы, значимая часть которой локализуется в ВББ. Таким образом, снижение ЦВР в ВББ можно считать одним из факторов риска развития эпилепсии в условиях ишемической болезни головного мозга.
Список литературы / References
- Гехт А.Б., Тлапшкова Л.Б., Лебедева А.В. Постинсультная эпилепсия. Журнал неврологии и психиатрии им. С.С. Корсакова. 2000;100(9):67-70. Режим доступа: http://nature.web.ru/db/msg.html?mid=1181543&uri=index.html.
- Epsztein J., Ben-Ari Y., Represa A., Crépel V. Late-onset epileptogenesis and seizure genesis: lessons from models of cerebral ischemia. Neuroscientist. 2008;14(1):78-90. https://doi.org/10.1177/1073858407301681.
- Guekht A., Hauser W.A., Milchakova L., Churillin Y., Shpak A., Gusev E. The epidemiology of epilepsy in the Russian Federation. Epilepsy Res. 2010;92(2-3):209-218. https://doi.org/10.1016/j.eplepsyres.2010.09.011.
- Hassani M., Cooray G., Sveinsson O., Cooray C. Post-stroke epilepsy in an ischemic stroke cohort-Incidence and diagnosis. Acta Neurol Scand. 2020;141(2):141-147. https://doi.org/10.1111/ane.13174.
- Menon B., Shorvon S.D. Ischaemic stroke in adults and epilepsy. Epilepsy Res. 2009;87(1):1-11. https://doi.org/10.1016/j.eplepsyres.2009.08.007.
- Wall J., Knight J., Emsley H.C.A. Late-onset epilepsy predicts stroke: Systematic review and meta-analysis. Epilepsy Behav. 2021;115:107634. https://doi.org/10.1016/j.yebeh.2020.107634.
- Zelano J., Holtkamp M., Agarwal N., Lattanzi S., Trinka E., Brigo F. How to diagnose and treat post-stroke seizures and epilepsy. Epileptic Disord. 2020;22(3):252-263. https://doi.org/10.1684/epd.2020.1159.
- Гайдар Б.В., Парфенов В.Е., Свистов Д.В. Оценка реактивности мозгового кровотока с применением ультразвуковых методов диагностики. В: Никитин Ю.М., Труханов А.И. (ред.). Ультразвуковая допплеровская диагностика сосудистых заболеваний. М.: Видар; 1998. С. 241-248.
- Janský P., Růžičková T., Olšerová A., Reichl J., Vosko M.S., Šťovíčková L. et al. Occurrence and risk factors of unprovoked seizures in ischaemic stroke patients. Cesk Slov Neurol N. 2020;83/116(3):278-284. https://doi.org/10.14735/amcsnn2020278.
- Galovic M., Ferreira-Atuesta C., Abraira L., Döhler N., Sinka L., Brigo F. et al. Seizures and Epilepsy After Stroke: Epidemiology, Biomarkers and Management. Drugs Aging. 2021;38(4):285-299. https://doi.org/10.1007/s40266-021-00837-7.
- Feyissa A.M., Hasan T.F., Meschia J.F. Stroke-related epilepsy. Eur J Neurol. 2019;26(1):18-e3. https://doi.org/10.1111/ene.13813.
- Liang M., Zhang L., Geng Z. Advances in the Development of Biomarkers for Poststroke Epilepsy. Biomed Res Int. 2021;2021:5567046. https://doi.org/10.1155/2021/5567046.
- Сорокина Н.Д., Селицкий Г.В., Косицын Н.С., Свинов М.М. Нейробиологические аспекты ишемии мозга и постинсультной эпилепсии. Журнал высшей нервной деятельности им. И.П. Павлова. 2002;52(6):656-664. Режим доступа: https://www.elibrary.ru/item.asp?id=14961985.
- Бурд Г.С., Гехт А.Б., Лебедева А.В., Бурд С.Г. Эпилепсия у больных ишемической болезнью головного мозга. Журнал неврологии и психиатрии им. С.С. Корсакова. 1998;98(2):4-8.
- Дубенко А.Е., Калашников В.И., Череватенко Г.Ф., Петухова И.С. Состояние цереброваскулярной реактивности и вегетативного обеспечения у больных эпилепсией. Международный неврологический журнал. 2007;(3):17-19. Режим доступа: http://www.mif-ua.com/archive/article/140.
- Grinberg L.T., Thal D.R. Vascular pathology in the aged human brain. Acta Neuropathol. 2010;119(3):277-290. https://doi.org/10.1007/s00401-010-0652-7.
- Гехт А.Б., Кураш О.Я., Беликова А.П., Лебедева А.В., Кабанов А.А. Фейгина А.А. Особенности церебральной гемодинамики у больных с эпилептическими припадками после ишемического инсульта. Журнал неврологии и психиатрии им. С.С. Корсакова. 2003;103(9):28-32. Режим доступа: http://elib.fesmu.ru/elib/Article.aspx?id=97603.
- Гехт А.Б., Мильчакова Л.Е., Чурилин Ю.Ю. Эпидемиология эпилепсии в России. Журнал неврологии и психиатрии им. С.С. Корсакова. 2006;106(1):3-7.
- Котов А.С., Руденко А.М. Криптогенные и симптоматические височные эпилепсии у взрослых. Анналы клинической и экспериментальной неврологии. 2009;3(2):9-13. Режим доступа: https://annaly-nevrologii.com/journal/pathID/article/view/378.
- Giroud M., Gras P., Fayolle H., André N., Soichot P., Dumas R. Early seizures after acute stroke: a study of 1,640 cases. Epilepsia. 1994;35(5):959-964. https://doi.org/10.1111/j.1528-1157.1994.tb02540.x.
- Кирилловских О.Н., Мякотных В.С., Сорокова Е.В. Нейрофизиологические особенности течения эпилепсии у пациентов пожилого и старческого возраста. Функциональная диагностика. 2011;(2):46-53. Режим доступа: https://elibrary.ru/item.asp?id=17019145.
- Визило Т.Л., Михайлов В.П., Власова И.В., Орлова И.Ф., Кравченко А.И., Кузьмичев А.А. Клиническое значение оценки церебрального кровотока при дисциркуляторной атеросклеротической энцефалопатии. Бюллетень физиологии и патологии дыхания. 2002;(11):16-20. Режим доступа: https://www.elibrary.ru/item.asp?id=9125749.
- Гусев Е.И., Скворцова В.И. Ишемия головного мозга. М.: Медицина; 2001. 328 с.
- Lo Y.K., Yiu C.H., Hu H.H., Su M.S., Laeuchli S.C. Frequency and characteristics of early seizures in Chinese acute stroke. Acta Neurol Scand. 1994;90(2):83-85. https://doi.org/10.1111/j.1600-0404.1994.tb02684.x.
- Добрынина Л.А., Калашникова Л.А., Кадыров А.С., Шведков В.В. Поздняя постинсультная эпилепсия вследствие ишемических инфарктов мозга. В: Материалы VIII Всероссийского съезда неврологов. Казань; 2001. С. 386. Режим доступа: https://elibrary.ru/item.asp?id=23789139.




 1
1 2
2 3
3 4
4


Комментарии (0)