
Журнал "Медицинский совет" №3/2024
DOI: 10.21518/ms2024-044
Ю.В. Житкова1,2, А.А. Гаспарян1,
А.Ф. Сарварова2, Д.А. Коробова2,
Ф.И. Галявова2, А.И. Байназарова3,
А.М. Хамидуллина3, Е.В. Доманская4
1 Межрегиональный клинико-диагностический центр; 420101, Россия, Республика Татарстан, Казань, ул. Карбышева, д. 12а
2 Казанский государственный медицинский университет; 420012, Россия, Республика Татарстан, Казань, ул. Бутлерова, д. 49
3 Благотворительный фонд «Благие дела»; 420049, Россия, Республика Татарстан, Казань, ул. Нурсултана Назарбаева, д. 8а
4 Центр социальной заботы «Зилант»; 420141, Россия, Республика Татарстан, Казань, ул. Юлиуса Фучика, д. 82
Введение. Метод когнитивной стимулирующей терапии (КСТ) применяется в мире для лечения когнитивных нарушений и в последние годы вызывает интерес в России. Однако существует потребность в адаптации КСТ для русскоговорящих пациентов с деменцией.
Цель. Оценить эффективность и безопасность русскоязычной версии КСТ у русскоговорящих пациентов с болезнью Альцгеймера на стадии умеренной деменции.
Материалы и методы. В исследование включены 8 пациентов с установленным диагнозом деменции при болезни Альцгеймера, проживающих в центре социальной заботы «Зилант». Средний возраст участников 76 ± 10,8 года. Значение по шкале MMSE на скрининге составило 17 ± 5,0 балла. Проведен основной курс КСТ по методике, разработанной Э. Спектор и соавт., переведенной и культурно адаптированной нами на русский язык. Динамически оценивалось состояние когнитивных функций, когнитивное функционирование, психическая симптоматика, а также удовольствие и вовлеченность пациентов в процесс занятий. Исследование завершили 7 пациентов: один был исключен по причине неусидчивости и беспокойства.
Результаты. К концу лечения установлено улучшение когнитивных функций (р = 0,002 по шкале ADAS-Cog по сравнению с исходным уровнем). По шкале NPI установлена редукция симптомов бреда и апатии с соответствующим снижением дистресса ухаживающих, что способствовало уменьшению дозировок антипсихотиков. По шкалам Lowton & Brody и ADCS-ADL установлено улучшение когнитивного функционирования. Наиболее ярким показателем эффективности КСТ явилось повышение настроения и удовлетворенности пациентов, что более значимо в повседневной жизни и может считаться показателем безопасности КСТ.
Выводы. Русскоязычная версия КСТ была эффективна и безопасна у пациентов с болезнью Альцгеймера на стадии умеренной деменции и может быть рекомендована для внедрения в клиническую практику. Это открывает перспективы для изучения КСТ в комплексном лечении деменций различного генеза.
Для цитирования: Житкова ЮВ, Гаспарян АА, Сарварова АФ, Коробова ДА, Галявова ФИ, Байназарова АИ, Хамидуллина АМ, Доманская ЕВ. Результаты открытого одноцентрового клинического исследования по оценке эффективности и безопасности групповой когнитивной стимулирующей терапии у русскоговорящих пациентов с болезнью Альцгеймера на стадии умеренной деменции. Медицинский совет. 2024;18(3):43–50. https://doi.org/10.21518/ms2024-044.
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Results from the open-label, single-center, clinical study assessing the efficacy and safety of a group cognitive stimulation therapy in Russian-speaking patients with the moderate dementia stage of Alzheimer's disease
Yulia V. Zhitkova1,2, Armine А. Gasparian1,
Adelya F. Sarvarova2, Daria А. Korobova2,
Firyuza I. Galyavova2, Aliya I. Baynazarova3,
Aliya М. Khamidullina3, Elena V. Domanskaya4
1 Interregional Clinical and Diagnostic Center; 12а, Karbishev St., Kazan, Republic of Tatarstan, 420101, Russia
2 Kazan State Medical University; 49, Butlerov St., Kazan, Republic of Tatarstan, 420012, Russia
3 Charitable Foundation “Good Deeds”; 8а, Nursultan Nazarbayev St., Kazan, Republic of Tatarstan, 420049, Russia
4 Zilant Social Care Center; 82, Julius Fuchik St., Kazan, Republic of Tatarstan, 420141, Russia
Introduction. Cognitive stimulation therapy (CST) used worldwide to treat cognitive impairment has recently attracted interest of Russian medical and scientific minds. However, when applied to Russian-speaking patients with dementia, CST requires adaptation.
Aim. To evaluate the effectiveness and safety of the Russian-language version of CST for Russian-speaking patients with Alzheimer’s disease at the stage of moderate dementia.
Materials and мethods. 8 participants involved into the trial were residents of social care center ZILANT diagnosed as dementia patients with Alzheimer’s, aged 76 ± 10.8 years, with the median MMSE score identified 17 ± 5.0. Before implementing the main course of CST developed by E. Spector et al we translated and localized it for Russian patients. The patients undergoing CST were assessed for the state of cognitive functions, everyday activity, mental symptoms, as well as enjoyment and involvement. One of the recruited patients was excluded due to restlessness and anxiety.
Results. Seven patients had significantly improved on ADAS-Cog scale (p = 0.002), Lowton&Brody and ADCS-ADL. The NPI scale indicated a reduction in symptoms of delirium and apathy which contributed to a reduction in antipsychotic dosages and a corresponding decrease in caregiver’s distress. The most striking indicator of CST effectiveness was improvements in the patient’s mood and satisfaction, which we view significant in everyday life and as an indicator of CST safety.
Conclusion. The Russian-language version of CST proved effective and safe for moderate dementia patients with Alzheimer’s and can be recommended for implementing in clinical practice. This opens up prospects for studying CST as part of various drug strategies in treatment of dementia of various origins.
For citation: Zhitkova YuV, Gasparian АА, Sarvarova AF, Korobova DA, Galyavova FI, Baynazarova AI, Khamidullina АМ, Domanskaya EV. Results from the open-label, single-center, clinical study assessing the efficacy and safety of a group cognitive stimulation therapy in Russian-speaking patients with the moderate dementia stage of Alzheimer's disease. Meditsinskiy Sovet. 2024;18(3):43–50. (In Russ.) https://doi.org/10.21518/ms2024-044.
Conflict of interest: the authors declare no conflict of interest.
Введение
Когнитивные нарушения и деменция являются одной из наиболее актуальных проблем современной медицины. В 60–80% случаев причиной деменции – когнитивных нарушений тяжелой степени становится болезнь Альцгеймера1,2 [1–5], которая на сегодняшний день неизлечима и неизбежно приводит к инвалидизации и повышению смертности пациентов [6–11]. В отсутствие радикального лечения большинства деменций ключевой задачей терапии является смягчение клинических симптомов и отдаление периода полной инвалидизации пациента. Для достижения этих целей традиционно используют два подхода – лекарственный и нелекарственный, каждый из которых по-своему стимулирует процессы пластичности мозга. Феномен пластичности составляет основу функциональности мозга и представляет собой способность мозга изменяться, формировать новые связи, адаптироваться и перестраиваться в условиях повреждения, что позволяет сохранить или восстановить утраченную функцию за счет реорганизации работы головного мозга в целом. Лекарственный метод поддерживает важнейшие нейробиологические процессы: рост и созревание новых нейронов, формирование контактов между нейронами, синтез и обмен биологически важных веществ и т. д. Целью нелекарственного метода является ослабление влияния поражения головного мозга на повседневную активность, адаптация пациента, поддержание способности к выполнению повседневных действий и самообслуживанию и в конечном счете повышение качества жизни пациента. Оптимальным является мультимодальный подход, сочетающий в себе лекарственный и нелекарственный методы терапии [12].
Среди нелекарственных методов лечения наибольшее признание получил метод когнитивной стимулирующей терапии (КСТ), основанный на персонализированном подходе, учитывающем личностные особенности, уровень образования, предпочтения, интересы, семейную ситуацию, что значительно повышает вовлеченность пациентов и результат [13–29]. Методика проведения КСТ разработана под руководством профессора Э. Спектор в Университетском колледже Лондона, она вошла в рекомендации Национального института здравоохранения и качества ухода (NICE) Великобритании для людей с деменцией легкой и умеренной тяжести [30] и применяется в повседневной клинической практике в 38 странах мира. Эффективность метода доказана в рандомизированных клинических исследованиях (РКИ), сопоставима с эффектами известной на сегодняшний день лекарственной терапии, экономически выгоднее и рентабельнее, чем обычное лечение, с учетом приносимой пользы, достоверно улучшает память, ориентировку, речь (подбор слов и понимание), зрительно-пространственные функции, улучшает повседневное функционирование и качество жизни (по данным РКИ, мнению пациентов, ухаживающих лиц и медперсонала) [13–29]. В России в последние годы растет интерес к методу КСТ. В 2014 г. в рамках научного исследования мы изучили применение КСТ в качестве монотерапии в составе различных лекарственных стратегий лечения пациентов с постинсультной деменцией [12]. В 2020– 2021 гг. на базе клиник памяти программа КСТ успешно применялась на пожилых людях с возрастным когнитивным снижением и людях с додементными когнитивными нарушениями [31]. Однако лечение людей с деменцией при болезни Альцгеймера имеет свои особенности и требует доказательств эффективности и безопасности КСТ на российской популяции пациентов.
Цель настоящего исследования – оценка эффективности и безопасности применения русскоязычной версии групповой КСТ у русскоговорящих пациентов с болезнью Альцгеймера на стадии умеренной деменции для последующего внедрения в повседневную клиническую практику на территории Российской Федерации.
Материалы и методы
Мы использовали собственную русскоязычную версию и культурную адаптацию метода КСТ, разработанного Э. Спектор и соавт. [30]. Исследование проведено в соответствии с дизайном открытого одноцентрового клинического исследования. Протокол исследования и форма информированного согласия пациента одобрены локальным этическим комитетом при Межрегиональном клинико-диагностическом центре г. Казани. Все пациенты-участники проживали на территории центра социальной заботы «Зилант» в г. Казани. Согласно рекомендациям авторов метода, количество участников в группе не должно превышать 10 человек. Первоначально было отобрано 8 участников, соответствующих критериям отбора. Для включения в исследование применялись следующие критерии: пациенты с установленным диагнозом болезни Альцгеймера, имеющие оценку по шкале MMSE 12–22 балла; наличие информированного согласия, подписанного пациентом или его законным представителем; пациенты, находящиеся на стабильной терапии основного и сопутствующих заболеваний не менее 3 мес. Критериями невключения в исследование явились: наличие сопутствующего хронического цереброваскулярного заболевания, подтвержденного данными нейровизуализации (2 и более баллов по шкале Fazekas на sМРТ), неврологического осмотра и нейропсихологического обследования; инсульт в анамнезе; черепно-мозговая травма в анамнезе; наличие других заболеваний и состояний, способных вызвать когнитивную дисфункцию; выраженные речевые, зрительные, слуховые и двигательные нарушения, уровень образования, культурные или религиозные особенности, мешающие коммуникации в группе и выполнению заданий; наличие депрессии, определяемой по Корнелльской шкале (оценка 10 и более баллов); наличие тяжелых соматических или обострение хронических заболеваний. Средний возраст участников составил 76 ± 10,8 года, все пациенты – женщины. В течение всего исследования пациенты находились на стабильной терапии мемантином, ингибиторами ацетидхолинэстеразы, четверо принимали атипичные нейролептики, один пациент – антидепрессант группы СИОЗС. Терапия сопутствующих заболеваний у 7 пациентов (гипертоническая болезнь, ишемическая болезнь сердца) также оставалась стабильной на протяжении исследования. Было проведено 14 занятий по 45 мин дважды в неделю, продолжительность 7 нед. Занятия проводили психологи и волонтеры в количестве 2–3 на группу. Оценка когнитивных функций, аффективных и поведенческих нарушений проводилась врачами-неврологами Республиканского центра когнитивных расстройств г. Казани по стандартным психометрическим шкалам: MMSE, ADAS-Cog, CSDD (Cornell Scale for Depressionin Dementia), NPI (Neuropsychiatric Inventory). Когнитивное функционирование (способность к выполнению повседневных действий) оценивалось по шкалам Lowton & Brody и ADCS-ADL (The Alzheimer’s Disease Cooperative Study – Activities of Daily Living) на основе информации, полученной от персонала центра пребывания пациентов. Психометрическое обследование проводилось до и после курса КСТ. На каждом занятии по шкале Ликерта оценивалась вовлеченность участников в процесс. Оценка проводилась по следующим параметрам: интерес, коммуникация, удовольствие, настроение. Использован рейтинговый вариант шкалы Ликерта с 5-балльной оценкой для каждого из пунктов, где значение 3 являлось нейтральным, а значения 1 и 5 – противоположными критическими значениями. Исследование полностью завершили 7 пациентов. Один пациент был исключен из исследования после 3-го занятия по причине избыточного беспокойства, мешающего коммуникации с другими участниками и исследователями.
Для повышения контроля качества на каждом занятии проводилась видеофиксация. Полученные данные подверглись статистической обработке с использованием критериев Манна – Уитни для малых выборок. Значения р < 0,05 расценивались как достоверные.
Результаты
Оценка когнитивных функций в исследуемой группе по шкале MMSE до и после окончания терапии динамики не выявила: медианное значение при исходной и конечной оценке составило 17 ± 5,0 балла и 17 ± 4,8 балла соответственно (p = 0,06). Для более тонкой оценки состояния когнитивных функций были проанализированы данные шкалы ADAS-Cog, в т. ч. отдельные субтесты. По результатам анализа получено статистически значимое улучшение когнитивных функций в целом, а также по большинству субтестов данной шкалы (табл. 1). Так, достоверное улучшение было отмечено в процессах ориентировки, повторении и узнавании слов, нахождении цифр, запоминании и выполнении инструкций, идеаторного праксиса. При оценке речевых функций (понимание обращенной речи, подбор слов в спонтанной речи), а также конструктивного праксиса и способности к концентрации динамики не выявлено.
Таблица 1. Динамика значений по субтестам шкалы ADAS-Cog (приведены только статистически значимые различия)
| Общий балл по шкале | 46,5 | 43,8 | 0,002 |
| Повторение слов | 7,2 | 6,3 | 0,01 |
| Выполнение инструкций | 2,2 | 1,8 | 0,03 |
| Идеаторный праксис | 3,1 | 2,5 | 0,02 |
| Ориентировка | 5,3 | 4,5 | 0,03 |
| Узнавание слов | 9,4 | 7,8 | 0,003 |
| Запоминание инструкций задания | 2,2 | 1,4 | 0,04 |
| Зачеркивание цифр | 2,2 | 1,3 | 0,04 |
р – уровень значимости различий с исходными показателями
Наличие симптомов депрессии, определяемой по Корнелльской шкале, явилось критерием невключения в исследование. Контрольная оценка по шкале Корнелла после окончания курса терапии симптомов депрессии также не выявила. При дополнительной оценке по шкале NPI на этапе отбора в группе не было зарегистрировано выраженных психических симптомов (медианное значение по всем доменам шкалы NPI составило 28,5 (при максимальном общем балле по шкале 144)). Тем не менее к концу терапии мы наблюдали достоверное уменьшение выраженности бредовой симптоматики у троих пациентов с соответствующим уменьшением дистресса у лиц, предоставляющих уход. Также к концу курса терапии установлено снижение симптомов апатии (табл. 2). После проведения контрольной психометрической оценки двоим пациентам была снижена доза применяемых антипсихотических препаратов. В целом к концу лечения зарегистрировано уменьшение выраженности психиатрической симптоматики (медианное значение по шкале NPI – 24,2, р = 0,001 по сравнению с исходным уровнем).
Таблица 2. Динамика психической симптоматики по шкале NPI
| Бредовые идеи | 5,2 | 3,1 | 0,001 |
| Галлюцинации | 2,0 | 2,0 | 0,05 |
| Возбуждение / агрессия | 2,2 | 2,0 | 0,05 |
| Депрессия | 0 | 0 | |
| Тревога | 2,0 | 2,0 | 0,05 |
| Гипертимия | 0 | 0 | |
| Апатия | 6,8 | 4,6 | 0,001 |
| Расторможенность | 2,3 | 2,2 | 0,05 |
| Аномальная двигательная активность | 2,4 | 3,2 | 0,05 |
| Сон и нарушение поведения в ночное время | 2,3 | 2,0 | 0,05 |
| Нарушение аппетита и пищевого поведения | 3,3 | 3,1 | 0,05 |
| Общий балл по шкале | 28,5 | 24,2 | 0,001 |
р – уровень значимости различий с исходными показателями
Наибольшая положительная динамика установлена при анализе шкал Lowton & Brody и ADCS-ADL, оценивающих когнитивное функционирование (табл. 3). Выявлено достоверное улучшение инструментальной и базисной повседневной активности за счет улучшения способностей по уходу за собой (меньше постороннего участия требовалось при совершении гигиенических мероприятий, одевании), пользованию мобильным телефоном (активное совершение звонков с использованием записной книжки), появился интерес к чтению и просмотру телепередач с последующим обсуждением сюжета или прочитанного.
Таблица 3. Динамика повседневной активности по шкалам Lowton&Brody и ADCS-ADL (приведены только статистически значимые различия)
| Инструментальная активность | 18,7 | 19,9 | 0,001 |
| Базисная активность | 20,2 | 22,0 | 0,001 |
| ADCS-ADL | |||
| Пользование мобильным телефоном | 3,2 | 4,7 | 0,001 |
| Купание | 2,0 | 2,8 | 0,001 |
| Уход за собой | 1,9 | 2,7 | 0,001 |
| Одевание | 2,9 | 3,7 | 0,001 |
| Запоминание запланированных мероприятий | 1,3 | 2,0 | 0,001 |
| Чтение | 1,2 | 1,7 | 0,001 |
| Разговор о прошедших / увиденных событиях или прочитанном | 1,5 | 2,2 | 0,001 |
| Общий балл по ADCS-ADL | 34 | 29 | 0,001 |
р – уровень значимости различий с исходными показателями
Для выявления динамики вовлеченности пациентов в процесс КСТ мы сравнили значения каждого из анализируемых параметров за начальный период (с 1-го по 7-е занятие) и завершающий период (с 8-го по 14-е занятие). В результате установлено достоверное увеличение значений по всем пунктам: интерес, коммуникация, удовольствие, настроение (рис.). Участники стали интересоваться временем проведения следующего занятия, делали записи, чтобы его не пропустить, ожидали начала занятия, самостоятельно собираясь в комнате для проведения КСТ.
Рисунок 1. Динамика вовлеченности пациентов в когнитивную стимулирующую терапию
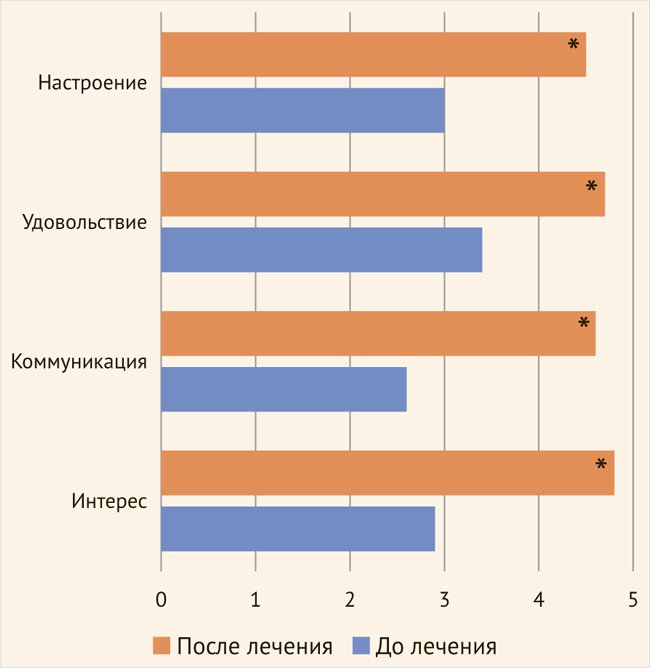
* р < 0,001 в сравнении с исходными показателями
Серьезных медицинских и немедицинских событий в процессе терапии не зарегистрировано.
Обсуждение
Одним их показателей эффективности КСТ является улучшение когнитивных функций, что было продемонстрировано в результате проведенного исследования. У обследованных нами пациентов мы наблюдали улучшение в тех же когнитивных доменах, что и авторы метода КСТ в оригинальных исследованиях [13–29]. Однако для выявления этих изменений требуется использование более тонких шкал, чем MMSE, например ADAS-Cog.
Другим не менее важным показателем эффективности КСТ является способность к совершению повседневных действий, самостоятельность пациентов. Постоянное пребывание в пансионате лишало участников нашего исследования необходимости самостоятельно готовить еду, совершать уборку, стирку и некоторые другие виды бытовой и инструментальной активности. Учитывая особенности среды проживания пациентов, при подведении итогов данные пункты оценочных шкал не учитывались. С одной стороны, этот фактор можно считать ограничением в оценке когнитивного функционирования, однако было установлено достоверное улучшение бытовой адаптации участников исследования. С другой стороны, проживание в пансионате имело и значительные плюсы, например исключало стресс, связанный с перемещением пациента, новой обстановкой. Все пациенты были знакомы и изначально расположены к общению друг с другом. Все это в значительной мере облегчало задачу по отбору участников на этапе скрининга.
Отдельного обсуждения заслуживает редукция психотической симптоматики, которая, как известно, трудно поддается фармакотерапии, особенно такие симптомы, как апатия и бред ущерба. Дополнение лекарственного лечения методом КСТ позволило не только уменьшить выраженность данных психических симптомов и дистресс ухаживающих лиц, но и снизить дозу антипсихотических препаратов, что представляется нам особенно ценным.
Для создания благоприятной атмосферы и настроения мы следовали инструкциям авторов методики, в частности предварительно изучали личную и семейную историю каждого из членов группы. Это позволило повысить интерес и удовольствие от занятий у участников (что косвенно говорит также о редукции апатии) и в то же время избежать психотравмирующих тем, таких как утрата близких людей и т. п. Улучшение коммуникативных качеств и настроения свидетельствует об удачном выборе тем для занятий и комфортной обстановке, которую нам удалось создать. Таким образом, можно заключить, что предложенная нами русскоязычная версия КСТ была эффективна. Что касается оценки безопасности КСТ, то это представляет некоторые трудности в связи с отсутствием консенсусных критериев оценки для нелекарственных методов лечения. В своем исследовании мы руководствовались подходом, который применяется в оценке безопасности психотерапии, а именно изменениями, которые произошли в клинической картине, в психическом и социальном статусе пациентов, а также собственной позитивной оценкой пациентами происходящих с ними изменений. На этом основании можно сделать вывод о безопасности проведенной нами КСТ.
Помимо оценки эффективности русскоязычной версии метода КСТ по перечисленным выше параметрам, мы ставили себе целью выявление ключевых моментов, препятствующих внедрению метода групповой КСТ в клиническую практику. Так, несмотря на исходную оценку уровня тревожности у будущих участников исследования, один пациент был исключен в процессе терапии по причине неусидчивости, повышенной отвлекаемости, которые, помимо тревоги, могут быть обусловлены особенностями личности и тоже должны быть учтены при отборе в исследование. Целесообразно было бы использование с этой целью соответствующих психометрических шкал. Очевидно, что применение метода групповой КСТ у пациентов, проживающих дома, будет иметь отличия, требующие изучения, что может служить перспективой для дальнейшего исследования.
По данным авторов метода и современных метаанализов, КСТ имеет долгосрочный положительный эффект [28, 29]. Для поддержания долговременного эффекта авторы рекомендуют после основного курса терапии проведение поддерживающих занятий с частотой 1 раз в неделю, с целью чего Э. Спектор и соавт. был разработан дополнительный курс из 24 занятий, который мы в настоящее время применяем в качестве продолженной терапии у пациентов, завершивших основной курс. Результаты продолженного исследования будут опубликованы.
Выводы
В проведенном нами исследовании русскоязычная версия групповой КСТ была эффективна и безопасна у пациентов с болезнью Альцгеймера на стадии умеренной деменциии и может быть рекомендована для внедрения в повседневную клиническую практику. Полученные данные открывают перспективы для изучения эффективности совместного применения КСТ в комбинациях с лекарственной терапией в лечении деменций различной степени тяжести и генеза. Для получения более точного представления об особенностях проведения групповой КСТ в различных условиях необходимо проведение продолженного исследования с пациентами, проживающими дома.
1 Деменция: информационный бюллетень. Женева: Всемирная организация здравоохранения; 2020. Available at: https://www.who.int/ (дата обращения: 20.01.2024).
2 World Alzheimer report 2019: The benefits of early diagnosis and intervention. Alzheimer’s Disease International; 2019. Available at: https://www.alzint.org/ (дата обращения: 20.01.2024).
Список литературы / References
Развернуть
- Livingston G, Sommerlad A, Orgeta V, Costafreda SG, Huntley J, Ames D et al. Dementia prevention, intervention, and care. Lancet. 2017;390(10113):2673–734. doi: 10.1016/S0140-6736(17)31363-6.
- Парфенов ВА, Захаров ВВ, Преображенская ИС. Когнитивные расстройства. М.; 2014. 192 с.
- Парфенов ВА. Болезнь Альцгеймера: ошибки ведения пациентов. Медицинский совет. 2020;(19):23–28. doi: 10.21518/2079-701X-2020-19-23-28. / Parfenov VA. Alzheimer’s disease: clinical management errors. Meditsinskiy Sovet. 2020;(19):23–28. (In Russ.) doi: 10.21518/2079-701X-2020-19-23-28.
- Левин ОС. Диагностика и лечение когнитивных нарушений и деменции в клинической практике. М: МЕДпресс-информ; 2019. 448 c.
- Локшина АБ, Гришина ДА. Терапия некогнитивных нервно-психических расстройств при болезни Альцгеймера. Неврология, нейропсихиатрия, психосоматика. 2021;13(6):132–138. doi: 10.14412/2074-2711-2021-6-132-138. / Lokshina AB, Grishina DA. Treatment of noncognitive neuropsychiatric disorders in Alzheimer’s disease. Neurology, Neuropsychiatry, Psychosomatics. 2021;13(6):132–138. (In Russ.) doi: 10.14412/2074-2711-2021-6-132-138.
- Kontis V, Bennett JE, Mathers CD, Li G, Foreman K, Ezzati M. Future life expectancy in 35 industrialised countries: projections with a Bayesian model ensemble. Lancet. 2017;389(10076):1323–1335. doi: 10.1016/S0140-6736(16)3238.
- Михайлова НМ. Деменции позднего возраста: смертность и сроки дожития. Психиатрия. 2019;17(2):54–67. doi: 10.30629/2618-6667-2019-17-2-54-67. / Mikhaylova NM. Dementia of Old Age: Mortality and Survival. Psychiatry (Moscow). 2019;17(2):54–67. (In Russ.) doi: 10.30629/2618-6667-2019-17-2-54-67.
- Helmer C, Joly P, Letenneur L, Commenges D, Dartigues JF. Mortality with Dementia: Results from a French Prospective Community-based Cohort. Am J Epidemiol. 2001;154(7):642–648. doi: 10.1093/aje/154.7.642.
- Rait G, Walters K, Bottomley C, Petersen I, Iliffe S, Nazareth I. Survival of people with clinical diagnosis of dementia in primary care: cohort study. BMJ. 2010;341:c3584. doi: 10.1136/bmj.c3584.
- Villarejo A, Benito-León J, Trincado R, Posada IJ, Puertas-Martín V, Boix R et al. Dementia-associated mortality at thirteen years in the NEDICES Cohort Study. J Alzheimers Dis. 2011;26(3):543–551. doi: 10.3233/JAD-2011-110443.
- Gillum RF, Yorrick R, Obisesan ThO. Population Surveillance of Dementia Mortality Int. J Environ Res Public Health. 2011;8(4):1244–1257. doi: 10.3390/ijerph8041244.
- Хасанова ДР, Житкова ЮВ, Яушева ЛМ. Лекарственная терапия и когнитивное стимулирование у больных с постинсультными когнитивными нарушениями. Неврология, нейропсихиатрия, психосоматика. 2014;(2S):22–27. doi: 10.14412/2074-2711-2014-2S-22-27. / Khasanova DR, Zhitkova YuV, Yausheva LM. Drug therapy and cognitive stimulation in patients with poststroke cognitive impairments. Neurology, Neuropsychiatry, Psychosomatics. 2014;(2S):22–27. (In Russ.) doi: 10.14412/2074-2711-2014-2S-22-27.
- Spector A, Orrell M, Davies S, Woods B. Can reality orientation be rehabilitated? Development and piloting of an evidence based programme of cognition-based therapies for people with dementia. Neuropsychol Rehabil. 2001;11(3–4):377–397. doi: 10.1080/09602010143000068.
- Spector A, Thorgrimsen L, Woods B, Royan L, Davies S, Butterworth M, Orrell M. Efficacy of an evidence-based cognitive stimulation therapy programme for people with dementia: Randomised Controlled Trial. Br J Psychiatry. 2003;183:248–254. doi: 10.1192/bjp.183.3.248.
- Spector A, Gardner C, Orrell M. The impact of Cognitive Stimulation Therapy groups on people with dementia: views from participants, their carers and group facilitators. Aging Ment Health. 2011;15(8):945–949. doi: 10.1080/13607863.2011.586622.
- Orrell M, Spector A, Thorgrimsen L, Woods B. A pilot study examining the effectiveness of maintenance Cognitive Stimulation Therapy (MCST) for people with dementia. Int J Geriatr Psychiatry. 2005;20(5):446–451. doi: 10.1002/gps.1304.
- Knapp M, Thorgrimsen L, Patel A, Spector A, Hallam A, Woods B, Orrell M. Cognitive Stimulation Therapy for people with dementia: cost effectiveness analysis. Br J Psychiatry. 2006;188:574–580. doi: 10.1192/bjp.bp.105.010561.
- Aguirre E, Hoare Z, Streater A, Spector A, Woods B, Hoe J, Orrell M. Cognitive stimulation therapy (CST) for people with dementia – who benefits most? Int J Geriatr Psychiatry. 2013;28(3):284–290. doi: 10.1002/gps.3823.
- Lobbia A, Carbone E, Faggian S, Gardini S, Piras F, Spector A, Borella E. The efficacy of cognitive stimulation therapy (CST) for people with mild-to-moderate dementia. Eur Psychol. 2018;24(3). doi: 10.1027/1016-9040/a000342.
- Niu YX, Tan JP, Guan JQ, Zhang ZQ, Wang LN. Cognitive stimulation therapy in the treatment of neuropsychiatric symptoms in Alzheimer’s disease: a randomized controlled trial. Clin Rehabil. 2010;24(12):1102–1111. doi: 10.1177/0269215510376004.
- Apóstolo JLA, Cardoso DFB, Rosa AI, Paúl C. The effect of cognitive stimulation on nursing home elders: A randomized controlled trial. J Nurs Scholarsh. 2014;46(3):157–166. doi: 10.1111/jnu.12072.
- Orgeta V, Leung P, Yates L, Kang S, Hoare Z, Henderson C et al. Individual cognitive stimulation therapy for dementia: a clinical effectiveness and cost-effectiveness pragmatic, multicentre, randomised controlled trial. Health Technol Assess. 2015;19(64):1–108. doi: 10.3310/hta19640.
- Stott J, Spector A. A review of the effectiveness of memory interventions in mild cognitive impairment (MCI). Int Psychogeriatr. 2011;23(4):526–538. doi: 10.1017/S1041610210001973.
- Bahar-Fuchs A, Clare L, Woods B. Cognitive training and cognitive rehabilitation for mild to moderate Alzheimer’s disease and vascular dementia (Review). Alzheimers Res Ther. 2013;5(4):35. doi: 10.1186/alzrt189.
- Piras F, Carbone E, Faggian S, Salvalaio E, Gardini S, Borella E. Efficacy of cognitive stimulation therapy for older adults with vascular dementia. Dement Neuropsychol. 2017;11(4):434–441. doi: 10.1590/1980-57642016dn11-040014.
- Clare L, Woods RT. Cognitive training and cognitive rehabilitation for people with early-stage Alzheimer’s disease: A review. Neuropsychol Rehabil. 2004;14(4):385–401. doi: 10.1080/09602010443000074.
- Gibbor L, Yates L, Volkmer A, Spector A. Cognitive stimulation therapy (CST) for dementia: a systematic review of qualitative research. Aging Mental Health. 2021;25(6):980–990. doi: 10.1080/13607863.2020.1746741.
- Cao Y, Wang N, Zhang Q, Shen N, Bai J, Luo X, Liu Y. Effects of cognitive stimulation therapy on patients with dementia: An umbrella review of systematic reviews and meta-analyses. Exp Gerontol. 2023;177:112197. doi: 10.1016/j.exger.2023.112197.
- Aguirre E, Spector A, Hoe J, Russell IT, Knapp M, Woods RT, Orrell M. Maintenance Cognitive Stimulation Therapy (CST) for dementia: a single-blind, multi-centre, randomized controlled trial of Maintenance CST vs. CST for dementia. Trials. 2010;11:46. doi: 10.1186/1745-6215-11-46.
- Fairbairn А, Gould N, Kendall Т, Ashley Р, Bainbridge I, Bower L et al. Dementia: A NICE-SCIE Guideline on Supporting People with Dementia and Their Carers in Health and Social Care. Leicester (UK): British Psychological Society; 2007.
- Рощина ИФ, Калантарова МВ, Шведовская АА, Хромов АИ. Профилактика когнитивного снижения в позднем онтогенезе: программы «Клиника памяти» и «Когнитивная стимулирующая терапия». Клиническая и специальная психология. 2022;11(3):44–70. doi: 10.17759/cpse.2022110302. / Roshchina IF, Kalantarova MV, Shvedovskaya AA, Khromov AI. Prevention of cognitive decline in late ontogenesis: programs “Memory Clinic” and “Cognitive stimulating therapy”. Clinical Psychology and Special Education. 2022;11(3):44–70. (In Russ.) doi: 10.17759/cpse.2022110302.
Фото:
Shutterstoсk/FOTODOM



 1
1 2
2 3
3 4
4


Комментарии (0)