
Журнал "Медицинский совет" №11/2024
DOI: 10.21518/ms2024-314
И.Н. Захарова1, ORCID: 0000-0003-4200-4598
И.В. Бережная1,2, ORCID: 0000-0002-2847-6268
Д.К. Дмитриева1,2, ORCID: 0000-0002-1593-0732
Е.В. Скоробогатова1,2, ORCID: 0009-0003-9227-9378
1 Российская медицинская академия непрерывного профессионального образования; 125993, Россия, Москва, ул. Баррикадная, д. 2/1, стр. 1
2 Детская городская клиническая больница имени З.А. Башляевой; 125373, Россия, Москва, ул. Героев Панфиловцев, д. 28
Распространенность аллергических заболеваний растет темпами, соответствующими эпидемическим. Одной из самых частых причин пищевой аллергии в раннем детском возрасте является аллергия к белку коровьего молока. Ее клинические варианты остаются сложно диагностируемыми заболеваниями из-за множества клинических масок. Пищевая аллергия может протекать по пути, ассоциированному как с иммуноглобулином E, так и не-IgE, или смешанному. Не-IgE-ассоциированные варианты пищевой аллергии за счет отсутствия точных и специфичных лабораторных маркеров могут вызывать значительные трудности при постановке диагноза. Продолжаются поиски новых диагностических маркеров. Одним из них может стать фекальный кальпротектин – кальций-связывающий лейкоцитарный белок, состоящий из комплекса двух мономеров – S100A8 и S100A9. Уровень концентрации фекального кальпротектина прямо пропорционален количеству лейкоцитов, мигрирующих в стенку кишечника, за счет чего фекальный кальпротектин становится точным, неинвазивным и чувствительным показателем, отражающим уровень воспаления в кишечнике. В настоящее время в качестве лабораторного маркера используется сывороточный и фекальный кальпротектин, причем последний как более доступный и нетребовательный к сбору материала широко известен в качестве диагностического маркера воспалительных заболеваний кишечника. Согласно результатам некоторых исследований, фекальный кальпротектин может использоваться для диагностики аллергии к белку коровьего молока у младенцев раннего возраста, когда другие диагностические тесты не доступны. Данные, полученные в ходе различных исследований, остаются противоречивыми. Необходимо дальнейшее изучение возможности использования фекального кальпротектина в качестве маркера гастроинтестинальной формы пищевой аллергии у детей раннего возраста.
Для цитирования: Захарова ИН, Бережная ИВ, Дмитриева ДК, Скоробогатова ЕВ. Сложности диагностики не-IgE-зависимой гастроинтестинальной формы пищевой аллергии: насколько информативен фекальный кальпротектин? Медицинский совет. 2024;18(11):138–144. https://doi.org/10.21518/ms2024-314.
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Difficulties in diagnosing non-IgE-dependent gastrointestinal forms of food allergy: How informative is fecal calprotectin?
Irina N. Zakharova1, ORCID: 0000-0003-4200-4598
Irina V. Berezhnaya1,2, ORCID: 0000-0002-2847-6268
Diana K. Dmitrieva1,2, ORCID: 0000-0002-1593-0732
Ekaterina V. Skorobogatova1,2, ORCID: 0009-0003-9227-9378
1 Russian Medical Academy of Continuous Professional Education; 2/1, Bldg. 1, Barrikadnaya St., Moscow, 125993, Russia
2 Bashlyaeva Children’s City Clinical Hospital; 28, Geroev Panfilovtsev St., Moskow, 125373, Russia
The prevalence of allergic diseases is increasing at rates corresponding to epidemic’s spread rates. Cow’s milk protein allergy (CMPA) is one of the most common food allergies in infancy. Its clinical variants remain hard-to-diagnose diseases due to their multiple clinical faces. Food allergy can develop along the pathway associated with both IgE and non-IgE, or mixed one. Non-IgE-associated variants of food allergies, due to the lack of accurate and specific laboratory markers, can cause significant difficulties in making a diagnosis. The search for new diagnostic markers continues. Faecal calprotectin, a calcium-binding leukocyte protein consisting of a complex of two monomers S100A8 and S100A9, may be one of them. Faecal calprotectin concentration is directly proportional to the number of leukocytes migrating into the intestinal wall, due to which faecal calprotectin becomes an accurate, non-invasive and sensitive indicator reflecting the level of inflammation in the intestines. Today, serum and faecal calprotectin are used as laboratory markers, and the latter, being more accessible and not critical for collection material is widely known as a diagnostic marker of inflammatory bowel diseases. Some studies suggest that faecal calprotectin may be used to diagnose cow’s milk protein allergy in young infants when other diagnostic tests are not available. Data from various studies remain contradictory. Further studies to investigate the possibilities of using faecal calprotectin as a marker of the gastrointestinal food allergy in young children is needed.
For citation: Zakharova IN, Berezhnaya IV, Dmitrieva DK, Skorobogatova EV. Difficulties in diagnosing non-IgE-dependent gastrointestinal forms of food allergy: How informative is fecal calprotectin? Meditsinskiy Sovet. 2024;18(11):138–144. (In Russ.) https://doi.org/10.21518/ms2024-314.
Conflict of interest: the authors declare no conflict of interest.
Введение
В настоящее время по всему миру отмечается неуклонный рост аллергических заболеваний с темпами, соответствующими эпидемическим. Аллергический ринит и бронхиальная астма чаще затрагивают детей старшего возраста, в раннем возрасте дебютирует пищевая аллергия, атопический дерматит. Пищевая аллергия чаще проявляется у детей до года и зачастую обусловлена аллергией к белкам коровьего молока (АБКМ) [1]. Гастроинтестинальная форма пищевой аллергии является наиболее трудной для диагностики, ввиду того что может быть как ассоциирована с повышенным уровнем иммуноглобулина Е (IgE), так и нет. АБКМ, несмотря на длительный период изучения, все еще остается трудно диагностируемым заболеванием за счет разнообразных клинических масок (табл. 1).
Таблица 1. IgE- и не-IgE-опосредованные заболевания
| IgE-опосредованные | • Анафилаксия • Оральный аллергический синдром • Крапивница, ангиоотек • Бронхиальная астма • Пищевая анафилаксия, индуцированная физической нагрузкой |
| Не-IgE-опосредованные | • Энтеропатия, индуцированная пищевыми белками (FPE) • Энтероколит, индуцированный пищевыми белками (FPIES) • Проктоколит, индуцированный пищевыми белками (FPIAP) • Целиакия |
| Смешанные (IgE и не-IgE) | • Эозинофильный эзофагит • Эозинофильный гастрит • Эозинофильный энтерит • Эозинофильный колит |
Аллергический проктоколит
Отдельно следует выделить аллергический проктоколит, индуцированный пищевыми белками (FPIAP). Это не-IgEассоциированное состояние, которое позже может провоцировать развитие IgE-ассоциированных аллергических заболеваний, таких как пищевая аллергия, в том числе сохранение реакции на коровье молоко, а также атопический дерматит и другие атопические расстройства. Чаще всего FPIAP проявляется у младенцев первых 2 мес. жизни, достигая частоты 17%. В некоторых случаях FPIAP также возникает у детей до 6 мес., проявляясь воспалением толстой кишки и гематохезией. Провоцирующим фактором выступают продукты, входящие в золотую восьмерку аллергенов: белок коровьего молока, яйца, пшеница и соя [2]. В случаях гематохезии у детей раннего возраста явления FPIAP составляют более 60% [3]. Как правило, симптомы исчезают при исключении из питания ребенка провоцирующего элемента в течение 48–72 ч. Однако у детей, находящихся на грудном вскармливании, эффект может быть отложенным до 1–2 нед. в связи с длительным сохранением фрагментов белковой структуры коровьего молока [2]. Патогенез FPIAP, как и патогенез АБКМ в классическом понимании, изучен недостаточно, но высказываются предположения, преимущественно связанные с повышением уровней провоспалительных цитокинов, в том числе фактора некроза опухоли альфа (TNF-α) и трансформирующего фактора роста бета, ассоциированных с повышенной эпителиальной проницаемостью и ослаблением иммунного ответа, что приводит к снижению толерантности к пищевым белкам [4, 5]. Нельзя исключать и влияние GALT (лимфоидной ткани, связанной с кишечником) и ILC (врожденных лимфоидных клеток) как регуляторов тканевого гомеостаза и воспаления [6]. ILC2, демонстрирующие функциональное сходство с Th2-клетками, могут продуцировать цитокины, активирующие тучные клетки и эозинофильное воспаление, приводящее к переключению В-клеток на IgE, что может объяснять переход не-IgE-ассоциированных реакций в IgE-ассоциированную сенсибилизацию, хотя большинство детей с FPIAP перерастут проявляющиеся реакции к возрасту 1 года без формирования IgE-сенсибилизации.
В исследовании 2020 г. было проанализировано состояние здоровья 903 здоровых детей, из которых 153 продемонстрировали симптомы FPIAP, а у 56 развилась IgE-опосредованная пищевая аллергия, причем позже она развилась у 11% пациентов с FPIAP [7]. Как известно, исключение пищевых продуктов в раннем возрасте может быть ассоциировано с развитием IgE-сенсибилизации к ним. Таким образом, формирование IgE-опосредованных реакций у детей с FPIAP может быть связано с необходимостью исключать провоцирующий продукт на относительно длительный срок [8, 9]. Однако в отличие от IgE-опосредованных реакций, которые могут быть подтверждены лабораторными исследованиями, для не-IgE-ассоциированных аллергий, включая FPIAP, нет диагностических лабораторных маркеров (табл. 2). С этим может быть связана гипердиагностика АБКМ у детей на грудном, искусственном и смешанном вскармливании, что подтверждается мнением Европейского общества детской гастроэнтерологии, гепатологии и питания (ESPGHAN) [10].
Таблица 2. Диагностика IgE- и не-IgE-зависимых состояний
| IgE-зависимые | Обнаружение специфических антител IgE в крови | Высокая специфичность, но может быть низкая корреляция с клиническими симптомами |
| Кожный прик-тест | В случае некоторых аллергенов (например, соя) снижена чувствительность и специфичность | |
| Тест активации базофилов | Низкая доступность; предполагается использовать в случае аллергических реакций на орехи | |
| Пероральный пищевой тест | Высокий риск побочных реакций, в том числе анафилаксии | |
| Не-IgE-зависимые | Сбор анамнеза | Требует внимательной и длительной беседы с родителем, включая сбор семейного анамнеза атопии |
| Диагностические диетические ограничения | Могут назначаться избыточно; диетические ограничения часто вызывают неудобства у семьи из-за цены или вкуса, могут нарушаться | |
| Первичные диагносностические критерии различных не-IgE-состояний (исключение IgE-зависимых состояний при возникновении рвоты через 1–4 ч после приема предполагаемого аллергена) | Может быть неспецифическая клиническая картина, затрудняющая диагностику | |
| Эндоскопическое исследование с забором биоптатов | Неспецифическая клиническая картина; высокоинвазивное дорогое обследование, не всегда доступное в клинической практике |
Фекальный кальпротектин как высокочувствительный маркер
Учитывая относительную распространенность аллергических реакций в возрасте до года с постоянно увеличивающимися темпами роста и затруднения в диагностике, продолжаются поиски новых возможных диагностических маркеров. Одним из них, вероятно, может стать фекальный кальпротектин – высокочувствительный маркер, отражающий уровень воспаления в кишечнике.
Впервые кальпротектин был описан в 1980-е гг. Он принадлежит к семейству кальций-связывающих лейкоцитарных белков S100 и у некоторых млекопитающих и человека состоит из комплекса двух мономеров – S100A8 и S100A9. Белок, составляющий кальпротектин, содержится в цитозоле нейтрофилов, занимая около 45% общего цитозольного белка [11]. На экспрессию кальпротектина во время воспаления могут влиять различные клеточные пути и медиаторы воспаления, такие как TNF-α, интерлейкин-1β, липополисахариды, а также некоторые лекарственные средства и дефицит питания и микроэлементов [12].
Биологическая функция кальпротектина – регуляция внутриклеточных путей иммунных клеток и модуляция воспалительного ответа. Управление воспалительным ответом происходит за счет рекрутирования лейкоцитов за счет хемотаксиса лейкоцитов и инфильтрации тканей и транспорта арахидоновой и олеиновой кислоты [13, 14]. Арахидоновая кислота, относящаяся к группе омега-6 полиненасыщенных жирных кислот, является медиатором воспалительных липидов и необходима для синтеза лейкотриена В4, способствующего воспалению и повреждению тканей при воспалительных заболеваниях кишечника (ВЗК) [15]. Таким образом, кальпротектин участвует в транспорте полиненасыщенных жирных кислот к очагам воспаления, провоцируя местный иммунный ответ [16]. В настоящий момент в качестве лабораторного маркера используется сывороточный и фекальный кальпротектин, причем последний как более доступный и нетребовательный к сбору материала широко известен в качестве диагностического маркера ВЗК. Фекальный кальпротектин может использоваться как лабораторный маркер для дифференциальной диагностики заболеваний желудочно-кишечного тракта (исследование Y. Rashed [17]), однако наиболее высокую чувствительность и специфичность демонстрирует в отношении ВЗК (табл. 3).
Таблица 3. Уровень кальпротектина при различных заболеваниях в исследовании Y. Rashed (n = 180) [17]
| Воспалительные заболевания кишечника | 4640 ± 850 | 30 |
| Аллергия к белкам коровьего молока с гастроинтестинальными проявлениями | 1260 ± 625, через 4 нед. после исключения аллергена – 420 ± 190 | 30 |
| Инфекция Helicobacter pylori | 78,9 ± 25,1 | 30 |
| Целиакия | 456 ± 123 | 30 |
| Эозинофильный колит | 4,2 ± 2,9 | 20 |
| Функциональный запор | 23,6 ± 21,8 | 40 |
| Здоровые дети | 4,1 ± 6,9 | 30 |
Кальпротектин у новорожденных (рис. 1) может выступать в качестве защитного и даже антимикробного (за счет способности хелатировать ионы металлов) агента. В 2017 г. группа исследователей из Германии проанализировала грудное молоко 97 женщин и выявила, что содержание гетеродимера S100A8/A9 в нем резко увеличивается после родов с постепенным снижением до нормы в течение месяца, что может объяснять в том числе высокие уровни фекального кальпротектина у новорожденных детей. В течение первых двух дней после родов уровень кальпротектина был резко повышен (18 400 ± 6 500 нг/мл), особенно при вагинальных родах по сравнению с кесаревым сечением, что оказывало на младенцев антисептическое, антимикробное защитное действие [18].
Рисунок 1. Особенности уровней и функций фекального кальпротектина у детей раннего возраста
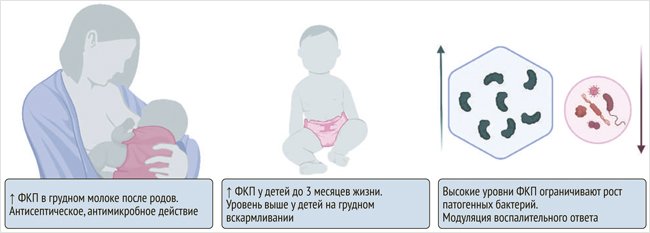
ФКТ – фекальный кальпротектин.
Несколько позже, в 2020 г., с целью уточнения уровней фекального кальпротектина у здоровых новорожденных были проанализированы 517 образцов стула, полученных от 72 доношенных и 49 недоношенных детей. В ходе исследования обнаружилось, что уровни фекального кальпротектина значительно выше в группе доношенных детей, находящихся на грудном вскармливании, а также в группе детей до 3 мес. жизни. Недоношенные дети демонстрировали более низкие уровни с постепенным увеличением в течение первого месяца жизни. Также было продемонстрировано, что высокие уровни кальпротектина ограничивают рост патогенных бактерий, таких как энтеробактерии, и ассоциированы с более высоким содержанием актинои бифидобактерий [19].
В настоящее время также высказывается предположение, что фекальный кальпротектин, помимо выполнения функции воспалительного маркера, непосредственно участвует в процессе развития пищевой аллергии, усугубляя каскадную реакцию при аллергическом процессе [20]. Эозинофилы и нейтрофилы активируются, отвечая на проникновение пищевых аллергенов, что приводит к повышению уровня кальпротектина вследствие его инициирования под воздействием нейтрофилов и эпителиальных клеток слизистой оболочки кишечника [21]. Повышенный уровень кальпротектина влияет на механизм передачи сигнала дендритных клеток, способствуя дифференцировке исходных CD4+ T-клеток в Th2-клетки и провоцируя иммунные ответы по схеме аллергической реакции [20]. Тем самым образуется цикл, в ходе которого аллергическое воспаление в кишечнике повышает уровень фекального кальпротектина, который способствует усилению каскада связанных с аллергическими и воспалительными реакциями иммунных процессов.
На фекальный кальпротектин как маркер, который может демонстрировать выраженность и даже предсказывать развитие пищевой аллергии [22], обратили внимание сравнительно недавно. Уровень концентрации фекального кальпротектина прямо пропорционален количеству лейкоцитов, мигрирующих в стенку кишечника. Продукты деградации активированных нейтрофилов обнаруживаются в фекалиях (рис. 2), и благодаря стабильности и устойчивости к протеолизу фекальный кальпротектин является надежным маркером кишечного воспаления. Фекальный кальпротектин определяется при помощи быстрого, не требующего высоких затрат и легко воспроизводимого твердофазного иммуноферментного анализа. Следовательно, анализ на концентрацию фекального кальпротектина в настоящее время можно использовать в качестве недорогого, неинвазивного, чувствительного маркера заболеваний кишечника, биоматериал для которого можно замораживать и хранить длительное время, что является дополнительным преимуществом по сравнению с другими методами исследований [23].
Рисунок 2. Выделение кальпротектина нейтрофилами и макрофагами в кишечное пространство
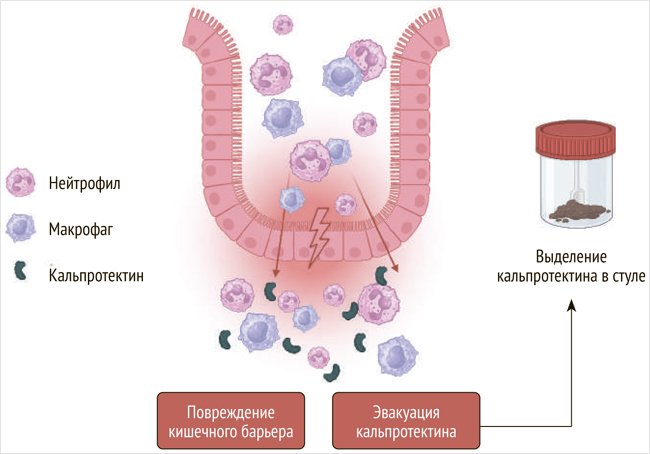
У взрослых пациентов с пищевой аллергией в возрасте от 1 года до 18 лет не было выявлено значительного повышения показателя кальпротектина, а также не было получено значимых различий между исходным уровнем и после 3-месячной элиминационной диеты: 73,98 (71,12) мкг/г и 68,11 (74,4) мкг/г соответственно, p = 0,331, но отмечалось снижение фекального кальпротектина на фоне соблюдения строгой диеты: 84,06 (79,48) мкг/г и 41,11 (34,24) мкг/г соответственно, р = 0,001 [24].
В 2009 г. было продемонстрировано, что у детей на грудном вскармливании отмечаются повышенные уровни фекального кальпротектина. При анализе 74 образцов стула, из которых от здоровых младенцев в возрасте 13–90 дней 39 были на грудном вскармливании, а 35 – на искусственном, уровень фекального кальпротектина составлял 555,00 мкг/г (диапазон 122,5–2000,0 мкг/г) у детей на грудном вскармливании при 206,60 мкг/г (диапазон 31,2–797,6 мкг/г, p < 0,001) – у детей на искусственном вскармливании, однако исследователями не была определена причина выявленной разницы. Как было продемонстрировано в более позднем исследовании, полученные результаты могут быть связаны с высокими уровнями кальпротектина в грудном молоке [18, 25].
Турецкое исследование 2014 г. продемонстрировало положительную корреляцию между АБКМ и повышением фекального кальпротектина у 32 пациентов, из которых 24 детям была диагностирована IgE-опосредованная АБКМ, а 8 – не-IgEопосредованная. До элиминационной диеты среднее значение фекального кальпротектина в группе IgE-АБКМ составляло 516 ± 311 мкг/г, в группе не-IgEАБКМ – 886 ± 278 мкг/г, в группе контроля (39 здоровых детей) – 254 ± 169 мкг/г, и на фоне соблюдения элиминационной диеты отмечалось уменьшение показателей до 218 ± 90 и 359 ± 288 мкг/г соответственно [26].
В 2021 г. в ходе проведенных исследований было продемонстрировано двукратное превышение уровня фекального кальпротектина у детей с пищевой аллергией по сравнению со здоровыми детьми: средний уровень кальпротектина у здоровых младенцев составил 141 мкг/г (41–373 мкг/г), у детей с аллергией – 410 мкг/г (168–1739 мкг/г), что значительно превышало уровень фекального кальпротектина в здоровой группе (z = –9,335, p < 0,001). Через 8 нед. диетического вмешательства в виде исключения белка коровьего молока в питании матери у детей, находящихся исключительно на грудном вскармливании, и замены молочной смеси на смесь на основе полного гидролиза белка либо аминокислотную смесь у детей на искусственном вскармливании среднее значение фекального кальпротектина составило 160 мкг/г (34–699 мкг/г), что коррелировало с облегчением клинической симптоматики. Таким образом, значение фекального кальпротектина отражало уровень кишечного воспаления у детей с пищевой аллергией до и после диетического вмешательства (z = –8,173, p < 0,001) [27, 28].
В исследовании, проведенном в Испании в 2016 г., уровень фекального кальпротектина также достоверно коррелировал с проявлениями АБКМ: по результатам однолетнего проспективного исследования с включением 82 младенцев в возрасте до года, у которых проводился анализ на содержание кальпротектина в кале в момент обращения, через 1 и 3 мес., были получены достоверные данные, указывающие на возможность его использования для диагностики АБКМ, но не прогнозирования клинического ответа. У 52 младенцев была заподозрена не-IgE-опосредованная реакция на коровье молоко, 30 здоровых детей вошли в контрольную группу [29]. После 4-недельной элиминационной диеты 40 пациентов продемонстрировали улучшение состояния, у них была диагностирована не-IgEопосредованная реакция на коровье молоко. У 20 пациентов наблюдалось минимальное улучшение или отсутствие эффекта, и они были включены в группу гастроинтестинальных проявлений, не ассоциированных с АБКМ. На момент обращения в группе АБКМ уровень фекального кальпротектина составил 442,65 мкг/г, в группе гастроинтестинальных проявлений – 268,58 мкг/г и в группе здоровых детей – 100,30 мкг/г, и на фоне соблюдения элиминационной диеты было обнаружено статистически значимое снижение в группе не-IgE-опосредованной АБКМ – до 228,51 мкг/г через 1 мес. и 92,78 мкг/г через 3 мес. соблюдения диеты. В качестве чувствительного для АБКМ уровня фекального кальпротектина было предложено значение 138 мкг/г, при превышении которого вероятность наличия АБКМ увеличивалась до 8%, а уменьшение ниже этого уровня исключало заболевание. Однако значимые различия были получены только у пациентов с диареей или гематохезией, которые являются наглядными симптомами кишечного воспаления, и не были получены у пациентов с изменениями массы тела, беспокойством и срыгиваниями, которые также демонстрируют пациенты с АБКМ. Кроме того, учитывая полученный результат, в котором повышение фекального кальпротектина более 110 мкг/г имело специфичность 50% (площадь под ROC-кривой 0,68; 95%-й доверительный интервал 0,48–0,89), исследователи сделали вывод, что фекальный кальпротектин не может считаться удовлетворительным маркером для прогнозирования положительного клинического ответа на элиминацию белка коровьего молока из рациона [30].
Заключение
Данные, полученные в ходе многолетних исследований, все еще остаются противоречивыми, и полного консенсуса в вопросе использования фекального кальпротектина как маркера АБКМ не достигнуто: некоторые исследования демонстрируют позитивные результаты, некоторые – отсутствие корреляции [31, 32]. Необходимо дальнейшее изучение возможности использования фекального кальпротектина в качестве лабораторного маркера на более масштабных выборках и оценка чувствительности и специфичности в разных возрастных группах.
Список литературы / References
Развернуть
- Muraro A, Werfel T, Hoffmann-Sommergruber K, Roberts G, Beyer K, Bindslev-Jensen C et al. EAACI food allergy and anaphylaxis guidelines: diagnosis and management of food allergy. Allergy. 2014;69(8):1008–1025. doi: 10.1111/all.12429.
- Mennini M, Fiocchi AG, Cafarotti A, Montesano M, Mauro A, Villa MP, Di Nardo G. Food protein-induced allergic proctocolitis in infants: Literature review and proposal of a management protocol. World Allergy Organ J. 2020;13(10):100471. doi: 10.1016/j.waojou.2020.100471.
- Arvola T, Ruuska T, Keränen J, Hyöty H, Salminen S, Isolauri E. Rectal bleeding in infancy: clinical, allergological, and microbiological examination. Pediatrics. 2006;117(4):e760–768. doi: 10.1542/peds.2005-1069.
- Ozen A, Gulcan EM, Ercan Saricoban H, Ozkan F, Cengizlier R. Food Protein-Induced Non-Immunoglobulin E-Mediated Allergic Colitis in Infants and Older Children: What Cytokines Are Involved? Int Arch Allergy Immunol. 2015;168(1):61–68. doi: 10.1159/000441471.
- Morita H, Nomura I, Orihara K, Yoshida K, Akasawa A, Tachimoto H et al. Antigen-specific T-cell responses in patients with non-IgE-mediated gastrointestinal food allergy are predominantly skewed to T(H)2. J Allergy Clin Immunol. 2013;131(2):590–592.e6. doi: 10.1016/j.jaci.2012.09.005.
- Peterson LW, Artis D. Intestinal epithelial cells: regulators of barrier function and immune homeostasis. Nat Rev Immunol. 2014;14(3):141–153. doi: 10.1038/nri3608.
- Martin VM, Virkud YV, Phadke NA, Su KW, Seay H, Atkins MR et al. Increased IgE-Mediated Food Allergy With Food Protein-Induced Allergic Proctocolitis. Pediatrics. 2020;146(3):e20200202. doi: 10.1542/peds.2020-0202.
- Perkin MR, Logan K, Bahnson HT, Marrs T, Radulovic S, Craven J et al. Efficacy of the Enquiring About Tolerance (EAT) study among infants at high risk of developing food allergy. J Allergy Clin Immunol. 2019;144(6):1606–1614.e2. doi: 10.1016/j.jaci.2019.06.045.
- Tran KL, Wisner EL, Jeha GM, Wall LA. Development of IgE-mediated food allergies in children with history of food protein-induced allergic proctocolitis: a series of five cases. Front Allergy. 2024;5:1354106. doi: 10.3389/falgy.2024.1354106.
- Vandenplas Y, Broekaert I, Domellöf M, Indrio F, Lapillonne A, Pienar C et al. An ESPGHAN Position Paper on the Diagnosis, Management, and Prevention of Cow’s Milk Allergy. J Pediatr Gastroenterol Nutr. 2024;78(2):386–413. doi: 10.1097/MPG.0000000000003897.
- Edgeworth J, Gorman M, Bennett R, Freemont P, Hogg N. Identification of p8,14 as a highly abundant heterodimeric calcium binding protein complex of myeloid cells. J Biol Chem. 1991;266(12):7706–7713. doi: 10.1016/S0021-9258(20)89506-4.
- Kido J, Hayashi N, Kataoka M, Nagata T. Calprotectin expression in human monocytes: induction by porphyromonas gingivalis lipopolysaccharide, tumor necrosis factor-alpha, and interleukin-1beta. J Periodontol. 2005;76(3):437–442. doi: 10.1902/jop.2005.76.3.437.
- Klempt M, Melkonyan H, Nacken W, Wiesmann D, Holtkemper U, Sorg C. The heterodimer of the Ca2+-binding proteins MRP8 and MRP14 binds to arachidonic acid. FEBS Lett. 1997;408(1):81–84. doi: 10.1016/s0014-5793(97)00394-3.
- Gheibi N, Ghorbani M, Shariatifar H, Farasat A. Effects of unsaturated fatty acids (Arachidonic/Oleic Acids) on stability and structural properties of Calprotectin using molecular docking and molecular dynamics simulation approach. PLoS ONE. 2020;15(3):e0230780. doi: 10.1371/journal.pone.0230780.
- Jukic A, Bakiri L, Wagner EF, Tilg H, Adolph TE. Calprotectin: from biomarker to biological function. Gut. 2021;70(10):1978–1988. doi: 10.1136/gutjnl-2021-324855.
- Kerkhoff C, Vogl T, Nacken W, Sopalla C, Sorg C. Zinc binding reverses the calcium-induced arachidonic acid-binding capacity of the S100A8/A9 protein complex. FEBS Lett. 1999;460(1):134–138. doi: 10.1016/s0014-5793(99)01322-8.
- Rashed Y. Fecal Calprotectin in Children Can Differentiate Between Different Gastrointestinal Diseases. Open Access Maced J Med Sci. 2022;10(B):773–778. doi: 10.3889/oamjms.2022.8367.
- Pirr S, Richter M, Fehlhaber B, Pagel J, Härtel C, Roth J et al. High Amounts of S100-Alarmins Confer Antimicrobial Activity on Human Breast Milk Targeting Pathogens Relevant in Neonatal Sepsis. Front Immunol. 2017;8:1822. doi: 10.3389/fimmu.2017.01822.
- Willers M, Ulas T, Völlger L, Vogl T, Heinemann AS, Pirr S et al. S100A8 and S100A9 Are Important for Postnatal Development of Gut Microbiota and Immune System in Mice and Infants. Gastroenterology. 2020;159(6):2130–2145.e5. doi: 10.1053/j.gastro.2020.08.019.
- Zhu Q, Li F, Wang J, Ma J, Sheng X. Upregulation of calprotectin in mild IgE-mediated ovalbumin hypersensitivity. Oncotarget. 2017;8(23):37342–37354. doi: 10.18632/oncotarget.16954.
- Morita H, Nomura I, Matsuda A, Saito H, Matsumoto K. Gastrointestinal food allergy in infants. Allergol Int. 2013;62(3):297–307. doi: 10.2332/allergolint.13-RA-0542.
- Kukkonen K, Kuitunen M, Haahtela T, Korpela R, Poussa T, Savilahti E. High intestinal IgA associates with reduced risk of IgE-associated allergic diseases. Pediatr Allergy Immunol. 2010;21(1):67–73. doi: 10.1111/j.1399-3038.2009.00907.x.
- Lee YW, Lee KM, Lee JM, Chung YY, Kim DB, Kim YJ et al. The usefulness of fecal calprotectin in assessing inflammatory bowel disease activity. Korean J Intern Med. 2019;34(1):72–80. doi: 10.3904/kjim.2016.324.
- Lendvai-Emmert D, Emmert V, Makai A, Fusz K, Prémusz V, Eklics K et al. Fecal calprotectin levels in pediatric cow’s milk protein allergy. Front Pediatr. 2022;10:945212. doi: 10.3389/fped.2022.945212.
- Savino F, Castagno E, Calabrese R, Viola S, Oggero R, Miniero R. High faecal calprotectin levels in healthy, exclusively breast-fed infants. Neonatology. 2010;97(4):299–304. doi: 10.1159/000255161.
- Beşer OF, Sancak S, Erkan T, Kutlu T, Cokuğraş H, Cokuğraş FÇ. Can Fecal Calprotectin Level Be Used as a Markers of Inflammation in the Diagnosis and Follow-Up of Cow’s Milk Protein Allergy? Allergy Asthma Immunol Res. 2014;6(1):33–38. doi: 10.4168/aair.2014.6.1.33.
- Qiu L, Wang J, Ren F, Shen L, Li F. Can fecal calprotectin levels be used to monitor infant milk protein allergies? Allergy Asthma Clin Immunol. 2021;17(1):132. doi: 10.1186/s13223-021-00636-0.
- Мигачева НБ, Печкуров ДВ, Каганова ТИ, Сушкова ТВ. Влияние приема синбиотического комплекса, содержащего Lactobacillus rhamnosus GG и фруктоолигосахариды, на динамику уровня фекального кальпротектина у детей первого года жизни. Альманах клинической медицины. 2017;45(1):33–39. doi: 10.18786/2072-0505-2017-45-1-33-39. / Migacheva NB, Pechkurov DV, Kaganova TI, Sushkova TV. Effect of a synbiotic containing Lactobacillus rhamnosus GG and fructooligosaccharides on the dynamics of the level of fecal calprotectin in children of first year of life. Almanac of Clinical Medicine. 2017;45(1):33–39. (In Russ.) doi: 10.18786/2072-0505-2017-45-1-33-39.
- Макарова СГ, Лаврова ТЕ, Новик ГА. Не-IgE-опосредованная гастроинтестинальная пищевая аллергия у детей. Диагностика, дифференциальная диагностика, тактика диетотерапии. Лечащий Врач. 2023;(6):20–28. doi: 10.51793/OS.2023.26.6.003. / Makarova SG, Lavrova TE, Novik GA. Non-IgE-mediated gastrointestinal food allergy in children. Diagnostics, differential diagnostics, tactics of diet therapy. Lechaschi Vrach. 2023;(6):20–28. (In Russ.) doi: 10.51793/OS.2023.26.6.003.
- Trillo Belizón C, Ortega Páez E, Medina Claros AF, Rodríguez Sánchez I, Reina González A, Vera Medialdea R, Ramón Salguero JM. Calprotectina fecal como apoyo al diagnóstico en la alergia a las proteínas de leche de vaca no IgE mediada. An Pediatr (Barc). 2016;84(6):318–323. doi: 10.1016/j.anpedi.2015.07.007.
- Ataee P, Zoghali M, Nikkhoo B, Ghaderi E, Mansouri M, Nasiri R, Eftekhari K. Diagnostic Value of Fecal Calprotectin in Response to Mother’s Diet in Breast-Fed Infants with Cow’s Milk Allergy Colitis. Iran J Pediatr. 2018;28(4):e66172. doi: 10.5812/ijp.66172.
- Díaz M, Guadamuro L, Espinosa-Martos I, Mancabelli L, Jiménez S, Molinos-Norniella C et al. Microbiota and Derived Parameters in Fecal Samples of Infants with Non-IgE Cow’s Milk Protein Allergy under a Restricted Diet. Nutrients. 2018;10(10):1481. doi: 10.3390/nu10101481.



 1
1 2
2 3
3 4
4


Комментарии (0)