Журнал "Медицинский совет" №8/2025
DOI: 10.21518/ms2025-223
В.А. Приходько1, https://orcid.org/0000-0002-4690-1811
С.В. Оковитый1,2, https://orcid.org/0000-0003-4294-5531
1 Санкт-Петербургский государственный химико-фармацевтический университет; 197376, Россия, Санкт-Петербург, ул. Профессора Попова, д. 14а
2 Санкт-Петербургский государственный университет; 199034, Россия, Санкт-Петербург, Университетская наб., д. 7-9
Саркопения – синдром, характеризующийся прогрессирующей и генерализованной потерей мышечной массы, силы и функции, имеющий первичную и вторичную формы. Вторичная саркопения осложняет течение хронических заболеваний печени с частотой встречаемости от 30 до 100% в зависимости от их характера, тяжести и степени компенсации. Наличие саркопении ограничивает повседневную активность и трудоспособность больных, снижает качество жизни, может приводить к инвалидизации и значительно повышает риск смерти от всех причин. Несмотря на высокую медико-социальную значимость этого состояния, на сегодняшний день отсутствуют препараты для его коррекции с доказанной эффективностью и безопасностью. Значительное внимание исследователей в последние годы привлекают соединения, способные восстанавливать нормальное функционирование соматотропной оси, страдающее при всех видах саркопении. L-орнитин и его соли (L-аспартат, α-кетоглутарат) не только обладают прямым гепатопротекторным и гипоаммониемическим действием, но и оказывают влияние на соматотропную ось, а также обладают плейотропными метаболическими эффектами. Доклиническими исследованиями установлено, что посредством стимуляции экспрессии и релиза грелина L-орнитин выступает в роли непрямого секретагога соматотропина и способствует повышению активности его основного эффектора – инсулиноподобного фактора роста 1. В клинических исследования курсовой прием L-орнитина – L-аспартата в дополнение к стандартной терапии у больных патологиями печени сопровождался увеличением системных уровней соматотропного гормона (СТГ), ростом объемов мышц плеча, повышением показателей динамометрии и результатов координационных проб. L-орнитина α-кетоглутарат стимулировал аппетит и набор мышечной массы при синдроме мальнутриции у пожилых, предупреждал потерю глутамина скелетными мышцами после оперативных вмешательств, а также повышал качество жизни возрастных пациентов в восстановительном периоде после перенесенных заболеваний. Имеющиеся данные свидетельствуют о потенциальной эффективности препаратов L-орнитина для коррекции саркопении на фоне хронических заболеваний печени и подчеркивают актуальность дальнейших исследований в этой области.
Для цитирования: Приходько ВА, Оковитый СВ. Препараты L-орнитина как модуляторы соматотропной оси для коррекции саркопении при хронических болезнях печени. Медицинский Совет. 2025;(8):80-93. https://doi.org/10.21518/ms2025-223
Конфликт интересов: автор заявляет об отсутствии конфликта интересов.
L-Ornithine salts as somatotropic axis modulators for the correction of sarcopenia in chronic liver disease
Inna G. Pakhomova, ORCID: 0000-0002-3125-6282
Veronika A. Prikhodko1, https://orcid.org/0000-0002-4690-1811
Sergey V. Okovityi1,2, https://orcid.org/0000-0003-4294-5531
1 Saint-Petersburg State Chemical-Pharmaceutical University; 14а, Professor Popov St., St Petersburg, 197376, Russia
2 St Petersburg State University; 7–9, Universitetskaya Emb., St Petersburg, 199034, Russia
Sarcopenia
is a syndrome characterized by a progressive and generalized loss of skeletal
muscle mass, strength, and function, that exists in a primary and a secondary
form. Secondary sarcopenia complicates chronic liver disease with a prevalence
ranging from 30 to 100% depending on the nature of disease, its severity, and
compensation status. The presence of sarcopenia limits normal daily activity,
reduces work capacity, diminishes quality of life, may lead to disability, and
increases all-cause mortality risk. Despite the evident medical and social
burden of this condition, as of today, no agents for its treatment have proven
to be both effective and safe. Significant attention of the scientific
community has recently been drawn to molecules that improve and normalize the
somatotropic axis function, which is found to be impaired in all types of
sarcopenia. L-ornithine and its salts (L-aspartate, α-ketoglutarate) are not
only capable of direct hepatoprotection and facilitation of ammonia clearance,
but also modulate the somatotropic axis as well as have a number of pleiotropic
metabolic effects. Preclinical studies have found L-ornithine to act as an
indirect growth hormone secretagogue and enhance the activity of its main
effector molecule, insulin-like growth factor 1. In clinical trials, course
treatment with L-ornithine L-aspartate as an add-on to standard therapy
increased the levels of circulating growth hormone, promoted arm muscle growth,
improved handgrip strength and standing balance. L-ornithine α-ketoglutarate
increased appetite and skeletal muscle gain in malnourished older adults,
mitigated glutamine loss by skeletal muscle following major surgery, and
improved quality of life in elderly convalescent subjects. The available data
suggest potential effectiveness of L-ornithine formulations for the treatment
of sarcopenia associated with chronic liver disease, and highlight this
indication as an important field for future research.
For citation: Prikhodko VA, Okovityi SV. L-Ornithine salts as somatotropic axis modulators for the correction of sarcopenia in chronic liver disease. Meditsinskiy sovet = Medical Council. 2025;(8):80-93. (In Russ.) https://doi.org/10.21518/ms2025-223
Conflict of interest: the author declares no conflict of interest.
Введение
Саркопения представляет
собой синдром, характеризующийся прогрессирующей и генерализованной потерей
мышечной массы, силы и функции. В качестве диагностического критерия саркопении
используют сочетание снижения мышечной массы и силы сжатия кисти (рекомендации
Европейской рабочей группы по саркопении у пожилых людей (EWGSOP2, 2018 г.))
и/или скорости ходьбы (рекомендации Азиатской рабочей группы по саркопении (AWGS2, 2019 г.)) [1, 2]. В 2016 г.
саркопения была официально выделена в самостоятельное заболевание с присвоением
кода М62.84 по актуальной в РФ МКБ-10, однако уже в МКБ-11 была лишена этого
статуса и определена в группу «FB32.Y. Другие уточненные поражения мышц».
В настоящее время принято
выделять саркопению первичную, связанную с процессами естественного старения, и
вторичную, развивающуюся на фоне погрешностей в питании, нездорового образа
жизни и/или заболеваний других органов и систем, включая в первую очередь
хронические воспалительные процессы, злокачественные новообразования, ожирение,
патологии желез внутренней секреции, почек и печени [2–4]. Кроме этого,
выделяют четыре основных фенотипа саркопении: изолированная саркопения,
остеосаркопения, саркопеническое ожирение, остеосаркопеническое ожирение [5].
По разным оценкам, первичная
саркопения выявляется у 8–36% лиц взрослого, 5–27% — пожилого (60–70 лет) и 11–50%
— старческого (80 лет и старше) возраста [6, 7]. Вторичной саркопенией во всем
мире страдают от 2 до 80% пациентов в зависимости от основного заболевания и
используемых диагностических критериев; максимальные значения характерны для
популяций онкобольных и отделений интенсивной терапии и реанимации [8]. При неалкогольной
(метаболически ассоциированной) жировой болезни печени (НАЖБП) распространенность
саркопении варьирует в широком диапазоне и в среднем находится на уровне 30%,
при неалкогольном стеатогепатите (НАСГ) — 35,0%, при компенсированном циррозе
печени — 30–50% и при декомпенсации — до 100% [9–12]. Наиболее частым фенотипом
саркопении при НАЖБП является саркопеническое ожирение, наименее
распространенным — изолированная саркопения [5].
При вторичном генезе
саркопении приоритетным является установление патогенетических причин и их
устранение или коррекция. Тем не менее у подавляющего большинства больных
мультисистемными патологиями, такими как НАЖБП, единственная причина развития
саркопении фактически не может быть установлена, что затрудняет постановку
диагноза и подбор адекватной терапии [4].
Саркопения приводит к
локомоторным нарушениям, увеличивает риск падений и травм, ограничивает
повседневную активность, снижает качество жизни, может приводить к утрате
самостоятельности, инвалидизации и необходимости обеспечения ухода за больным,
способствует более чем двукратному повышению риска смерти от всех причин [4, 13].
Кроме этого, наличие саркопении положительно ассоциировано с тяжестью
остеопороза и частотой переломов, факторами кардиоваскулярного риска, сопутствующими
нарушениями углеводного обмена, когнитивными расстройствами, прогрессией и
неблагоприятными исходами основной патологии [4, 9, 14].
В различное время в
клинических исследованиях по показанию «саркопения» оценивалась эффективность
тестостерона, нандролона, селективных модуляторов рецепторов андрогенов (трестолон,
энобосарм, LGD-4033), дегидроэпиандростерона, эстрогенов, модуляторов
сигнальных путей миостатина/активина-A (ландогрозумаб, бимагрумаб, AMG 745), витамина D, ингибиторов ангиотензинпревращающего
фермента, блокаторов рецепторов ангиотензина II, β-блокаторов, антагонистов
индоксилсульфата (ренамезин), тиазолидиндионов (пиоглитазон),
20-гидроксиэкдизона (BIO101) и др. [15, 16]. Запланированы к проведению
испытания деносумаба, бисфосфонатов, сиролимуса, ресвератрола, элдекальцитола,
пре- и пробиотиков, многочисленных биоактивных добавок к пище на основе
белковых изолятов, растительных масел и аминокислот, а также систем электро- и
магнитной миостимуляции[1]. На
этапе доклинических исследований потенциальную эффективность демонстрировали некоторые
соединения групп экзеркинов (иризин, апелин), их антагонистов (антитела к
интерлейкину-6/15, фактору некроза опухоли α и его рецептору) и сенолитиков
(дазатиниб, руксолитиниб) [16].
Несмотря на объем
вышеприведенного (далеко не исчерпывающего) списка, на сегодняшний день
отсутствуют лекарственные препараты для коррекции саркопении с доказанной
эффективностью и безопасностью, а меры поддержки пациентов сводятся к
поддержанию адекватного нутритивного статуса с повышенным потреблением белка и
обеспечением физических нагрузок [3, 17]. В контексте наблюдаемого роста
распространенности хронических патологий печени представляется актуальным поиск
средств коррекции ассоциированной с ними саркопении среди препаратов с
первичным гепатопротекторным действием. В настоящей работе рассмотрен один из
ключевых патогенетических механизмов саркопении — дисрегуляция соматотропной
оси — и проанализированы данные о потенциальной эффективности препаратов
L-орнитина как ее фармакологических модуляторов.
Соматотропная
ось в норме и при патологии. Соматотропный гормон и его секреция
Соматотропный гормон (СТГ,
гормон роста, соматотропин) — пептидный гормон, кодируемый у человека пятью
высокогомологичными генами. Практически весь пул циркулирующего СТГ у взрослых
является продуктом экзона GH1, при этом 90% его представлены одноцепочечной изоформой
22 кДа-СТГ, состоящей из 191 аминокислотного остатка, и еще до 10% —
альтернативно сплайсированной изоформой 20 кДа-СТГ, редуцированной до 176
остатков [18]. Обе эти изоформы (СТГ-1) секретируются соматотропными клетками,
находящимися преимущественно в латеральных отделах передней доли гипофиза, в то
время как экзоны GH2 и CS (СТГ-2) экспрессируются исключительно в клетках
синцитиотрофобласта плаценты, а функция и биологическое значение продукта экзона
CSL на текущий момент изучены мало. 20 кДа-СТГ и 22 кДа-СТГ, а также
многочисленные сплайс-варианты и продукты посттрансляционных модификаций
последнего обладают в целом схожими профилями активности. Однако действие 20 кДа-СТГ
вследствие его более устойчивой димеризации и замедленного клиренса может быть
пролонгировано, что потенциально увеличивает его вклад в общий эффект, несмотря
на значительно меньшие абсолютные количества [18].
Основное звено регуляции секреции
СТГ представлено пептидными гормонами соматолиберином (СРГ; соматотропин-рилизинг-гормон,
соматокринин) и соматостатином (ССТ, соматотропин-рилиз-ингибирующий фактор),
продуцируемыми (в пределах головного мозга) нейроэндокринными клетками
вентромедиального, дугообразного и перивентрикулярного ядер гипоталамуса. СРГ
оказывает стимулирующий эффект посредством активации G-белоксопряженного
рецептора GHRH-R, который дополнительно усиливает секрецию СРГ по механизму
положительной обратной связи. ССТ путем активации схожих по структуре
рецепторов SST-R ингибирует экзоцитоз везикул с СТГ, блокирует клеточный цикл и
стимулирует апоптоз соматотрофов, а также может подавлять транскрипцию генов
СТГ [19]. Эндогенным агонистом гипофизарных SST-R у человека также является нейропептид
кортистатин-17, обладающий структурным сходством с ССТ и продуцируемый
нейронами коры головного мозга и гиппокампа [20].
Продукция и секреция СТГ
соматотрофами также регулируются системой грелина/обестатина, образующихся в
ходе дифференциального протеолиза общего предшественника препрогрелина.
Октаноилированная форма грелина, поступающая из дугообразного ядра гипоталамуса
и периферической крови, посредством активации рецептора секретагогов СТГ-1a (GHS-R1a) стимулирует секрецию СРГ
гипоталамусом и СТГ — гипофизом. Вне центральной нервной системы в
постнатальном периоде грелин продуцируется желудком, кишечником, α- и β-клетками островков Лангерганса,
почечными клубочками, клетками Лейдига и Сертоли [21, 22]. Обестатин, продуцируемый
клетками желудка, тонкой кишки и слюнных желез, оказывает противоположное
влияние и устраняет эффекты грелина при введении в эквимолярных концентрациях
посредством взаимодействия с рецепторами GPR39, GHS-R1a и/или неустановленной мишенью [23].
Менее специфические стимулы,
вызывающие секрецию СТГ, включают гипогликемию, сон, физическую активность,
влияние глюкагона, андрогенов и тиреоидных гормонов, белка Клото, потребление
пищи, богатой белком и некоторыми аминокислотами (аргинин, лизин, глутамин,
орнитин). Уменьшение секреции происходит при повышении плазменных уровней
инсулина, глюкозы, эстрогенов, нейропептидов несфатинов, а также под действием
прямых эффекторов СТГ по принципу отрицательной обратной связи [22, 24].
Сигнальные пути и физиологические
эффекты звеньев соматотропной оси
Клетки-мишени СТГ
обнаружены практически во всех органах и тканях, включая нервную,
репродуктивную, иммунную, сердечно-сосудистую системы, почки, поджелудочную
железу, костную и мышечную ткани, кожу и ее производные, структуры глаза [22].
СТГ необходим для роста и поддержания величины и силы скелетных мышц, линейного
роста и минерализации костей, регуляции соотношения жировой и мышечной массы,
нейрогенеза, гемопоэза, роста волос, функционирования миокарда, сосудов, почек
и желез внешней секреции [25]. Генетически детерминированный абсолютный дефицит
СТГ у детей приводит к гипофизарному нанизму; относительный дефицит, или
резистентность к СТГ, обусловленная дисфункцией GHR и недостаточностью
продукции IGF1, носит название синдрома Ларона. Клиническая картина дефицита
СТГ у взрослых проявляется, помимо низкорослости, висцеральным ожирением,
гипер- и дислипидемией, инсулинорезистентностью, нарушением толерантности к
глюкозе [26, 27].
Биологическая активность
СТГ реализуется как напрямую, так и при участии специфических
белков-посредников — соматомединов. Рецептор СТГ (GH-R) при связывании лиганда
димеризуется, присоединяет и активирует янус-киназу-2 (JAK2) и в комплексе с
ней в фосфорилированном состоянии передает сигнал по нескольким основным путям:
1. Трансдукторы сигнала и активаторы
транскрипции (STAT) (преимущественно STAT5), регулирующие экспрессию большого
числа генов, среди которых — инсулиноподобный фактор роста 1 (IGF1; соматомедин С), о роли которого см.
далее.
2. Адаптерные белки семейства Shc и впоследствии киназы,
регулируемые внеклеточным сигналом (ERK1/2). Этот путь опосредует регуляцию
клеточного цикла, пролиферации, дифференцировки, ответа на стресс и апоптоза
путем изменения экспрессии протеинкиназ, белков цитоскелета, фосфолипаз и
дополнительных транскрипционных факторов [28, 29].
3. Субстрат-1 рецептора инсулина (IRS1), фосфатидилинозитол-3-киназа
(PI3K) и протеинкиназа-B (Akt). Последняя фосфорилирует и тем самым ингибирует гликогенсинтазу-3
(GSK3), что увеличивает относительную активность факторов транскрипции LAP и ATF4, стимулирующих дифференцировку
остеобластов и минерализацию костного матрикса, а также обладающих
антионкогенным эффектом [28, 30].
4. Сигнальный регуляторный белок α (SIRPα/SHPS1)
и нерецепторные тирозинфосфатазы SHP1/2. Нормальная активность SHP2, известной
также как PTPN11, необходима для протекания гемопоэза, клеточной миграции,
транскрипции, функционирования иммунных контрольных точек, регуляции клеточного
цикла, апоптоза и онкотрансформации. Кроме этого, SHP2-доменсодержащие белки
позволяют достичь полной возможной активности эффекторам вышеупомянутой оси
ERK1/2 [28, 31].
5. Адаптерный белок SH2B1, дополнительно повышающий
активность JAK2 и облегчающий рекрутирование ей различных нижележащих
сигнальных белков, а также модулирующий активность путей JAK1 и JAK3.
Посредством взаимодействия с JAK2, а также благодаря собственным свойствам
скаффолда SH2B1 оказывает положительное влияние на подвижность элементов
цитоскелета и способность клетки к адгезии и миграции [28].
СТГ также напрямую без
участия GHR активирует нерецепторные мембраноассоциированные тирозинкиназы
семейства Src (SFK), принимающие участие в регуляции пролиферации и
дифференцировки клеток, тканеобразования, эмбрионального развития, ангиогенеза,
воспаления, активации B-лимфоцитов и иных иммунных механизмов. В число полифункциональных
сигнальных молекул, активируемых SFK, входят с-Jun-N-терминальные киназы (JNK), STAT, ERK1/2 и PI3K [32].
Посредством активации STAT5b
СТГ индуцирует экспрессию инсулиноподобного фактора роста 1 (IGF1), обладающего прямым анаболическим и
пропролиферативным действием, реализуемым эндо-, пара- и аутокринным путями.
Циркулирующий пул IGF1 на 75% имеет происхождение в печени и на 25% — в мышечной, костной, хрящевой
и белой жировой тканях [33]. Основным биологически активным сплайс-вариантом
IGF1 является IGF1-Ea, однако для скелетных мышц особое значение имеет вариант
IGF1-Eс, известный также как механический фактор роста (MGF). MGF является одним из основных эффекторов
СТГ в хондроцитах эпифизарной пластинки в период роста костей, а также
стимулирует миграцию и пролиферацию миобластов в ходе репарации мышечной ткани
после интенсивных нагрузок и механического повреждения [34]. Кроме этого,
установлено, что в скелетных мышцах преобладает не сам IGF1, а его
предшественник про-IGF1 в свободной и гликозилированной формах, которые
облегчают связывание зрелого IGF1 с рецептором и пролонгируют его эффекты [35].
IGF2 также играет немаловажную роль в пре- и постнатальном развитии тканей
опорно-двигательного аппарата, однако его экспрессия находится вне контроля СТГ
[33].
Рецептор IGF1 (IGF1-R), имеющий высокую степень гомологии и
структурного сходства с рецептором инсулина (IR), обладает внутренней тирозинкиназной
активностью. При связывании с внеклеточным доменом агониста IGF1 фосфорилирует общие
с IR субстраты IRS1 и Shc, что усиливает
вышеописанную активацию путей PI3K/Akt и Shc/ERK1/2, вызванную СТГ напрямую. Экспрессию IGF1-R индуцируют внутриклеточные рецепторы
андрогенов и эстрогенов, негистоновый белок хроматина HMBA1, Krüppel-подобный фактор 6 (KLF6), факторы транскрипции E2F1 и c-Jun, угнетают — многие антионкогены и
онкосупрессоры, такие как p53, белок-1 опухоли Вильмса (WT1), супрессор фон Гиппеля
– Линдау (vHL), ген-1 рака молочной железы (BRCA1) [33].
Посредством
вышеперечисленных механизмов, а также путем паракринного сигналинга СТГ/IGF1
выступают в роли универсальных стимуляторов активации стволовых клеток, пролиферации,
дифференцировки, клеточной подвижности, ангиогенеза и тканеобразования. В
состоянии покоя и после потребления пищи СТГ проявляет анаболическое действие,
синергичное таковому инсулина, стимулирует биосинтез белка и аминокислот,
тормозит их расщепление и окисление, способствует формированию жировых и
гликогеновых депо [36]. При голодании и стрессе он оказывает контринсулярные
эффекты, направленные в первую очередь на сохранение безжировой массы и запасов
белка, включая активацию гликогенолиза, липолиза, β-окисления жирных кислот и
кетогенеза. Длительная экспозиция к высоким уровням СТГ (например, при
продолжающемся выраженном стрессе) создает условия для формирования
инсулинорезистентности за счет сдвига обмена в сторону расщепления липидов и замедления
утилизации глюкозы [36].
Абсолютный дефицит СТГ или
тканевая резистентность к нему могут сопровождаться индукцией миостатина
(фактора роста и дифференцировки-8) — секретируемого селективного ингибитора роста
и дифференцировки скелетных миоцитов [37]. Одновременно наблюдается угнетение
экспрессии и процессинга пептидного гормона иризина, обладающего пропролиферативным
эффектом и регулирующего энергетический обмен клеток скелетной мускулатуры и
жировой ткани [38]. Существуют данные в пользу необходимости IGF1 и/или его
нижележащих мишеней для поддержания нормальных уровней экспрессии миозина [39]
и транскрипционного фактора миогенина [40].
Адекватный сигналинг
СТГ/IGF1 также необходим для физиологического подавления активности
убиквитин-протеасомной клеточной системы и предупреждения избыточной деградации
скелетномышечных волокон. При угнетении пути IGF1/PI3K/Akt наблюдается повышение активности
транскрипционного фактора FOXO3, который, в свою очередь, индуцирует экспрессию
атрогина-1 (FBXO32) и MuRF1 (TRIM63) — специфичных для скелетных мышц убиквитинлигаз,
опосредующих деградацию внутриклеточных белков. Гиперактивация FOXO3 также ассоциирована с угнетением
активации и замедлением дифференцировки миосателлитов и увеличением скорости
апоптоза зрелых миоцитов [41, 42].
Соматотропная ось при старении,
болезнях печени и саркопении
В патогенезе старческой
саркопении важную роль играет снижение продукции ряда гормонов и факторов,
стимулирующих рост мышечной массы, включая СТГ, IGF1, MGF, грелин, тестостерон и
дегидроэпиандростерон, а также уменьшение соотношения СТГ/IGF1, что объединяется в понятие
соматопаузы. Для саркопении, ассоциированной с патологиями гепатобилиарной
системы, относительно бóльшее значение может иметь снижение продукции IGF1
вследствие поражения печени и нарушения ее функций [24, 43]. Кроме этого,
наблюдаемая при НАЖБП/НАСГ инсулинорезистентность и компенсаторная
гиперинсулинемия является важнейшим отрицательным регулятором активности СТГ и
IGF1 [44].
Секреция СРГ, ССТ и СТГ
носит пиковый (импульсный) характер, причем амплитуда и частота пиков
существенно изменяются в рамках циркадных ритмов, а также по мере взросления и
старения организма. Начиная с 30-летнего возраста среднесуточная секреция СТГ
уменьшается на 15% в течение каждых последующих 10 лет жизни, к 55 годам
снижаясь приблизительно до 25 мкг/кг/д, что составляет менее 20% от пиковых
значений, наблюдаемых в период пубертата. Возрастные изменения затрагивают преимущественно
амплитуду, но не частоту пиков секреции, и в первую очередь «сглаживают»
высокоамплитудные ночные пики [45], критически важные для роста скелетных мышц
[46].
В качестве возможных
механизмов снижения секреции СТГ с возрастом предложены уменьшение продукции
грелина и чувствительности к нему гипофиза, относительное усиление
отрицательной обратной связи через IGF1, снижение интенсивности нисходящей стимуляции
от гипоталамуса, а также относительное повышение активности ССТ. С учетом
наблюдаемого сохранения чувствительности соматотрофов как к СРГ, так и к IGF1
предполагается, что возрастное снижение секреции СТГ в целом носит
мультифакториальный характер и может иметь происхождение на уровнях выше
гипофиза [45]. Отмечается, что соматотрофы при старении становятся избирательно
менее восприимчивы к влиянию физической активности, что достаточно сложно для
диагностики в условиях клинической практики, но может вносить свой вклад в
развитие саркопении в долгосрочной перспективе [45].
В кровеносном русле
порядка 50% 22 кДа-СТГ находятся в депонированном состоянии за счет взаимодействия
с высокоаффинным СТГ-связывающим белком (GHBP), и еще от 5 до 20% — с
низкоаффинными вариантами GHBP. Имеются основания предполагать, что уровень
GHBP за счет замедления клиренса СТГ может прямо коррелировать с его тканевой
доступностью и, следовательно, общей биологической активностью [47]. После 60
лет плазменные концентрации GHBP линейно снижаются у лиц обоих полов [48],
однако у мужчин, по некоторым данным, снижение может начинаться на несколько
десятилетий раньше [49].
Старение ассоциировано с
уменьшением базальных уровней грелина, доли его ацилированной (активной) формы
и выраженности его постпрандиальной продукции, что не только вносит вклад в
формирование относительного СТГ-дефицита, но и обусловливает снижение аппетита
и, как следствие, поступление в организм питательных веществ [50, 51]. Уменьшение
плазменных уровней грелина также характерно для многих патологий печени,
включая НАЖБП, алкогольную болезнь печени (АБП), хронические вирусные гепатиты,
компенсированный и декомпенсированный цирроз. При этом между тяжестью поражения
печени и степенью дефицита грелина, как правило, отмечается двусторонняя прямая
корреляция и взаимное усугубление по мере прогрессирования заболевания [21, 52].
Продукция IGF1
демонстрирует наиболее заметное снижение в возрасте 21–50 лет, уменьшаясь в
среднем вдвое по сравнению с максимальными значениями к 30 годам, после чего
выходит на плато до 70 лет [53]. Циркулирующий IGF1 является маркером
нутритивного статуса, особенно у пожилых людей, и демонстрирует параболическую
корреляцию с индексом массы тела: как недостаток, так и избыток массы тела ассоциирован
со снижением концентрации IGF1 в крови [53]. У больных хроническими патологиями
печени, в т. ч. при пренеопластических изменениях и гепатоцеллюлярном раке
(ГЦР), наблюдается уменьшение тканевой экспрессии и сывороточных концентраций
IGF1, происходящее под влиянием провоспалительных цитокинов, реактивных форм
кислорода и азота и других возможных факторов [43].
У пожилых людей обнаружены
разнонаправленные изменения как общих уровней IGF-связывающих белков (IGFBP1-6),
осуществляющих транспорт и депонирование IGF1 [54], так и связывающей
способности их различных изоформ [55].
Абсолютный дефицит GHBP, IGF1, его основного белка-переносчика IGFBP3 и
вспомогательной связывающей субъединицы ALS может являться маркером старческой
саркопении, при этом не будучи характерным для гериатрических пациентов с
нормальной мышечной массой и функцией [56].
В отношении же уровней
перечисленных маркеров при хронических болезнях печени имеются неоднозначные
данные. Так, у больных стеатозом печени с ожирением наблюдается повышение сывороточных
концентраций GHBP и IGFBP-3 с одновременным
снижением пиков секреции СТГ и IGF1 и отсутствием значимых изменений со
стороны ALS [57]. НАСГ (по данным in vitro) был ассоциирован со значительным
угнетением трансляции и экспрессии IGF1 и IGFBP3 в гепатоцитах человека [43]. Экспериментальные
результаты позволяют предполагать, что пул IGF1 при этом может
перераспределяться в пользу активированных и гиперэкспрессирующих IGF1-R звездчатых клеток печени,
дополнительно стимулируя их пролиферацию и продукцию ими коллагена [58]. Кроме
этого, в исследованиях на грызунах было показано, что при прогрессии НАСГ может
иметь место усиливающийся сдвиг экспрессии в сторону изоформы IGF2, во взрослом
организме не являющейся основной для реализации эффектов СТГ, но обладающей
потенциальной стеато- и протоонкогенной активностью [43].
Прогрессия НАЖБП, и в
частности неалкогольного фиброза печени, в клинических исследованиях была
ассоциирована с увеличением сывороточных уровней IGFBP1 и IGFBP5 и
одновременным уменьшением соотношения IGF1/IGFBP3, отражающего тканевую
биодоступность IGF1 [43]. Обратная корреляция между IGF1/IGFBP3 и выраженностью
стеатоза печени, по-видимому, сохраняется вне зависимости от возраста, что
позволяет предполагать взаимоотягощающее влияние двух этих факторов у пожилых
пациентов с НАЖБП. Абсолютный дефицит IGF1, IGF2 и/или IGFBP3 является
предиктором прогрессии, декомпенсации, смерти и развития ГЦР у больных циррозом
печени, дефицит IGF1 — также смерти в раннем периоде после трансплантации
печени [43].
Наряду с
инсулинорезистентностью, гипераммониемией, хроническим воспалением и оксидативным
стрессом, дисрегуляция соматотропной оси рассматривается как один из основных
патогенетических механизмов, связывающих заболевания печени и саркопению [5, 12,
41, 59]. Уровни свободных СТГ и IGF1 демонстрируют обратную корреляцию как с
индексом стеатоза печени (FLI), так и с отношением TrFM/ASM (масса жировой ткани
на туловище/масса аппендикулярных скелетных мышц), отражающим тяжесть
саркопенического ожирения [60]. Сниженные концентрации IGF1 ассоциированы с
выраженностью саркопении и астенического синдрома при алкогольном гепатите [61],
а также дополнительно коррелируют с тяжестью остеодистрофии и могут быть
использованы в качестве предиктора асцита, печеночной энцефалопатии и смерти
при декомпенсированном алкогольном циррозе печени [62]. Данные клинических
исследований позволяют предположить, что аналогичные взаимосвязи справедливы и
для аутоиммунных холестатических заболеваний печени [63, 64].
Положительная
фармакологическая модуляция соматотропной оси
Современные подходы к
фармакологической модуляции соматотропной оси могут затрагивать различные ее уровни
от регуляции секреции СТГ гипофизом до реализации внутриклеточных сигнальных
путей через GH-R и IGF1-R. В нескольких доклинических
исследованиях на моделях НАЖБП и НАСГ была подтверждена эффективность
препаратов СТГ и IGF1 для уменьшения тяжести как поражения печени, так и
сопутствующей саркопении [65, 66]. Тем не менее сейчас соединения – модуляторы
соматотропной оси разрабатываются в первую очередь для коррекции СТГ-дефицита у
детей или взрослых; меньшее их число изначально позиционируется для коррекции
старческой слабости, саркопении и кахексии онкобольных [67].
Исторически первым
препаратом, используемым для лечения гипофизарного нанизма, был нативный СТГ,
экстрагируемый из трупных гипофизов человека, однако с 1985 г. его применение
было запрещено ввиду риска трансмиссии прионных заболеваний [68]. Нативная
форма была на время замещена рекомбинантным метионил-СТГ (соматремом), который,
в свою очередь, вышел из употребления с появлением биосинтетического СТГ (МНН
соматропин), идентичного эндогенному. В настоящий момент применяются за рубежом
биоинженерные аналоги, модификации и пролекарства СТГ соматрогон, сомапацитан,
соматропин пэгилированный, лонапэгсоматропин; в клинической разработке
находятся эфтансоматропин альфа (GX-H9) и др.[2] [69].
Использование СТГ для коррекции саркопении в исследованиях обеспечивало
значимое увеличение мышечной массы, однако демонстрировало минимальную
эффективность или ее отсутствие в отношении силы и функции скелетных мышц [70].
Рекомбинантный СРГ под
международным непатентованным наименованием (МНН) соматорелин применяется в Великобритании
в качестве диагностического средства для выявления дефицита СТГ (GHRH Ferring®) [3], а также
изучался в клинических исследованиях по ряду показаний, включая саркопению и
мышечную слабость, ассоциированные со старением [4].
Стабилизированное путем транс-3-гексеноилирования производное СРГ тезаморелин
(Egrifta SV®) зарегистрировано для лечения ВИЧ-ассоциированной липодистрофии [5], однако
также оценивается на предмет эффективности в отношении снижения физической
работоспособности у ослабленных ВИЧ-инфицированных больных [6]. Получены
и находятся на разных стадиях разработки функциональные фрагменты человеческого
и свиного СРГ, их модификации и биоконъюгаты, включая серморелин, рисморелин,
CJC-1295 и др.[7]
[71, 72].
Эффективность и
безопасность биосинтетического грелина (МНН леноморелин) как стимулятора
аппетита, набора массы тела и повышения физической работоспособности оцениваются
в клинических исследованиях I–III фаз при кахексии и саркопении у онкобольных, нервной анорексии и
старческой астении [8].
В группу синтетических агонистов GHS-R1a, известных также как миметики грелина
и СТГ-рилизинг-пептиды, входят несколько аналогов мет-энкефалина, лишенных
опиоидергической активности. GHRP-6 и его более селективное производное GHRP-2
(пралморелин) у здоровых молодых и пожилых добровольцев увеличивали секрецию
СТГ, превосходя по активности СРГ, однако их применение также сопровождалось
значимым выбросом пролактина, адренокортикотропного гормона и кортизола. Кроме
этого, как и в случае СРГ, их целевой эффект значительно уменьшался при
одновременном употреблении пищи, богатой углеводами и жирами, что потенциально
ограничивало их терапевтическую ценность [73, 74]. Пралморелин (GHRP Kaken 100®)
и псевдопептид мациморелин (Macrilen®) одобрены в различных странах
только для проведения диагностических проб на СТГ-дефицит [9]. Разработка
нескольких других пептидных миметиков грелина (эксаморелин, табиморелин,
ипаморелин, реламорелин) была прекращена, во многих случаях из-за
неудовлетворительного профиля безопасности, связанного с низкой тканевой селективностью [10] [26, 75].
К непептидным агонистам
GHS-R1a относятся ибутаморен, капроморелин, анаморелин, HM01 и др. [76]. Ибутаморен
(MK-677, LUM-201) способствовал сохранению и набору безжировой и общей массы
тела у здоровых добровольцев пожилого и старческого возраста, а также замедлял
резорбцию костной ткани у женщин с постменопаузальным остеопорозом в сочетании
с алендроновой кислотой. Капроморелин (Elura®) в клинических исследованиях, проведенных до его
регистрации в качестве ветеринарного препарата, повышал мышечную массу,
облегчал подъем по лестнице, увеличивал скорость и улучшал координацию в тесте
тандемной ходьбы у пожилых людей с нетяжелыми двигательными расстройствами [77].
Анаморелин (Adlumiz®) одобрен в Японии для коррекции кахексии у
больных злокачественными новообразованиями легких и пищеварительного тракта [78].
Агонисты IGF1-R включают рекомбинантный IGF1 мекасермин, используемый для
коррекции СТГ/IGF1-дефицита у детей, а также его пролонгированный комплекс с IGFBP3
мекасермин ринфабат, в настоящий момент не применяемый [11].
Разрабатываются альтернативные модуляторы сигналинга IGF1, в т. ч. по показанию
«саркопения» (TB682) [12]. Предполагается,
что IGF1-подобные препараты могут иметь сравнительно бóльшую терапевтическую
эффективность, чем СТГ или его миметики, поскольку хроническая экспозиция
скелетных мышц к супрафизиологическим уровням СТГ сопровождается развитием
локальной резистентности [79]. Наконец, в рамках противоположного подхода к
амплификации эффектов СТГ — блокады оси ССТ — разработан экспериментальный
антагонист SST-R5
SCO-240 [80].
Препараты
L-орнитина при
саркопении
@L-орнитин, L-орнитина
гидрохлорид
L-орнитин
(диаминовалериановая кислота) — заменимая двухосновная аминокислота, не
входящая в состав белков и присутствующая в организме человека в свободном
виде. L-орнитин
является лимитирующим фактором детоксификации аммиака с образованием
малотоксичной мочевины и L-аргинина в ходе т. н. цикла мочевины (орнитинового цикла) в
гепатоцитах. L-орнитин
также выступает в качестве субстрата для биосинтеза полиаминов (путресцина,
спермина, спермидина), участвует в обмене пролина, гидроксипролина, глутамина и
глутамата. При поражениях печени введение экзогенного L-орнитина позволяет восполнить его пул
для работы цикла мочевины и предупредить избыточную активацию альтернативного
пути утилизации аммиака — синтез глутамина, обладающий меньшей эффективностью и
побочными эффектами в виде гиперпродукции глутамата и обратного высвобождения
аммиака в кишечнике. L-орнитин также обладает косвенным антиоксидантным эффектом за счет
активации образования глутамата и впоследствии глутатиона [81, 82].
Доклиническими
исследованиями установлено, что L-орнитин косвенно стимулирует секрецию СТГ посредством
активации экспрессии и релиза грелина в двенадцатиперстной кишке. Сигнал
грелина в центральную нервную систему при этом преимущественно передается через
локальные GHS-R по афферентным окончаниям блуждающего нерва, в то время как его
плазменные и гипоталамические уровни могут изменяться лишь незначительно. Эффект
L-орнитина у крыс
значительно уменьшался при системной блокаде GHS-R, а также β-адренергических
рецепторов, которые являются важнейшим положительным регулятором релиза грелина
энтероэндокринными клетками [83–85], но не изменялся при введении антагонистов
соматостатина или GHRH [86]. Влияние L-орнитина на соматотропную ось подтверждается значимым стойким
увеличением плазменных уровней IGF1, продемонстрированным у здоровых
добровольцев (n
= 22) [87]. Важное значение для реализации его антисаркопенического действия также
может иметь повышение продукции L-аргинина и далее — оксида азота, что приводит к S-нитрозилированию и инактивации
кальпаина — Ca2+-регулируемого фермента, участвующего в протеолизе
миофибрилл [88].
У молодых крыс-самцов,
получавших корм с содержанием 0,5% или 0,7% L-орнитина гидрохлорида на протяжении
10 дней, наблюдали значимое увеличение плазменных уровней СТГ, прямо
коррелировавшее с интенсивностью биосинтеза белка в икроножной мышце, печени и
головном мозге [89]. При одинаковых массовых долях в рационе (0,7%) L-орнитин позволял достичь в 2 раза
бóльших пиковых концентраций СТГ и значимо большего удельного объема синтеза
белка по сравнению с L-аргинином [90]. Вышеописанные эффекты L-орнитина не наблюдались у
гипофизэктомированных крыс, что подтверждает гипотезу об их реализации
преимущественно за счет стимуляции секреции СТГ [91].
Потенциальные клинические эффекты
L-орнитина как
секретагога СТГ активно изучаются с последней четверти XX в. В 1972 г. M. Gourmelen et al. сообщили, что системное введение
орнитина гидрохлорида сопровождается повышением плазменных уровней СТГ, после
чего тест с L-орнитином
стал использоваться для выявления СТГ-дефицита в клинике наряду со
стимуляционными пробами с СРГ, глюкагоном и др. [92]. У детей от 4 до 14 лет с
конституциональной задержкой роста инфузионное введение L-орнитина гидрохлорида (12 г/м2
площади поверхности тела) сопровождалось значимым повышением уровней СТГ на
порядка 70% через 45 мин с приближением к базальным значениям к 90-й мин.
Параллельно фиксировалась аналогичная динамика концентраций кортизола с
предшествующим пиком выброса АКТГ; у подгруппы пациентов с пангипопитуитаризмом
эффекты L-орнитина
отсутствовали [93].
В исследованиях эффективности
L-орнитина как
секретагога СТГ у спортсменов и бодибилдеров при однократном введении получены
несколько противоречивые результаты. Так, прием внутрь 1,1 г L-орнитина + 0,75 г L-тирозина (~13,8 и ~9,4 мг/кг
соответственно [13])
натощак утром не приводил к значимым изменениям уровней циркулирующего СТГ в
течение 3 ч у мужчин-бодибилдеров (n = 7) [94]. Более высокие дозы (40, 100, 170 мг/кг внутрь)
у бодибилдеров-мужчин (n = 9) и женщин (n = 3) были ассоциированы с дозозависимым увеличением концентраций СТГ в
течение 1,5 ч, однако только наивысшая доза обеспечивала статистически значимый
эффект к моменту окончания исследования. Следует отметить, что прием 170 мг/кг L-орнитина также сопровождался
нежелательными явлениями в виде спастической боли в животе и диареи у всех участников
[95]. 100 мг/кг L-орнитина
гидрохлорида не влияли на сывороточные уровни СТГ у молодых здоровых
нетренированных мужчин (n = 10) при последующей нагрузке с отягощением [96].
Смешанные результаты были
также получены для комбинаций L-орнитина с другими аминокислотами, включая L-изомеры аргинина, лизина, фенилаланина,
метионина и др., что может объясняться малыми выборками и высокой
гетерогенностью как параметров участников, так и экспериментальных протоколов [97].
В проведенных исследованиях женщины, как правило, демонстрировали более
выраженный и воспроизводимый ответ на введение аминокислот в эквивалентных с
мужчинами дозах; сравнительно бóльшая эффективность препаратов была также
характерна для лиц младше 19 лет (ответ у 100%) по сравнению с участниками в
возрасте 20–29 (44%) и 30–71 лет (18%) [97].
Влияние длительного (5 нед.)
приема комбинации L-орнитина и L-аргинина (1 г + 2 г × 25 приемов) на
выносливость и объем мышечной массы у мужчин при высокоинтенсивных нагрузках
оценивалось в двойном слепом плацебо-контролируемом исследовании (n = 22). У добровольцев, получавших
аминокислоты, наблюдали значимо больший прирост мышечной массы, лучшую
переносимость нагрузок и меньшие концентрации гидроксипролина в моче, отражающие
скорость распада коллагена и резорбции костей [98]. В другом исследовании
схожего дизайна комбинация L-орнитина, L-аргинина и цианокобаламина (2.2 г + 3 г + 12 мг 2 р/д в
течение 3 нед.) значимо увеличивала плазменные уровни СТГ в период тренировки и
восстановления, но не покоя, и уровни IGF1 — во всех трех периодах у
профессиональных спортсменов (n = 17) при регулярных силовых тренировках. Кроме этого,
при приеме аминокислотной смеси наблюдалось снижение постнагрузочных уровней IGFBP3 и продукции молочной кислоты во
время выполнения нагрузок [99].
@L-орнитин-L-аспартат
Наиболее часто L-орнитин применяется в качестве
гепатопротекторного средства с первичным гипоаммониемическим эффектом в виде
средней соли с L-аспарагиновой кислотой (LOLA). L-аспартат дополнительно стимулирует
протекание реакций орнитинового цикла, принимает участие в биосинтезе азотистых
оснований, выступает в роли субстрата для образования интермедиатов цикла
трикарбоновых кислот и опосредует его сопряжение с электронтранспортной цепью
через малат-аспартатный челнок [82]. LOLA является базисным средством
патогенетической коррекции гипераммониемии при циррозе печени, НАЖБП и других
хронических патологиях органа, а также проявлений печеночной энцефалопатии у
больных с печеночной недостаточностью [100, 101]. Поскольку гипераммониемия
имеет прямую патогенетическую взаимосвязь с саркопенией, LOLA считается одним из наиболее
эффективных средств комплексной терапии последней наряду с рифаксимином [81, 102].
Курсовое пероральное
введение LOLA крысам с портокавальным анастомозом сопровождалось значимым уменьшением
гипераммониемии, экспрессии миостатина, маркеров клеточного стресса и
аутофагии, увеличением безжировой массы тела, силы хвата конечностями, массы и
диаметра мышечных волокон, восстановлением нормального соотношения волокон I и II типов [41]. На мышиной модели
саркопенического ожирения при НАСГ LOLA также способствовал набору безжировой
массы тела, увеличению силы хвата и среднего диаметра скелетномышечных волокон
[103]. У мутантных мышей foz/foz, страдающих генетически
детерминированными метаболическим синдромом, прогрессирующим НАСГ и фиброзом
печени, профилактическое (но не лечебное) введение LOLA уменьшало проявления миостеатоза и
способствовало сохранению мышечной функции в отсутствие значимых изменений со
стороны как обмена аммиака, так и морфологии печени [104].
У взрослых больных НАСГ
без сахарного диабета прием LOLA (60–80 мг/кг/д в течение 2 мес.) в
дополнение к соблюдению диеты и модификации образа жизни сопровождался
нормализацией активности печеночных ферментов и снижением доли атерогенных
фракций липидов крови, сопряженными со значимым повышением уровня
циркулирующего СТГ [105]. При различных хронических заболеваниях печени (НАЖБП,
ЦП) и гипераммониемии дополнительное назначение LOLA (9 г/д в течение 1 мес.) позволило
достичь значимо большего увеличения силы сжатия кисти и снижения общей тяжести
саркопении по данным опросника SARC-F, нежели только схемы базисной терапии [106].
По данным рандомизированного
плацебо-контролируемого клинического исследования, включившего 34 пациента с
компенсированным ЦП и минимальной печеночной энцефалопатией, прием LOLA (6 г 3 р/д в течение 3 мес.) был
ассоциирован со значимым увеличением толщины кожной складки над бицепсом и
повышением субъективно оцениваемого общего уровня энергии, однако не оказывал
влияния на толщину складок других локализаций, результаты кистевой динамометрии
и теста 6-минутной ходьбы [107]. В проспективном когортном исследовании с
участием 42 больных с гипераммониемией на фоне декомпенсированного ЦП курсовая
терапия LOLA (3 г 3 р/д в течение 3 мес.) способствовала росту объемов мышц плеча,
показателей силы квадрицепсов и результатов тестов на равновесие вне
зависимости от концентраций аммиака в капиллярной крови. Сила сжатия кисти в
результате лечения повышалась в большей степени у женщин, нежели у мужчин [108].
@L-орнитина α-кетоглутарат
Определенный интерес в
аспекте коррекции саркопении представляет L-орнитина α-кетоглутарат (оксоглутарат)
(OAKG), для которого показано наличие анаболического, иммуностимулирующего, антиостеопоротического
эффектов и положительного влияния на проницаемость кишечной стенки. Альфа-кетоглутарат
является ключевым интермедиатом цикла трикарбоновых кислот, одним из
неэнзиматических эндогенных антиоксидантов, предшественником цитруллина,
α-кетоизокапроата, глутамата и γ-аминомасляной кислоты, модулятором активности
лейкотриенов, обладает инсулин-сенситизирующей, актопротекторной,
антиостеосаркопенической и сенолитической активностью [109]. В качестве
возможных молекулярных механизмов действия α-кетоглутарата рассматриваются
повышение численности и стабильности β2-адренергических рецепторов
путем угнетения экспрессии пролилгидроксилазы-3, а также ингибирование
скелетномышечного протеолиза, вызываемого кортикостероидами [110].
В условиях животных
моделей ишемически-реперфузионного поражения печени и НАЖБП OAKG обладал
противовоспалительным, антистеатозным, антиадипогенным и гиполипидемическим действием
[111, 112]. В клинических исследованиях препарат использовался для уменьшения
гипераммониемии на терминальных стадиях печеночной недостаточности; его
эффективность в отношении печеночной энцефалопатии была невелика, однако
внимание на себя обращало значимое улучшение нутритивного статуса больных [113].
Предположительно, для коррекции остеосаркопении среди многочисленных эффектов
OAKG одними из важнейших могут быть стимуляция митохондриальной энергопродукции
и биосинтеза белка, обусловленных увеличением образования цитруллина из обоих
входящих в его состав компонентов. Кроме этого, OAKG способен повышать
эффективность расщепления и утилизации пищевых аминокислот в кишечнике,
улучшать кровоснабжение и функцию эндотелия сосудов скелетных мышц [109, 114].
В эксперименте на крысах
метаболические эффекты OAKG превосходили таковые α-кетоглутарата и L-орнитина по отдельности [114], что
может объясняться синергичным взаимодействием этих соединений как субстратов
синтеза глутамина, пролина и аргинина [113]. OAKG (350 мг/кг/д или 20 г/д) ускорял
рубцевание, репарацию и регенерацию тканей у пациентов с послеоперационными
ранами и ожогами, стимулировал аппетит и набор мышечной массы при синдроме
мальнутриции у пожилых людей [109, 115, 116]. Введение 350 мг/кг/д OAKG
парентерально в течение 3 дней после оперативного вмешательства на брюшной
полости позволило уменьшить потерю глутамина скелетными мышцами практически в 2
раза, не уступая по эффективности самому глутамину [117]. В двойном слепом
рандомизированном клиническом исследовании с участием 185 пожилых пациентов в
восстановительном периоде после острых заболеваний или хирургических операций
OAKG (10 г/д внутрь в течение 2 мес.) улучшал нутритивный статус, общий аппетит
и аппетит к мясным продуктам, стимулировал набор общей массы тела и повышал
качество жизни, однако не оказывал значимого влияния на величину окружности
плеча по сравнению с плацебо [118].
Основные механизмы
реализации эффектов соматотропной оси, ее регуляции и влияния на нее L-орнитина отражены на рисунке.
Рисунок. Основные механизмы функции
соматотропной оси, ее регуляции и влияния на нее L-орнитина
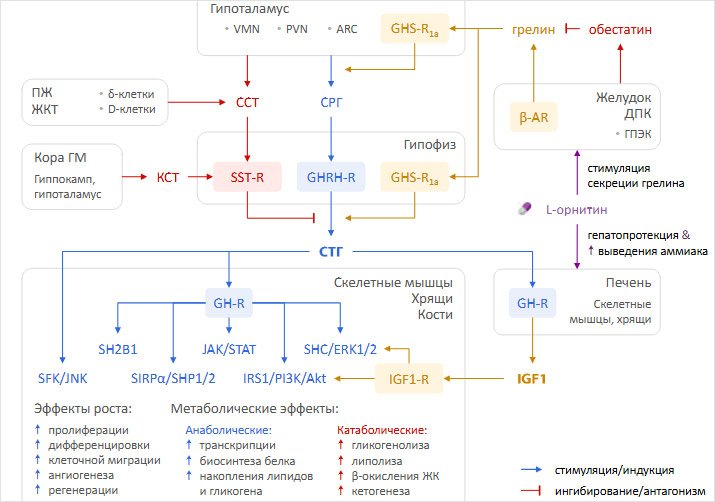
ГМ — головной мозг, ГПЭК — грелинпродуцирующие энтероэндокринные клетки, ДПК — двенадцатиперстная кишка, ЖК — жирные кислоты, ЖКТ — желудочно-кишечный тракт, КСТ — кортистатин, ПЖ — поджелудочная железа, СРГ — соматотропин-рилизинг-гормон, ССТ — соматостатин, СТГ — соматотропный гормон, Akt — протеинкиназа-B, AR — адренорецептор, ARC — дугообразное ядро, ERK1/2 — киназа-1/2, регулируемая внеклеточным сигналом, GH-R — рецептор соматотропного гормона, GHRH-R — рецептор соматотропин-рилизинг-гормона, GHS-R1a
— рецептор секретагогов соматотропного гормона-1a, IGF1 — инсулиноподобный фактор роста-1, IGF1-R — рецептор инсулиноподобного фактора роста-1, IRS1 — субстрат-1 рецептора инсулина, JAK — янус-киназа, JNK — c-Jun-N-терминальная киназа, PI3K — фосфатидилинозитол-3-киназа, PVN — перивентрикулярное ядро, SH2B1 — адаптерный белок SH2B1, SHC — Src-гомологичный домен-2-содержащий белок, SFK — киназа семейства Src, SHP1/2 — Src-гомологичный домен-2-содержащая фосфатаза-1, SIRPα — сигнальный регуляторный белок-α, SST-R — рецептор соматостатина, STAT — трансдуктор сигнала и активатор транскрипции, VMN — вентромедиальное ядро
Заключение
Несмотря на обширный
список экспериментальных препаратов с потенциальной эффективностью,
фармакологическая коррекция саркопении по настоящее время представляет собой
открытую проблему. Одним из современных подходов к ее решению является
положительная модуляция оси СТГ/IGF1, для которой предложен ряд соединений,
включая миметики СТГ, СРГ, грелина, агонисты IGF1-R, антагонисты ССТ. Для коррекции
саркопении и миостеатоза на фоне хронических патологий печени перспективным представляется
применение препаратов L-орнитина (гидрохлорида, L-аспартата, α-кетоглутарата), являющегося
секретагогом СТГ и стимулятором биосинтетических процессов, а также обладающего
гипоаммониемической, косвенной антиоксидантной и противовоспалительной
активностью. Данные доклинических и клинических исследований свидетельствуют о
том, что перечисленные анионы обладают синергизмом с L-орнитином и оказывают положительное
влияние на прирост безжировой массы тела, баланс биосинтеза белка и протеолиза,
кровоснабжение скелетной мускулатуры, репарацию и регенерацию тканей, нутритивный
статус, переносимость физических нагрузок и субъективно оцениваемый уровень
энергии больных. Возможности применения солей L-орнитина в режимах моно- и
политерапии для коррекции различных фенотипов саркопении при отдельных
патологиях печени требуют дальнейшего изучения.
[1] The United States Clinical Trial
Register. Available at: https://www.clinicaltrials.gov.
[2] The United States Food and Drug
Administration. FDA-Approved Drugs. Available at: https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm.
[3] UK Medicines & Healthcare
products Regulatory Agency. Available at: https://products.mhra.gov.uk.
[4] The United States Clinical Trial
Register. Three Month Treatment of Growth Hormone Releasing Hormone (GHRH) in
the Elderly. Available at: https://www.clinicaltrials.gov/study/NCT01410799.
[5] The United States Food and Drug
Administration. FDA-Approved Drugs. Available at: https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm.
[6] The United States Clinical Trial
Register. Tesamorelin as an Adjunct to Exercise for Improving Physical Function
in HIV (TRIUMPH). Available at: https://www.clinicaltrials.gov/study/NCT06554717.
[7] Sermorelin acetate: Summary
Report. 2020;
32 p. Available at: https://archive.hshsl.umaryland.edu/bitstream/handle/10713/14877/Sermorelin acetate_Final_2020_12.pdf.
[8] The United States Clinical Trial
Register. Individual Dose-escalated Bi-daily Subcutaneously (sc) Ghrelin in
Cancer Cachexia: a Phase I/II Study. Available at: https://www.clinicaltrials.gov/study/NCT00933361; The United States Clinical Trial
Register. Ghrelin With Anorexia Nervosa. Available at: https://www.clinicaltrials.gov/study/NCT00825461; The United States Clinical Trial
Register. Ghrelin Plus Strength Training in Frail Elderly Study. Available at: https://www.clinicaltrials.gov/study/NCT01898611.
[9] The United States Food and Drug
Administration. FDA-Approved Drugs. Available at: https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm.
[10] Japan Pharmaceuticals and Medical Devices Agency. List of
approved drugs (April 2004 to March 2024). Available at: https://www.pmda.go.jp/files/000269224.pdf.
[11] The United States Food and Drug
Administration. FDA-Approved Drugs. Available at: https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm.
[12] TwinPig BioLab. Clinical
Development: TB682 (previously TB796). Available at: http://twinpigbio.com/theme/business02/html/tb796.php.
[13] Рассчитано
на основании приведенных в источнике данных массы тела.
Список литературы / References
Развернуть
- Cruz-Jentoft AJ, Bahat G, Bauer J, Boirie Y, Bruyère O, Cederholm T et al. Sarcopenia: revised European consensus on definition and diagnosis. Age Ageing. 2019;48(1):16-31. https://doi.org/10.1093/ageing/afy169.
- Голоунина ОО, Фадеев ВВ, Белая ЖЕ. Современные рекомендации по диагностике саркопении. Клиническая медицина. 2023;101(4-5):198-207. https://doi.org/10.30629/0023-2149-2023-101-4-5-198-207.
- Мокрышева НГ, Крупинова ЮА, Володичева ВЛ, Мирная СС, Мельниченко ГА. Саркопения глазами эндокринолога. Остеопороз и остеопатии. 2019;22(4):19-26. https://doi.org/10.14341/osteo12465.
- Торопцова НВ, Феклистов АЮ. Патология костно-мышечной системы: фокус на саркопению и остеосаркопению. Медицинский совет. 2019;(4):78-86. https://doi.org/10.21518/2079-701X-2019-4-78-86.
- Адамова ИГ, Тараки БМ, Ибрагимова ГМ, Федоров ИГ, Мануйлова ОО, Пшенникова ИГ и др. Фенотипические особенности саркопении при жировой болезни печени. Эффективная фармакотерапия. 2024;20(18):86-92. Режим доступа: https://umedp.ru/articles/fenotipicheskie_osobennosti_sarkopenii_pri_zhirovoy_bolezni_pecheni.html.
- von Haehling S, Morley JE, Anker SD. An overview of sarcopenia: facts and numbers on prevalence and clinical impact. J Cachexia Sarcopenia Muscle. 2010;1(2):129-133. https://doi.org/10.1007/s13539-010-0014-2
- Petermann-Rocha F, Balntzi V, Gray SR, Lara J, Ho FK, Pell JP, CelisMorales C. Global prevalence of sarcopenia and severe sarcopenia: a systematic review and meta-analysis. J Cachexia Sarcopenia Muscle. 2022;13(1):86-99. https://doi.org/10.1002/jcsm.12783.
- Yuan S, Larsson SC. Epidemiology of sarcopenia: Prevalence, risk factors, and consequences. Metabolism. 2023;144:155533. https://doi.org/10.1016/j.metabol.2023.155533.
- Giri S, Anirvan P, Angadi S, Singh A, Lavekar A. Prevalence and outcome of sarcopenia in non-alcoholic fatty liver disease. World J Gastrointest Pathophysiol. 2024;15(1):91100. https://doi.org/10.4291/wjgp.v15.i1.91100.
- Sun X, Liu Z, Chen F, Du T. Sarcopenia modifies the associations of nonalcoholic fatty liver disease with all-cause and cardiovascular mortality among older adults. Sci Rep. 2021;11(1):15647. https://doi.org/10.1038/s41598-021-95108-1.
- Tuo S, Yeo YH, Chang R, Wen Z, Ran Q, Yang L et al. Prevalence of and associated factors for sarcopenia in patients with liver cirrhosis: A systematic review and meta-analysis. Clin Nutr. 2024;43(1):84-94. https://doi.org/10.1016/j.clnu.2023.11.008.
- Островская АС, Маевская МВ. Саркопения и мальнутриция у пациентов с заболеваниями печени. Медицинский совет. 2023;17(18):35-42. https://doi.org/10.21518/ms2023-374.
- Landi F, Cruz-Jentoft AJ, Liperoti R, Russo A, Giovannini S, Tosato M et al. Sarcopenia and mortality risk in frail older persons aged 80 years and older: results from ilSIRENTE study. Age Ageing. 2013;42(2):203-209. https://doi.org/10.1093/ageing/afs194.
- Салимов УР, Стома ИО, Федорук ДА, Ковалев АА, Щерба АЕ, Руммо ОО. Саркопения хронических болезней печени. Можем ли мы предвидеть осложнения? Трансплантология. 2022;14(4):408-420. https://doi.org/10.23873/2074-0506-2022-14-4-408-420.
- Cesari M, Bernabei R, Vellas B, Fielding RA, Rooks D, Azzolino D et al. Challenges in the Development of Drugs for Sarcopenia and Frailty - Report from the International Conference on Frailty and Sarcopenia Research (ICFSR) Task Force. J Frailty Aging. 2022;11(2):135-142. https://doi.org/10.14283/jfa.2022.30.
- Rolland Y, Dray C, Vellas B, Barreto PS. Current and investigational medications for the treatment of sarcopenia. Metabolism. 2023;149:155597. https://doi.org/10.1016/j.metabol.2023.155597.
- Dent E, Morley JE, Cruz-Jentoft AJ, Arai H, Kritchevsky SB, Guralnik J et al. International Clinical Practice Guidelines for Sarcopenia (ICFSR): Screening, Diagnosis and Management. J Nutr Health Aging. 2018;22(10):1148-1161. https://doi.org/10.1007/s12603-018-1139-9.
- Ribeiro de Oliveira Longo Schweizer J, Ribeiro-Oliveira A Jr, Bidlingmaier M. Growth hormone: isoforms, clinical aspects and assays interference. Clin Diabetes Endocrinol. 2018;4:18. https://doi.org/10.1186/s40842-018-0068-1.
- Ben-Shlomo A, Melmed S. Pituitary somatostatin receptor signaling. Trends Endocrinol Metab. 2010;21(3):123-133. https://doi.org/10.1016/j.tem.2009.12.003.
- de Lecea L, Criado JR, Prospero-Garcia O, Gautvik KM, Schweitzer P, Danielson PE et al. A cortical neuropeptide with neuronal depressant and sleep-modulating properties. Nature. 1996;381(6579):242-245. https://doi.org/10.1038/381242a0.
- Elaghori A, Salem PES, Azzam E, Abu Elfotoh N. Ghrelin level in patients with liver cirrhosis. Acta Endocrinol. 2019;15(1):62-68. https://doi.org/10.4183/aeb.2019.62.
- Devesa J. The Complex World of Regulation of Pituitary Growth Hormone Secretion: The Role of Ghrelin, Klotho, and Nesfatins in It. Front Endocrinol. 2021;12:636403. https://doi.org/10.3389/fendo.2021.636403.
- Hassouna R, Zizzari P, Tolle V. The ghrelin/obestatin balance in the physiological and pathological control of growth hormone secretion, body composition and food intake. J Neuroendocrinol. 2010;22(7):793-804. https://doi.org/10.1111/j.1365-2826.2010.02019.x.
- Булгакова СВ, Тренева ЕВ, Захарова НО, Горелик СГ. Старение и гормон роста: предположения и факты (обзор литературы). Клиническая лабораторная диагностика. 2019;64(12):708-715. https://doi.org/10.18821/0869-2084-2019-64-12-708-715.
- Ho KK, O’Sullivan AJ, Burt MG. The physiology of growth hormone (GH) in adults: translational journey to GH replacement therapy. J Endocrinol. 2023;257(2):e220197. https://doi.org/10.1530/JOE-22-0197.
- Луценко АС, Нагаева ЕВ, Белая ЖЕ, Чухачева ОС, Зенкова ТС, Мельниченко ГА. Современные аспекты диагностики и лечения СТГдефицита взрослых. Проблемы эндокринологии. 2019;65(5):373-388. https://doi.org/10.14341/probl10322.
- Дедов ИИ, Безлепкина ОБ, Панкратова МС, Нагаева ЕВ, Райкина ЕН, Петеркова ВА. Гормон роста - 30 лет клинической практики: прошлое, настоящее, будущее. Проблемы эндокринологии. 2024;70(1):4-12. https://doi.org/10.14341/probl13432.
- Carter-Su C, Schwartz J, Argetsinger LS. Growth hormone signaling pathways. Growth Horm IGF Res. 2016;28:11-15. https://doi.org/10.1016/j.ghir.2015.09.002.
- Ahmed SBM, Prigent SA. Insights into the Shc Family of Adaptor Proteins. J Mol Signal. 2017;12:2. https://doi.org/10.5334/1750-2187-12-2.
- Piwien-Pilipuk G, Van Mater D, Ross SE, MacDougald OA, Schwartz J. Growth hormone regulates phosphorylation and function of CCAAT/ enhancer-binding protein beta by modulating Akt and glycogen synthase kinase-3. J Biol Chem. 2001;276(22):19664-19671. https://doi.org/10.1074/jbc.M010193200.
- Welsh CL, Allen S, Madan LK. Setting sail: Maneuvering SHP2 activity and its effects in cancer. Adv Cancer Res. 2023;160:17-60. https://doi.org/10.1016/bs.acr.2023.03.003.
- Dehkhoda F, Lee CMM, Medina J, Brooks AJ. The Growth Hormone Receptor: Mechanism of Receptor Activation, Cell Signaling, and Physiological Aspects. Front Endocrinol. 2018;9:35. https://doi.org/10.3389/fendo.2018.00035.
- LeRoith D, Holly JMP, Forbes BE. Insulin-like growth factors: Ligands, binding proteins, and receptors. Mol Metab. 2021;52:101245. https://doi.org/10.1016/j.molmet.2021.101245.
- Liu Y, Duan M, Zhang D, Xie J. The role of mechano growth factor in chondrocytes and cartilage defects: a concise review. Acta Biochim Biophys Sin. 2023;55(5):701-712. https://doi.org/10.3724/abbs.2023086.
- Durzyńska J, Philippou A, Brisson BK, Nguyen-McCarty M, Barton ER. The pro-forms of insulin-like growth factor I (IGF-I) are predominant in skeletal muscle and alter IGF-I receptor activation. Endocrinology. 2013;154(3):1215-1224. https://doi.org/10.1210/en.2012-1992.
- Møller N, Jørgensen JO. Effects of growth hormone on glucose, lipid, and protein metabolism in human subjects. Endocr Rev. 2009;30(2):152-177. https://doi.org/10.1210/er.2008-0027.
- Liu W, Thomas SG, Asa SL, Gonzalez-Cadavid N, Bhasin S, Ezzat S. Myostatin is a skeletal muscle target of growth hormone anabolic action. J Clin Endocrinol Metab. 2003;88(11):5490-5496. https://doi.org/10.1210/jc.2003-030497.
- Huh JY, Panagiotou G, Mougios V, Brinkoetter M, Vamvini MT, Schneider BE, Mantzoros CS. FNDC5 and irisin in humans: I. Predictors of circulating concentrations in serum and plasma and II. mRNA expression and circulating concentrations in response to weight loss and exercise. Metabolism. 2012;61(12):1725-1738. https://doi.org/10.1016/j.metabol.2012.09.002.
- Matheny RW Jr, Nindl BC. Loss of IGF-IEa or IGF-IEb impairs myogenic differentiation. Endocrinology. 2011;152(5):1923-1934. https://doi.org/10.1210/en.2010-1279.
- Fang XB, Song ZB, Xie MS, Liu YM, Zhang WX. Synergistic effect of glucocorticoids and IGF-1 on myogenic differentiation through the Akt/GSK-3β pathway in C2C12 myoblasts. Int J Neurosci. 2020;130(11):1125-1135. https://doi.org/10.1080/00207454.2020.1730367.
- Kumar A, Davuluri G, Silva RNE, Engelen MPKJ, Ten Have GAM, Prayson R et al. Ammonia lowering reverses sarcopenia of cirrhosis by restoring skeletal muscle proteostasis. Hepatology. 2017;65(6):2045-2058. https://doi.org/10.1002/hep.29107.
- Gellhaus B, Böker KO, Schilling AF, Saul D. Therapeutic Consequences of Targeting the IGF-1/PI3K/AKT/FOXO3 Axis in Sarcopenia: A Narrative Review. Cells. 2023;12(24):2787. https://doi.org/10.3390/cells12242787.
- Adamek A, Kasprzak A. Insulin-Like Growth Factor (IGF) System in Liver Diseases. Int J Mol Sci. 2018;19(5):1308. https://doi.org/10.3390/ijms19051308.
- Joo SK, Kim W. Interaction between sarcopenia and nonalcoholic fatty liver disease. Clin Mol Hepatol. 2023;29(Suppl.):S68-S78. https://doi.org/10.3350/cmh.2022.0358.
- Hersch EC, Merriam GR. Growth hormone (GH)-releasing hormone and GH secretagogues in normal aging: Fountain of Youth or Pool of Tantalus? Clin Interv Aging. 2008;3(1):121-129. Available at: https://pubmed.ncbi.nlm.nih.gov/18488883.
- Zaffanello M, Pietrobelli A, Cavarzere P, Guzzo A, Antoniazzi F. Complex relationship between growth hormone and sleep in children: insights, discrepancies, and implications. Front Endocrinol. 2024;14:1332114. https://doi.org/10.3389/fendo.2023.1332114.
- Schilbach K, Bidlingmaier M. Growth hormone binding protein - physiological and analytical aspects. Best Pract Res Clin Endocrinol Metab. 2015;29(5):671-683. https://doi.org/10.1016/j.beem.2015.06.004.
- Maheshwari H, Sharma L, Baumann G. Decline of plasma growth hormone binding protein in old age. J Clin Endocrinol Metab. 1996;81(3):995-997. https://doi.org/10.1210/jcem.81.3.8772563.
- Hattori N, Kurahachi H, Ikekubo K, Ishihara T, Moridera K, Hino M et al. Effects of sex and age on serum GH binding protein levels in normal adults. Clin Endocrinol. 1991;35(4):295-297. https://doi.org/10.1111/j.1365-2265.1991.tb03539.x.
- Akamizu T, Murayama T, Teramukai S, Miura K, Bando I, Irako T et al. Plasma ghrelin levels in healthy elderly volunteers: the levels of acylated ghrelin in elderly females correlate positively with serum IGF-I levels and bowel movement frequency and negatively with systolic blood pressure. J Endocrinol. 2006;188(2):333-344. https://doi.org/10.1677/joe.1.06442.
- Di Francesco V, Fantin F, Residori L, Bissoli L, Micciolo R, Zivelonghi A et al. Effect of age on the dynamics of acylated ghrelin in fasting conditions and in response to a meal. J Am Geriatr Soc. 2008;56(7):1369-1370. https://doi.org/10.1111/j.1532-5415.2008.01732.x.
- Zhu J, Zhou T, Menggen M, Aimulajiang K, Wen H. Ghrelin regulating liver activity and its potential effects on liver fibrosis and Echinococcosis. Front Cell Infect Microbiol. 2024;13:1324134. https://doi.org/10.3389/fcimb.2023.1324134.
- Ильющенко АК, Мачехина ЛВ, Стражеско ИД, Ткачева ОН. Роль ИФР-1/СТГ в процессах старения и развитии возраст-ассоциированных заболеваний. Ожирение и метаболизм. 2023;20(2):149-157. https://doi.org/10.14341/omet12934.
- van den Beld AW, Carlson OD, Doyle ME, Rizopoulos D, Ferrucci L, van der Lely AJ, Egan JM. IGFBP-2 and aging: a 20-year longitudinal study on IGFBP-2, IGF-I, BMI, insulin sensitivity and mortality in an aging population. Eur J Endocrinol. 2019;180(2):109-116. https://doi.org/10.1530/eje-18-0422.
- Donahue LR, Hunter SJ, Sherblom AP, Rosen C. Age-related changes in serum insulin-like growth factor-binding proteins in women. J Clin Endocrinol Metab. 1990;71(3):575-579. https://doi.org/10.1210/jcem71-3-575.
- Ferrari U, Schmidmaier R, Jung T, Reincke M, Martini S, Schoser B et al. IGF-I/IGFBP3/ALS Deficiency in Sarcopenia: Low GHBP Suggests GH Resistance in a Subgroup of Geriatric Patients. J Clin Endocrinol Metab. 2021;106(4):e1698-e1707. https://doi.org/10.1210/clinem/dgaa972.
- Fusco A, Miele L, D’Uonnolo A, Forgione A, Riccardi L, Cefalo C et al. Nonalcoholic fatty liver disease is associated with increased GHBP and reduced GH/IGF-I levels. Clin Endocrinol. 2012;77(4):531-536. https://doi.org/10.1111/j.1365-2265.2011.04291.x.
- Svegliati-Baroni G, Ridolfi F, Di Sario A, Casini A, Marucci L, Gaggiotti G et al. Insulin and insulin-like growth factor-1 stimulate proliferation and type I collagen accumulation by human hepatic stellate cells: differential effects on signal transduction pathways. Hepatology. 1999;29(6):1743-1751. https://doi.org/10.1002/hep.510290632.
- Шептулина АФ, Джиоева ОН, Драпкина ОМ. Саркопения и неалкогольная жировая болезнь печени: общие патогенетические механизмы как возможные мишени терапии и профилактики. Профилактическая медицина. 2021;24(4):57-62. https://doi.org/10.17116/profmed20212404157.
- Poggiogalle E, Lubrano C, Gnessi L, Mariani S, Lenzi A, Donini LM. Fatty Liver Index Associates with Relative Sarcopenia and GH/IGF-1 Status in Obese Subjects. PLoS ONE. 2016;11(1):e0145811. https://doi.org/10.1371/journal.pone.0145811.
- Wadhawan A, Verma N, Kaur P, Garg P, Ralmilay S, Nadda RK et al. Sarcopenia, frailty and growth hormone-insulin like growth factor axis among decompensated and alcohol-associated hepatitis patients. J Clin Exp Hepatol. 2024;14(Suppl. 1):102013. https://doi.org/10.1016/j.jceh.2024.102013.
- Kaur P, Verma N, Wadhawan A, Garg P, Ralmilay S, Kalra N et al. Insulinlike Growth Factor-1 Levels Reflect Muscle and Bone Health and Determine Complications and Mortality in Decompensated Cirrhosis. J Clin Exp Hepatol. 2025;15(1):102402. https://doi.org/10.1016/j.jceh.2024.102402.
- Saeki C, Oikawa T, Kanai T, Nakano M, Torisu Y, Sasaki N et al. Relationship between osteoporosis, sarcopenia, vertebral fracture, and osteosarcopenia in patients with primary biliary cholangitis. Eur J Gastroenterol Hepatol. 2021;33(5):731-737. https://doi.org/10.1097/MEG.0000000000001791.
- Pugliese N, Arcari I, Aghemo A, Lania AG, Lleo A, Mazziotti G. Osteosarcopenia in autoimmune cholestatic liver diseases: Causes, management, and challenges. World J Gastroenterol. 2022;28(14):1430-1443. https://doi.org/10.3748/wjg.v28.i14.1430.
- Cabrera D, Cabello-Verrugio C, Solís N, San Martín D, Cofré C, Pizarro M et al. Somatotropic Axis Dysfunction in Non-Alcoholic Fatty Liver Disease: Beneficial Hepatic and Systemic Effects of Hormone Supplementation. Int J Mol Sci. 2018;19(5):1339. https://doi.org/10.3390/ijms19051339.
- Tanaka M, Kaji K, Nishimura N, Asada S, Koizumi A, Matsuda T et al. Blockade of angiotensin II modulates insulin-like growth factor 1-mediated skeletal muscle homeostasis in experimental steatohepatitis. Biochim Biophys Acta Mol Cell Res. 2024;1871(2):119649. https://doi.org/10.1016/j.bbamcr.2023.119649.
- Miller BS. What do we do now that the long-acting growth hormone is here? Front Endocrinol. 2022;13:980979. https://doi.org/10.3389/fendo.2022.980979.
- Laron Z. The Era of Cadaveric Pituitary Extracted Human Growth Hormone (1958-1985): Biological and Clinical Aspects. Pediatr Endocrinol Rev. 2018;16(Suppl. 1):11-16. https://doi.org/10.17458/per.vol16.2018.la.hghcadavericpituitary.
- Miller BS. What do we do now that the long-acting growth hormone is here? Front Endocrinol. 2022;13:980979. https://doi.org/10.3389/fendo.2022.980979.
- Шарашкина НВ, Рунихина НК, Ткачева ОН, Остапенко ВС, Дудинская ЕН. Распространенность, методы диагностики и коррекция саркопении у пожилых. Клиническая геронтология. 2016;22(3-4):46-51. Режим доступа: https://cyberleninka.ru/article/n/rasprostranennost-metodydiagnostiki-i-korrektsiya-sarkopenii-u-pozhilyh/viewer.
- Thompson WW, Anderson DB, Heiman ML. Biodegradable microspheres as a delivery system for rismorelin porcine, a porcine-growth-hormonereleasing-hormone. J Control Release. 1997;43(1):9-22. https://doi.org/10.1016/S0168-3659(96)01467-8.
- Teichman SL, Neale A, Lawrence B, Gagnon C, Castaigne JP, Frohman LA. Prolonged stimulation of growth hormone (GH) and insulin-like growth factor I secretion by CJC-1295, a long-acting analog of GH-releasing hormone, in healthy adults. J Clin Endocrinol Metab. 2006;91(3):799-805. https://doi.org/10.1210/jc.2005-1536.
- Arvat E, di Vito L, Maccagno B, Broglio F, Boghen MF, Deghenghi R et al. Effects of GHRP-2 and hexarelin, two synthetic GH-releasing peptides, on GH, prolactin, ACTH and cortisol levels in man. Comparison with the effects of GHRH, TRH and hCRH. Peptides. 1997;18(6):885-891. https://doi.org/10.1016/s0196-9781(97)00016-8.
- Camanni F, Ghigo E, Arvat E. Growth hormone-releasing peptides and their analogs. Front Neuroendocrinol. 1998;19(1):47-72. https://doi.org/10.1006/frne.1997.0158.
- Ishida J, Saitoh M, Ebner N, Springer J, Anker SD, von Haehling S. Growth hormone secretagogues: history, mechanism of action, and clinical development. JCSM Rapid Commun. 2020;3(1):25-37. https://doi.org/10.1002/rco2.9.
- Giorgioni G, Del Bello F, Quaglia W, Botticelli L, Cifani C, Micioni Di Bonaventura E et al. Advances in the Development of Nonpeptide Small Molecules Targeting Ghrelin Receptor. J Med Chem. 2022;65(4):3098-3118. https://doi.org/10.1021/acs.jmedchem.1c02191.
- Smith RG, Thorner MO. Growth Hormone Secretagogues as Potential Therapeutic Agents to Restore Growth Hormone Secretion in Older Subjects to Those Observed in Young Adults. J Gerontol A Biol Sci Med Sci. 2023;78(Suppl. 1):38-43. https://doi.org/10.1093/gerona/glad022.
- Wakabayashi H, Arai H, Inui A. The regulatory approval of anamorelin for treatment of cachexia in patients with non-small cell lung cancer, gastric cancer, pancreatic cancer, and colorectal cancer in Japan: facts and numbers. J Cachexia Sarcopenia Muscle. 2021;12(1):14-16. https://doi.org/10.1002/jcsm.12675.
- Consitt LA, Saneda A, Saxena G, List EO, Kopchick JJ. Mice overexpressing growth hormone exhibit increased skeletal muscle myostatin and MuRF1 with attenuation of muscle mass. Skelet Muscle. 2017;7(1):17. https://doi.org/10.1186/s13395-017-0133-y.
- Nishizaki H, Kagawa T, Sugama J, Kobayashi A, Moritoh Y, Watanabe M. Oral SSTR5 Antagonist SCO-240 for Growth Hormone Stimulation: A Phase I Single-Dose Study in Healthy Individuals. Clin Pharmacol Ther. 2024;115(6):1326-1335. https://doi.org/10.1002/cpt.3212.
- Butterworth RF. L-Ornithine L-Aspartate for the Treatment of Sarcopenia in Chronic Liver Disease: The Taming of a Vicious Cycle. Can J Gastroenterol Hepatol. 2019;2019:8182195. https://doi.org/10.1155/2019/8182195.
- Оковитый СВ, Приходько ВА, Безбородкина НН, Кудрявцев БН. Гепатопротекторы. 2-е изд. М.: ГЭОТАР-Медиа; 2022. 240 с. https://doi.org/10.33029/9704-6689-6-LIV-1-240.
- Zhao TJ, Sakata I, Li RL, Liang G, Richardson JA, Brown MS et al. Ghrelin secretion stimulated by {beta}1-adrenergic receptors in cultured ghrelinoma cells and in fasted mice. Proc Natl Acad Sci U S A. 2010;107(36):15868-15873. https://doi.org/10.1073/pnas.1011116107.
- Date Y. Ghrelin and the vagus nerve. Methods Enzymol. 2012;514:261-269. https://doi.org/10.1016/B978-0-12-381272-8.00016-7.
- Ho YY, Nakato J, Mizushige T, Kanamoto R, Tanida M, Akiduki S, Ohinata K. l-Ornithine stimulates growth hormone release in a manner dependent on the ghrelin system. Food Funct. 2017;8(6):2110-2114. https://doi.org/10.1039/c7fo00309a.
- Taniguchi E, Hattori A, Kurogi K, Hishida Y, Watanabe F, Furuse M, Yasuo S. Temporal patterns of increased growth hormone secretion in mice after oral administration of L-ornithine: possible involvement of ghrelin receptors. J Vet Med Sci. 2022;84(9):1283-1287. https://doi.org/10.1292/jvms.22-0125.
- Ito N, Seki S, Ueda F. Effects of Composite Supplement Containing Collagen Peptide and Ornithine on Skin Conditions and Plasma IGF-1 Levels-A Randomized, Double-Blind, Placebo-Controlled Trial. Mar Drugs. 2018;16(12):482. https://doi.org/10.3390/md16120482.
- Samengo G, Avik A, Fedor B, Whittaker D, Myung KH, Wehling-Henricks M, Tidball JG. Age-related loss of nitric oxide synthase in skeletal muscle causes reductions in calpain S-nitrosylation that increase myofibril degradation and sarcopenia. Aging Cell. 2012;11(6):1036-1045. https://doi.org/10.1111/acel.12003.
- Tujioka K, Yamada T, Aoki M, Morishita K, Hayase K, Yokogoshi H. Dietary ornithine affects the tissue protein synthesis rate in young rats. J Nutr Sci Vitaminol. 2012;58(4):297-302. https://doi.org/10.3177/jnsv.58.297.
- Suzumura S, Tujioka K, Yamada T, Yokogoshi H, Akiduki S, Hishida Y et al. Comparison of the Effects of Ornithine and Arginine on the Brain Protein Synthesis Rate in Young Rats. J Nutr Sci Vitaminol. 2015;61(5):417-421. https://doi.org/10.3177/jnsv.61.417.
- Tujioka K, Yamada T, Abiko H, Aoki M, Morishita K, Hayase K, Yokogoshi H. Effect of dietary ornithine on the brain protein synthesis rate in hypophysectomized aged rats. J Nutr Sci Vitaminol. 2012;58(5):346-353. https://doi.org/10.3177/jnsv.58.346.
- Gourmelen M, Donnadieu M, Schimpff RM, Lestradet H, Girard F. Effect of ornithine hydrochloride on growth hormone (HGH) plasma levels. Ann Endocrinol. 1972;33(5):526-528. Available at: https://pubmed.ncbi.nlm.nih.gov/4660448.
- Evain-Brion D, Donnadieu M, Roger M, Job JC. Simultaneous study of somatotrophic and corticotrophic pituitary secretions during ornithine infusion test. Clin Endocrinol. 1982;17(2):119-122. https://doi.org/10.1111/j.1365-2265.1982.tb01571.x.
- Lambert MI, Hefer JA, Millar RP, Macfarlane PW. Failure of commercial oral amino acid supplements to increase serum growth hormone concentrations in male body-builders. Int J Sport Nutr. 1993;3(3):298-305. https://doi.org/10.1123/ijsn.3.3.298.
- Bucci L, Hickson JF Jr, Pivarnik JM, Wolinsky I, McMahon JC, Turner SD. Ornithine ingestion and growth hormone release in bodybuilders. Nutr Res. 1990;10(3):239-245. https://doi.org/10.1016/S0271-5317(05)80265-9.
- Demura S, Yamada T, Yamaji S, Uchiyama M. L-ornithine hydrochloride ingestion increased carbohydrate oxidation but not lipid oxidation during submaximal endurance exercise following resistance exercise. Adv Biosci Biotechnol. 2013;4(1):81-88. https://doi.org/10.4236/abb.2013.41012.
- Chromiak JA, Antonio J. Use of amino acids as growth hormone-releasing agents by athletes. Nutrition. 2002;18(7-8):657-661. https://doi.org/10.1016/s0899-9007(02)00807-9.
- Elam RP, Hardin DH, Sutton RA, Hagen L. Effects of arginine and ornithine on strength, lean body mass and urinary hydroxyproline in adult males. J Sports Med Phys Fitness. 1989;29(1):52-56. Available at: https://pubmed.ncbi.nlm.nih.gov/2770269.
- Zajac A, Poprzecki S, Zebrowska A, Chalimoniuk M, Langfort J. Arginine and ornithine supplementation increases growth hormone and insulinlike growth factor-1 serum levels after heavy-resistance exercise in strength-trained athletes. J Strength Cond Res. 2010;24(4):1082-1090. https://doi.org/10.1519/JSC.0b013e3181d321ff.
- Лазебник ЛБ, Голованова ЕВ, Алексеенко СА, Буеверов АО, Плотникова ЕЮ, Долгушина АИ и др. Российский консенсус «Гипераммониемии у взрослых» (Версия 2021). Экспериментальная и клиническая гастроэнтерология. 2021;(12):154-172. https://doi.org/10.31146/1682-8658-ecg-196-12-154-172.
- Ивашкин ВТ, Драпкина ОМ, Маевская МВ, Райхельсон КЛ, Оковитый СВ, Жаркова МС и др. Клинические рекомендации Российского общества по изучению печени, Российской гастроэнтерологической ассоциации, Российского общества профилактики неинфекционных заболеваний, Российской ассоциации эндокринологов, Российского научного медицинского общества терапевтов, Национального общества профилактической кардиологии, Российской ассоциации геронтологов и гериатров по неалкогольной жировой болезни печени. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2025;35(1):94-152. https://doi.org/10.22416/1382-4376-2025-35-1-94-152.
- Надинская МЮ, Маевская МВ, Бакулин ИГ, Бессонова ЕН, Буеверов АО, Жаркова МС и др. Диагностическое и прогностическое значение гипераммониемии у пациентов с циррозом печени, печеночной энцефалопатией и саркопенией (соглашение специалистов). Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2024;34(1):85-100. https://doi.org/10.22416/1382-4376-2024-34-1-85-100.
- Wang ZX, Wang MY, Yang RX, Zhao ZH, Xin FZ, Li Y et al. Ammonia Scavenger Restores Liver and Muscle Injury in a Mouse Model of Nonalcoholic Steatohepatitis With Sarcopenic Obesity. Front Nutr. 2022;9:808497. https://doi.org/10.3389/fnut.2022.808497.
- Pichon C, Nachit M, Gillard J, Vande Velde G, Lanthier N, Leclercq IA. Impact of L-ornithine L-aspartate on non-alcoholic steatohepatitisassociated hyperammonemia and muscle alterations. Front Nutr. 2022;9:1051157. https://doi.org/10.3389/fnut.2022.1051157.
- Сас ЕИ, Барнакова ВА. Гормональная активность скелетной мускулатуры и неалкогольная жировая болезнь печени. Медицинский алфавит. 2020;(17):31-34. https://doi.org/10.33667/2078-5631-2020-17-31-34.
- Мязин РГ. Изучение эффективности и безопасности применения L-орнитина-L-аспартата при лечении хронических заболеваний печени, осложненных развитием гипераммониемии и саркопении: результаты клинического исследования. Терапия. 2024;10(8 Suppl.):223. Режим доступа: https://therapy-journal.ru/ru/archive/article/45928.
- Pasha Y, Taylor-Robinson S, Leech R, Ribeiro I, Cook N, Crossey M, Marcinkowski H. PWE-091 L-ornithine l-aspartate in minimal hepatic encephalopathy: possible effects on the brain-muscle axis? Gut. 2018;67(Suppl. 1):A117-A118. https://doi.org/10.1136/gutjnl-2018-BSGAbstracts.233.
- Островская АС, Маевская МВ, Лобан КМ, Жаркова МС, Шапка МП, Васильцова ЕА и др. Возможности лечения саркопении при циррозе печени гипоаммониемическими средствами. Медицинский совет. 2024;18(15):51-60. https://doi.org/10.21518/ms2024-383.
- Walrand S. Role of ornithine α-ketoglutarate in sarcopenia. Nutr Clin Métab. 2009;23(3):137-148. https://doi.org/10.1016/j.nupar.2009.06.005.
- Cai X, Yuan Y, Liao Z, Xing K, Zhu C, Xu Y et al. α-Ketoglutarate prevents skeletal muscle protein degradation and muscle atrophy through PHD3/ ADRB2 pathway. FASEB J. 2018;32(1):488-499. https://doi.org/10.1096/fj.201700670r.
- Schuster H, Blanc MC, Genthon C, Thérond P, Bonnefont-Rousselot D, Le Tourneau A et al. Does dietary ornithine alpha-ketoglutarate supplementation protect the liver against ischemia-reperfusion injury? Clin Nutr. 2005;24(3):375-384. https://doi.org/10.1016/j.clnu.2004.12.002.
- Nagaoka K, Mulla J, Cao K, Cheng Z, Liu D, Mueller W et al. The metabolite, alpha-ketoglutarate inhibits non-alcoholic fatty liver disease progression by targeting lipid metabolism. Liver Res. 2020;4(2):94-100. https://doi.org/10.1016/j.livres.2020.04.001.
- Cynober L. Ornithine alpha-ketoglutarate as a potent precursor of arginine and nitric oxide: a new job for an old friend. J Nutr. 2004;134(10 Suppl.):2858S-2895S. https://doi.org/10.1093/jn/134.10.2858s.
- Jeevanandam M, Holaday NJ, Petersen SR. Ornithine-alpha-ketoglutarate (OKG) supplementation is more effective than its component salts in traumatized rats. J Nutr. 1996;126(9):2141-2150. https://doi.org/10.1093/jn/126.9.2141.
- Wernerman J, Hammarqvist F, von der Decken A, Vinnars E. Ornithinealpha-ketoglutarate improves skeletal muscle protein synthesis as assessed by ribosome analysis and nitrogen use after surgery. Ann Surg. 1987;206(5):674-680. https://doi.org/10.1097/00000658-198711000-00020.
- Donati L, Ziegler F, Pongelli G, Signorini MS. Nutritional and clinical efficacy of ornithine alpha-ketoglutarate in severe burn patients. Clin Nutr. 1999;18(5):307-311. Available at: https://pubmed.ncbi.nlm.nih.gov/10601539.
- Wernerman J, Hammarkvist F, Ali MR, Vinnars E. Glutamine and ornithinealpha-ketoglutarate but not branched-chain amino acids reduce the loss of muscle glutamine after surgical trauma. Metabolism. 1989;38(Suppl. 1):63-66. https://doi.org/10.1016/0026-0495(89)90144-3.
- Brocker P, Vellas B, Albarede JL, Poynard T. A two-centre, randomized, double-blind trial of ornithine oxoglutarate in 194 elderly, ambulatory, convalescent subjects. Age Ageing. 1994;23(4):303-306. https://doi.org/10.1093/ageing/23.4.303.
Фото:
Shutterstoсk/FOTODOM



 1
1 2
2 3
3 4
4


Комментарии (0)