
Фото: Svitlana Hulko/FOTODOM/Shutterstoсk
Журнал "Медицинский совет" №11/2025
DOI: 10.21518/ms2025-252
И.Н. Захарова1, О.В. Зайцева2, Е.С. Феденко3, А.Н. Пампура1,4, Н.Н. Мурашкин5,6,7, В.В. Пупыкина1
1 Российская медицинская академия непрерывного профессионального образования; 125993, Россия, Москва, ул. Баррикадная, д. 2/1, стр. 1
2 Российский университет медицины (РосУниМед); 127006, Россия, Москва, ул. Долгоруковская, д. 4
3 Государственный научный центр «Институт иммунологии» Федерального медико-биологического агентства; 115478, Россия, Москва, Каширское шоссе, д. 24
4 Научно-исследовательский клинический институт педиатрии и детской хирургии имени академика Ю.Е. Вельтищева Российского национального исследовательского медицинского университета имени Н.И. Пирогова; 125412, Россия, Москва, ул. Талдомская, д. 2
5 Национальный медицинский исследовательский центр здоровья детей; 119926, Россия, Москва, Ломоносовский проспект, д. 2, стр. 1
6 Центральная государственная медицинская академия Управления делами Президента Российской Федерации; 121359, Россия, Москва, ул. Маршала Тимошенко, д. 19, стр. 1А
7 Первый Московский государственный медицинский университет имени И.М. Сеченова (Сеченовский Университет); 119048, Россия, Москва, ул. Трубецкая, д. 8, стр. 2
У новорожденных и детей раннего возраста кожа отличается относительной морфофункциональной незрелостью, сниженной степенью дифференцировки структурных элементов и толщиной эпидермального и дермального слоев, вследствие чего наблюдается повышенная восприимчивость к воздействию экзогенных факторов и повышенный риск проникновения патогенов, что увеличивает вероятность развития инфекционных и воспалительных процессов. Пеленочный дерматит является распространенным воспалительным заболеванием кожи, которое значительно снижает качество жизни ребенка и его родителей. Основными симптомами являются покраснение, отечность и дискомфорт в области подгузника. Эффективное лечение и профилактика пеленочного дерматита требуют восстановления и укрепления кожного барьера, а также обеспечения достаточного увлажнения кожи. В данной статье рассматриваются анатомо-физиологические особенности кожи новорожденных и детей раннего возраста, определяющие ее повышенную чувствительность и уязвимость к внешним воздействиям. Подробно анализируются факторы, способствующие развитию пеленочного дерматита, включая повышенную влажность, трение, воздействие мочи и кала, а также нарушение барьерной функции кожи. Особое внимание уделено профилактике и лечению пеленочного дерматита при использовании средств, обладающих барьерными свойствами, в частности эмолентов. Основная задача эмолентов – восстановление липидного барьера кожи, ее питание и глубокое увлажнение, обогащение необходимыми липидами и аминокислотами, уменьшение раздражения и зуда, придание мягкости и эластичности детской коже. Современные технологии позволили усилить восстанавливающую барьерную функцию эпидермиса за счет использования средств с регенеративным потенциалом – эмолентов-плюс, содержащих не только увлажняющие и смягчающие компоненты, но и дополнительные ингредиенты, такие как пребиотики, антиоксиданты и противовоспалительные вещества, для профилактики и лечения пеленочного дерматита.
Для цитирования: Захарова ИН, Зайцева ОВ, Феденко ЕС, Пампура АН, Мурашкин НН, Пупыкина ВВ. Роль эмолентов-плюс при пеленочном дерматите. Медицинский Совет. 2025;(11):123-132. https://doi.org/10.21518/ms2025-252
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
The role of emollients is a plus in diaper dermatitis
Irina N. Zakharova1, Olga V. Zaytseva2, Elena S. Fedenko3, Alexander N. Pampura1,4, Nikolay N. Murashkin5,6,7, Viktoria V. Pupykina1
1 Russian Medical Academy of Continuous Professional Education; 2/1, Bldg. 1, Barrikadnaya St., Moscow, 125993, Russia
2 Russian University of Medicine (ROSUNIMED); 4, Dolgorukovskaya St., Moscow, 127006, Russia
3 National Research Center – Institute of Immunology, Federal Medical-Biological Agency of Russia; 24, Kashirskoye Shosse, Moscow, 115478, Russia
4 Veltischev Research and Clinical Institute for Pediatrics and Pediatric Surgery of the Pirogov Russian National Research Medical University; 2, Taldomskaya St., Moscow, 125412, Russia
5 National Medical Research Center for Children's Health; 2, Bldg. 1, Lomonosovsky Ave., Moscow, 119926, Russia 6 Central State Medical Academy of Department for Presidential Affairs of the Russian Federation; 19, Bldg. 1А, Marshal Timoshenko St., Moscow, 121359, Russia
7 Sechenov First Moscow State Medical University (Sechenov University); 8, Bldg. 2, Trubetskaya St., Moscow, 119048, Russia
In newborns and young children, the skin is characterized by relative morphofunctional immaturity, a reduced degree of differentiation of structural elements and the thickness of the epidermal and dermal layers, resulting in increased susceptibility to exogenous factors and an increased risk of pathogens, which increases the likelihood of infectious and inflammatory processes. Diaper dermatitis is a common inflammatory skin disease that significantly reduces the quality of life of the child and his parents. The main symptoms are redness, swelling and discomfort in the diaper area. Effective treatment and prevention of diaper dermatitis require restoration and strengthening of the skin barrier, as well as ensuring sufficient skin hydration. This article examines the anatomical and physiological features of the skin of newborns and young children that determine its increased sensitivity and vulnerability to external influences. The factors contributing to the development of diaper dermatitis are analyzed in detail, including increased humidity, friction, exposure to urine and feces, as well as a violation of the barrier function of the skin. Particular attention is paid to the role of emollients-plus – modern products containing not only moisturizing and softening components, but also additional ingredients such as prebiotics, antioxidants and anti-inflammatory substances for the prevention and treatment of diaper dermatitis.
For citation: Zakharova IN, Zaytseva OV, Fedenko ES, Pampura AN, Murashkin NN, Pupykina VV. The role of emollients is a plus in diaper dermatitis. Meditsinskiy sovet = Medical Council. 2025;(11):123-132. (In Russ.) https://doi.org/10.21518/ms2025-252
Conflict of interest: the authors declare no conflict of interest.
Введение
Самым крупным, постоянно самообновляющимся, сложным и полифункциональным органом человека является кожа, которая покрывает поверхность тела и отделяет ее от внешнего мира. Основными функциями кожи являются:
1) терморегуляция: участие в поддержании постоянной температуры тела посредством теплоотдачи и потоотделения;
2) сенсорное восприятие: обеспечение чувствительности к различным раздражителям благодаря наличию многочисленных нервных окончаний;
3) газообмен: участие в дыхании через поглощение кислорода и выделение углекислого газа;
4) поддержание водно-электролитного баланса: регуляция содержания воды и электролитов в организме через процессы потоотделения;
5) иммунологическая защита: предотвращение проникновения патогенных микроорганизмов и участие в иммунных реакциях;
6) физическая защита: обеспечение механической защиты внутренних органов от внешних воздействий.
Площадь кожного покрова изменяется с возрастом: у новорожденных она составляет около 0,25 м², к концу первого года жизни увеличивается до 0,43 м², а у взрослого человека достигает 1,5–2 м² [1].
Анатомо-физиологичекие характеристики кожи новорожденного
Кожа представляет собой самый большой сенсорный орган и играет важную роль в становлении аффективной связи между матерью и ребенком в ранний постнатальный период [2].
Формирование кожи плода представляет собой поэтапный процесс, включающий последовательные этапы развития. На 4-й нед. эмбриогенеза кожный покров состоит из перидермы и базального эпителия, выполняющих защитную функцию по отношению к воздействию амниотической жидкости [3, 4]. В период с 5-й по 8-ю нед. в базальном слое закладываются меланоциты – клетки, ответственные за пигментообразование. К 8–11-й нед. гестации формируется шиповатый слой кератиноцитов. Начиная с 9-й нед. развивается система волосяных фолликулов. С 12-й по 16-ю нед. кожный покров состоит из двух шиповатых слоев, базальной мембраны, десмосомных соединений и развивающихся волосяных фолликулов. На последующих этапах формируется зернистый слой, а начиная с 23-й нед. перидерма замещается роговым слоем. Полный морфогенез эпидермиса завершается к 26-й нед. внутриутробного развития [5].
У новорожденных и детей грудного возраста кожа характеризуется рядом морфологических и функциональных особенностей, отличающихся от кожных структур взрослого организма [6]. Так, коллагеновые волокна дермы младенцев более однородны по размеру, равномерно распределены и имеют менее выраженную плотность. Поверхностный кожный микрорельеф представлен более тесно расположенной сетью линий по сравнению с кожей взрослого человека.
Эпидермис новорожденного включает базальный слой, 2–3 слоя шиповатых клеток, зернистый слой и 5–6 рядов слабосвязанных роговых клеток. Несмотря на наличие всех основных слоев, эпидермис остается морфологически незрелым, что отражается на барьерной функции. Клетки зернистого слоя характеризуются более высокой плотностью укладки. Роговой слой представлен несколькими рядами корнеоцитов, соединенных между собой слабыми межклеточными связями, что способствует их легкому физиологическому слущиванию [7–9].
Пограничная структура между эпидермисом и дермой (дермоэпидермальный переход) отличается сглаженностью, а базальная мембрана эпителия состоит из четырех слабо дифференцированных субкомпонентов. Подобное строение обуславливает слабую устойчивость соединения эпидермиса с дермой и предрасположенность к развитию отдельных форм буллезных дерматозов [10].
Дерма у новорожденных и грудных детей представлена недостаточно сформированными слоями, имеет преимущественно клеточное строение – преобладают недифференцированные и тучные клетки. Из-за отсутствия выраженного ретикулярного слоя дерма остается мягкой и тонкой. В верхних отделах дермы обнаруживаются рыхлые соединительнотканные структуры, преимущественно состоящие из малодифференцированных клеток и тонких коллагеновых волокон, в то время как в более глубоких слоях преобладают зрелые фибробласты и более массивные коллагеновые пучки. Для кожи новорожденного характерна высокая гидрофильность тканей, что способствует усиленному накоплению влаги и электролитов в эпидермально-дермальном комплексе. Это определяет особенности водно-солевого обмена и адаптационные механизмы кожного барьера новорожденного в постнатальном периоде [9].
К моменту рождения эпидермальный барьер кожи обладает способностью противостоять воздействиям внешней (внеутробной) среды, однако его структурно-функциональное созревание продолжается на протяжении первых лет жизни [11].
Для кожи младенцев характерны повышенные показатели трансэпидермальной потери влаги (ТЭПВ), а также сниженное содержание натурального увлажняющего фактора (NMF). Эти физиологические особенности свидетельствуют о функциональной незрелости и ограниченной эффективности кожного барьера в раннем постнатальном периоде [12].
Важнейшим компонентом системы кожной защиты является кислотная мантия – поверхностная пленка, состоящая из кожного сала, пота и органических кислот. Кислая среда на поверхности кожи регулирует микробиоценоз, ограничивая рост патогенной микрофлоры, а также оказывает влияние на активность рН-чувствительных ферментов, задействованных в синтезе и реорганизации межклеточного липидного матрикса – ключевого звена эпидермального барьера проницаемости [12].
Компоненты эпидермального барьера и их значение для поддержания здоровья кожи
Эпидермальный барьер характеризуется рядом адаптивных морфофункциональных особенностей, которые формируют основу его защитной способности и обеспечивают поддержание физиологического уровня гидратации кожного покрова [13].
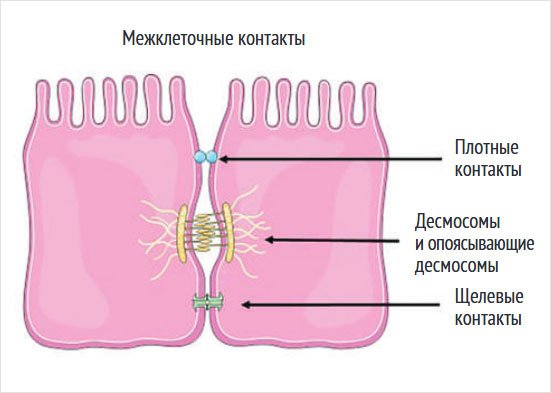
Плотные контакты и десмосомы обеспечивают прочную межклеточную адгезию между кератиноцитами, способствуя герметизации межклеточного пространства (рис. 1) [14]. Эти структуры ограничивают парацеллюлярный транспорт, осуществляя селективную блокаду диффузии макромолекул и жидкостей, что обеспечивает снижение ТЭПВ и поддержание водного гомеостаза в роговом слое [13].
Рисунок 1. Межклеточные контакты: плотные контакты и десмосомы [14]
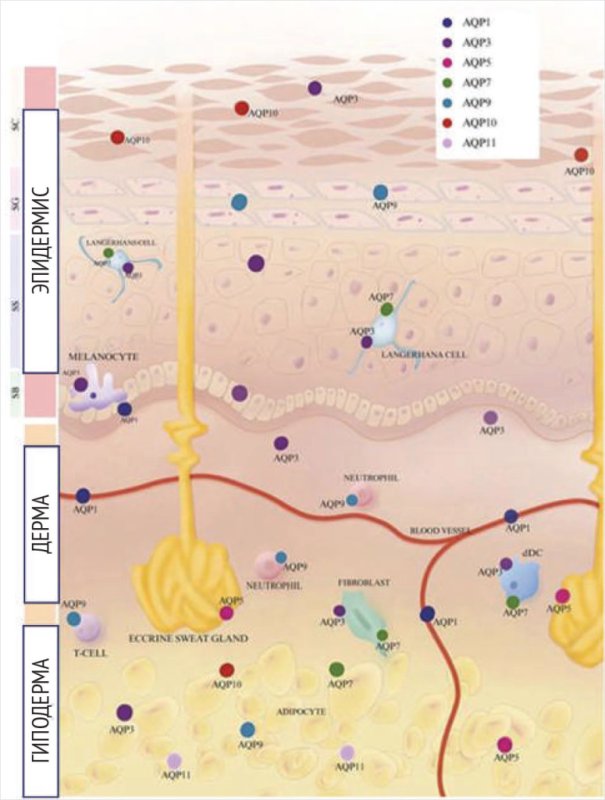
Аквапорины – трансмембранные белки, выполняющие функцию высокоселективных водных каналов, локализованных в мембранах метаболически активных кератиноцитов. В терминально дифференцированных клетках рогового слоя – корнеоцитах – аквапорины практически отсутствуют, что дополнительно ограничивает ТЭПВ, способствуя сохранению барьерной функции кожи (рис. 2) [15].
Рисунок 2. Экспрессия аквапоринов в коже (адаптировано из [15])
Корнеоциты содержат натуральный увлажняющий фактор – комплекс низкомолекулярных высокогидрофильных соединений, способных абсорбировать влагу из окружающей среды и удерживать ее внутри рогового слоя [13].
Липидный барьер. Между корнеоцитами располагается организованная система межклеточных липидов, образующих структурированную ламеллярную сеть, которая выполняет функцию липидного барьера – одного из основных компонентов эпидермального проницаемого барьера. Эта структура регулирует бифазный (двунаправленный) транспорт веществ через роговой слой: как ТЭПВ, так и проникновение экзогенных субстанций. Благодаря своей организации липидный барьер избирательно проницаем для низкомолекулярных липофильных соединений и практически непроницаем для гидрофильных субстанций и водных растворов. Функциональная целостность липидного барьера обеспечивает эффективный контроль за потерей влаги, поддержание физиологического уровня увлажненности рогового слоя, а также препятствует проникновению в организм потенциально вредных веществ извне (рис. 3) [1] [16].
Рисунок 3. Структура межклеточных липидных бислоев*
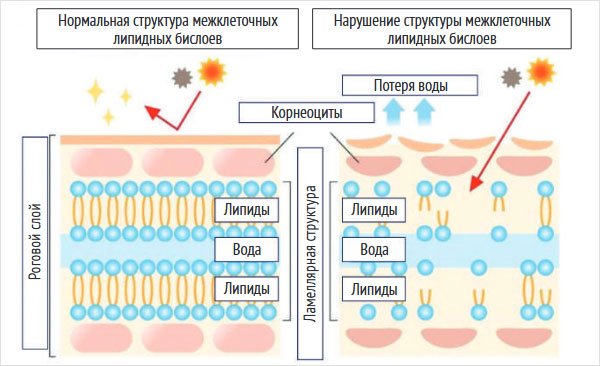
*Первый шаг к здоровой коже. Барьерные функции кожи. Режим доступа: https://welcometoclub.com/blog/cildin-bariyer-fonksiyonlari.
Себум – секрет сальных желез, выполняет функцию природного окклюзионного увлажнителя: он формирует гидрофобную пленку на поверхности кожи, приглаживает чешуйки рогового слоя и тем самым минимизирует испарение воды. Липидный состав себума в комплексе с секретом потовых желез формирует полупроницаемую гидролипидную пленку, или кислотную мантию, – важную компоненту поверхностной защиты кожи. Эта структура не только предотвращает испарение влаги, но и уменьшает воздействие загрязнителей окружающей среды, а также создает оптимальные условия для поддержания стабильности и разнообразия кожного микробиома [13].
Кератин – основной белок корнеоцитов, представлен высокомолекулярными, нерастворимыми структурами, обладающими способностью к набуханию в присутствии воды и формированию прочных электростатических связей с молекулами жидкости, тем самым способствуя удержанию влаги в роговом слое [13].
Здоровый микробиом кожи. Микробиом кожи младенца начинает формироваться во время беременности, кожа плода в утробе матери купается в околоплодных водах и после рождения сталкивается с газообразной средой, богатой микробами. Неонатальный микробиом кожи созревает и быстро эволюционирует во взрослый микробиом [17, 18]. На первом году жизни отмечаются изменения в микробном разнообразии кожи детей (рис. 4) [18].
Рисунок 4. Наиболее распространенные роды бактерий на коже детей первого года жизни
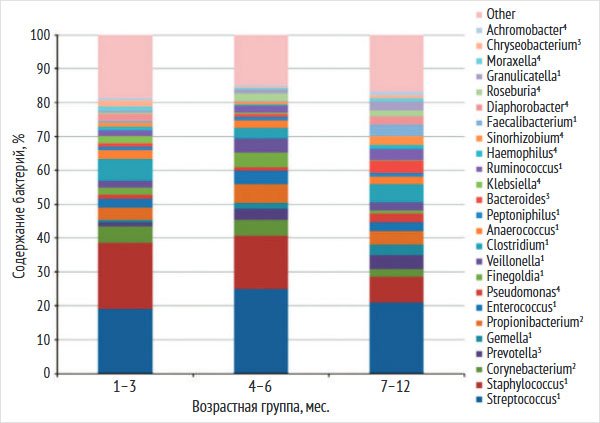
Типы: 1 – Firmicutes; 2 – Actinobacteria; 3 – Bacteroidetes; 4 – Proteobacteria [18]
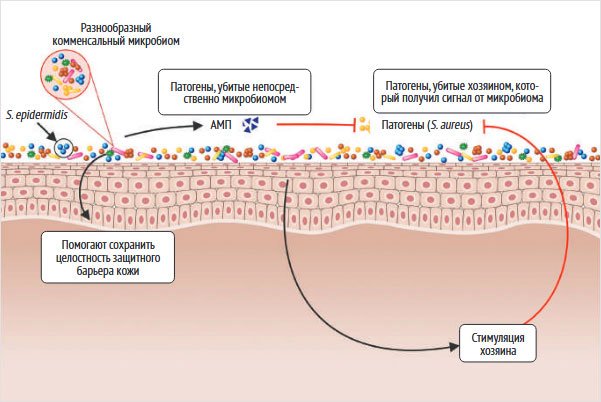
Микробиота кожи неразрывно связана с барьерной функцией и гомеостазом эпидермиса (рис. 5) [19]. Комменсальные микроорганизмы продуцируют ферменты, в частности сфингомиелинидазу, необходимую для синтеза церамидов – ключевых структурных компонентов межклеточного липидного матрикса. Поддержание сбалансированного микробиома также способствует конкурентному вытеснению патогенных микроорганизмов за счет конкуренции за субстраты, синтеза антимикробных пептидов и снижения pH поверхности кожи, что препятствует колонизации патогенами. Кроме того, представители нормальной микробиоты принимают участие в модуляции кожного иммунного ответа: они способствуют снижению хронического воспаления, создавая противовоспалительную микросреду, а также стимулируют контролируемую воспалительную реакцию, необходимую на ранних этапах регенерации и заживления кожного покрова [20].
Рисунок 5. Нормальная кожа и ее микробиом [19]
В связи с функциональной незрелостью эпидермального барьера кожа детей первого года жизни характеризуется повышенной восприимчивостью к мацерации и воздействию внешних раздражающих факторов. Особенно это проявляется в области под подгузником, где совокупность неблагоприятных условий (повышенная влажность, механическое трение, а также контакт с мочой и каловыми массами) создает предпосылки для активации локального воспалительного процесса, клинически манифестирующегося в виде пеленочного дерматита (ПД) [21].
Пеленочный дерматит
ПД представляет собой воспалительное поражение кожи в аногенитальной области, обусловленное окклюзией кожного покрова подгузником и воздействием совокупности физических (повышенная влажность, трение), химических (моча, кал), а также биологических (микробные агенты) факторов. При избыточном контакте кожи с подгузниками наблюдается повышенная влажность, что приводит к мацерации рогового слоя эпидермиса. В результате снижаются барьерные функции кожи, делая ее более восприимчивой и уязвимой. Эти изменения способствуют колонизации поверхности кожи дрожжеподобными грибами Candida albicans и грамположительными бактериями, такими как Staphylococcus aureus и Streptococcocus. Ферменты, выделяемые этими микроорганизмами, расщепляют мочевину, способствуя образованию аммиака и повышению pH кожи до щелочных значений, что, в свою очередь, активирует ферментативную активность кала [22].
ПД является одним из наиболее распространенных дерматологических заболеваний у новорожденных и детей в течение первого года жизни. Заболевание может сопровождаться выраженным дискомфортом у ребенка, нарушением сна и поведения, а также психоэмоциональной нагрузкой у лиц, осуществляющих уход. Согласно эпидемиологическим данным, различные степени тяжести симптоматики ПД отмечаются у 50–65% детей раннего возраста [12].
В конце XIX – начале XX в. в медицинской литературе преобладала точка зрения, согласно которой воспалительные изменения кожи в области промежности у младенцев обусловлены длительным контактом с влажными и загрязненными тканевыми пеленками, что и легло в основу термина «пеленочный дерматит». В 1915 г. J. Zahorsky впервые предложил так называемую аммиачную концепцию, согласно которой повреждение кожных покровов обусловливалось раздражающим действием аммиака, образующегося в результате бактериального разложения мочевины и накапливающегося в загрязненных пеленках. Данная концепция сохраняла доминирующее положение вплоть до 1950–1970-х гг., пока результаты исследований G. Rapp (1955 г.), C. Burgoon (1961 г.), P. Koblenzer (1973 г.), J. Leyden (1977 г.) и других ученых не опровергли представление об аммиаке как о главном и единственном патогенетическом факторе заболевания [23].
Эпидемиология ПД отличается значительной вариабельностью в зависимости от географического региона, социально-экономических условий и санитарно-гигиенических практик. Распространенность и частота возникновения ПД демонстрируют выраженные колебания, обуславливаемые различиями в культуре ухода за младенцами. К факторам, влияющим на вариативность показателей, относятся: частота и характер использования одноразовых гигиенических средств (подгузников, влажных салфеток), средств по уходу за кожей (крема, мази), возраст начала приучения к горшку, принципы и методы интимной гигиены, а также общие условия жизни. Наибольшая распространенность ПД зафиксирована в развитых странах, таких как Япония, США, где использование подгузников носит повсеместный характер [24].
Кожные высыпания при ПД преимущественно локализуются на выступающих участках кожи, находящихся в непосредственном контакте с подгузником и подверженных повышенному механическому трению. К таким зонам относятся внутренняя поверхность бедер, ягодичные области, перианальная зона, наружные половые органы, нижняя часть живота и область поясницы. На начальных этапах клинического течения патологический процесс характеризуется ограниченной эритемой с незначительной выраженностью воспалительных изменений. По мере прогрессирования дерматита происходит увеличение площади поражения, нарастает интенсивность гиперемии, и в клинической картине могут появляться элементы более глубокой морфологической организации – папулы, пустулы и эрозивные участки [25].
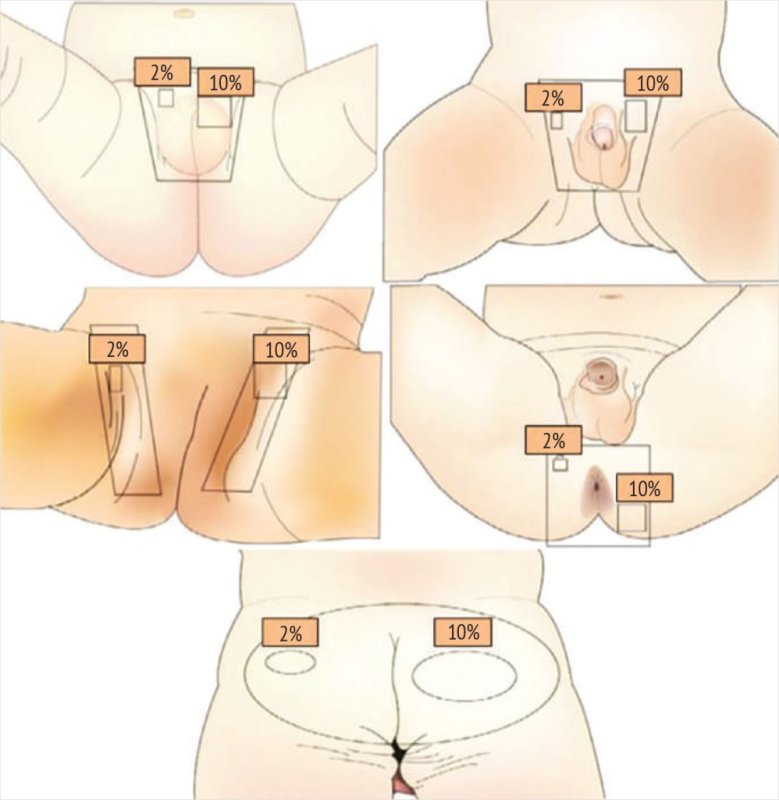
Существует три степени тяжести ПД. При легкой степени площадь поражения составляет менее 10% кожной поверхности, отмечаются умеренное покраснение, слабо выраженная папулезная сыпь и шелушение эпидермиса (рис. 6) [26]. При среднем течении возникают папулы, пустулы, эрозии, в складках кожи могут формироваться инфильтраты, что сопровождается высокой частотой инфицирования. При отсутствии устранения раздражающих факторов и длительном течении заболевания (тяжелая степень) наблюдаются инфильтраты, папулы, пузырьки, мокнутие, глубокие эрозии и изъязвления, а также значительное увеличение площади поражения. Неосложненный ПД при адекватном уходе за кожей ребенка проходит в течение 2–3 дней, в то время как инфицирование может привести к ухудшению воспалительного процесса и увеличению продолжительности заболевания [27].
Рисунок 6. Схема определения степени выраженности пеленочного дерматита [26]
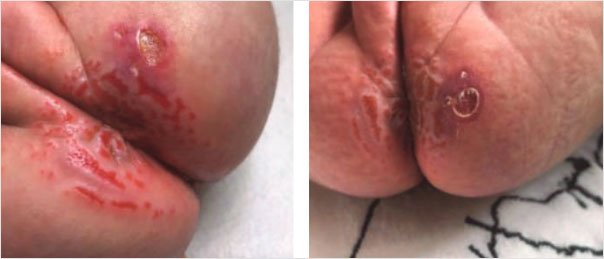
Эрозивный дерматит Жаке является редким и тяжелым вариантом ПД, который развивается в результате длительного воздействия раздражающих факторов в условиях окклюзии и характеризуется четко очерченными язвами и эрозиями с приподнятыми краями (рис. 7) [28].
Рисунок 7. Эрозивный дерматит Жаке [28]
Комплекс лечебно-профилактических мероприятий при уходе за кожей в области подгузника основывается на многоступенчатом алгоритме, включающем следующие направления: А (Air) – аэрация – обеспечение достаточного доступа воздуха к кожным покровам; В (Barrier) – восстановление и поддержание барьерной функции кожи с использованием средств, обладающих регенерирующим и противовоспалительным действием; С (Cleaning) – очищение с помощью мягких моющих препаратов, способствующих бережному удалению загрязнений без нарушения липидного слоя и физиологического рН поверхности кожи; D (Diaper) – рациональное применение подгузников и пеленок; а также E (Education) – обучение родителей принципам правильного ухода [29].
Для деликатного очищения кожи в области под подгузником рекомендуется применение специально разработанных щадящих моющих средств, обеспечивающих эффективное устранение раздражающих агентов и способствующих поддержанию кислотно-щелочного баланса кожи, а также сохранению поверхностных липидов [30]. В качестве такого очищающего средства может быть использован специализированный продукт для поврежденной кожи из гаммы Cicaplast (La Roche-Posay). После удаления загрязнений необходимо тщательно, но деликатно осушить кожу без трения, во избежание механического повреждения.
При выборе наружных средств ухода важно учитывать, что они не должны формировать окклюзионную пленку, препятствующую физиологическому испарению влаги и нарушающую местный рН кожных покровов. Применение присыпок для постоянного использования не рекомендуется, поскольку данные средства не обеспечивают устойчивого защитного барьера и могут обладать абразивными свойствами, способствуя дополнительному повреждению кожи [31].
При терапии ПД необходимо учитывать клинические проявления заболевания. Лечебные мероприятия должны быть направлены на купирование воспалительных процессов, подавление вторичной инфекции и восстановление барьерной функции кожи [24].
Роль эмолентов в поддержании кожного барьера
В настоящее время одним из важных направлений профилактики и лечения ПД является использование средств, обладающих барьерными свойствами, в частности эмолентов. Основная задача эмолентов – восстановление липидного барьера кожи, ее питание и глубокое увлажнение. Эмоленты обогащают кожу необходимыми липидами и аминокислотами, уменьшают раздражение и зуд, придают мягкость и эластичность детской коже. Современные технологии позволили усилить восстанавливающую барьерную функцию эпидермиса за счет использования средств с регенеративным потенциалом [24].
Эмоленты (от англ. emollient – смягчающий) представляют собой топические средства, направленные на восстановление пластичности и мягкости рогового слоя кожи. Этот термин объединяет препараты с различным составом и механизмом действия, обеспечивающие схожий клинический эффект в виде смягчения кожи.
Функциональные вещества, входящие в состав эмолентов, подразделяются на три группы [13]:
1. Окклюзионные агенты: жироподобные тугоплавкие вещества, которые при нанесении на кожу формируют водоотталкивающий защитный слой, аналогичный себуму. К ним относятся:
- углеводороды: минеральное масло, вазелин, жидкий парафин, церезин;
- жидкие силиконы (силиконовые масла);
- синтетические воски, жирные спирты (например, октадеканол, гексилдеканол), жирные эфиры (децилолеат, изопропилмиристат);
- животные жиры (гусиный, китовый, свиной, барсучий);
- растительные масла, преимущественно тугоплавкие и твердые, такие как масло ши;
- природные воски и их эфиры, включая пчелиный воск и растительные воски (хвойный, тростниковый и др.).
2. Липиды со смягчающими свойствами: липиды, входящие в состав липидного барьера кожи, при нанесении проникают в роговой слой и интегрируются в межклеточные липидные структуры. Часть этих липидов достигает живых кератиноцитов, которые используют их для синтеза собственных липидов или молекул-регуляторов местного иммунитета. Особенно эффективны смеси, содержащие физиологические липиды, такие как церамиды, холестерин и свободные жирные кислоты.
3. Увлажнители: гигроскопичные вещества, способные притягивать и удерживать влагу в роговом слое, способствуя его гидратации. К ним относятся глицерин, сорбитол, мочевина, молочная кислота и другие компоненты, входящие в состав натурального увлажняющего фактора.
Таким образом, эмоленты представляют собой комплексные средства, направленные на восстановление и поддержание барьерной функции кожи, улучшение ее гидратации и смягчение, что способствует снижению воспалительных процессов и повышению комфорта пациента.
Эмоленты выпускаются в различных текстурах: от легких, таких как молочко или лосьон, до более насыщенных, например, бальзамов. Чем более кожа склонна к сухости, тем более насыщенными должны быть текстуры эмолентов. Современные эмоленты, известные как эмоленты-плюс, выходят за рамки простых смягчающих средств. Они содержат активные компоненты, которые усиливают противовоспалительный, противозудный и ранозаживляющий эффекты, а также положительно влияют на микробиом кожи. Примером таких инновационных средств является Cicaplast Baume B5+ от La Roche-Posay.
Cicaplast Baume B5+ (La Roche-Posay, Франция) предназначен для ухода за кожей с нарушенным эпидермальным барьером, выраженной сухостью и воспалением. Обновленная формула этого средства основана на исследованиях микробиома и включает комплекс Tribioma – пребиотический комплекс, в состав которого входят сахара (альфа-глюкоолигосахариды и манноза), растительный экстракт корня Якона, богатый бета-фруктанами, и инактивированные лактобактерии (L. casei и L. acidophilus). Таким образом, Tribioma выступает в качестве питательной среды, обладающей высокой биоселективностью для размножения полезной микрофлоры и способствующей росту комменсальных бактерий (S. epidermidis), которые конкурируют с патогенными бактериями (S. aureus) и подавляют их рост, ввиду чего происходит укрепление врожденного иммунитета кожи. Дополнительно в состав входят пантенол (5%) и мадекассосид, которые способствуют успокоению кожи и восстановлению ее защитного барьера. Также бальзам содержит комплекс микроэлементов с антибактериальными свойствами, включая цинк и марганец. Активные компоненты Cicaplast Baume B5+ представлены в таблице.
Таблица. Активные компоненты Cicaplast Baume B5+
Активные компоненты | Биологические эффекты |
Восстановление эпидермального барьера | |
Пантенол (пантотеновая кислота, витамин B5) |
|
Глицерин |
|
Масло ши (карите) |
|
Противовоспалительное действие, нормализация клеточного цикла кератиноцитов | |
Цинк и глюконат марганца |
|
Мадекассосид (Madecassoside) – изолят из Centella asiatica |
|
Aqua posae filiformis (APF), – лизат бактерий Vitreoscilla filiformis (VF), выращенных в термальной воде La Roche-Posay |
|
Формирование здорового микробиома | |
Комплекс Tribioma | Инактивированные штаммы L. casei и L. acidophilus. Растительный экстракт якона (Smallanthus sonchifolius) – источник фруктоолигосахаридов, обладающих пребиотическими свойствами, и полифенолов. α-глюкоолигосахарид – биоселективный пребиотик, полученный путем ферментации натуральных сахаров (сахарозы и мальтозы), стимулирует рост и жизнедеятельность нормальной микрофлоры. Манноза – моносахарид, служащий питательной средой для бактерий, стимулирует рост и жизнедеятельность нормальной микрофлоры |
Примечание. ТЭПВ – трансэпидермальная потеря влаги
Cicaplast Spray B5 представляет собой средство с облегченной текстурой, оптимально подходящее для ситуаций, требующих минимального контакта с кожей, таких как термические и солнечные ожоги, эритема, раздражения, ссадины и царапины. Клинические исследования, проведенные с участием 43 детей в возрасте от 2 до 39 мес. с нормальной или сухой кожей, небольшими ранами и легкой формой опрелостей, показали, что двукратное ежедневное применение спрея в течение 14 дней приводило к регрессу воспалительных изменений кожи и уменьшению дискомфорта, связанного с жжением, зудом и болевыми ощущениями. Таким образом, средства линии Cicaplast рекомендуются для ухода за чувствительной, раздраженной и поврежденной кожей у младенцев, детей и взрослых.
Заключение
Правильный и рациональный уход за кожей новорожденных и детей раннего возраста играет ведущую роль в обеспечении и сохранении ее многочисленных и важных функций. Применение топических средств для ухода за кожей эффективно способствует восстановлению и укреплению эпидермального барьера, что приводит к минимизации клинических проявлений повышенной кожной проницаемости, таких как сухость, воспаление и зуд. Линейка Cicaplast (La Roche-Posay, Франция) представляет собой оптимальный выбор для регулярного ухода за чувствительной кожей младенцев и детей. Эмоленты-плюс серии Cicaplast рекомендуется использовать в профилактических целях при уходе за поврежденной, сухой, воспаленной кожей.
[1] Первый шаг к здоровой коже. Барьерные функции кожи. Режим доступа: https://welcometoclub.com/blog/cildin-bariyer-fonksiyonlari.
Список литературы / References
Развернуть
- Рыбкина НЛ. Современные подходы к уходу за кожей новорожденного тактика педиатра. Вестник современной клинической медицины. 2014;7(6):84-89. Режим доступа: https://vskmjournal.org/images/Files/Issues_Archive/2014/Issue_6/VSKM_2014_N_6.pdf.
- Blume-Peytavi U, Kanti V. Prevention and treatment of diaper dermatitis. Pediatr Dermatol. 2018;35(Suppl. 1):s19-s23. https://doi.org/10.1111/pde.13495.
- Захарова ИН, Пшеничникова ИИ, Мачнева ЕБ. Правильный уход за кожей новорожденных и детей раннего возраста: что нужно знать педиатру. Педиатрия. Consilium Medicum. 2016;(1):24-30. Режим доступа: https://elibrary.ru/xbdylr.
- Gao Z, Tseng CH, Pei Z, Blaser MJ. Molecular analysis of human forearm superficial skin bacterial biota. Proc Natl Acad Sci U S A. 2007;104(8):2927-2932. https://doi.org/10.1073/pnas.0607077104.
- Blume-Peytavi U, Hauser M, Stamatas GN, Pathirana D, Garcia Bartels N. Skin care practices for newborns and infants: review of the clinical evidence for best practices. Pediatr Dermatol. 2012;29(1):1-14. https://doi.org/10.1111/j.1525-1470.2011.01594.x.
- Stamatas GN, Nikolovski J, Luedtke M, Kollias N, Wiegand BC. Infant skin microstructure assessed in vivo differs from adult skin in organization and at the cellular level. Pediatr Dermatol. 2010;27(2):125-131. https://doi.org/10.1111/j.1525-1470.2009.00973.x.
- Visscher MO, Barai N, LaRuffa AA, Pickens WL, Narendran V, Hoath SB. Epidermal barrier treatments based on vernix caseosa. Skin Pharmacol Physiol. 2011;24(6):322-329. https://doi.org/10.1159/000328744.
- Stamatas GN, de Sterke J, Hauser M, von Stetten O, van der Pol A. Lipid uptake and skin occlusion following topical application of oils on adult and infant skin. J Dermatol Sci. 2008;50(2):135-142. https://doi.org/10.1016/j.jdermsci.2007.11.006.
- Горланов ИА (ред.). Детская дерматовенерология. М.: ГЭОТАР-Медиа; 2017. 512 с. Режим доступа: https://djvu.online/file/hx2EWu9GhvD7e.
- Воронцов ИМ, Мазурин АВ. Пропедевтика детских болезней. 3-е изд., доп. и перераб. СПб.: Фолиант; 2009. 1008 с. Режим доступа: https://djvu.online/file/4X70a8fYe0WhA.
- Fluhr JW, Darlenski R, Lachmann N, Baudouin C, Msika P, De Belilovsky C, Hachem JP. Infant epidermal skin physiology: adaptation after birth. Br J Dermatol. 2012;166(3):483-490. https://doi.org/10.1111/j.1365-2133.2011.10659.x.
- Захарова ИН, Пшеничникова ИИ, Творогова ТМ. Пеленочный дерматит: дифференциальная диагностика и вопросы профилактики. Медицинский совет. 2021;(1):14-19. https://doi.org/10.21518/2079-701X-2021-1-14-19.
- Эрнандес ЕИ, Альбанова ВИ, Калашникова НГ, Новицкая АВ, Уракова ДС. Атопический дерматит и псориаз в практике косметолога. М.: Косметика и медицина; 2020. 172 c.
- Киясов АП. Homo sapiens под микроскопом. Казань: Изд-во Казан. ун-та; 2022. 428 с.
- Liu J, Jin Y, Wei Q, Hu Y, Liu L, Feng Y, Jin Y, Jiang Y. The relationship between aquaporins and skin diseases. Eur J Dermatol. 2023;33(4):350-359. https://doi.org/10.1684/ejd.2023.4526.
- Мурашкин НН, Амбарчян ЭТ, Епишев РВ, Материкин АИ. Барьерные свойства кожи в норме и патологии. Педиатрия. Журнал имени Г.Н. Сперанского. 2015;94(6):165-169. Режим доступа: https://pediatriajournal.ru/files/upload/mags/349/2015_6_4500.pdf.
- Grice EA, Segre JA. The skin microbiome. Nat Rev Microbiol. 2011;9(4):244-253. https://doi.org/10.1038/nrmicro2537.
- Capone KA, Dowd SE, Stamatas GN, Nikolovski J. Diversity of the human skin microbiome early in life. J Invest Dermatol. 2011;131(10):2026-2032. https://doi.org/10.1038/jid.2011.168.
- Canchy L, Kerob D, Demessant A, Amici JM. Wound healing and microbiome, an unexpected relationship. J Eur Acad Dermatol Venereol. 2023;37(Suppl. 3):7-15. https://doi.org/10.1111/jdv.18854.
- Захарова ИН, Касьянова АН. Микробиом кожи: что нам известно сегодня? Медицинский совет. 2019;(17):168-176. https://doi.org/10.21518/2079-701X-2019-17-168-176.
- Šikić Pogačar M, Maver U, Marčun Varda N, Mičetić-Turk D. Diagnosis and management of diaper dermatitis in infants with emphasis on skin microbiota in the diaper area. Int J Dermatol. 2018;57(3):265-275. https://doi.org/10.1111/ijd.13748.
- Lucky AW. Transient Benign Cutaneous Lesions in the Newborn. In: Eichenfield LF, Frieden IJ, Esterl NB (eds.). Neonatal Dermatology. 2nd ed. Philadelphia: WB Saunders; 2001, pp. 88−102. https://doi.org/10.1016/B978-1-4160-3432-2.50010-8.
- Гаранина СВ, Солдатова ОН, Тумаева ЛА, Балыкова ЛА. Современные представления о механизмах возникновения и подходах к лечению пеленочного дерматита. Лечащий врач. 2014;(9):59. Режим доступа: https://www.lvrach.ru/2014/09/15436047.
- Мурашкин НН, Материкин АИ, Епишев РВ, Амбарчян ЭТ. Особенности течения и профилактики пеленочного дерматита у новорожденных и детей грудного возраста. Вопросы современной педиатрии. 2015;14(6):710-713. https://doi.org/10.15690/vsp.v14i6.1481.
- Stamatas GN, Tierney NK. Diaper dermatitis: etiology, manifestations, prevention, and management. Pediatr Dermatol. 2014;31(1):1-7. https://doi.org/10.1111/pde.12245.
- Carr AN, DeWitt T, Cork MJ, Eichenfield LF, Fölster-Holst R, Hohl D et al. Diaper dermatitis prevalence and severity: Global perspective on the impact of caregiver behavior. Pediatr Dermatol. 2020;37(1):130-136. https://doi.org/10.1111/pde.14047.
- Blume-Peytavi U, Lavender T, Jenerowicz D, Ryumina I, Stalder JF, Torrelo A, Cork MJ. Recommendations from a European Roundtable Meeting on Best Practice Healthy Infant Skin Care. Pediatr Dermatol. 2016;33(3):311-321. https://doi.org/10.1111/pde.12819.
- Ribeiro-Mourão F, Martinho I, Machado S, Rêgo C. A Rare and Severe Form of Diaper Dermatitis. Port J Pediatr. 2021;52:162-163. Available at: https://www.researchgate.net/publication/351056829_A_rare_and_severe_form_of_diaper_dermatitis.
- Klunk C, Domingues E, Wiss K. An update on diaper dermatitis. Clin Dermatol. 2014;32(4):477-487. https://doi.org/10.1016/j.clindermatol.2014.02.003.
- Мурашкин НН, Опрятин ЛА, Епишев РВ, Материкин АИ, Амбарчян ЭТ, Иванов РА и др. Уход за кожей новорожденного - основа профилактики развития атопического дерматита. Вопросы современной педиатрии. 2021;20(5):383-389. https://doi.org/10.15690/vsp.v20i5.2311.
- Одинаева НД, Беляева ИА, Яцык ГВ. Профилактические и лечебные средства для ухода за кожей недоношенных детей. Педиатрическая фармакология. 2009;6(6):118-120. Режим доступа: https://www.pedpharma.ru/jour/article/view/955.
- Gorski J, Proksch E, Baron JM, Schmid D, Zhang L. Dexpanthenol in Wound Healing after Medical and Cosmetic Interventions (Postprocedure Wound Healing). Pharmaceuticals. 2020;13(7):138. https://doi.org/10.3390/ph13070138.
- Shahriari-Khalaji M, Hong S, Hu G, Ji Y, Hong FF. Bacterial Nanocellulose-Enhanced Alginate Double-Network Hydrogels Cross-Linked with Six Metal Cations for Antibacterial Wound Dressing. Polymers. 2020;12(11):2683. https://doi.org/10.3390/polym12112683.
- Tan C, Bhattamisra SK, Chellappan DK, Candasamy M. Actions and Therapeutic Potential of Madecassoside and Other Major Constituents of Centella asiatica: A Review. Appl Sci. 2021;11(18):8475. https://doi.org/10.3390/app11188475.
- Mahe YF, Perez MJ, Tacheau C, Fanchon C, Martin R, Rousset F, Seite S. A new Vitreoscilla filiformis extract grown on spa water-enriched medium activates endogenous cutaneous antioxidant and antimicrobial defenses through a potential Toll-like receptor 2/protein kinase C, zeta transduction pathway. Clin Cosmet Investig Dermatol. 2013;6:191-196. https://doi.org/10.2147/CCID.S47324.
- Mahé Y, Martin R. Use of a lipopolysaccharide fraction of Vitreoscilla filiformis as agent for stimulating the synthesis of antimicrobial peptides on the skin. Patent FR-2914189-A1, 2008/10/03. Available at: https://pubchem.ncbi.nlm.nih.gov/patent/FR-2914189-A1.
- Gueniche A, Liboutet M, Cheilian S, Fagot D, Juchaux F, Breton L. Vitreoscilla filiformis Extract for Topical Skin Care: A Review. Front Cell Infect Microbiol. 2021;11:747663. https://doi.org/10.3389/fcimb.2021.747663.
Фото:
Svitlana Hulko/FOTODOM/Shutterstoсk



 1
1 2
2 3
3 4
4


Комментарии (0)