Журнал "Медицинский совет" №11/2021
DOI: 10.21518/2079-701X-2021-11-174-182
А.В. Витебская, ORCID: 0000-0001-5689-0194
А.В. Попович, ORCID: 0000-0002-9660-8795
Клинический институт детского здоровья имени Н.Ф. Филатова Первого Московского государственного медицинского университета имени И.М. Сеченова (Сеченовского Университета); Россия, 119435, Москва, ул. Б. Пироговская, д. 19
Введение. Ожирение является одним из социально значимых заболеваний современности и общепризнанным фактором риска развития нарушений углеводного обмена, в т. ч. сахарного диабета (СД) 2-го типа, распространенность которого в детской популяции стремительно растет.
Цель работы. Продемонстрировать наиболее часто встречающиеся варианты нарушений углеводного обмена у детей и подростков с ожирением.
Материалы и методы. Обследовано 123 пациента до 18 лет с ожирением, проанализирована структура осложнений ожирения.
Результаты. Нарушения углеводного обмена выявлены у 24 пациентов (19%): нарушенная гликемия натощак (НТГ) (8 девочек, 6 мальчиков (11%)), СД 2-го типа (6 девочек, 3 мальчика (7%)) и СД 1-го типа (1 мальчик (1%)). Приведены описания 4 клинических случаев: 1) пациент, 17 лет, с конституциональноэкзогенным ожирением 3-й степени, артериальной гипертензией (АГ), дислипидемией и неалкогольной жировой болезнью печени (НЖБП) и транзиторной НТГ в анамнезе; 2) пациентка, 16 лет, с морбидным ожирением, НЖБП, АГ, синдромом поликистозных яичников (СПКЯ), СД 2-го типа, компенсированным на фоне терапии метформином; 3) пациент, 17 лет, с конституциональноэкзогенным ожирением 3-й степени, АГ, дислипидемией, НЖБП, СД 2-го типа (на помповой инсулинотерапии), осложненным диабетической нефропатией и диабетической полинейропатией; 4) пациент, 12 лет, с СД 1-го типа, манифестировавшим на фоне ожирения.
Заключение. При скрининге осложнений ожирения у детей и подростков нарушения углеводного обмена могут выявляться у каждого пятого пациента. Предиабет в детском возрасте может носить транзиторный характер. При выявлении СД у ребенка с ожирением необходимо проводить дифференциальную диагностику СД 1-го и 2-го типов. Необходимо обучать пациентов с СД 2-го типа навыкам самоконтроля наравне с пациентами с СД 1-го типа и мотивировать регулярно контролировать гликемию в домашних условиях.
Для цитирования: Витебская А.В., Попович А.В. Нарушения углеводного обмена у детей и подростков с ожирением. Медицинский Совет. 2021;(11):174-182. https://doi.org/10.21518/2079-701X-2021-11-174-182
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Impairment of carbohydrate metabolism in children and adolescents with obesity
Alisa V. Vitebskaya, ORCID: 0000-0001-5689-0194
Anastasia V. Popovich, ORCID: 0000-0002-9660-8795
Filatov Clinical Institute for Children’s Health, Sechenov First Moscow State Medical University (Sechenov University); 19, B. Pirogovskaya St., Moscow, 119435, Russia
Introduction. Obesity is one of the socially significant diseases of our time and is a generally recognized risk factor for the development of carbohydrate metabolism disorders, including type 2 diabetes mellitus (DM), the prevalence of which in the pediatric population is rapidly increasing.
Aim of the study. To demonstrate the most frequent types of carbohydrate metabolism disorders in children and adolescents with obesity.
Materials and methods. 123 obese patients under 18 years old were examined and the structure of obesity complications was analyzed.
Results. Carbohydrate metabolism disorders were identified in 24 patients (19%): impaired fasting glycemia (IFG) (8 girls, 6 boys (11%)), type 2 DM (6 girls, 3 boys (7%)), and type 1 DM (1 boy (1%)). Descriptions of 4 clinical cases are given: 1) patient, 17 years old, with constitutional-exogenous obesity of 3rd degree, arterial hypertension (AH), dyslipidemia and nonalcoholic fatty liver disease (NAFLD) and a history of transient IFG; 2) patient, 16 years old, with morbid obesity, NAFLD, AH, polycystic ovarian syndrome (PCOS), type 2 DM, compensated on metformin therapy; 3) patient, 17 years old, with constitutional-exogenous obesity of the 3rd degree, AH, dyslipidemia, NAFLD, type 2 DM (on insulin pump therapy), complicated by diabetic nephropathy and diabetic polyneuropathy; 4) patient, 12 years old, with type 1 DM, manifested against the background of obesity.
Сonclusion. When screening for obesity complications in children and adolescents, carbohydrate metabolism disorders may be detected in one in five patients. Prediabetes in childhood can be transient. When a child with obesity is identified, differential diagnosis of type 1 and type 2 DM should be made. It is necessary to teach patients with type 2 DM the skills of self-monitoring on a par with patients with type 1 DM and motivate them to control glycemia regularly at home.
For citation: Vitebskaya A.V., Popovich A.V. Impairment of carbohydrate metabolism in children and adolescents with obesity. Meditsinskiy sovet = Medical Council. 2021;(11):174-182. (In Russ.) https://doi.org/10.21518/2079-701X-2021-11-174-182
Conflict of interest: the authors declare no conflict of interest.
Введение
Ожирение является одним из социально значимых заболеваний современности. Глобальная распространенность детского ожирения с 1975 по 2016 г. выросла с 0,7 до 5,6% среди девочек и с 0,9 до 7,8% – среди мальчиков [1].
В 2016 г. в мире насчитывалось 50 млн девочек и 74 млн мальчиков с ожирением. Особенно высокие показатели распространенности ожирения – более 30% – выявлены среди детского населения некоторых островов Полинезии и Микронезии. Распространенность выше 20% зарегистрирована в Ближневосточном регионе, на севере Африки, в странах Карибского бассейна и США [1].
В Российской Федерации также отмечается рост эпидемиологических показателей этого заболевания. По результатам отечественного исследования, опубликованного в 2018 г., ожирение в 11-летнем возрасте выявлено у 9% девочек и 19% мальчиков, а в 15 лет – у 4% и 10% соответственно [2].
Ожирение в детском возрасте является общепризнанным фактором риска развития нарушений углеводного обмена, в т. ч. сахарного диабета (СД) 2-го типа, распространенность которого в детской популяции в последние годы также стремительно растет [3]. Например, в США отмечается ежегодный прирост заболеваемости СД 2-го типа у детей в среднем на 7% [4].
Цель работы – продемонстрировать наиболее часто встречающиеся варианты нарушений углеводного обмена у детей и подростков с ожирением.
Материалы и методы
За 2019 г. в детском эндокринологическом отделении Университетской детской клинической больницы Клинического института детского здоровья имени Н.Ф. Филатова Первого Московского государственного медицинского университета имени И.М. Сеченова (Сеченовского Университета) проведено стационарное обследование 123 пациентов: 61 девочки, 62 мальчиков до 18 лет с жалобами на ожирение. Пациенты имели ожирение различной тяжести: 1-й степени – 45 чел. (37%), 2-й – 34 (28%), 3-й – 41 (33%) и морбидное – 3 (2%). Диагностика ожирения и скрининг осложнений проводились в соответствии с федеральными клиническими рекомендациями (протоколами) по диагностике и лечению ожирения у детей и подростков [5]. Проанализированы частота встречаемости и структура нарушений углеводного обмена среди данных пациентов. Приведено описание клинических случаев нарушенной толерантности к глюкозе (НТГ), СД 1-го и 2-го типов, манифестировавших на фоне ожирения.
Результаты
Скрининг осложнений ожирения выявил неалкогольную жировую болезнь печени (НЖБП) у 79 пациентов (64%), дислипидемию – у 39 (32%), нарушения углеводного обмена – у 24 (19%), артериальную гипертензию (АГ) – у 11 (9%), различные варианты дисфункции яичников – у 7 девочек (12% или 6% пациентов). Нарушения углеводного обмена были представлены НТГ (8 девочек, 6 мальчиков (11%)), СД 2-го типа (6 девочек, 3 мальчика (7%)) и СД 1-го типа (1 мальчик (1%)).
Клинический случай 1: пациент с нарушенной толерантностью к глюкозе
Юноша, 17 лет, наблюдается детским эндокринологом с 5 лет по поводу ожирения. Помимо лишнего веса беспокоят повышенный аппетит, множественные стрии на всей поверхности тела, эпизоды повышения артериального давления (АД). Наследственный анамнез отягощен по ожирению и СД 2-го типа.
При осмотре обращают на себя внимание множественные мелкие бледные стрии на животе, груди, бедрах, плечах, свидетельствующие о выраженной прибавке массы тела в предшествующие годы; выраженный черный акантоз на шее, в подмышечных впадинах, в складках кожи под грудными железами и на боковых поверхностях живота, типичный для инсулинорезистентности. Подкожно-жировая клетчатка развита избыточно, распределена равномерно. АД – 135–145/90–95 мм рт. ст. По остальным органам и системам – без особенностей. Половое созревание по Таннеру – 5.
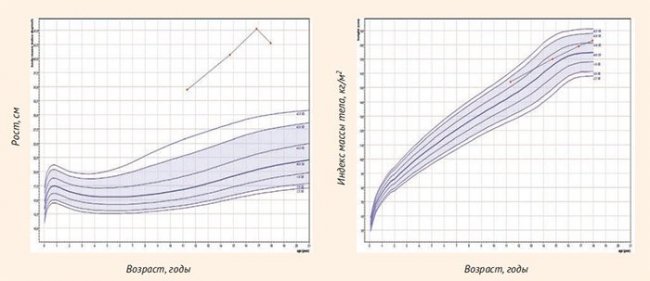
Пациент впервые обследован в детском эндокринологическом отделении в 11,3 лет: подтверждено конституционально-экзогенное ожирение 3-й степени. При скрининге осложнений выявлены дислипидемия и НЖБП, показатели гликемии в ходе перорального глюкозотолерантного теста (ПГТТ) в пределах нормы, уровень инсулина свидетельствует об инсулинорезистентности (табл. 1, рис. 1).
Таблица 1. Антропометрические данные и показатели углеводного обмена пациента 1
11,3 | 154,0 | 81,7 | 34,5 (3,5) | 4,3 | 5,0 | 32,0 (0,13) | - |
14,7 | 170,1 | 117,5 | 40,7 (3,7) | 5,5 | 10,0 | 28,9 (0,19) | 5,3 |
16,8 | 179,0 | 145,0 | 45,3 (4,0) | 6,5 | - | - | - |
17,9 | 181,3 | 143,5 | 43,7 (3,9) | 4,6 | 5,0 | 13,2 (0,35) | 5,3 |
Примечание. НГН – нарушенная гликемия натощак, НТГ – нарушенная толерантность к глюкозе.
При повторном обследовании в 14,7 лет отмечено прогрессирование ожирения, дислипидемия и НЖБП сохраняются, при проведении ПГТТ выявлена НТГ (табл. 1, рис. 1).
Рисунок 1. Графики роста и индекса массы тела пациента 1
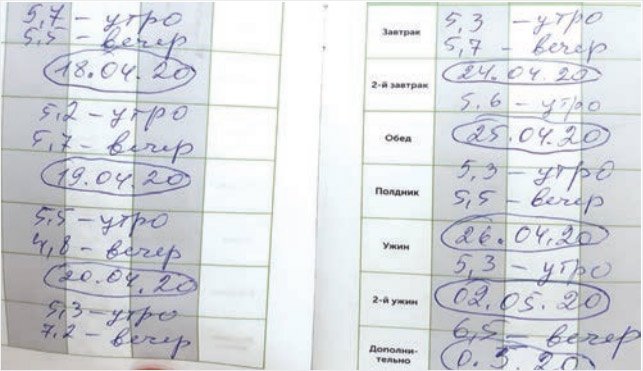
В 16,8 лет отмечено дальнейшее прогрессирование ожирения до морбидного. Однократно выявлена нарушенная гликемия натощак (НГН), но пациент не был обследован в детском эндокринологическом стационаре, поэтому ПГГТ не проводился. При контроле гликемии в домашних условиях с помощью глюкометра все показатели в пределах нормативных значений (табл. 1, рис. 1, 2).
Рисунок 2. Дневник гликемии пациента 1
В 17,9 лет впервые за период наблюдения отмечено уменьшение степени тяжести ожирения благодаря уменьшению SDSимт. При обследовании подтверждены АГ (по данным суточного мониторирования), дислипидемия, НЖБП, нарушений углеводного обмена и инсулинорезистентности по результатам проведения ПГТТ не выявлено (табл. 1, рис. 1).
Таким образом, у пациента конституционально-экзогенное ожирение 3-й степени осложнено АГ, дислипидемией и НЖБП. Нарушения углеводного обмена были транзиторными.
Клинический случай 2: пациентка с сахарным диабетом 2-го типа на терапии метформином
Девушка, 16 лет, с жалобами на лишний вес, отсутствие менструального цикла, избыточный рост волос на лице, животе, бедрах и ягодицах, повышение АД. Избыточная прибавка массы тела отмечается с трехлетнего возраста. Наследственный анамнез отягощен по ожирению и АГ.
При осмотре обращает на себя внимание выраженный черный акантоз в области шеи и подмышечных впадин, множественные бледно-розовые стрии на руках, боках, спине, животе, бедрах; фолликулярный кератоз на плечах, спине, ягодицах; избыточный рост волос в области подбородка, белой линии живота, ягодиц, бедер (12 баллов по шкале Ферримана – Галлвея); подкожно-жировая клетчатка развита чрезмерно, распределена в целом равномерно, избыточное отложение в области 7-го шейного позвонка; при осмотре отмечено повышение АД до 160/85 мм рт. ст. По остальным органам и системам – без особенностей. Половое созревание по Таннеру – 5.
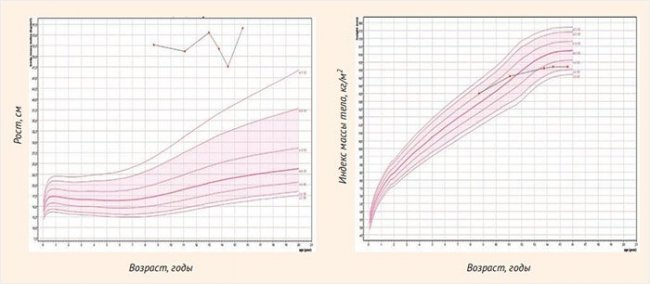
Впервые обследована в возрасте 8,7 лет. Выявлены морбидное ожирение, НТГ и инсулинорезистентность. При повторном обследовании по поводу морбидного ожирения в 11,1 лет все показатели углеводного обмена были в пределах нормы, исследование инсулина не проводилось (табл. 2, рис. 3).
Таблица 2. Антропометрические данные и показатели углеводного обмена пациентки 2
8,7 | 135,4 | 94,6 | 51,6 (4,8) | 5,8 | 8,4 | 28,7 (0,20) | 5,8 |
11,1 | 146,0 | 109,0 | 51,1 (4,5) | 5,1 | 7,2 | - | 5,6 |
13,0 | 150,0 | 125,5 | 55,6 (4,6) | 4,6 | 11,7 | 19,4 (0,24) | 5,3 |
13,8* | 150,1 | 118,2 | 52,4 (4,4) | 4,5 | - | 33,3 (0,14) | 5,3 |
14,5* | 152,0 | 110,0 | 47,6 (4,2) | 4,7 | - | 14,2 (0,33) | 5,1 |
15,6 | 152,0 | 130,8 | 56,7 (4,6) | 5,0 | - | 26,4 (0,19) ) | 5,0 |
Примечание. * – на терапии метформином 1 500–1 700 мг/сут; НГН – нарушенная гликемия натощак, НТГ – нарушенная толерантность к глюкозе, СД – сахарный диабет
СД 2-го типа диагностирован при обследовании по поводу прогрессирования ожирения в 13,0 лет. Пациентке был рекомендован прием метформина в дозе 1 500 мг/сут (500 мг утром и 1 000 мг вечером). При скрининге осложнений ожирения выявлена НЖБП (табл. 2, рис. 3).
Рисунок 3. Графики роста и индекса массы тела пациентки 2
В 13,8 лет, несмотря на уменьшение SDSимт, сохраняется морбидное ожирение. Пациентка впервые обследована по поводу аменореи и прогрессирующего гирсутизма: диагностирована гиперандрогения, в дальнейшем расцененная как проявление синдрома поликистозных яичников (СПКЯ). При самостоятельном прекращении приема метформина девочка отмечала эпизоды гипергликемии до 9–10 ммоль/л. В период нахождения в стационаре на фоне приема препарата все показатели в пределах целевых значений (табл. 2, 3, рис. 3).
Таблица 3. Показатели гликемии пациентки 2 в период пребывания в стационаре на фоне приема метформина*
13,8 | 500 + 1 000 | 6,4 | 7,2 | 9,2 | 6,2 | 4,9 | 5,4 | 5,9 | 6,3 | 5,6 |
14,5 | 850 + 850 | 5,6 | 5,3 | 7,5 | 4,7 | 4,9 | 4,9 | 6,5 | 6,0 | 6,0 |
15,6 | 850 + 850 | 5,8 | 8,7 | 6,0 | 5,6 | 7,1 | 5,1 | 6,6 | 5,3 | 4,9 |
Примечание. * – Целевые значения гликемии при СД у детей и подростков: натощак – 4,0–7,0 ммоль/л, через 2 ч после еды – 5,0–10,0 ммоль/л, перед сном и ночью – 4,4–7,8 ммоль/л [3].
В 14,5 лет сохраняется аменорея, отмечено прогрессирование гирсутизма, по рекомендации гинеколога инициирована терапия комбинированными эстрогенгестагенными препаратами. На фоне небольшого снижения SDSимт и продолжающегося приема метформина в дозе 1 700 мг/сут показатели гликемического контроля находятся в пределах целевых значений (табл. 2, 3, рис. 3). В 15,6 лет отмечено дальнейшее прогрессирование ожирения; проведено суточное мониторирование АД – выявлена стабильная систоло-диастолическая гипертензия. Сохраняются проявления СПКЯ и НЖБП. На фоне приема 1 700 мг метформина показатели гликемии и гликированного гемоглобина в пределах целевых значений, осложнений СД 2-го типа не выявлено (табл. 2, 3, рис. 3).
Таким образом, у пациентки осложнения морбидного ожирения представлены СД 2-го типа, НЖБП, АГ и СПКЯ. СД компенсирован на фоне таблетированной сахароснижающей терапии – метформина. Пациентка нуждается в ежедневном контроле гликемии в домашних условиях – не менее 1 р/сут в разное время и дополнительно в 1 гликемическом профиле в неделю [3]. Несмотря на это, измерения гликемии в домашних условиях проводит редко, дневниковые записи об измерениях отсутствуют.
Клинический случай 3: пациентка с сахарным диабетом 2-го типа на терапии на инсулинотерапии
Юноша, 17 лет, с выраженной прибавкой массы тела с 8 лет, с жалобами на частые эпизоды гипергликемии, боли в животе. Наследственность отягощена по ожирению и СД 2-го типа.
При осмотре рост 177,0 см, вес 120,2 кг (ИМТ – 38,3 кг/м2, SDSимт – 3,7). Кожные покровы физиологической окраски, умеренный черный акантоз в области шеи и подмышечных впадинах. Подкожно-жировая клетчатка развита избыточно с преимущественным отложением в абдоминальной области. АД – 120/60 мм рт. ст. Живот мягкий, умеренно болезненный в эпигастрии, печень выступает из-под края реберной дуги на 1 см, мягкоэластична. Патологических отклонений со стороны остальных органов и систем при осмотре не выявлено. Половое созревание по Таннеру – 5.
Состоит на диспансерном учете у детского эндокринолога с диагнозом «экзогенно-конституциональное ожирение» с 11 лет. СД 2-го типа диагностирован в 13 лет (гликемия – 12 ммоль/л, HbA1c – 9,1%), рекомендован прием метформина в дозе 1 700 мг/сут.
В 14 лет диагностирована диабетическая нефропатия, по поводу которой пациент принимает эналаприл 20 мг/сут.
В 16 лет в связи с высокими значениями гликемии, гликированного гемоглобина (HbA1c – 11,5%) пациент переведен на инсулинотерапию в интенсифицированном режиме (аналоги инсулина гларгин и аспарт), а в 17 лет – на помповую инсулинотерапию (аналог инсулина аспарт). Перед поступлением в стационар в 17,5 лет среднесуточная доза инсулина составляла 85 Ед (0,7 Ед/кг). Гликемию в домашних условиях измеряет редко, дневник не ведет. На этом фоне отмечена выраженная декомпенсация СД 2-го типа: HbA1c – 12,7% (целевые значения гликированного гемоглобина при СД < 7,0% [3]). При обследовании в 17,5 лет выявлены осложнения ожирения: АГ (подтверждена по результатам суточного мониторирования), дислипидемия (общий холестерин – 7,4 ммоль/л, триглицериды – 3,6 ммоль/л) и НЖБП. Также выявлена сопутствующая гастроэнтерологическая патология, послужившая причиной болей в эпигастрии.
Выявлены осложнения СД: диабетическая нефропатия, стадия протеинурии (альбумины в суточной моче – 430–558 мг/л) и диабетическая полинейропатия (снижение болевой чувствительности на ладонной и тыльной поверхностях I и II пальцев кисти, на тыльной и подошвенной поверхностях I и II пальцев стопы). В период пребывания в стационаре проведены обучение пациента в Школе диабета и коррекция инсулинотерапии под контролем гликемических профилей (табл. 4). В результате суточная потребность в инсулине достигла 100 Ед (0,8 Ед/кг). После выписки из стационара пациенту следует продолжить регулярный контроль гликемии в домашних условиях 6–10 раз в день, вести дневник самоконтроля [3].
Таблица 4. Показатели гликемии пациента 3 в период пребывания в стационаре на фоне коррекции инсулинотерапии*
При поступлении | 10,0 | 8,2 | 15,8 | 12,0 | 10,2 | 9,8 | 6,4 | 7,4 | 7,2 |
При выписке | 5,1 | 8,8 | 6,0 | 5,3 | 6,6 | 7,5 | 7,1 | 4,8 | 6,5 |
Примечание. * – Целевые значения гликемии при СД у детей и подростков: натощак – 4,0–7,0 ммоль/л, через 2 ч после еды – 5,0–10,0 ммоль/л, перед сном и ночью – 4,4–7,8 ммоль/л [3].
Клинический случай 4: пациент с сахарным диабетом 1-го типа и ожирением
Юноша, 12 лет, с жалобами на лишний вес. Наследственность отягощена по СД 2-го типа. В 12,5 лет проконсультирован детским эндокринологом, выявлено ожирение 1-й степени (рост – 151,0 см, вес – 53,8 кг (ИМТ – 23,6 кг/м2, SDSимт – 2,0)). При скрининге осложнений ожирения выявлены погранично высокие значения гликемии – 5,5– 6,5 ммоль/л, повышение HbA1c до 6,7%. В связи с этим пациент был госпитализирован в детское эндокринологическое отделение. Диагноз СД подтвержден на основании результатов ПГТТ: гликемия натощак – 5,6 ммоль/л, через 2 ч – 11,8 ммоль/л.
С целью дифференциальной диагностики СД 1-го и 2-го типов проведено исследование инсулина – 4,0 мкМЕ/мл (референсный интервал – 2–27) и С-пептида – 394 пмоль/л (референсный интервал – 298–2 350). В связи с отсутствием инсулинорезистентности данных об СД 2-го типа не получено. Проведено исследование иммунологических маркеров СД 1-го типа: антитела к тирозинфосфатазе – 243 МЕ/мл (в норме < 8,0), антитела к глутаматдекарбоксилазе – 5,23 МЕ/мл (в норме < 1,0), антитела к β-клеткам – 0,42 Ед/мл (в норме < 0,95). Диагноз СД 1-го типа был подтвержден. Однако на момент диагностики СД 1-го типа показатели гликемии в течение суток оставались в пределах целевых значений, инсулинотерапия не назначалась.
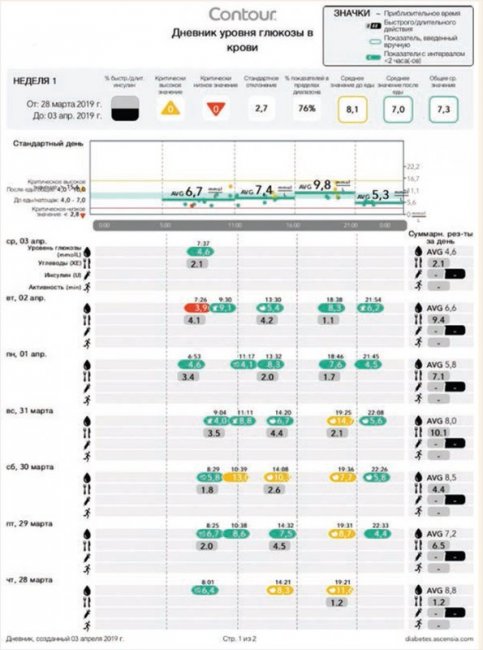
В домашних условиях ежедневно проводился контроль гликемии по скользящему графику, а после выявления высоких постпрандиальных значений – исследование нескольких гликемических профилей. Пациент вел дневник в бесплатном мобильном приложении Contour Diabetes, в котором автоматически фиксировались все измерения гликемии, проводимые сопряженным с приложением глюкометром Контур Плюс Уан (Contour Plus One), а отметки о приемах пищи вносились вручную (рис. 4).
Рисунок 4. Показатели гликемии пациента 4 в период подбора инсулино-
терапии: дневник из мобильного приложения Contour Diabetes*
Примечание. * – Целевые значения гликемии при СД у детей и подростков: натощак – 4,0–7,0 ммоль/л, через 2 ч после еды – 5,0–10,0 ммоль/л, перед сном и ночью – 4,4–7,8 ммоль/л [3].
Через 5 мес., в 12,9 лет, стали отмечаться подъемы гликемии выше целевых значений: в дневнике самоконтроля показатели гликемии, соответствующие целевым значениям, окрашены зеленым цветом, а выше целевых значений – желтым (рис. 4). Пациент был госпитализирован, инициирована инсулинотерапия, проведено обучение в Школе диабета. В дальнейшем пациенту рекомендовано контролировать гликемию 6–10 р/сут [3].
Обсуждение
Согласно литературным данным, наиболее распространенным нарушением углеводного обмена в детскоподростковом возрасте является НТГ, которая диагностируется у 5–25% пациентов с ожирением [6–10], причем по одним данным распространенность НТГ у детей и подростков не различается [8], а по другим – значительно выше в подростковом возрасте [6].
Во взрослом возрасте НТГ является предиктором развития СД 2-го типа [11]. Однако в детстве исходы НТГ могут быть различны. В одном из исследований было продемонстрировано, что лишь у 2% детей и подростков с НТГ при повторном обследовании через 3–5 лет был диагностирован СД 2-го типа, в то же время 75% детей с НТГ возвращались к нормогликемии. Риск развития СД 2-го типа не зависел от возраста, пола, степени ожирения, АД и уровня гликемии натощак на момент выявления НТГ. Он был выше при более высоком исходном уровне гликемии через 2 ч после нагрузки глюкозой, а также при большой прибавке массы тела [12]. По данным отечественных исследователей, одним из ведущих факторов риска прогрессирования НТГ до СД 2-го типа является инсулинорезистентность [13].
Приведенные нами клинические наблюдения согласуются с литературными данными как по частоте выявления НТГ среди детей с ожирением, так и по вариабельности исходов данного состояния. В первом клиническом случае после НТГ на фоне стабилизации и небольшого уменьшения SDSимт отмечена нормализация показателей гликемии. В то же время во втором клиническом случае у пациентки с морбидным ожирением сначала была диагностирована НТГ, затем нормогликемия, а при следующем проведении ПГТТ – СД 2-го типа. Существенных различий по выраженности инсулинорезистентности между приведенными пациентами выявлено не было. Распространенность НГН в детском возрасте обычно ниже, чем НТГ и составляет 3–8% [8–10], хотя в отдельных популяциях может быть значительно выше, в частности среди шведских детей с выраженным ожирением она достигает 36% [6]. Интересно отметить, что среди обследованных за 2019 г. пациентов с ожирением не выявлено ни одного с НГН. Это может быть отчасти обусловлено небольшой выборкой, но за предшествующие 5 лет пациенты с НГН были единичны.
СД обычно выявляется по результатам ПГТТ у 2–6,5% детей и подростков с ожирением, что значительно реже, чем НТГ [7, 9, 10]. Небольшое преобладание девочек среди пациентов с СД 2-го типа, выявленное среди наших пациентов, ранее описано в литературе. Считается, что манифестация СД 2-го типа в детском возрасте более типична для женского пола [12].
В связи с высоким риском развития нарушений углеводного обмена рекомендовано после достижения ребенком с ожирением 10-летнего возраста повторять ПГТТ каждые 2 года [3].
У пациентов с СД 2-го типа и ожирением обычно выявляются признаки НЖБП, так как эти состояния имеют сходные механизмы патогенеза [7, 9]. Также при манифестации СД 2-го типа в детском возрасте с высокой частотой могут выявляться и другие осложнения ожирения и СД: АГ – в 11,6–33,8%, дислипидемия – 4,5–79,7%, микроальбуминурия – 6,3–16,6%, ретинопатия – 13,9% [13, 14]. Раннее формирование осложнений и быстрое развитие инсулинопотребности, продемонстрированные в клиническом случае 3, являются характерной особенностью СД 2-го типа в детском возрасте [3].
Манифестация в детском возрасте более типична для СД 1-го типа, а сочетание с ожирением более характерно для СД 2-го типа. Последний клинический случай наглядно демонстрирует принципы дифференциальной диагностики СД 1-го и 2-го типов у ребенка с ожирением. При сочетании ожирения и СД проводят исследования инсулина и С-пептида. Высокие показатели, характерные для инсулинорезистентности, подтверждают наличие СД 2-го типа. При низких значениях проводят исследование антител, типичных для аутоиммунного поражения β-клеток при СД 1-го типа [3].
После постановки диагноза СД 2-го типа пациенту даются рекомендации по диете и физическим нагрузкам, а при их неэффективности назначается таблетированная терапия. При недостижении компенсации на лечении пероральными препаратами, как это продемонстрировано в клиническом случае 3, назначается инсулинотерапия [3, 15].
Одним из важных элементов лечения является контроль гликемии. В действующих отечественных и международных клинических рекомендациях даны единые целевые значения гликемии, к которым нужно стремиться для компенсации углеводного обмена независимо от типа СД. Частота контроля также не зависит от типа СД, а рекомендуется с учетом терапии: при пероральной сахароснижающей терапии и (или) базальном инсулине не менее 1 р/сут в разное время и дополнительно 1 гликемический профиль в неделю, а на интенсифицированной инсулинотерапии – 6–10 р/сут. В период подбора терапии, при стрессах и интеркуррентных заболеваниях рекомендуется проводить дополнительные измерения [3, 15, 16].
К сожалению, пациенты с СД 2-го типа обычно демонстрируют невысокую приверженность к самоконтролю. Так как абсолютное большинство детей и подростков с СД 2-го типа принимают пероральные препараты, у них не возникает потребности в постоянном непрерывном мониторинге гликемии. В связи с отсутствием необходимости ежедневной коррекции терапии они редко ведут дневниковые записи, что существенно затрудняет оценку компенсации заболевания при обращении к детскому эндокринологу. В частности нам удалось получить реальные дневниковые записи лишь у пациента 1 и только за период длительностью 2 нед. в течение 1 года, предшествовавшего последней госпитализации (рис. 2), хотя именно этот пациент не нуждался в постоянных измерениях гликемии, так как у него не был диагностирован СД 2-го типа. У пациентов 2 и 3, несмотря на наличие диагноза СД 2-го типа, дневниковые записи отсутствовали, и все данные о контроле гликемии в домашних условиях были получены со слов пациентов и их родителей.
В качестве одного из рациональных подходов к самоконтролю можно рассматривать использование мобильных приложений, в которые данные из глюкометра могут загружаться автоматически [16]. В последнем клиническом случае результаты измерения гликемии представлены в виде распечатки дневника из бесплатного мобильного приложения, в котором автоматически фиксируются все измерения гликемии, проводимые сопряженным с ним глюкометром. Приложение также позволяет вручную вносить отметки о приеме пищи, физической активности, дозе лекарственных препаратов и значениях гликемии, измеренных с помощью других устройств. Дневниковые записи и структурированные отчеты можно просматривать на мобильном телефоне или пересылать на электронную почту. Кроме этого, при установке аналогичного приложения на смартфон родителей они могут в режиме реального времени получать информацию об измерениях, что также должно способствовать повышению приверженности к самоконтролю.
Положительное влияние подобных мобильных приложений на компенсацию СД 2-го типа продемонстрировано в исследованиях с участием взрослых [17]. В частности доказано, что использование мобильных приложений, сопряженных с измерением гликемии, при СД 2-го типа способствует увеличению доли пациентов с гликированным гемоглобином ниже 7% [18]. А использование глюкометра со световым индикатором, оповещающим о соответствии показателя гликемии целевым значениям, повышает удовлетворенность пациента проводимыми процедурами самоконтроля [19]. Обучение пациентов использованию дополнительных функций глюкометра, например, внесению отметок о приеме пищи или дозе препарата, является еще одним фактором, влияющим на приверженность пациентов к самоконтролю [20]. С учетом популярности смартфонов такой вид ведения дневника самоконтроля может быть более приемлем для подростков [16].
Заключение
При скрининге осложнений ожирения у детей и подростков нарушения углеводного обмена могут выявляться почти у каждого пятого пациента. Предиабет (НГН и НТГ) в детском возрасте может носить транзиторный характер, сменяясь на нормогликемию, или трансформироваться в СД 2-го типа, что может быть обнаружено при повторном обследовании. С учетом этой особенности детского возраста детям с ожирением, достигшим 10 лет, целесообразно проводить ПГТТ каждые 2 года. При выявлении СД у ребенка с ожирением необходимо проводить дифференциальную диагностику СД 1-го и 2-го типов. Терапия СД 2-го типа подбирается под контролем гликемии. Необходимо обучать пациентов с СД 2-го типа навыкам самоконтроля наравне с пациентами с СД 1-го типа и мотивировать регулярно контролировать гликемию в домашних условиях.
Список литературы / References
- NCD Risk Factor Collaboration (NCD-RisC). Worldwide Trends in BodyMass Index, Underweight, Overweight, and Obesity from 1975 to 2016: A Pooled Analysis of 2416 PopulationBased Measurement Studies in 128•9 Million Children, Adolescents, and Adults. Lancet. 2017;390(10113):2627-2642. https://doi.org/10.1016/S0140-6736(17)32129-3.
- НамазоваБаранова Л.С., Елецкая К.А., Кайтукова Е.В., Макарова С.Г. Оценка физического развития детей среднего и старшего школьного возраста: анализ результатов одномоментного исследования. Педиатрическая фармакология. 2018;15(4):333-342. https://doi.org/10.15690/pf.v15i4.1948.
- Дедов И.И., Шестакова М.В., Майоров А.Ю., Викулова О.К., Галстян Г.Р., Кураева Т.Л. и др. Алгоритмы специализированной медицинской помощи больным сахарным диабетом. Под ред. И.И. Дедова, М.В. Шестаковой, А.Ю. Майорова 9-й вып. Сахарный диабет. 2019;22(1S1): 1-144. https://doi.org/10.14341/DM221S1.
- MayerDavis E.J., Lawrence J.M., Dabelea D., Divers J., Isom S., Dolan L. et al. Incidence Trends of Type 1 and Type 2 Diabetes among Youths, 2002-2012. N Engl J Med. 2017;376(15):1419-1429. https://doi.org/10.1056/NEJMoa1610187.
- Дедов И.И., Петеркова В.А. (ред.). Федеральные клинические рекомендации (протоколы) по ведению детей с эндокринными заболеваниями. М.: Практика; 2014. 442 с. Режим доступа: https://minzdrav.gov-murman.ru/documents/poryadkiokazaniya-meditsinskoypomoshchi/deti 2015(1).pdf.
- Ek A.E., Rössner S.M., Hagman E., Marcus C. High Prevalence of Prediabetes in a Swedish Cohort of Severely Obese Children. Pediatr Diabetes. 2015;16(2):117-128. https://doi.org/10.1111/pedi.12136.
- Newton K.P., Hou J., Crimmins N.A., Lavine J.E., Barlow S.E., Xanthakos S.A. et al. Prevalence of Prediabetes and Type 2 Diabetes in Children with Nonalcoholic Fatty Liver Disease. JAMA Pediatr. 2016;170(10):e161971. https://doi.org/10.1001/jamapediatrics.2016.1971.
- Di Bonito P., Pacifico L., Chiesa C., Valerio G., Miraglia Del Giudice E., Maffeis C. et al. Impaired Fasting Glucose and Impaired Glucose Tolerance in Children and Adolescents with Overweight/Obesity. J Endocrinol Invest. 2017;40(4):409-416. https://doi.org/10.1007/s40618-016-0576-8.
- Koutny F., Weghuber D., Bollow E., GreberPlatzer S., Hartmann K., Körner A. et al. Prevalence of Prediabetes and Type 2 Diabetes in Children with Obesity and Increased Transaminases in European GermanSpeaking Countries. Analysis of the APV Initiative. Pediatr Obes. 2020;15(4):e12601. https://doi.org/10.1111/ijpo.12601.
- Ciba I., Warnakulasuriya L.S., Adikaram A.V.N., Bergsten P., Dahlbom M., Fernando M.M.A. et al. Prevalence of Different States of Glucose Intolerance in Sri Lankan Children and Adolescents with Obesity and Its Relation to Other Comorbidities. Pediatr Diabetes. 2021;22(2):168-181. https://doi.org/10.1111/pedi.13145.
- Yip W.C.Y., Sequeira I.R., Plank L.D., Poppitt S.D. Prevalence of PreDiabetes across Ethnicities: A Review of Impaired Fasting Glucose (IFG) and Impaired Glucose Tolerance (IGT) for Classification of Dysglycaemia. Nutrients. 2017;9(11):1273. https://doi.org/10.3390/nu9111273.
- Kleber M., deSousa G., Papcke S., Wabitsch M., Reinehr T. Impaired Glucose Tolerance in Obese White Children and Adolescents: Three to Five Year FollowUp in Untreated Patients. Exp Clin Endocrinol Diabetes. 2011;119(3):172-176. https://doi.org/10.1055/s-0030-1263150.
- Copeland K.C., Zeitler P., Geffner M., Guandalini C., Higgins J., Hirst K. et al. Characteristics of Adolescents and Youth with RecentOnset Type 2 Diabetes: the TODAY Cohort at Baseline. J Clin Endocrinol Metab. 2011;96(1):159-167. https://doi.org/10.1210/jc.2010-1642.
- Tryggestad J.B., Willi S.M. Complications and Comorbidities of T2DM in Adolescents: Findings from the TODAY Clinical Trial. J Diabetes Complications. 2015;29(2):307-312. https://doi.org/10.1016/j.jdiacomp.2014.10.009.
- Петеркова В.А., Шестакова М.В., Безлепкина О.Б., Лаптев Д.Н., Кураева Т.Л., Майоров А.Ю. и др. Сахарный диабет 1 типа у детей. Сахарный диабет. 2020;23(1S):4-40. https://doi.org/10.14341/DM12504.
- DiMeglio L.A., Acerini C.L., Codner E., Craig M.E., Hofer S.E., Pillay K., Maahs D.M. ISPAD Clinical Practice Consensus Guidelines 2018: Glycemic Control Targets and Glucose Monitoring for Children, Adolescents, and Young Adults with Diabetes. Pediatr Diabetes. 2018;19 Suppl 27:105-114. https://doi.org/10.1111/pedi.12737.
- Fu H., McMahon S.K., Gross C.R., Adam T.J., Wyman J.F. Usability and Clinical Efficacy of Diabetes Mobile Applications for Adults with Type 2 Diabetes: A Systematic Review. Diabetes Res Clin Pract. 2017;131:70-81. https://doi.org/10.1016/j.diabres.2017.06.016.
- Yu Y., Yan Q., Li H., Li H., Wang L., Wang H. et al. Effects of Mobile Phone Application Combined with or without SelfMonitoring of Blood Glucose on Glycemic Control in Patients with Diabetes: A Randomized Controlled Trial. J Diabetes Investig. 2019;10(5):1365-1371. https://doi.org/10.1111/jdi.13031.
- Al Hayek A., Alwin Robert A., Al Dawish M. Patient Satisfaction and Clinical Efficacy of Novel Blood Glucose Meters Featuring Color Range Indicators in Patients with Type 2 Diabetes: A Prospective Study. Cureus. 2020;12(10):e11195. https://doi.org/10.7759/cureus.11195.
- Bergenstal R.M., Bode B.W., Tamler R., Trence D.L., Stenger P., Schachner H.C. et al. Advanced Meter Features Improve Postprandial and Paired SelfMonitoring of Blood Glucose in Individuals with Diabetes: Results of the Actions with the CONTOUR Blood Glucose Meter and Behaviors in Frequent Testers (ACT) Study. Diabetes Technol Ther. 2012;14(10):851-857. https://doi.org/10.1089/dia.2012.0051.




 1
1 2
2 3
3 4
4


Комментарии (0)