Журнал "Медицинский совет" №15/2022
DOI: 10.21518/2079-701X-2022-16-15-119-126
В.В. Цуканов, ORCID: 0000-0002-9980-2294
А.В. Васютин, ORCID: 0000-0002-6481-3196
Ю.Л. Тонких, ORCID: 0000-0001-7518-1895
Красноярский научный центр Сибирского отделения Российской академии наук, Научно-исследовательский институт медицинских проблем Севера; 660022, Россия, Красноярск, ул. Партизана Железняка, д. 3г
Выполнен обзор современных данных литературы, обосновывающий высокую распространенность и социальную значимость синдрома раздраженного кишечника (СРК). В различных регионах мира распространенность СРК колеблется от 10 до 15%. Патогенез СРК является мультифакториальным процессом, включающим нарушения моторики, вялотекущее иммунное воспаление, изменение кишечной проницаемости, дисбиоз, воздействие инфекционных агентов, нарушения питания, нейрогуморальную дисрегуляцию, изменения центральной нервной системы (психологический стресс, когнитивная дисфункция) в сочетании с генетическими факторами. Сложность патогенеза обусловливает гетерогенность клинических проявлений СРК, среди которых могут наблюдаться формы с преобладанием болевого синдрома, запора, диареи, метеоризма, что, в свою очередь, затрудняет подходы к лечению этого заболевания. Сейчас признано определяющее значение фекального дисбиоза для патогенеза функциональной патологии кишечника. Систематический обзор 2019 г. продемонстрировал отчетливое снижение родов Bifidobacterium и Faecalibacterium, увеличение семейств Lactobacillaceae, Enterobacteriaceae и рода Bacteroides у больных СРК в сравнении со здоровыми лицами. Римские критерии IV пересмотра, рекомендации Британского общества гастроэнтерологов, Объединенной европейской гастроэнтерологии и Европейского общества нейрогастроэнтерологии и моторики, Российской гастроэнтерологической ассоциации обосновывают применение пробиотиков для лечения СРК. Плацебо-контролируемые клинические исследования подтверждают действие Bifidobacterium longum 35624 для нормализации частоты и формы стула, купирования общей симптоматики, боли в животе, метеоризма, а также для повышения качества жизни у больных СРК. Экспертный совет, состоявшийся 18 марта 2022 г. в Москве под председательством главного внештатного специалиста гастроэнтеролога Минздрава РФ академика РАН В.Т. Ивашкина, подтвердил эффективность пробиотиков в лечении СРК.
Для цитирования: Цуканов В.В., Васютин А.В., Тонких Ю.Л. Современные аспекты ведения пациентов с синдромом раздраженного кишечника. Медицинский совет. 2021;(5):22–28. doi: 10.21518/2079-701X-2021-5-22-28.
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Efficacy of probiotics for the treatment of irritable bowel syndrome
Vladislav V. Tsukanov, ORCID: 0000-0002-9980-2294
Alexander V. Vasyutin, ORCID: 0000-0002-6481-3196
Julia L. Tonkikh, ORCID: 0000-0001-7518-1895
Krasnoyarsk Science Centre of the Siberian Branch of Russian Academy of Science, Scientific Research Institute of medical problems of the North; 3g, Partizan Zheleznyak St., Krasnoyarsk, 660022, Russia
A review of modern data from the study of functional disorders of the digestive tract is performed. In the United States, 4 million people with functional bowel disorders seek medical care annually, and the annual cost of managing these patients is $ 358 million. Due to the urgency of the problem, new developments appear, among which it is necessary to highlight the American College of Gastroenterology (ACG) guidelines for the management of patients with IBS. To examine patients with suspected IBS, the authors of the ACG guideline proposed a positive diagnostic strategy, which is based on a careful study of the anamnesis, focusing on the key symptoms of the relationship between abdominal pain and bowel function during a long course of the disease (more than 6 months) and the absence of alarming symptoms with minimal use of instrumental diagnostic tests. For the diagnosis of IBS, the authors recommended serological testing for celiac disease, determination of fecal calprotectin and C-reactive protein to exclude inflammatory bowel diseases, but they did not consider it necessary to routinely analyze stool for intestinal pathogens. From our point of view, the absence of routine stool analysis for intestinal pathogens is completely inapplicable for Russia, since in our country the frequency of detection of diphyllobothriasis, giardiasis and opisthorchiasis is very high. The ACG consensus drew attention to the need to expand the evidence base for the use of some standard drugs for the treatment of IBS, proposed a number of new drugs (lebiprostone, linaclotide), recommended the use of rifaximin (for the treatment of IBS with a predominance of diarrhea) and tricyclic antidepressants (for the treatment of IBS). Analysis of modern international recommendations suggests that the clinical guidelines of the Russian Gastroenterological Association and the Association of Coloproctologists of Russia for the diagnosis and treatment of IBS are currently the main document governing the management of these patients in our country.
For citation: Tsukanov V.V., Vasyutin A.V., Tonkikh J.L. Modern aspects of the management of patients with irritable bowel syndrome. Meditsinskiy sovet = Medical Council. 2021;(5):22–28. (In Russ.) doi: 10.21518/2079-701X-2021-5-22-28.
Conflict of interest: the authors declare no conflict of interest.
Введение
Синдром раздраженного кишечника (СРК) – функциональное расстройство, характеризующееся абдоминальной болью и дискомфортом, ассоциированными с изменением частоты и формы стула [1]. Распространенность СРК варьирует от 7% в Юго-Восточной Азии и на Среднем Востоке до 11,8–14,0% в Северной Америке, Северной Европе и Австралии и 15,0–21,0% в Южной Европе, Африке, Южной Америке [2, 3]. Проявления СРК оказывают значительное влияние на качество жизни, достигая наибольшего значения у пациентов с преобладанием диареи [4]. Высокая частота патологии, сопровождающаяся значительным снижением качества жизни, обусловливает ее чрезвычайно высокую глобальную социальную значимость [5].
Патогенез синдрома раздраженного кишечника
Патогенез СРК является мультифакториальным процессом, включающим нарушения моторики, вялотекущее иммунное воспаление, изменение кишечной проницаемости, дисбиоз, воздействие инфекционных агентов, нарушения питания, нейрогуморальную дисрегуляцию, изменения центральной нервной системы (психологический стресс, когнитивная дисфункция) в сочетании с генетическими факторами [6, 7]. Сложность патогенеза обусловливает гетерогенность клинических проявлений СРК, среди которых могут наблюдаться формы с преобладанием болевого синдрома, запора, диареи, метеоризма [8], что, в свою очередь, затрудняет подходы к лечению этого заболевания [9].
Роль изменения фекального микробиома в патогенезе синдрома раздраженного кишечника
Важным аспектом является доказательство изменений микробиома у больных СРК. Наиболее значимой работой в этом плане явился систематический обзор с участием P. Moayyedi, опубликованный в журнале Gastroenterology в 2019 г. [10]. С целью подготовки обзора авторы отобрали 24 работы. Для изучения микробиома в 11 исследованиях применялась методика секвенирования гена 16S рибосомальной рибонуклеиновой кислоты (рНК), в 11 работах использовалась количественная полимеразная цепная реакция, в трех исследованиях применяли флюоресцентную гибридизацию, в двух работах определение включало посев бактериальной культуры. Статистическая обработка продемонстрировала отчетливое снижение родов Bifidobacterium и Faecalibacterium, увеличение семейств Lactobacillaceae, Enterobacteriaceae и рода Bacteroides у больных СРК, в сравнении со здоровыми лицами. В другом метаанализе, опубликованном в 2019 г., авторы отобрали 23 исследования (1340 пациентов) из Северной Америки, Европы и Азии. Фекальный микробиом исследовался при помощи секвенирования гена 16S рНК. У больных СРК, в сравнении со здоровыми лицами, было снижено содержание Lactobacillus (p < 0,001) и Bifidobacterium (p < 0,001), увеличено содержание Escherichia coli (p < 0,001) и Enterobacter (p = 0,001). Не было найдено отличий в содержании Bacteroides (p = 0,18) и Enterococcus (p = 0,18) [11].
В работе финских авторов было обследовано 24 пациента с СРК и 23 здоровых человека. Фекальный микробиом определялся при помощи метода секвенирования гена 16S рНК. Математическая обработка показала достоверное отличие бактериальных популяций в изученных группах. У больных СРК было увеличено содержание родов Coprococcus, Collinsella и Coprobacillus [12]. Наличие фекального дисбиоза у больных СРК, в сравнении со здоровыми лицами, поддерживается Римскими критериями IV пересмотра [1], рекомендациями Британского общества гастроэнтерологов (публикация в журнале Gut в 2021 г.) [13], новыми рекомендациями Объединенной европейской гастроэнтерологии (United European Gastroenterology) и Европейского общества нейрогастроэнтерологии и моторики (European Society for Neurogastroenterology and Motility) [14], рекомендациями Российской гастроэнтерологической ассоциации (РГА) [15], показано в обзорных статьях авторов из США [16], Европы [17], Японии [18], Индии [8, 19] и России [20].
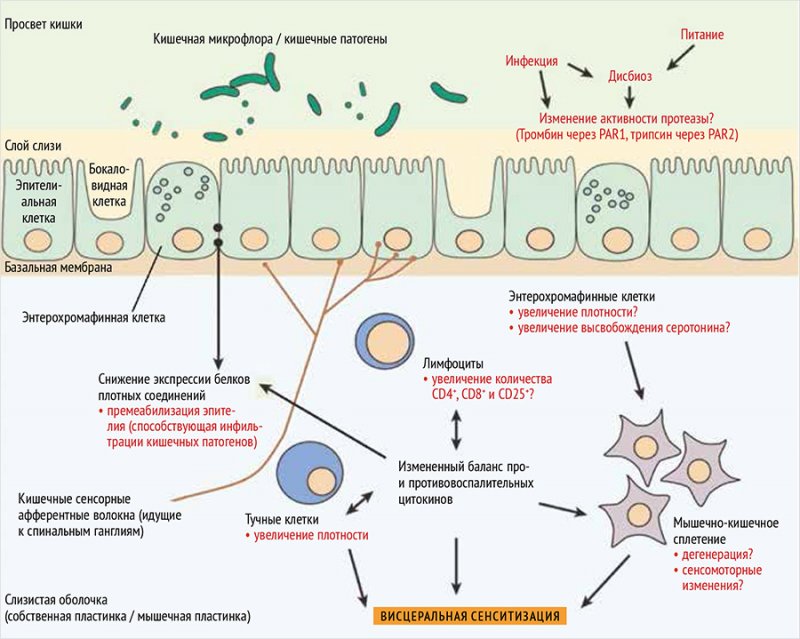
В настоящее время очевидно, что дисбиоз является ключевым звеном патогенеза СРК [18, 21, 22]. Он приводит к увеличению кишечной проницаемости, проникновению бактерий и их фрагментов в кровоток, что стимулирует вялотекущее иммунное воспаление в стенке кишечника [23]. У больных СРК в стенке кишечника обнаруживается увеличение количества активированных иммунокомпетентных клеток, включая Т-лимфоциты, нейтрофилы и тучные клетки [24, 25]. Принципиальное значение имеют механизмы конвергенции дисбиоза, нейроэндокринных и иммунных механизмов в патогенезе СРК [26]. Необходимо обратить внимание, что тучные клетки секретируют не только интерлейкин (IL) 6 и IL-1β, но и гистамин, триптазу, химазу и протеазы. Как известно, гистамин и триптаза являются нейромедиаторами, играющими активную роль в секреторной и моторной функциях желудочно-кишечного тракта. Ряд авторов продемонстрировали зависимость функции подслизистых нейронов у пациентов с СРК от гистамина, триптазы и серотонина [27]. Было показано, что повышение активности тучных клеток коррелирует с изменением висцеральной чувствительности [28]. Ключевые факторы взаимосвязи дисбиоза и иммунной активации в патофизиологии СРК показаны на рис. 1 [29].
Рисунок 1. Ключевые факторы, вовлеченные в иммунную активацию, и потенциальные патофизиологические механизмы у больных синдромом раздраженного кишечника
Возможность применения пробиотиков в лечении синдрома раздраженного кишечника
По вопросу включения пробиотиков в схему лечения СРК существует определенная дискуссия. В 2022 г. были опубликованы рекомендации Американской гастроэнтерологической ассоциации (AGA) по лечению пациентов с СРК с преобладанием запора или диареи, не упоминающие о пробиотиках [30, 31]. Но противоположная точка зрения, отстаивающая целесообразность купирования дисбиоза при помощи пробиотиков, является более весомой. Ее поддерживают ведущие международные рекомендации по ведению пациентов с СРК – Римские критерии IV пересмотра [1], рекомендации Британского общества гастроэнтерологов по диагностике и лечению СРК [13] и опубликованный в 2022 г. гайдлайн Объединенной европейской гастроэнтерологии и Европейского общества нейрогастроэнтерологии и моторики [14]. Европейские рекомендации твердо и однозначно отстаивают свою точку зрения, ссылаясь на достаточную доказательную базу в современных работах.
A. Ford et al. в 2018 г. опубликовали систематический обзор и метаанализ, в который было включено 53 рандомизированных исследования, объединявших 5545 пациентов. Авторы отметили, что пробиотики оказывают положительный эффект на частоту глобальных симптомов СРК и абдоминальной боли [32]. A.P. Hungin et al. в систематическом обзоре рандомизированных и плацебо-контролируемых исследований отобрали 70 работ. В заключение авторы указали, что определен высокий доказательный уровень эффективности пробиотиков в уменьшении общей симптоматики, абдоминальной боли, длительности и интенсивности диареи у пациентов. В положениях консенсуса указывается, что пробиотики уменьшают метеоризм [33]. C.J. Martoni et al. выполнили рандомизированное мультицентровое плацебо-контролируемое исследование эффективности двух разных пробиотиков (Lactobacillus acidophilus DDS-1 и Bifidobacterium animalis subsp. lactis UABla-12) у 330 пациентов с СРК. В итоге было показано, что оба пробиотика были достоверно более эффективны, чем плацебо для купирования общей симптоматики и абдоминальной боли [34].
Принципиально важное значение имеет точка зрения национальных ассоциаций. В 2021–2022 гг. в России были опубликованы рекомендации Научного сообщества по содействию клиническому изучению микробиома человека (НСОИМ) и РГА по применению пробиотиков, пребиотиков и синбиотиков для лечения и профилактики заболеваний гастроэнтерологического профиля у детей и взрослых [35] и рекомендации РГА по ведению пациентов с СРК [15], которые сочли доказательную базу, верифицирующую эффективность пробиотиков в лечении СРК, достаточной и безусловно рекомендовали эту группу препаратов для лечения пациентов с СРК.
Необходимо подчеркнуть, что в настоящее время к качеству пробиотиков предъявляются высокие требования. Рекомендуемая минимальная эффективная суточная доза пробиотиков должна составлять 108–109 колониеобразующих единиц (КОЕ) [36]. Сохранение жизнеспособности штаммов в указанном количестве до конца срока годности пробиотика и синбиотика также является необходимым условием для его эффективного применения. Другим немаловажным фактором, определяющим выживаемость пробиотических микроорганизмов и поступление достаточного количества КОЕ в толстую кишку, является агрессивная среда верхних отделов пищеварительного тракта: высокая кислотность, пищеварительные ферменты и соли желчных кислот [37]. Технологические характеристики штамма пробиотика должны обеспечивать доставку препарата в толстую кишку. Следует подчеркнуть, что пробиотический штамм идентифицируется на уровне рода, вида и имеет буквенное, цифровое или буквенно-цифровое обозначение, например, Bifidobacterium longum 35624, Lactobacillus rhamnosus GG или Bifidobacterium animalis BB-12. Определенный штамм пробиотика должен обладать заявленными эффектами при лечении тех или иных заболеваний или состояний, которые подтверждены клиническими исследованиями [35]. Важно отметить, что Bifidobacterium longum 35624 в клинических исследованиях показал соответствие всем вышеперечисленным требованиям и доказал свою безопасность.
Доказательство эффективности Bifidobacterium longum 35624 в терапии синдрома раздраженного кишечника
В современных международных рекомендациях в качестве одного из пробиотиков присутствуют бифидобактерии, ведущими штаммами среди которых являются Bifidobacterium bifidum, Bifidobacterium breve и Bifidobacterium longum. Бифидобактерии являются грамположительными анаэробными бактериями, которые относятся к типу Actinobacteria. Бифидобактерии, включая Bifidobacterium longum, обладают антиинфекционной, противораковой, противовоспалительной активностью, участвуют в регулировании иммунитета и промотируют психологическое здоровье [38]. НСОИМ и РГА обращают особое внимание на Bifidobacterium longum 35624 (Симбиозис Альфлорекс) для лечения пациентов с СРК [35].
Эффективность лечения СРК при помощи Bifidobacterium longum 35624 хорошо документирована. P.J. Whorwell et al. в плацебо-контролируемом исследовании лечили 362 пациентов с СРК при помощи Bifidobacterium longum 35624 в течение 4 нед. В результате было показано, что назначение Bifidobacterium longum 35624 в дозе 1 × 108 КОЕ было достоверно эффективнее плацебо для улучшения показателей общей симптоматики, абдоминальной боли, метеоризма [39]. L. O’Mahony et al. проводили лечение 77 пациентов с СРК при помощи Lactobacillus salivarius UCC4331 или Bifidobacterium longum 35624 в дозе 1 × 1010 КОЕ в течение 8 нед. в плацебо-контролируемом исследовании. Было продемонстрировано, что применение Bifidobacterium longum 35624 позволило получить достоверное улучшение показателей абдоминальной боли, метеоризма и оптимизировать соотношение IL-10/ IL-12 у пациентов с СРК [40].
В 2022 г. французские гастроэнтерологи J.M. Sabaté и F. Iglicki опубликовали в Journal of Gastroenterology мультицентровое обсервационное исследование, выполнявшееся с 2018 по 2020 г., по изучению эффективности терапии Bifidobacterium longum 35624 в дозе 1 × 109 КОЕ в день в течение 30 дней у пациентов с СРК [41]. Диагностика СРК осуществлялась на основании Римских критериев IV пересмотра [1]. Выраженность симптомов СРК определялась с помощью балльной системы оценки выраженности симптоматики СРК (Irritable Bowel Syndrome Severity Scoring System – IBS-SSS). Количество баллов меньше 75 было индикатором ремиссии, баллы между 75 и 174 указывали на легкую выраженность СРК, баллы от 175 до 299 являлись индикатором средней выраженности СРК и баллы от 300 до 500 позволяли диагностировать выраженное обострение заболевания [42]. Качество жизни определялось при помощи опросника IBS-QOL (Irritable Bowel Syndrome Quality of Life Instrument) [43].
Исходная характеристика участников исследования показана в табл. 1. Следует обратить внимание, что доли лиц с тремя основными субтипами СРК – с преобладанием запора (СРК-З), диареи (СРК-Д) и смешанного (СРК-М) типа – были примерно одинаковыми. Принадлежали к средней и выраженной степеням клинических проявлений СРК по шкале IBS-SSS 94,5% пациентов. Суммарная оценка ответа на лечение Bifidobacterium longum 35624 через 30 дней продемонстрировала отчетливое улучшение показателей оценки тяжести СРК по шкале IBS-SSS и качества жизни пациентов по шкале IBS-QOL (рис. 2). У пациентов с различными субтипами СРК, включая СРК-З, СРК-Д, СРК-М, отмечались однотипные и значительные улучшения качества жизни по шкале IBS-QOL (рис. 3). В итоге лечение СРК Bifidobacterium longum 35624 в течение 30 дней позволило добиться очевидного терапевтического эффекта. Доля лиц с легкой симптоматикой СРК увеличилась через 30 дней лечения в 7,5 раза, доля лиц со средней клиникой СРК снизилась в 1,3 раза, доля лиц с выраженным проявлением СРК уменьшилась в 2,3 раза (табл. 2). По результатам исследования авторы сделали выводы, что у пациентов с СРК, диагностированным на основании Римских критериев IV пересмотра, имевших различные субтипы патологии и различный уровень выраженности симптоматики СРК, лечение при помощи Bifidobacterium longum 35624 в течение 30 дней позволило получить отчетливое снижение выраженности симптоматики СРК и улучшение качества жизни во всех субгруппах пациентов независимо от интенсивности проявлений патологии.
Таблица 1. Исходные характеристики участников исследования
Характеристики | Группа СРК (n = 233) |
Средний возраст, Me (C25 – C75), лет | 51,0 (37–66) |
Женский пол, n (%) | 166 (71,2) |
Индекс массы тела, m ± SD, кг/м2 | 24,5 ± 4,3 |
Подтипы СРК, n (%): • СРК-З; • СРК-Д; • СРК-М; • СРК-Н | 71 (30,5) 89 (38,2) 61 (26,2) 12 (5,2) |
Категории тяжести СРК по шкале IBS-SSS, n (%), баллы: • Ремиссия (0–74); • Легкая (75–174); • Средняя (175–299); • Выраженная (> 300) | 2 (0,8) 11 (4,7) 112 (48,1) 108 (46,4) |
Среднее значение качества жизни при СРК по шкале IBS-QOL (0–100 баллов), m ± SD, баллы | 60,2 ± 20,5 |
Примечание. СРК – синдром раздраженного кишечника; СРК-З – синдром раздраженного кишечника с преобладанием запора; СРК-Д – синдром раздраженного кишечника с преобладанием диареи; СРК-М – синдром раздраженного кишечника смешанного типа; СРК-Н – синдром раздраженного кишечника неспецифический.
Рисунок 2. Оценки тяжести и качества жизни при синдроме раздраженного кишечника на исходном уровне и в конце лечения
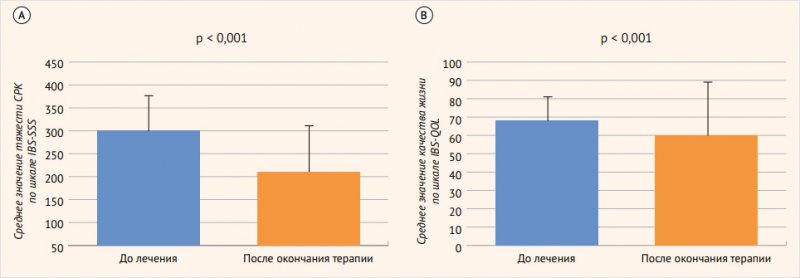
А – оценка тяжести синдроме раздраженного кишечника по шкале IBS-SSS; B – оценка качества жизни при синдроме раздраженного кишечника по шкале IBS-QOL.
Рисунок 3. Оценка качества жизни на исходном уровне и в конце лечения у пациентов с разными субтипами синдрома раздраженного кишечника
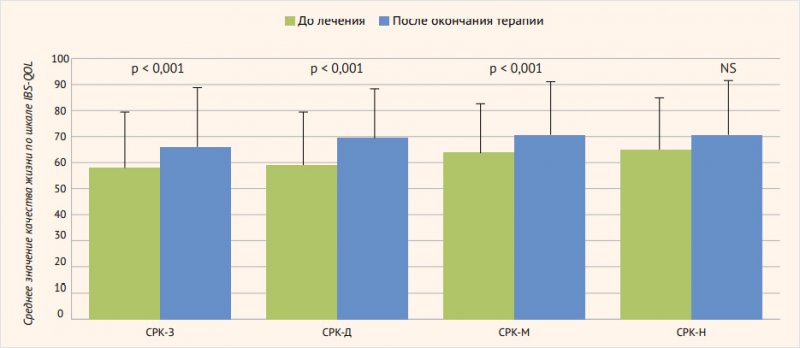
СРК-З – синдром раздраженного кишечника с преобладанием запора; СРК-Д – синдром раздраженного кишечника с преобладанием диареи; СРК-М – синдром раздраженного кишечника смешанного типа; СРК-Н – синдром раздраженного кишечника неспецифический.
Таблица 2. Изменение количества пациентов с синдромом раздраженного кишечника в различных категориях тяжести по шкале IBS-SSS после лечения Bifidobacterium longum 35624
До лечения (n = 233) | n | 2 | 11 | 112 | 108 |
% | 0,9 | 4,7 | 48,1 | 46,4 | |
После окончания терапии (n = 230) | n | 20 | 81 | 83 | 46 |
% | 8,7 | 35,2 | 36,1 | 20,0 | |
ОШ (95% ДИ) р | 0,11 (0,03–0,42) < 0,001 | 0,09 (0,05–0,18) < 0,001 | 1,64 (1,13–2,37) 0,01 | 3,43 (2,27–5,18) < 0,001 | |
Примечание. СРК – синдром раздраженного кишечника; ОШ – отношение шансов; ДИ – доверительный интервал. Достоверность отличий в показателях вычислена при помощи отношения шансов.
С нашей точки зрения, важной является информация об экспертном совете, состоявшемся 18 марта 2022 г. в Москве под председательством главного внештатного специалиста – гастроэнтеролога Министерства здравоохранения Российской Федерации, президента НСОИМ, академика РАН В.Т. Ивашкина, посвященном обсуждению возможностей назначения пробиотиков у пациентов с СРК. Обмен мнениями проводился очно и удаленно с помощью прямой трансляции, что позволило принять участие в заседании экспертам из различных субъектов Российской Федерации (Центральный, Дальневосточный, Приволжский, Северо-Западный, Сибирский, Уральский и Южный федеральные округа РФ) [44].
В своем вступительном слове В.Т. Ивашкин обратил внимание на актуальность и ключевые аспекты оптимизации лечения больных СРК: накопление знаний о роли кишечной микробиоты в патогенезе заболевания, нарастающий интерес к пробиотикам в мировой клинической практике, понимание терапевтических мишеней для пробиотических штаммов и появление практических рекомендаций для обоснованного выбора пробиотиков, зарегистрированных на территории РФ.
С большими докладами, посвященными различным аспектам применения пробиотиков у пациентов с СРК, выступили академик РАН В.Т. Ивашкин и А.И. Ульянин (Москва), академик РАН И.В. Маев (Москва), д.м.н. И.Б. Хлынов (Екатеринбург), д.м.н. Е.А. Полуэктова и к.м.н. Р.В. Масленников (Москва), профессор Н.В. Корочанская (Краснодар), профессор В.И. Симаненков (Санкт-Петербург). В дискуссии приняли участие профессор В.В. Цуканов (Красноярск) и профессор С.А. Алексеенко (Хабаровск).
После обсуждения представленных докладов была принята резолюция экспертного совета, основными положениями которой явились следующие:
1. Изменение состава и функции кишечной микробиоты – неотъемлемая часть патогенеза СРК. Назначение пробиотиков с доказанной эффективностью и отвечающих современным требованиям – обоснованная стратегия оптимизации лечения таких больных.
2. Клиническая эффективность пробиотиков при СРК должна быть обеспечена на основании специфичности входящих в них состав штаммов, должного количества КОЕ микроорганизмов, оптимальной формы выпуска для доставки пробиотических клеток в толстую кишку и соответствующих доз препарата, а также подтверждаться надлежащими клиническими исследованиями.
3. Определенные пробиотические штаммы (включая штаммы Bifidobacterium longum35624) доказали свою эффективность в нормализации частоты и консистенции стула.
4. Кроме антидиарейного действия, пробиотический штамм Bifidobacterium longum 35624 доказал свою эффективность в купировании таких симптомов, как абдоминальная боль и вздутие живота, а также в повышении качества жизни больных СРК.
5. Оптимальная продолжительность приема пробиотиков при СРК – не менее 4 нед., однако возможно увеличение продолжительности курса лечения в зависимости от конкретной клинической ситуации.
Заключение
Выполнен обзор современных данных литературы, обосновывающий высокую распространенность и социальную значимость СРК, определяющее значение фекального дисбиоза для патогенеза функциональной патологии кишечника. Актуальные международные рекомендации обосновывают применение пробиотиков для лечения СРК. Плацебо-контролируемые клинические исследования подтверждают действие Bifidobacterium longum для нормализации частоты и формы стула, купирования общей симптоматики, боли в животе, метеоризма, а также для повышения качества жизни у больных СРК.
Список литературы / References
- Lacy B.E., Mearin F., Chang L., Chey W.D., Lembo A.J., Simren M., Spiller R. Bowel Disorders. Gastroenterology. 2016;150(6):1393-1407. https://doi.org/10.1053/j.gastro.2016.02.031.
- Lovell R.M., Ford A.C. Global prevalence of and risk factors for irritable bowel syndrome: a meta-analysis. Clin Gastroenterol Hepatol. 2012;10(7):712-721.e4. https://doi.org/10.1016/j.cgh.2012.02.029.
- Oka P., Parr H., Barberio B., Black C.J., Savarino E.V., Ford A.C. Global prevalence of irritable bowel syndrome according to Rome III or IV criteria: a systematic review and meta-analysis. Lancet Gastroenterol Hepatol. 2020;5(10):908-917. https://doi.org/10.1016/S2468-1253(20)30217-X.
- Singh P., Staller K., Barshop K., Dai E., Newman J., Yoon S. et al. Patients with irritable bowel syndrome-diarrhea have lower disease-specific quality of life than irritable bowel syndrome-constipation. World J Gastroenterol. 2015;21(26):8103-8109. https://doi.org/10.3748/wjg.v21.i26.8103.
- Black C.J., Ford A.C. Global burden of irritable bowel syndrome: trends, predictions and risk factors. Nat Rev Gastroenterol Hepatol. 2020;17(8):473-486. https://doi.org/10.1038/s41575-020-0286-8.
- Enck P., Mazurak N. The “Biology-First” Hypothesis: Functional disorders may begin and end with biology-A scoping review. Neurogastroenterol Motil. 2018;30(10):e13394. https://doi.org/10.1111/nmo.13394.
- Wang X.J., Camilleri M. Personalized medicine in functional gastrointestinal disorders: Understanding pathogenesis to increase diagnostic and treatment efficacy. World J Gastroenterol. 2019;25(10):1185-1196. https://doi.org/10.3748/wjg.v25.i10.1185.
- Ghoshal U.C. Marshall and Warren Lecture 2019: A paradigm shift in pathophysiological basis of irritable bowel syndrome and its implication on treatment. J Gastroenterol Hepatol. 2020;35(5):712-721. https://doi.org/10.1111/jgh.15032.
- Lacy B.E., Pimentel M., Brenner D.M., Chey W.D., Keefer L.A., Long M.D., Moshiree B. ACG Clinical Guideline: Management of Irritable Bowel Syndrome. Am J Gastroenterol. 2021;116(1):17-44. https://doi.org/10.14309/ajg.0000000000001036.
- Pittayanon R., Lau J.T., Yuan Y., Leontiadis G.I., Tse F., Surette M., Moayyedi P. Gut Microbiota in Patients With Irritable Bowel Syndrome-A Systematic Review. Gastroenterology. 2019;157(1):97-108. https://doi.org/10.1053/j.gastro.2019.03.049.
- Wang L., Alammar N., Singh R., Nanavati J., Song Y., Chaudhary R., Mullin G.E. Gut Microbial Dysbiosis in the Irritable Bowel Syndrome: A Systematic Review and Meta-Analysis of Case-Control Studies. J Acad Nutr Diet. 2020;120(4):565-586. https://doi.org/10.1016/j.jand.2019.05.015.
- Kassinen A., Krogius-Kurikka L., Mäkivuokko H., Rinttilä T., Paulin L., Corander J. et al. The fecal microbiota of irritable bowel syndrome patients differs significantly from that of healthy subjects. Gastroenterology. 2007;133(1):24-33. https://doi.org/10.1053/j.gastro.2007.04.005.
- Vasant D.H., Paine P.A., Black C.J., Houghton L.A., Everitt H.A., Corsetti M. et al. British Society of Gastroenterology guidelines on the management of irritable bowel syndrome. Gut. 2021;70(7):1214-1240. https://doi.org/10.1136/gutjnl-2021-324598.
- Savarino E., Zingone F., Barberio B., Marasco G., Akyuz F., Akpinar H. et al. Functional bowel disorders with diarrhoea: Clinical guidelines of the United European Gastroenterology and European Society for Neurogastroenterology and Motility. United European Gastroenterol J. 2022;10(6):556-584. https://doi.org/10.1002/ueg2.12259.
- Ивашкин В.Т., Шелыгин Ю.А., Баранская Е.К., Ачкасов С.И., Белоус С.С., Белоусова Е.А. и соавт. Диагностика и лечение синдрома раздраженного кишечника. Колопроктология. 2022;21(1):10-25. https://doi.org/10.33878/2073-7556-2022-21-1-10-25. Ivashkin V.T., Shelygin Yu.A., Baranskaya E.K., Achkasov S.I., Belous S.S., Belousova E.A. et al. Irritable bowel syndrome. Koloproktologia. 2022;21(1):10-25. (In Russ.) https://doi.org/10.33878/2073-7556-2022-21-1-10-25.
- Pimentel M., Lembo A. Microbiome and Its Role in Irritable Bowel Syndrome. Dig Dis Sci. 2020;65(3):829-839. https://doi.org/10.1007/s10620-020-06109-5.
- Ghaffari P., Shoaie S., Nielsen L.K. Irritable bowel syndrome and microbiome; Switching from conventional diagnosis and therapies to personalized interventions. J Transl Med. 2022;20(1):173. https://doi.org/10.1186/s12967-022-03365-z.
- Mishima Y., Ishihara S. Molecular Mechanisms of Microbiota-Mediated Pathology in Irritable Bowel Syndrome. Int J Mol Sci. 2020;21(22):8664. https://doi.org/10.3390/ijms21228664.
- Singh R., Zogg H., Ghoshal U.C., Ro S. Current Treatment Options and Therapeutic Insights for Gastrointestinal Dysmotility and Functional Gastrointestinal Disorders. Front Pharmacol. 2022;13:808195. https://doi.org/10.3389/fphar.2022.808195.
- Mamieva Z., Poluektova E., Svistushkin V., Sobolev V., Shifrin O., Guarner F., Ivashkin V. Antibiotics, gut microbiota, and irritable bowel syndrome: What are the relations? World J Gastroenterol. 2022;28(12):1204-1219. https://doi.org/10.3748/wjg.v28.i12.1204.
- Holtmann G.J., Ford A.C., Talley N.J. Pathophysiology of irritable bowel syndrome. Lancet Gastroenterol Hepatol. 2016;1(2):133-146. https://doi.org/10.1016/S2468-1253(16)30023-1.
- Drago L., Valentina C., Fabio P. Gut microbiota, dysbiosis and colon lavage. Dig Liver Dis. 2019;51(9):1209-1213. https://doi.org/10.1016/j.dld.2019.06.012.
- Takakura W., Pimentel M. Small Intestinal Bacterial Overgrowth and Irritable Bowel Syndrome - An Update. Front Psychiatry. 2020;11:664. https://doi.org/10.3389/fpsyt.2020.00664.
- Chadwick V.S., Chen W., Shu D., Paulus B., Bethwaite P., Tie A., Wilson I. Activation of the mucosal immune system in irritable bowel syndrome. Gastroenterology. 2002;122(7):1778-1783. https://doi.org/10.1053/gast.2002.33579.
- Ohman L., Isaksson S., Lindmark A.C., Posserud I., Stotzer P.O., Strid H. et al. T-cell activation in patients with irritable bowel syndrome. Am J Gastroenterol. 2009;104(5):1205-1212. https://doi.org/10.1038/ajg.2009.116.
- Buckley M.M., O’Mahony S.M., O’Malley D. Convergence of neuro-endocrineimmune pathways in the pathophysiology of irritable bowel syndrome. World J Gastroenterol. 2014;20(27):8846-8858. https://doi.org/10.3748/wjg.v20.i27.8846.
- Buhner S., Li Q., Vignali S., Barbara G., De Giorgio R., Stanghellini V. et al. Activation of human enteric neurons by supernatants of colonic biopsy specimens from patients with irritable bowel syndrome. Gastroenterology. 2009;137(4):1425-1434. https://doi.org/10.1053/j.gastro.2009.07.005.
- Barbara G., Stanghellini V., De Giorgio R., Cremon C., Cottrell G.S., Santini D. et al. Activated mast cells in proximity to colonic nerves correlate with abdominal pain in irritable bowel syndrome. Gastroenterology. 2004;126(3):693-702. https://doi.org/10.1053/j.gastro.2003.11.055.
- Цуканов В.В., Каспаров Э.В., Васютин А.В., Тонких Ю.Л. Роль активации иммунной системы в патогенезе синдрома раздраженного кишечника. Дневник Казанской медицинской школы. 2016;(3):63-66. Режим доступа: https://www.elibrary.ru/item.asp?id=27471067. Tsukanov V.V., Kasparov E.V., Vasyutin A.V., Tonkikh J.L. The role of immune system activation in the pathogenesis of irritable bowel syndrome. Diary of the Kazan Medical School. 2016;(3):63-66. (In Russ.) Available at: https://www.elibrary.ru/item.asp?id=27471067.
- Chang L., Sultan S., Lembo A., Verne G.N., Smalley W., Heidelbaugh J.J. AGA Clinical Practice Guideline on the Pharmacological Management of Irritable Bowel Syndrome With Constipation. Gastroenterology. 2022;163(1):118-136. https://doi.org/10.1053/j.gastro.2022.04.016.
- Lembo A., Sultan S., Chang L., Heidelbaugh J.J., Smalley W., Verne G.N. AGA Clinical Practice Guideline on the Pharmacological Management of Irritable Bowel Syndrome With Diarrhea. Gastroenterology. 2022;163(1):137-151. https://doi.org/10.1053/j.gastro.2022.04.017.
- Ford A.C., Harris L.A., Lacy B.E., Quigley E.M.M., Moayyedi P. Systematic review with meta-analysis: the efficacy of prebiotics, probiotics, synbiotics and antibiotics in irritable bowel syndrome. Aliment Pharmacol Ther. 2018;48(10):1044-1060. https://doi.org/10.1111/apt.15001.
- Hungin A.P.S., Mitchell C.R., Whorwell P., Mulligan C., Cole O., Agréus L. et al. Systematic review: probiotics in the management of lower gastrointestinal symptoms - an updated evidence-based international consensus. Aliment Pharmacol Ther. 2018;47(8):1054-1070. https://doi.org/10.1111/apt.14539.
- Martoni C.J., Srivastava S., Leyer G.J. Lactobacillus acidophilus DDS-1 and Bifidobacterium lactis UABla-12 Improve Abdominal Pain Severity and Symptomology in Irritable Bowel Syndrome: Randomized Controlled Trial. Nutrients. 2020;12(2):363. https://doi.org/10.3390/nu12020363.
- Ивашкин В.Т., Маев И.В., Абдулганиева Д.И., Алексеенко С.А., Горелов А.В., Захарова И.Н. и др. Практические рекомендации Научного сообщества по содействию клиническому изучению микробиома человека (НСОИМ) и Российской гастроэнтерологической ассоциации (РГА) по применению пробиотиков, пребиотиков, синбиотиков и обогащенных ими функциональных пищевых продуктов для лечения и профилактики заболеваний гастроэнтерологического профиля у детей и взрослых. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2021;31(2):65-91. https://doi.org/10.22416/1382-4376-2021-31-2-65-91. Ivashkin V.T., Maev I.V., Abdulganieva D.I., Alekseenko S.A., Gorelov A.V., Zakharova I.N. et al. Practical Recommendations of Scientific Society for the Study of Human Microbiome and the Russian Gastroenterological Association on Use of Probiotics, Prebiotics, Synbiotics and Functional Foods in Treatment and Prevention of Gastroenterological Diseases in Children and Adults. Russian Journal of Gastroenterology, Hepatology, Coloproctology. 2021;31(2):65-91. (In Russ.) https://doi.org/10.22416/1382-4376-2021-31-2-65-91.
- Shi L.H., Balakrishnan K., Thiagarajah K., Mohd Ismail N.I., Yin O.S. Beneficial Properties of Probiotics. Trop Life Sci Res. 2016;27(2):73-90. https://doi.org/10.21315/tlsr2016.27.2.6.
- Ishibashi N., Yamazaki S. Probiotics and safety. Am J Clin Nutr. 2001;73(Suppl. 2):465S-470S. https://doi.org/10.1093/ajcn/73.2.465s.
- Chen J., Chen X., Ho C.L. Recent Development of Probiotic Bifidobacteria for Treating Human Diseases. Front Bioeng Biotechnol. 2021;9:770248. https://doi.org/10.3389/fbioe.2021.770248.
- Whorwell P.J., Altringer L., Morel J., Bond Y., Charbonneau D., O’Mahony L. et al. Efficacy of an encapsulated probiotic Bifidobacterium infantis 35624 in women with irritable bowel syndrome. Am J Gastroenterol. 2006;101(7):1581-1590. https://doi.org/10.1111/j.1572-0241.2006.00734.x.
- O’Mahony L., McCarthy J., Kelly P., Hurley G., Luo F., Chen K. et al. Lactobacillus and bifidobacterium in irritable bowel syndrome: symptom responses and relationship to cytokine profiles. Gastroenterology. 2005;128(3):541-551. https://doi.org/10.1053/j.gastro.2004.11.050.
- Sabaté J.M., Iglicki F. Effect of Bifidobacterium longum 35624 on disease severity and quality of life in patients with irritable bowel syndrome. World J Gastroenterol. 2022;28(7):732-744. https://doi.org/10.3748/wjg.v28.i7.732.
- Francis C.Y., Morris J., Whorwell P.J. The irritable bowel severity scoring system: a simple method of monitoring irritable bowel syndrome and its progress. Aliment Pharmacol Ther. 1997;11(2):395-402. https://doi.org/10.1046/j.1365-2036.1997.142318000.x.
- Drossman D.A., Patrick D.L., Whitehead W.E., Toner B.B., Diamant N.E., Hu Y. et al. Further validation of the IBS-QOL: a disease-specific quality-of-life questionnaire. Am J Gastroenterol. 2000;95(4):999-1007. https://doi.org/10.1111/j.1572-0241.2000.01941.x.
- Ивашкин В.Т., Маев И.В., Алексеева О.П., Алексеенко С.А., Корочанская Н.В., Полуэктова Е.А. и др. Определение показаний к назначению пробиотиков у пациентов с синдромом раздраженного кишечника (обзор литературы и резолюция Совета экспертов). Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2022;32(2):9-18. https://doi.org/10.22416/1382-4376-2022-32-2-9-18. Ivashkin V.T., Maev I.V., Alekseeva O.P., Alekseenko S.A., Korochanskaya N.V., Poluektova E.A. et al. Determination of Probiotics Prescription Indications in Patients with Irritable Bowel Syndrome (Materials of the Expert Council and Literature Review). Russian Journal of Gastroenterology, Hepatology, Coloproctology. 2022;32(2):9-18. (In Russ.) https://doi.org/10.22416/1382-4376-2022-32-2-9-18.



 1
1 2
2 3
3 4
4


Комментарии (0)