
Журнал "Медицинский совет" №18/2023
А.С. Островская, https://orcid.org/0000-0002-9152-1279
М.В. Маевская, https://orcid.org/0000-0001-8913-140X
Первый Московский государственный медицинский университет имени И.М. Сеченова (Сеченовский Университет); 119991, Россия, Москва, ул. Трубецкая, д. 8, стр. 2
Обзор посвящен наиболее актуальной информации по патогенезу, диагностике и лечению саркопении и мальнутриции у пациентов с заболеваниями печени. Саркопения и мальнутриция – распространенные осложнения заболеваний печени. Цирроз печени как стадия патологического процесса служит основным предрасполагающим фактором для развития мальнутриции и саркопении. Частота саркопении при циррозе печени составляет 30–50% и доходит до 100% у декомпенсированных пациентов. Основными патогенетическими звеньями являются: нарушение протеостаза скелетных мышц, системное воспаление и изменение микробиоты кишечника. За последние годы накоплено достаточно данных для того, чтобы рассматривать эти состояния как прогностически неблагоприятный фактор у пациентов с циррозом печени различной этиологии, влияющий на их качество жизни и выживаемость, а также ухудшающий исходы трансплантации. Это диктует необходимость определения унифицированных подходов к диагностике и коррекции данных состояний. В настоящее время для диагностики используются тесты, позволяющие оценить мышечную силу и функцию. Оценка мышечной массы проводится с применением инструментальных методов путем измерения отдельных мышц и расчета скелетно-мышечных индексов. У пациентов с циррозом печени и сопутствующей саркопенией и мальнутрицией с целью коррекции, помимо терапии, направленной на элиминацию этиологического фактора, применимы стратегии модификации питания и образа жизни. Цель обзора – на основе литературных данных оценить проблемы диагностики и эффективного лечения недостаточности питания и саркопении у пациентов с заболеваниями печени. В статье представлен обзор основных стратегий к подходу, диагностике и коррекции данных состояний.
Для цитирования: Островская А.С., Маевская М.В. Саркопения и мальнутриция у пациентов с заболеваниями печени. Медицинский Совет. 2023;(18):35-42. https://doi.org/10.21518/ms2023-374
Конфликт интересов: автор заявляет об отсутствии конфликта интересов.
Anna S. Ostrovskaya, https://orcid.org/0000-0002-9152-1279
Marina V. Maevskaya, https://orcid.org/0000-0001-8913-140X
Sechenov First Moscow State Medical University (Sechenov University); 1, Bldg. 1, Pogodinskaya St., Moscow, 119991, Russia
This review focuses on the most current information on the pathogenesis, diagnosis and treatment of sarcopenia and malnutrition in patients with liver disease. Sarcopenia and malnutrition are common complications of liver diseases. Liver cirrhosis, as a stage of the pathological process, serves as the main predisposing factor for the development of malnutrition and sarcopenia. The frequency of sarcopenia in liver cirrhosis is 30–50% and reaches 100% in decompensated patients. The main pathogenetic links are: impaired proteostasis of skeletal muscles, systemic inflammation and changes in gut microbiota. In recent years, enough data have been accumulated to consider these conditions as a prognostically unfavorable factor in patients with liver cirrhosis of various etiologies, affecting their quality of life and survival, as well as worsening the outcomes of transplantation. This dictates the necessity to define unified approaches to diagnostics and correction of these conditions. Currently, tests are used for diagnosis, which allow to assess muscle strength and function. Muscle mass is assessed using instrumental methods by measuring individual muscles and calculating skeletal muscle indices. In patients with liver cirrhosis and concomitant sarcopenia and malnutrition, nutritional and lifestyle modification strategies are applicable for correction in addition to therapy aimed at elimination of the etiologic factor. The aim of the review is to evaluate the problems of diagnosis and effective treatment of malnutrition and sarcopenia in patients with liver disease based on literature data. The article presents an overview of the main strategies for the approach, diagnosis and correction of these conditions.
For citation: Ostrovskaya A.S., Maevskaya M.V. Sarcopenia and malnutrition in patients with liver diseases. Meditsinskiy sovet = Medical Council. 2023;(18):35-42. (In Russ.) https://doi.org/10.21518/ms2023-374
Conflict of interest: the author declares no conflict of interest.
Введение
В последние годы мировое сообщество терапевтов, геронтологов, узких специалистов все чаще обращает внимание на проблемы веса, питания и физической активности у своих пациентов. В практике врача-гастроэнтеролога наиболее уязвимыми в плане развития мальнутриции и саркопении являются пациенты с заболеваниями печени, поскольку печень играет ключевую роль в регуляции метаболизма и энергетического баланса. Кроме того, хронические заболевания печени могут вызывать снижение аппетита, что приводит к уменьшению потребления питательных веществ. Важно отметить, что среди всех причин поражения печени хроническое злоупотребление алкоголем является сильным предиктором недостаточности питания [1]. Цирроз печени как стадия патологического процесса служит основным предрасполагающим фактором для развития мальнутриции и саркопении.
Мальнутриция, или недоедание, определяется как недостаточное поступление или усвоение питательных веществ [2]. Мальнутриция является распространенным осложнением у пациентов с продвинутой стадией заболеваний печени.
Саркопения. В 1989 г. И. Розенберг определил саркопению (греч. sarx – плоть и penia – потеря) как потерю мышечной массы после сравнения тощей массы бедра пожилой и молодой женщины. В 2010 г. Европейская рабочая группа по саркопении у пожилых людей (European Working Group on Sarcopenia in Older People – EWGSOP) опубликовала определение саркопении, которое получило широкое распространение во всем мире. Данное определение способствовало прогрессу в выявлении саркопении и уходе за людьми с риском ее развития или с ее проявлениями. В 2018 г. рабочая группа (EWGSOP2) провела повторное заседание, по результатам которого были выпущены обновленные данные по саркопении. В настоящее время саркопения официально признана мышечным заболеванием и имеет диагностический код МКБ-10. Согласно обновленному консенсусу рабочей группы по изучению саркопении (EWGSOP) саркопения – это прогрессирующее и генерализованное заболевание скелетных мышц, которое ассоциируется с повышенной вероятностью неблагоприятных исходов, включая падения, переломы, физическую инвалидизацию и смертность [3].
Понятие саркопении, появившееся всего несколько десятилетий назад в области питания и определения состава тела, сначала широко использовалось только для описания низкой мышечной массы. В последующем стало понятно, что саркопения включает в себя также и сниженное функциональное состояние мышц.
Многочисленные и взаимодополняющие определения мальнутриции и саркопении существуют в публикациях вне области гепатологии; однако мировое гепатологическое сообщество еще не выработало консенсусного определения этих состояний для пациентов с заболеваниями печени. Саркопения долгое время ассоциировалась со старением и пожилым возрастом, но в настоящее время известно, что фенотип саркопении имеет множество причин, не связанных со старением.
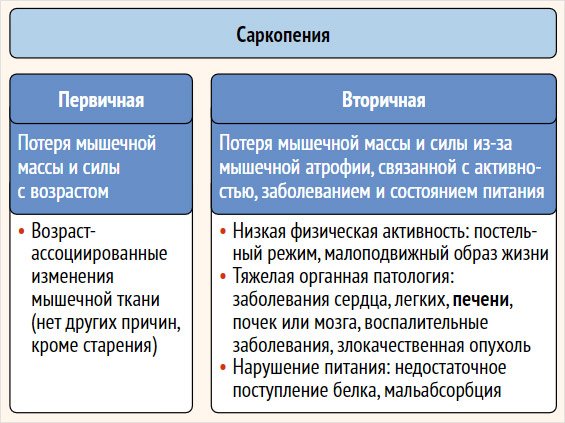
Саркопению условно подразделяют на первичную и вторичную. О первичной саркопении говорят, когда происходят изменения мышечной массы и силы, ассоциированные с возрастом без каких-либо других причин, кроме старения. Вторичная саркопения связана с различными состояниями и заболеваниями, например нарушением питания, ограничением физической активности или заболеваниями различных органов и систем [4]. Саркопения, ассоциированная с заболеваниями печени, в соответствии с классификацией относится к вторичной (рис. 1)
Рисунок 1. Классификация саркопении (адапт. из [4])
Распространенность и клиническое значение саркопении и мальнутриции
Этиология заболевания печени влияет на распространенность саркопении и мальнутриции. Особенно часто эти состояния встречаются у пациентов с алкогольассоциированными заболеваниями печени.
Распространенность недостаточности питания составляет в среднем 36,4% среди всех пациентов с заболеваниями печени [5]. Сведения по распространенности саркопении, представленные в литературе, вариабельны. По данным разных исследователей, распространенность саркопении при хронических заболеваниях печени составляет от 30–33 до 54–57% [6–8]. Распространенность саркопении увеличивается по мере прогрессирования заболевания. При циррозе печени частота саркопении выше и составляет 65–100%. Среди пациентов с циррозом печени, страдающих саркопенией, примерно 20% имеют компенсированное заболевание, 80% декомпенсированных и до 100% кандидатов на трансплантацию печени [9].
Недостаточность питания у пациентов с заболеваниями печени негативно влияет на качество их жизни [10, 11]. По литературным данным, саркопению следовало бы добавить как прогностический показатель в шкалу MELD [12]. Также саркопения и мальнутриция ассоциируются с повышенным риском развития осложнений цирроза печени, включая печеночную энцефалопатию. По данным K. Wijarnpreecha et al. [13], наличие саркопении у пациентов с циррозом печени связано с примерно двукратным увеличением риска явной и трехкратным увеличением риска минимальной печеночной энцефалопатии.
У пациентов с недостаточностью питания и/или саркопенией увеличивается продолжительность пребывания в стационаре, чаще развивается асцит и гепаторенальный синдром, повышается внутрибольничная смертность [14, 15]. Пациенты – кандидаты на трансплантацию печени с наличием саркопении – в группе риска развития посттрансплантационных осложнений, также у них ниже процент выживаемости после трансплантации печени [16].
Механизмы развития саркопении и мальнутриции
Механизмов развития мальнутриции и саркопении при заболеваниях печени несколько: недостаточное питание, изменение протеостаза скелетных мышц, изменение микробиома кишечника и системное воспаление [17–20].
Чаще всего в развитии мальнутриции при хронических заболеваниях печени присутствует несколько патогенетических факторов: снижение потребления или усвоения пищи и хроническое или острое воспаление различной степени [21], что приводит к изменению состава тела и снижению его биологических функций.
Снижение потребления пищи хорошо известный этиологический фактор недостаточности питания. Нарушению метаболизма и усвоению питательных веществ при заболеваниях печени способствуют: анорексия, гастропарез, тошнота, дисфагия, печеночная энцефалопатия, асцит с/без частыми парацентезами, синдром избыточного бактериального роста в тонкой кишке (СИБР), прием некоторых лекарственных препаратов (диуретики и лактулоза), диета с ограничением натрия, употребление алкоголя. Все эти факторы могут приводить к нарушению обмена веществ и способствовать уменьшению объема потребляемой пищи [22, 23]. Портальная гипертензия способствует повышению проницаемости слизистой оболочки кишечника, вызывая тем самым повышенную потерю белков. Это феномен в т. ч. наблюдается при кровотечениях из варикозно расширенных вен пищевода [24].
Мальабсорбция приводит к дефициту микронутриентов. Дефицит фолата, тиамина, цинка, селена витамина Д и Е описан у пациентов с алкогольной этиологией заболевания, дефицит жирорастворимых витаминов – у пациентов с холестатическими заболеваниями печени (за счет нарушения энтерогепатической циркуляции желчных солей).
Скелетная мышца – самый большой орган в организме, на ее долю приходится около 50% всей белковой массы тела, и она обеспечивает энерготраты во всем организме [25]. Масса скелетных мышц поддерживается за счет тонкого баланса между катаболизмом и анаболизмом мышечных белков. Атрофия скелетных мышц возникает в результате смещения баланса в сторону распада белка [26, 27]. Наиболее изучены механизмы развития саркопении при циррозе печени. Свой вклад в этот процесс вносят нарушение белкового обмена, повышение уровня аммиака, системное воспаление, снижение уровня тестостерона [28–30].
Три незаменимых аминокислоты с разветвленной боковой цепью (BCAA, Branched-Chain Amino Acids): валин, лейцин и изолейцин – играют важную роль в формировании и поддержании скелетной мускулатуры [22]. Снижение их уровня на фоне заболеваний печени может приводить к уменьшению мышечной массы независимо от возраста. Один из вероятных механизмов аминокислотного дисбаланса заключается в том, что при циррозе печени снижение детоксикационной функции ведет к внепеченочной утилизации аммиака за счет синтеза глутамина в скелетных мышцах, а BCAA используются в качестве субстратов в этом процессе [31].
Важнейшей метаболической функцией печени является преобразование аммиака в мочевину. Печеночно-клеточная недостаточность и портосистемное шунтирование как компоненты патофизиологических изменений при циррозе печени способствуют нарушению образования мочевины. Это оказывает патологическое воздействие на мышцы [32]. Аммиак реализует миотоксическое действие через механизмы, включающие снижение синтеза белка, усиление аутофагии, протеолиза и митохондриальной окислительной дисфункции в скелетных мышцах, что ведет к нарушению сократительной функции мышц и потере мышечной массы [33, 34].
Циркулирующие уровни маркеров воспаления, таких как IL-1, IL-6, IL-10, С-реактивный белок и TNF-α, повышены у пациентов с циррозом печени [32, 35]. Хроническое системное воспаление может способствовать развитию саркопении и последующих осложнений из-за снижения синтеза мышечного белка и повышенной деградации белка [28, 36].
Печень играет важную роль в гормональном обмене. К общим клиническим признакам цирроза печени относятся феминизация фигуры и гинекомастия, которые обусловлены в первую очередь снижением уровня тестостерона и одновременным увеличением соотношения эстрогенов и андрогенов. Эти изменения влияют на обмен мышечного белка, что приводит к подавлению дифференцировки миобластов в клетки скелетных мышц, в результате чего развивается саркопения [31]. Тестостерон специфически воздействует на рецепторы андрогенов в мышечных клетках, способствуя их росту, а также в клетках-сателлитах, способствуя их дифференцировке в новые миоциты; помимо этого, он снижает уровень миостатина и повышает уровень IGF-1, что может обусловливать его эффекты при циррозе печени [37]. Вероятно, дефицит тестостерона при циррозе печени связан с множеством факторов, причем могут быть затронуты все уровни гипоталамо-гипофизарно-тестикулярной оси. Тяжелые системные заболевания любой этиологии, включая печеночную недостаточность, могут снижать секрецию гонадотропин-рилизинг-гормона гипоталамусом и приводить к вторичной тестикулярной недостаточности [38]. Считается, что это, по крайней мере частично, связано с прямым воздействием повышенного уровня воспалительных цитокинов, таких как IL-1, IL-6 и фактор некроза опухоли альфа [39].
Современные подходы к диагностике
В клинической практике для оценки наличия у пациента недостаточности питания в первую очередь прибегают к простым методам, а именно к расспросу пациента о рационе питания и уровне физической активности, для этого существуют специальные опросники и шкалы. Специфическим опросником для оценки степени саркопении является SARC-F (табл. 1), разработанный специально для скрининга и отбора пациентов с подозрением на саркопению.
Таблица 1. SARC-F (опросник для оценки вероятности наличия саркопении)
| Составляющая | Вопрос | Баллы |
| Сила | Насколько тяжело для Вас поднять и удерживать порядка 4—5 кг? | • Совсем не тяжело = 0 • Немного тяжело = 1 • Очень тяжело или не могу поднять = 2 |
| Помощь при ходьбе | Насколько тяжело для Вас пройти по комнате? | • Совсем не тяжело = 0 • Немного тяжело = 1 • Очень тяжело, приходится использовать вспомогательные средства или не могу пройти = 2 |
| Подъем со стула | Насколько тяжело для Вас подняться со стула или кровати? | • Совсем не тяжело = 0 • Немного тяжело = 1 • Очень тяжело или не могу встать без посторонней помощи = 2 |
| Подъем по лестнице | Насколько тяжело для Вас пройти лестничный пролет в 10 ступеней? | • Совсем не тяжело = 0 • Немного тяжело = 1 • Очень тяжело или не могу пройти = 2 |
| Падения | Сколько раз Вы упали за последний год? | • Ни разу = 0 • 1—3 падения = 1 • 4 и более падения = 2 |
S Strength – сила; A Assistance – помощь; R Rise – вставание; C Climb – подъем; F Fall – падения 0—3 балла: нет саркопении; >4 баллов: вероятная саркопения
Разработаны также тесты для оценки функциональной активности мышц. Наиболее часто используемым является группа тестов – краткая батарея тестов физической активности (рис. 2).
Рисунок 2. Краткая батарея тестов физической активности
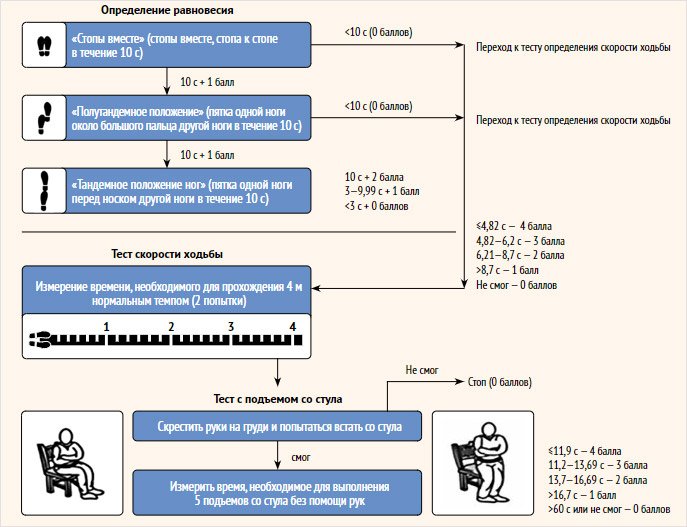
Антропометрические показатели – ИМТ, калиперометрия, измерения окружности голени, бедра, плеча, предплечья. Существуют также методы для оценки мышечной силы — это динамометрия, которая выполняется с помощью ручного динамометра.
К объективным методам, позволяющим рассчитать мышечную массу, относятся компьютерная томография (КТ), магнитно-резонансная томография (МРТ), биоимпедансный анализ, двуэнергетическая рентгеновская абсорбциометрия (ДРА или DEXA в англоязычной литературе), ультразвуковой метод (УЗИ) [32]. Все эти методы позволяют оценить мышечную массу путем измерения отдельных мышц и расчета скелетно-мышечных индексов для оценки степени саркопении. Они отличаются точностью, воспроизводимостью, доступностью, стоимостью исследования. КТ в настоящее время является «золотым стандартом» для оценки мышечной массы при циррозе печени, но стоимость и воздействие ионизирующего излучения делают рутинное использование данного метода исключительно для выявления саркопении нецелесообразным. Однако, когда КТ брюшной полости проводится по клиническим причинам, мышечная масса может быть измерена на снимках с помощью специального программного обеспечения. Мышечная масса указывается как скелетно-мышечный индекс (СМИ), рассчитанный как общая площадь скелетных мышц на уровне L3, нормированная на рост [31].
Наиболее простыми, доступными и изученными методами оценки состава тела являются: ДРА и биоимпедансный анализ. На точность данных методов влияет задержка жидкости у пациентов с заболеваниями печени.
Для целей реальной клинической практики нельзя выбрать только один диагностический инструмент. Выбор метода измерения саркопении будет зависеть от конкретного клинического случая и имеющихся диагностических ресурсов. Учитывая простоту, низкую стоимость и воспроизводимость показателей саркопении, рекомендуется проводить ее рутинную оценку у всех амбулаторных пациентов с циррозом печени. Оценка мышечной массы с помощью инструментальных методов может быть полезна в отдельных группах. К таким группам могут относиться госпитализированные, а также пациенты – кандидаты на трансплантацию печени.
Проводить оценку степени саркопении и мальнутриции следует не реже раза в год для декомпенсированных пациентов. Для тех, кто проходит активное лечение по поводу мальнутриции и саркопении, частота скрининга не реже одного раза в 8–12 нед. [32].
Возможности терапевтического воздействия
В настоящее время отсутствуют клинические рекомендации по лечению пациентов с саркопенией и мальнутрицией при заболеваниях печени. Наибольшее значение саркопения и мальнутриция имеют для пациентов с циррозом печени, поэтому больше всего данных о терапевтическом лечении именно этой категории пациентов.
Элиминация этиологического фактора – одна из важных задач лечения заболевания печени, в т. ч. и для лечения саркопении и мальнутриции, поскольку это предполагает разрешение хронического воспаления. Существуют дополнительные меры воздействия на саркопению и мальнутрицию.
Одним из ключевых мероприятий служит оптимизация питания [40]. Всем пациентам с циррозом печени должен быть предоставлен индивидуальный рецепт питания, учитывающий текущее состояние питания, т. е. с учетом степени недостаточности питания. Переоценка питания должна проводиться через регулярные интервалы времени, причем более частые интервалы должны проводиться для тех, кто соответствует критериям саркопении на исходном уровне и/или демонстрирует ухудшение сократительной функции или массы мышц.
Исследования по оценке энергозатрат у пациентов с циррозом печени показали, что общие энергозатраты составляют от 28 до 38 ккал/кг/день [41, 42]. Согласно современным рекомендациям по питанию для пациентов с хроническими заболеваниями печени и/или циррозом печени ежедневное потребление калорий должно составлять не менее 35 ккал/кг/день [43–46]. У пациентов с задержкой жидкости «сухой» вес может быть оценен после парацентеза либо путем вычитания процента веса в зависимости от степени задержки жидкости (легкая степень – 5%; умеренная – 10%; тяжелая – 15%; дополнительные 5% снимаются при двустороннем отеке ног до колен) [44]. Хотя данные о фактическом потреблении энергии пациентами с циррозом с разным индексом массы тела отсутствуют, все чаще признается необходимость установления целей потребления энергии с поправкой на индекс массы тела. В свете этого рекомендации по потреблению энергии с учетом веса могут быть изменены до 25–35 ккал/кг/день для лиц с ИМТ 30–40 кг/м2 и 20–25 ккал/кг/день для лиц с ИМТ ≥ 40 кг/м2 [46]. Для оценки точности уравнений с учетом веса в разных группах ИМТ необходимы дальнейшие исследования.
Исследования, проведенные еще в 1980-х гг., показали, что пациенты с циррозом печени имеют повышенные потребности в белке [47]. Установлено, что усиленное потребление белка пациентами с циррозом печени улучшает их нутритивный статус. В настоящее время доказано, что пациенты с печеночной энцефалопатией, которым в прошлом рекомендовалось ограничение белка, должны получать нормальное или повышенное количество белка, что благоприятно скажется на их нутритивном статусе [48, 49]. Рекомендации по потреблению белка незначительно отличаются в разных руководствах и составляют 1,2–1,5 г белка/кг массы тела (табл. 2) [48, 49]. Специальных рекомендаций по потреблению углеводов и жиров для пациентов с циррозом печени не существует.
Таблица 2. Рекомендации по суточному употреблению белка для разных групп пациентов с циррозом печени
|
|
|
|
| |
|
|
Некоторые исследования показали пользу от добавления аминокислот с разветвленной цепью (BCAA). Учитывая, что BCAA естественным образом присутствуют в белоксодержащих продуктах, нет рекомендаций по долгосрочному дополнительному приему BCAA сверх рекомендованных показателей потребления белка из продуктов питания или энтерального белкового питания [11, 32].
При циррозе печени следует избегать длительных периодов голодания. При этом имеются данные, подтверждающие пользу для увеличения мышечной массы раннего утреннего завтрака, позднего вечернего перекуса и приема небольших, частых приемов пищи и перекусов каждые 3–4 ч во время бодрствования [50, 51]. В литературе был рассмотрен широкий спектр вариантов поздних ночных перекусов, варьирующихся от 149 до 710 ккал, с различным углеводным и белковым составом [50]. Для госпитализированных пациентов с циррозом, у которых энергетические потребности не могут быть удовлетворены только за счет перорального приема продуктов питания, следует рассмотреть возможность энтерального питания.
Важно сконцентрироваться на патогенетических подходах. Здесь может быть применима стратегия гипоаммониемической терапии, поскольку существует прочная теоретическая основа для лечения саркопении с помощью средств, снижающих концентрацию циркулирующего в крови аммиака или уменьшающих его выработку. В животной модели комбинированное применение рифаксимина и L-орнитин L-аспартата снижало концентрацию аммиака в плазме и мышцах, улучшало мышечную массу и функцию [52]. Эти данные дают возможность предположить, что препараты, используемые для лечения печеночной энцефалопатии (ПЭ), могут также играть роль в профилактике и лечении саркопении. Однако данные, конкретно оценивающие влияние стратегий снижения аммиака на сократительную функцию мышц или мышечную массу у пациентов с циррозом печени, отсутствуют.
Карнитин играет ключевую роль в митохондриальном окислении жирных кислот – процессе, нарушаемом аммиаком и играющем центральную роль в функционировании митохондрий и энергетическом метаболизме. В небольших исследованиях прием L-карнитина был связан с дозозависимым снижением уровня аммиака в крови, снижением скорости потери мышечной массы, обратным развитием саркопении и повышением уровня физической активности [32].
Медицинская терапия задержки жидкости должна быть оптимизирована, т. к. асцит и отеки приводят к раннему насыщению, ограничивают физическую нагрузку и ограничивают подвижность. У некоторых пациентов терапевтический парацентез может уменьшить анорексию, увеличить чувство сытости и переносимость физических нагрузок [32].
Дефицит витаминов и минералов часто встречается при циррозе независимо от этиологии заболевания печени и особенно распространен среди пациентов с холестазом на продвинутой стадии заболевания печени. Лучше всего у пациентов с циррозом печени были изучены следующие витамины и минералы: витамин Д, витамины группы В (В1, В6, В12, В9), витамин А, витамин Е, цинк, селен. Однако, поскольку сложно регулярно оценивать витаминно-минеральный комплекс в клинической практике, а поливитаминные добавки недороги и практически не имеют побочных эффектов, существует подход эмпирического назначения перорального приема поливитаминных добавок у пациентов с циррозом печени, у которых определяются любые признаки мальнутриции или саркопении, как это было предложено в общей популяции [32].
Также для коррекции саркопении, слабости в программу реабилитации включают регулярные физические упражнения. В ряде исследований показана польза регулярных аэробных тренировок средней интенсивности [53–55]. Физическая активность позволяет увеличить мышечную массу и силу, снизить утомляемость, обеспечивает лучшее качество жизни [56]. Данные оценивали компенсированных пациентов с циррозом печени [53]. К сожалению, отсутствуют крупные клинические исследования о влиянии физических упражнений на клинические исходы.
Заключение
Проведенный анализ литературы показал, что диагностика и лечение саркопении и мальнутриции у пациентов с заболеваниями печени в настоящее время остаются нерешенной задачей. Саркопения и мальнутриция – распространенные осложнения цирроза печени. Саркопения связана с худшими прогнозами у пациентов с хроническими заболеваниями печени, кандидатов на трансплантацию, а также влияет на течение самого заболевания, посттрансплантационные исходы. Основой развития саркопении служит недостаточное потребление питательных веществ, системное воспаление, гипераммониемия, изменение протеостаза скелетных мышц. Оценка саркопении и мальнутриции проводится с помощью различных шкал и диагностических методов, разработанных для пожилых пациентов. Внедрение в практику специфических для пациентов с заболеваниями печени опросников, критериев и диагностических алгоритмов позволит улучшить выявляемость саркопении и мальнутриции. Коррекция саркопении оказывает значимое влияние на клинические исходы и прогноз пациента с хроническим заболеванием печени. Важными терапевтическими стратегиями являются коррекция диеты и физической активности, фармакотерапевтические подходы. Интересным представляется коррекция гипераммониемии у пациентов с саркопенией, поскольку это основное звено патогенеза данного состояния. Необходимо планировать дальнейшие клинические исследования в этой области.
Список литературы / References
- Purnak T, Yilmaz Y. Liver disease and malnutrition. Best Pract Res Clin Gastroenterol. 2013;27(4):619-629. https://doi.org/10.1016/j.bpg.2013.06.018.
- ATS, Parkash O, Hashmi SA. Malnutrition and liver disease in a developing country. World J Gastroenterol. 2021;27(30):4985-4998. https://doi.org/10.3748/wjg.v27.i30.4985.
- Cruz-Jentoft AJ, Bahat G, Bauer J, Boirie Y, Bruyère O, Cederholm T et al. Sarcopenia: revised European consensus on definition and diagnosis. Age Ageing. 2019;48(1):16-31. https://doi.org/10.1093/ageing/afy169.
- Nishiguchi Sh, Hino K, Moriya K, Shiraki M, Hiramatsu A, Nishikawa H. Assessment criteria for sarcopenia in liver disease (first edition): Report from the working group for creation of sarcopenia assessment criteria in the Japan Society of Hepatology. Kanzo. 2016;57(12):623-633. https://doi.org/10.2957/kanzo.57.623.
- Shin S, Jun DW, Saeed WK, Koh DH. A narrative review of malnutrition in chronic liver disease. Ann Transl Med. 2021;9(2):172. https://doi.org/10.21037/atm-20-4868.
- Mazeaud S, Zupo R, Couret A, Panza F, Sardone R, Castellana F. Prevalence of Sarcopenia in Liver Cirrhosis: A Systematic Review and Meta-Analysis. Clin Transl Gastroenterol. 2023;14(7):e00584. https://doi.org/10.14309/ctg.0000000000000584.
- Evuri P, Selvi C, Manimekala E, Aravind A, Karunakaran P, Muthukumaran K et al. Study of Prevalence of Sarcopenia in Chronic Liver Disease and its Impact on Outcomes. Int J Innov Res Med Sci. 2022;7(07):335-339. https://doi.org/10.23958/ijirms/vol07-i07/1439.
- Nakamura A, Yoshimura T, Sato T, Ichikawa T. Diagnosis and Pathogenesis of Sarcopenia in Chronic Liver Disease Using Liver Magnetic Resonance Imaging. Cureus. 2022;14(5):e24676. https://doi.org/10.7759/cureus.24676.
- Fox R, Stenning K, Slee A, Macnaughtan J, Davies N. Sarcopenia in liver cirrhosis: Prevalence, pathophysiology and therapeutic strategies. Anal Biochem. 2022;647:114581. https://doi.org/10.1016/j.ab.2022.114581.
- Topan MM, Sporea I, Dănilă M, Popescu A, Ghiuchici AM, Lupuşoru R, Şirli R. Impact of Sarcopenia on Survival and Clinical Outcomes in Patients With Liver Cirrhosis. Front Nutr. 2021;8:766451. https://doi.org/10.3389/fnut.2021.766451.
- Nishikawa H, Fukunishi S, Asai A, Nishiguchi S, Higuchi K. Sarcopenia and Frailty in Liver Cirrhosis. Life (Basel). 2021;11(5):399. https://doi.org/10.3390/life11050399.
- Kalafateli M, Mantzoukis K, Choi Yau Y, Mohammad AO, Arora S, Rodrigues S et al. Malnutrition and sarcopenia predict post-liver transplantation outcomes independently of the Model for End-stage Liver Disease score. J Cachexia Sarcopenia Muscle. 2017;8(1):113-121. https://doi.org/10.1002/jcsm.12095.
- Wijarnpreecha K, Werlang M, Panjawatanan P, Kroner PT, Cheungpasitporn W, Lukens FJ et al. Association between sarcopenia and hepatic encephalopathy: A systematic review and meta-analysis. Ann Hepatol. 2020;19(3):245-250. https://doi.org/10.1016/j.aohep.2019.06.007.
- Sam J, Nguyen GC. Protein-calorie malnutrition as a prognostic indicator of mortality among patients hospitalized with cirrhosis and portal hypertension. Liver Int. 2009;29(9):1396-1402. https://doi.org/10.1111/j.1478-3231.2009.02077.x.
- Bernal W, Martin-Mateos R, Lipcsey M, Tallis C, Woodsford K, McPhail MJ et al. Aerobic capacity during cardiopulmonary exercise testing and survival with and without liver transplantation for patients with chronic liver disease. Liver Transpl. 2014;20(1):54-62. https://doi.org/10.1002/lt.23766.
- Zeng X, Shi ZW, Yu JJ, Wang LF, Sun CY, Luo YY et al. Skeletal muscle alterations indicate poor prognosis in cirrhotic patients: a multicenter cohort study in China. Hepatol Int. 2023;10.1007/s12072-023-10497-x. https://doi.org/10.1007/s12072-023-10497-x.
- Frost RA, Lang CH. Multifaceted role of insulin-like growth factors and mammalian target of rapamycin in skeletal muscle. Endocrinol Metab Clin North Am. 2012;41(2):297-322. https://doi.org/10.1016/j.ecl.2012.04.012.
- Castilla-Cortazar I, Prieto J, Urdaneta E, Pascual M, Nuñez M, Zudaire E et al. Impaired intestinal sugar transport in cirrhotic rats: correction by low doses of insulin-like growth factor I. Gastroenterology. 1997;113(4):1180-1187. https://doi.org/10.1053/gast.1997.v113.pm9322513.
- Gluud C. Serum testosterone concentrations in men with alcoholic cirrhosis: background for variation. Metabolism. 1987;36(4):373-378. https://doi.org/10.1016/0026-0495(87)90210-1.
- Bauer TM, Schwacha H, Steinbrückner B, Brinkmann FE, Ditzen AK, Aponte JJ et al. Small intestinal bacterial overgrowth in human cirrhosis is associated with systemic endotoxemia. Am J Gastroenterol. 2002;97(9):2364-2370. https://doi.org/10.1111/j.1572-0241.2002.05791.x.
- Londhe P, Guttridge DC. Inflammation induced loss of skeletal muscle. Bone. 2015;80:131-142. https://doi.org/10.1016/j.bone.2015.03.015.
- Tandon P, Raman M, Mourtzakis M, Merli M. A practical approach to nutritional screening and assessment in cirrhosis. Hepatology. 2017;65(3):1044-1057. https://doi.org/10.1002/hep.29003.
- Mousa N, Mokhtar A, Neven A, Mahmoud А, Adel I. Nutritional status in cirrhosis; pathogenesis and management. Med J Vir Hepat. 2019;3.2(2):41-47. Available at: https://www.researchgate.net/publication/337351614_Nutritional_status_in_cirrhosis_pathogenesis_and_management.
- Nicoletti A, Ponziani FR, Biolato M, Valenza V, Marrone G, Sganga G et al. Intestinal permeability in the pathogenesis of liver damage: From non-alcoholic fatty liver disease to liver transplantation. World J Gastroenterol. 2019;25(33):4814-4834. https://doi.org/10.3748/wjg.v25.i33.4814.
- Carson JA, Manolagas SC. Effects of sex steroids on bones and muscles: Similarities, parallels, and putative interactions in health and disease. Bone. 2015;80:67-78. https://doi.org/10.1016/j.bone.2015.04.015.
- Iizuka K, Machida T, Hirafuji M. Skeletal muscle is an endocrine organ. J Pharmacol Sci. 2014;125(2):125-131. https://doi.org/10.1254/jphs.14r02cp.
- Bodine SC. Edward F. Adolph Distinguished Lecture. Skeletal muscle atrophy: Multiple pathways leading to a common outcome. J Appl Physiol (1985). 2020;129(2):272-282. https://doi.org/10.1152/japplphysiol.00381.2020.
- Meyer F, Bannert K, Wiese M, Esau S, Sautter LF, Ehlers L et al. Molecular Mechanism Contributing to Malnutrition and Sarcopenia in Patients with Liver Cirrhosis. Int J Mol Sci. 2020;21(15):5357. https://doi.org/10.3390/ijms21155357.
- Allen SL, Quinlan JI, Dhaliwal A, Armstrong MJ, Elsharkawy AM, Greig CA et al. Sarcopenia in chronic liver disease: mechanisms and countermeasures. Am J Physiol Gastrointest Liver Physiol. 2021;320(3):G241-G257. https://doi.org/10.1152/ajpgi.00373.2020.
- Henin G, Lanthier N, Dahlqvist G. Pathophysiological changes of the liver-muscle axis in end-stage liver disease: what is the right target? Acta Gastroenterol Belg. 2022;85(4):611-624. https://doi.org/10.51821/85.4.10899.
- Kamimura H, Sato T, Natsui K, Kobayashi T, Yoshida T, Kamimura K et al. Molecular Mechanisms and Treatment of Sarcopenia in Liver Disease: A Review of Current Knowledge. Int J Mol Sci. 2021;22(3):1425. https://doi.org/10.3390/ijms22031425.
- Lai JC, Tandon P, Bernal W, Tapper EB, Ekong U, Dasarathy S, Carey EJ. Malnutrition, Frailty, and Sarcopenia in Patients With Cirrhosis: 2021 Practice Guidance by the American Association for the Study of Liver Diseases. Hepatology. 2021;74(3):1611-1644. https://doi.org/10.1002/hep.32049.
- Dasarathy S, Hatzoglou M. Hyperammonemia and proteostasis in cirrhosis. Curr Opin Clin Nutr Metab Care. 2018;21(1):30-36. https://doi.org/10.1097/MCO.0000000000000426.
- Bunchorntavakul C. Sarcopenia and Frailty in Cirrhosis: Assessment and Management. Med Clin North Am. 2023;107(3):589-604. https://doi.org/10.1016/j.mcna.2022.12.007.
- Keller CW, Fokken C, Turville SG, Lünemann A, Schmidt J, Münz C, Lünemann JD. TNF-alpha induces macroautophagy and regulates MHC class II expression in human skeletal muscle cells. J Biol Chem. 2011;286(5):3970-3980. https://doi.org/10.1074/jbc.M110.159392.
- Xia Z, Cholewa J, Zhao Y, Shang HY, Yang YQ, Araújo Pessôa K et al. Targeting Inflammation and Downstream Protein Metabolism in Sarcopenia: A Brief Up-Dated Description of Concurrent Exercise and Leucine-Based Multimodal Intervention. Front Physiol. 2017;8:434. https://doi.org/10.3389/fphys.2017.00434.
- Sinclair M, Grossmann M, Gow PJ, Angus PW. Testosterone in men with advanced liver disease: abnormalities and implications. J Gastroenterol Hepatol. 2015;30(2):244-251. https://doi.org/10.1111/jgh.12695.
- Shen M, Shi H. Sex Hormones and Their Receptors Regulate Liver Energy Homeostasis. Int J Endocrinol. 2015;2015:294278. https://doi.org/10.1155/2015/294278.
- Mowat NA, Edwards CR, Fisher R, McNeilly AS, Green JR, Dawson AM. Hypothalamic-pituitary-gonadal function in men with cirrhosis of the liver. Gut. 1976;17(5):345-350. https://doi.org/10.1136/gut.17.5.345.
- Campillo B, Richardet JP, Scherman E, Bories PN. Evaluation of nutritional practice in hospitalized cirrhotic patients: results of a prospective study. Nutrition. 2003;19(6):515-521. https://doi.org/10.1016/s0899-9007(02)01071-7.
- Riggio O, Angeloni S, Ciuffa L, Nicolini G, Attili AF, Albanese C, Merli M. Malnutrition is not related to alterations in energy balance in patients with stable liver cirrhosis. Clin Nutr. 2003;22(6):553-559. https://doi.org/10.1016/s0261-5614(03)00058-x.
- Nielsen K, Kondrup J, Martinsen L, Døssing H, Larsson B, Stilling B, Jensen MG. Long-term oral refeeding of patients with cirrhosis of the liver. Br J Nutr. 1995;74(4):557-567. https://doi.org/10.1079/bjn19950158.
- Ивашкин ВТ, Маевская МВ, Жаркова МС, Жигалова СБ, Киценко ЕА, Манукьян ГВ и др. Клинические рекомендации Российского общества по изучению печени и Российской гастроэнтерологической ассоциации по диагностике и лечению фиброза и цирроза печени и их осложнений. Российский журнал гастроэнтерологии, гепатологии, колопрок тологии. 2021;31(6):56-102. Режим доступа: https://www.gastro-j.ru/jour/article/view/621/0.
- European Association for the Study of the Liver. Electronic address: easl-office@easloffice.eu; European Association for the Study of the Liver. EASL Clinical Practice Guidelines on nutrition in chronic liver disease. J Hepatol. 2019;70(1):172-193. https://doi.org/10.1016/j.jhep.2018.06.024.
- Plauth M, Bernal W, Dasarathy S, Merli M, Plank LD, Schütz T, Bischoff SC. ESPEN guideline on clinical nutrition in liver disease. Clin Nutr. 2019;38(2):485-521. https://doi.org/10.1016/j.clnu.2018.12.022.
- Amodio P, Bemeur C, Butterworth R, Cordoba J, Kato A, Montagnese S et al. The nutritional management of hepatic encephalopathy in patients with cirrhosis: International Society for Hepatic Encephalopathy and Nitrogen Metabolism Consensus. Hepatology. 2013;58(1):325-336. https://doi.org/10.1002/hep.26370.
- Swart GR, van den Berg JW, van Vuure JK, Rietveld T, Wattimena DL, Frenkel M. Minimum protein requirements in liver cirrhosis determined by nitrogen balance measurements at three levels of protein intake. Clin Nutr. 1989;8(6):329-336. https://doi.org/10.1016/0261-5614(89)90008-3
- Traub J, Reiss L, Aliwa B, Stadlbauer V. Malnutrition in Patients with Liver Cirrhosis. Nutrients. 2021;13(2):540. https://doi.org/10.3390/nu13020540.
- Ney M, Abraldes JG, Ma M, Belland D, Harvey A, Robbins S et al. Insufficient Protein Intake Is Associated With Increased Mortality in 630 Patients With Cirrhosis Awaiting Liver Transplantation. Nutr Clin Pract. 2015;30(4):530-536. https://doi.org/10.1177/0884533614567716.
- Tsien CD, McCullough AJ, Dasarathy S. Late evening snack: exploiting a period of anabolic opportunity in cirrhosis. J Gastroenterol Hepatol. 2012;27(3):430-441. https://doi.org/10.1111/j.1440-1746.2011.06951.x.
- Vaisman N, Katzman H, Carmiel-Haggai M, Lusthaus M, Niv E. Breakfast improves cognitive function in cirrhotic patients with cognitive impairment. Am J Clin Nutr. 2010;92(1):137-140. https://doi.org/10.3945/ajcn.2010.29211.
- Kumar A, Davuluri G, Silva RNE, Engelen MPKJ, Ten Have GAM, Prayson R et al. Ammonia lowering reverses sarcopenia of cirrhosis by restoring skeletal muscle proteostasis. Hepatology. 2017;65(6):2045-2058. https://doi.org/10.1002/hep.29107.
- Augustyn M, Grys I, Kukla M. Small intestinal bacterial overgrowth and nonalcoholic fatty liver disease. Clin Exp Hepatol. 2019;5(1):1-10. https://doi.org/10.5114/ceh.2019.83151.
- Farrugia MA, Le Garf S, Chierici A, Piche T, Gual P, Iannelli A, Anty R. Therapeutic Physical Exercise Programs in the Context of NASH Cirrhosis and Liver Transplantation: A Systematic Review. Metabolites. 2023;13(3):330. https://doi.org/10.3390/metabo13030330.
- Rossi D, D’Avila AF, Galant LH, Marroni CA. Exercise in the physical rehabilitation of cirrotics: a randomized pilot study. Arq Gastroenterol. 2022;59(3):408-413. https://doi.org/10.1590/S0004-2803.202203000-73.
- Duarte-Rojo A, Ruiz-Margáin A, Montaño-Loza AJ, Macías-Rodríguez RU, Ferrando A, Kim WR. Exercise and physical activity for patients with end-stage liver disease: Improving functional status and sarcopenia while on the transplant waiting list. Liver Transpl. 2018;24(1):122-139. https://doi.org/10.1002/lt.24958.



 1
1 2
2 3
3 4
4


Комментарии (0)