
Журнал "Медицинский совет" № 6/2024
DOI: 10.21518/ms2024-210
В.В. Салухов1, https://orcid.org/0000-0003-1851-0941
С.В. Айсаева, https://orcid.org/0009-0006-5845-1674
Военно-медицинская академия имени С.М. Кирова; 194044, Россия, Санкт-Петербург, ул. Академика Лебедева, д. 6
Современные представления о гипогонадизме у мужчин претерпевают существенную трансформацию. Концепция функционального гипогонадизма, которая сегодня находит все большую поддержку среди экспертного сообщества, базируется на обратимости симптоматической гипотестостеронемии после устранения причинного фактора или заболевания у мужчины с неповрежденной гипоталамо-гипофизарно-гонадной (ГГГ) системой. Функциональный гипогонадизм у мужчин встречается все чаще, что обусловлено его ассоциацией с такими неинфекционными пандемиями, как ожирение, сахарный диабет 2-го типа, и другой коморбидной патологией. С другой стороны, и возрастной гипогонадизм отвечает критериям функционального гипогонадизма, поскольку, как установлено, именно накопление возраст-ассоциированных сопутствующих заболеваний определяет решающий вклад в снижение тестостерона у стареющих мужчин. Кроме того, чрезмерная физическая активность, резкое сокращение потребления калорий, высокая психоэмоциональная нагрузка, травмы, операции и прием некоторых лекарственных препаратов также могут стать причинами функционального гипогонадизма. Несмотря на широкий диапазон и гетерогенность заболеваний и состояний, лежащих в основе функционального гипогонадизма, механизмы, определяющие его развитие, довольно схожи, поскольку в большинстве случаев этот андрогенодефицит является вторичным гипогонадотропным (центральным), существенно реже встречается первичный или смешанный варианты. Таким образом, в патогенезе функционального гипогонадизма задействовано множество разнообразных биологических путей, описание которых на основе подробного анализа литературы стало содержанием обзора. Особое внимание в статье уделено эволюционному значению феномена функционального гипогонадизма, адаптированной классификации его причин, а также описанию достижений отечественной школы исследователей, изучавших влияние острых состояний и экстремальных воздействий на гипоталамо-гипофизарно-гонадную систему мужчин.
Для цитирования: Салухов ВВ, Айсаева СВ. Функциональный гипогонадизм у мужчин: основные причины и нейроэндокринные механизмы его развития. Медицинский Совет. 2024;(6):112-123. https://doi.org/10.21518/ms2024-210
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Functional hypogonadism in men: key causes and neuroendocrine mechanisms of its development
Vladimir V. Salukhov, https://orcid.org/0000-0003-1851-0941, Svetlana V. Aisaeva, https://orcid.org/0000-0003-1851-0941, Military Medical Academy named after S.M. Kirov; 6, Akademik Lebedev St., St Petersburg, 194044, Russia
Modern concepts of hypogonadism in men are
undergoing significant transformation. The concept of functional hypogonadism,
which is gaining increasing support among expert communities today, is based on
the reversibility of symptomatic hypotestosteronemia after eliminating the
causal factor or disease in men with an intact hypothalamic-pituitary-gonadal
system. This makes the diagnosis of functional hypogonadism an exclusion
diagnosis of organic hypogonadism, which can be congenital (genetic) or
acquired (destructive or structural) irreversible disorder occurring at any
level of the hypothalamic-pituitary-gonadal axis. Functional hypogonadism in
men is becoming more common, attributed to its association with non-infectious
pandemics such as obesity, type 2 diabetes, and other comorbid pathologies.
Additionally, age-related hypogonadism meets the criteria of functional
hypogonadism, as accumulating age-associated comorbidities have been shown to
play a significant role in testosterone decline in aging men. Moreover,
excessive physical activity, drastic calorie restriction, high psycho-emotional
stress, injuries, surgeries, and the use of certain medications can also be
causes of functional hypogonadism. Despite the wide range and heterogeneity of
diseases and conditions underlying functional hypogonadism, the mechanisms
driving its development are quite similar since in most cases, this androgen
deficiency is secondary hypogonadotropic (central). However, in some cases, functional
hypogonadism can be primary or mixed. Therefore, understanding the pathogenesis
of functional hypogonadism is crucial as it involves a variety of biological
pathways depending on the etiological factor or disease, which is detailed
through a literature review. The article pays special attention to the
evolutionary significance of the phenomenon of functional hypogonadism, an
adapted classification of its causes, and describes the achievements of Russian
researchers who have studied the impact of acute conditions and extreme
influences on the hypothalamic-pituitary-gonadal system in men.
For citation: Salukhov VV, Aisaeva SV. Functional hypogonadism in men: key causes and neuroendocrine mechanisms of its development. Meditsinskiy sovet = Medical Council. 2024;(6):112-123. https://doi.org/10.21518/ms2024-210
Conflict of interest: the authors declare no conflict of interest.
Введение
Роль
андрогенов в организме человека многогранна. Тестостерон — основной половой стероид
мужчин, главная задача которого состоит в регулировании и поддержании репродуктивной
функции. Однако, являясь анаболическим гормоном, тестостерон оказывает
множественное воздействие на организм, участвуя в регуляции репаративных и пластических процессов в
организме, воздействуя на метаболизм углеводов, липидов и белков. В
головном мозге он стимулирует либидо и напористость, ассоциирован с процессом
познания и функционирования памяти. Существуют убедительные доказательства
снижения настроения при гипогонадизме и протективного действия тестостерона при
тревоге и депрессии. Также описаны результаты влияния терапии тестостерона на
социальное поведение мужчин и принятие ими решений в различных ситуациях.
Помимо этого, тестостерон оказывает влияние на развитие костей, рост мышечной
ткани, процессы адипогенеза и стимулирует эритропоэз. В коже он поддерживает
выработку коллагена, стимулирует рост волос и выработку кожного сала. В сердце оказывает
позитивное влияние на сердечный выброс и коронарный и периферический кровоток,
уменьшает интервал QTc и реперфузионное повреждение. Таким образом, в
значительной степени мужское
здоровье в широком диапазоне проявлений определяется уровнем тестостерона [1].
В основе саморегуляции гипофиз-гонадной
системы лежит принцип обратной связи, впервые открытый русским ученым М.М.
Завадовским. Гипоталамус вырабатывает
гонадотропин-рилизинг гормон (ГнРГ), который секретируется в портальный кровоток
пульсовыми волнами каждые 60–120 мин.
ГнРГ находится под мощным стимулирующим
влиянием кисспептина, который выделяется в нейронах KNDy в дугообразном ядре медиобазального гипоталамуса и
через свой рецептор KISS-1R реализует выброс ГнРГ. Нейрокинин В и лептин
участвуют в активации передачи сигналов кисспептина на KISS-1R, а
динорфин, также вырабатываемый в нейронах KNDy, напротив, эту передачу блокирует.
ГнРГ, воздействуя на
переднюю долю гипофиза, приводит к выработке лютеинизирующего гормона (ЛГ). По современным представлениям, в системе регуляции
имеется и механизм положительной обратной связи, где только эстрадиол, но не
тестостерон обеспечивает выброс ЛГ при определенных патофизиологических
условиях, например при кастрации или гипогонадизме [2]. В свою очередь клетки
Лейдига в яичках отвечают на действие ЛГ выработкой тестостерона в количестве 5–10 мг ежедневно. Тестостерон синтезируется из холестерина через
несколько промежуточных метаболитов, включающих дегидроэпиандростерон (ДГЭА) и
андростендион. Большая часть тестостерона в
системном кровотоке связана с транспортными белками: около 40% имеет прочно связь
с глобулином, связывающим половые гормоны (ГСПГ), и 58% – слабую связь с
альбумином. Таким образом, только около 2% циркулирующего тестостерона являются биодоступным для реализации его
основных функций. В тканях-мишенях с участием фермента 5-альфа-редуктазы около 70%
тестостерона превращаются в более активный
метаболит дигидротестостерон (ДГТ).
Нарушения в гипоталамо-гипофизарно-гонадной системе описывает
классификация, которая этиологически разделяет гипогонадизм мужчин на первичную,
вторичную и смешанную форму. Первичный (гипергонадотропный) гипогонадизм
возникает в связи с нарушением функции тестикул вследствие дефекта ткани самих
яичек. В патогенезе развития вторичного (гипогонадотропного или центрального) гипогонадизма
выделяют нарушение структуры гипофиза, снижение его гонадотропной функции или
поражение гипоталамических центров, регулирующих деятельность гипофиза. Если нарушена
как гипоталамо-гипофизарная функция, так и функция яичек и/или наблюдается
нечувствительность рецепторного аппарата, то такой
гипогонадизм является смешанным.
В 2017 г. М. Гроссманн и А. Мацумото
предложили новую классификацию гипогонадизма взрослых мужчин, различающую
органический и функциональный гипогонадизм [3]. В соответствии с этим классификационным подходом «органический» (или
классический) гипогонадизм представляет собой необратимую форму
гипогонадизма, вызванную врожденным (генетическим) или приобретенным
(деструктивным или структурным) нарушением, возникающим на любом уровне ГГГ-оси
[4,
5],
которое подразумевает традиционную терапию (например,
гонадотропинами или тестостероном). «Функциональный» гипогонадизм возникает
в отсутствие установленной органической патологии в ГГГ-системе и является потенциально
обратимым нарушением после устранения воздействующей причины. Другими словами,
функциональный гипогонадизм является диагнозом исключения органических причин
гипогонадизма.
Таким образом, гипогонадизм у мужчин представляет собой клинико-биохимический
синдром, связанный с постоянной или временной неспособностью гонад вырабатывать
физиологические концентрации тестостерона и/или нечувствительностью
рецепторного аппарата к нему и его метаболитам, оказывающий негативное влияние
на органы и системы, а также качество жизни.
В настоящее время патофизиологические
механизмы развития органического гипогонадизма достаточно подробно изучены,
однако причины функционального гипогонадизма остаются предметом оживленной научной
дискуссии.
Чаще всего подобного рода нарушения происходят на фоне воздействия эндогенных
или экзогенных модифицируемых факторов [6].
К основным причинам функционального снижения продукции тестостерона можно
отнести ожирение и метаболический синдром в целом, наличие сопутствующих острых
и хронических заболеваний, опосредованно
влияющих на синтез тестостерона, прием лекарственных средств, влияющих на его продукцию,
интенсивное воздействие физических факторов, таких как вибрация, излучение,
шум, температура, а также нарушение сна, интенсивные физические и
психоэмоциональные нагрузки и др. (рис. 1).
По мнению некоторых ученых, к функциональному гипогонадизму также можно
отнести возрастной андрогенодефицит, поскольку существует немалое количество
мужчин старше 80 лет с нормальным уровнем тестостерона и адекватно
функционирующей ГГГ-системой [7].
Так, в Европейском исследовании мужского старения (EMAS) было обнаружено, что решающий
вклад в возрастное снижение уровня тестостерона определяет не биологическое старение
как таковое, а скорее накопление возраст-ассоциированных сопутствующих
заболеваний, таких как ожирение, сахарный диабет 2-го типа и др., приводящих к
подавлению секреции ЛГ [8].
Рисунок 1. Основные причины функционального гипогонадизма (адаптировано из[9])
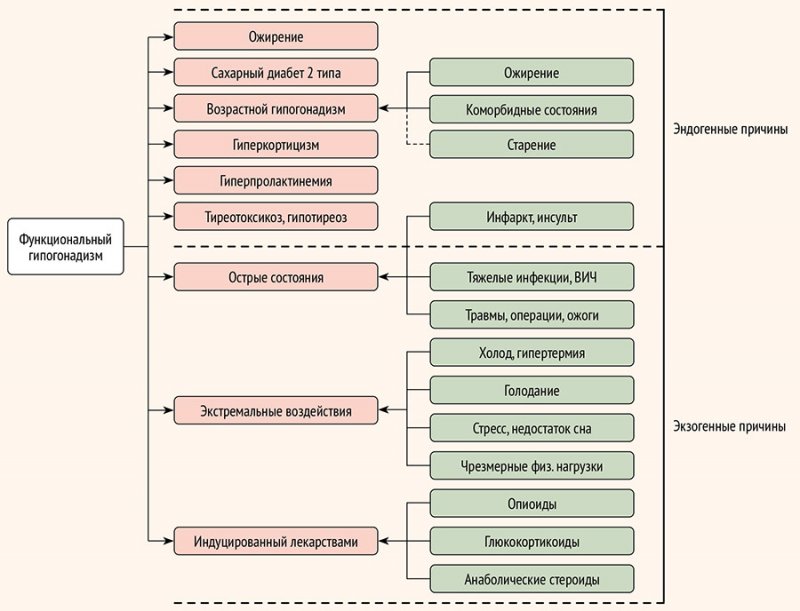
Как и для органического гипогонадизма, так и для функционального важное значение имеет дифференциальный диагноз между первичным и вторичным гипогонадизмом (табл.).
Таблица. Заболевания и состояния, вызывающие различные формы функционального гипогонадизма
Форма функционального гипогонадизма | Заболевания и состояния |
Первичный | Старение Лекарственно-индуцированные: кетоконазол, аминоглютетимид, митотан, метирапон Хронические системные заболевания Органная недостаточность Избыток глюкокортикоидов: ятрогенный, синдром Кушинга Алкоголь |
Вторичный | Острое или критическое заболевание Лекарственно-индуцированные: опиоиды, глюкокортикоиды, андрогены/анаболические андрогенные стероиды, аналоги ГнРГ, ципротерона ацетат, психотропные препараты, вызывающие гиперпролактинемию Недоедание, чрезмерные физические нагрузки ВИЧ/СПИД Злоупотребление каннабиноидами Ожирение, СД2, сопутствующие заболевания, обструктивное апноэ сна |
Резистентность к андрогенам/снижение биологической активности тестостерона | Лекарственно-индуцированная блокада андрогеновых рецепторов: стероидный антиандроген (например, ципротерона ацетат, спиронолактон), нестероидный антиандроген (например, флутамид, бикалутамид, нилутамид) Лекарственно-индуцированная блокада активности 5α-редуктазы: финастерид, дутастерид Повышенное содержание глобулина, связывающего половые гормоны |
Большинство случаев ФГГ следует отнести к вторичному или смешанному
гипогонадизму с низкими или низконормальными значениями лютеинизирующего гормона.
Однако встречается, хотя и нечасто, и первичный ФГГ с повышенным уровнем ЛГ у пожилых
мужчин (>70 лет), особенно в сочетании с сопутствующими заболеваниями [4].
Целью настоящего обзора станет освещение наиболее распространенных состояний,
которые приводят к функциональному гипогонадизму у мужчин, а также механизмов,
которые это определяют.
Эндогенные модифицируемые факторы
Ожирение
Ожирение, помимо метаболического синдрома и сердечно-сосудистых
заболеваний, не только может вызывать ФГГ, но и является одной из ведущих его
причин. Это доказывает распространенность гипогонадизма у лиц с морбидным ожирением
(ИМТ > 40 кг/м2), которая достигает 75%. Влияние ожирения на
уровень тестостерона реализуется через несколько механизмов, которые в основном связаны с избыточным количеством жировой
ткани, в т. ч. висцерального жира, а также с нарушением ее свойств [10].
I.
Прямое воздействие жировой ткани. Тестостерон, являясь липофильной молекулой,
задерживается в жировом депо, что в случае ожирения приводит к снижению его
концентрации в системном кровотоке. Так, адипоциты из подкожной жировой ткани у
мужчин с ожирением имеют более высокие концентрации внутриклеточного
тестостерона по сравнению с адипоцитами, полученными от худощавых мужчин [11].
Кроме того, жировая ткань у лиц с ожирением демонстрирует увеличение экспрессии
ароматазы, которая пропорциональна жировой массе тела и преобразует тестостерон
в эстрогены. Повышенное содержание эстрогенов, в свою очередь, снижает
амплитуду пульсирующего выброса ЛГ и может напрямую усиливать липогенез и
увеличивать подкожный, эктопический и висцеральный жир. Таким образом,
избыточное количество дисфункциональной жировой ткани может напрямую
участвовать в андрогенной депривации за счет удаления тестостерона из
системного кровотока, а также за счет его превращения в эстрадиол и косвенно за
счет уменьшения стимуляции синтеза тестостерона гипоталамусом [12].
II.
Эффекты адипокинов. При ожирении увеличивается производство адипокинов
из жировой ткани, важнейшим из которых является лептин. Лептин, высвобождаемый
из адипоцитов, соизмерим с объемом жировой ткани, выступая полезным биомаркером
резерва жира в организме, что обеспечивает важный периферический сигнал к нормальному
функционированию репродуктивной ГГГ-оси. Однако повышенная секреция лептина при
большом объеме жира приводит к дисфункции ГГГ-оси, дефициту андрогенов,
снижению количества сперматозоидов и их подвижности [13].
По-видимому, лептин регулирует функционирование ГГГ
системы как через опосредованный контроль нейронов гипоталамуса, с другой
стороны, если его уровень превышает определенный порог, он подавляет и функцию
гонад. В частности, повышенный уровень лептина способен подавлять экспрессию
гена кисспептина-1 и его рецепторов в дугообразных ядрах гипоталамуса, что снижает
продукцию кисспептина и приводит к ингибированию секреции ГнРГ с последующим снижением
стероидогенеза на уровне яичка и развитием гипогонадного состояния [14].
Существенна и роль адипонектина, снижение которого при
ожирении задокументировано в многочисленных исследованиях. Так, применение адипонектина
в высоких дозах стимулировало пролиферацию и выживаемость клеток в семенниках
мышей, усиливало транспорт энергетических субстратов, напротив, блокада
адипонектиновых рецепторов AdipoR2 приводила к увеличению ожирения и вызывала
атрофию семенных канальцев и аспермию [15].
Учитывая эти результаты, можно заключить, что адипонектин необходим для
поддержания эугонадного состояния, а снижение его секреции, обычно наблюдаемое
при дисфункциональной жировой ткани, способствует гипоандрогении.
III.
Влияние метавоспаления. Ожирение сопровождается низкоинтенсивным воспалением
(метавоспалением), которое характеризуется избыточной продукцией таких провоспалительных
цитокинов, как ИЛ-6, ИЛ-1, ФНО-α, главным образом из висцеральной жировой ткани.
Накапливающиеся данные указывают на то, что перепроизводство медиаторов
воспаления ассоциировано со снижением уровня тестостерона, а введение
провоспалительных цитокинов или эндотоксинов мужчинам или обработка клеток
Лейдига в культуре провоспалительными цитокинами снижают выработку тестостерона
[16].
Ингибирующее влияние провоспалительных цитокинов на
репродуктивную ось обусловлено снижением чувствительности нейронов гипоталамуса
к кисспептину через подавление экспрессии генов рецепторов кисспептина (KISS1R).
Значение возникающей при этом резистентности к кисспептину, приводящей к
уменьшению продукции ГнРГ, косвенно подтверждается исследованием, при котором
введение экзогенного кисспептина-54 здоровым мужчинам стимулировало
значительное повышение концентраций ЛГ, ФСГ и тестостерона в сыворотке крови [17].
IV.
Влияние оксидативного стресса. Увеличение жировой ткани требует не
только развития коллатерального кровотока, но и неоваскуляризации, обеспечивающих
адекватное кровоснабжение. При несоответствии скорости ее увеличения с
достаточным усилением кровотока и снабжения кислородом может возникнуть гипоксия
жировой ткани, которая создаст предпосылки для развития оксидативного стресса с
генерацией активных форм кислорода (АФК), приводящих к ее дисфункции. Интенсивный
оксидативный стресс, АФК могут нарушать работу митохондрий в клетках Лейдига,
что, в свою очередь, может влиять на стероидогенный каскад, определяя снижение
выработки тестостерона и бесплодие [18].
Кроме того, избыточная генерация АФК может способствовать
развитию ФГГ через усиление секреции кортизола, который, в свою очередь, обладает
ингибирующим влиянием на секрецию ЛГ гипофизом, тем самым снижая выработку
тестостерона клетками Лейдига [19].
V. Влияние на глобулин, связывающий половые гормоны.
Глобулин, связывающий половые гормоны (ГСПГ), — это гликопротеин,
играющий ключевую роль в перекрестных связях между метаболическими нарушениями
и дефицитом тестостерона. Действительно, мужчины с избыточной массой тела и
ожирением, как правило, имеют более низкие концентрации ГСПГ по сравнению с
худощавыми субъектами. Это обусловлено наличием гиперинсулинемии, нередко сопровождающей
висцеральное ожирение, которая может снижать выработку ГСПГ печенью [20].
Более того, многие данные свидетельствуют о том, что ГСПГ подавляется
провоспалительными цитокинами, уровни которых значительно повышены у пациентов
с ожирением. Это снижение ГСПГ может привести к временному повышению уровня
свободного тестостерона, что способствует еще большему увеличению активности
ароматазы с усилением работы тестостерон-эстрадиолового шунта. Повышение
содержания эстрадиола по отрицательной обратной связи подавляет ГГГ-систему,
что в конечном итоге приводит к снижению уровня как общего, так и свободного
тестостерона [12].
Суммируя вышеизложенное, можно заключить, что ожирение
приводит к дисфункции ГГГ-системы, одновременно формируя порочный круг, в
котором увеличение количества жировой ткани снижает выработку тестостерона,
определяя тем самым дальнейшее накопление жировой ткани.
Подтверждением решающего значения ожирения в развитии ФГГ является
серьезная доказательная база о коррекции андрогенодефицита модификацией образа
жизни и снижением массы тела. Проведенный G. Corona et al. метаанализ показал, что соблюдение диеты и
бариатрическое хирургическое лечение приводят к значимому повышению уровня как
общего, так и свободного тестостерона [21].
Аналогичные результаты демонстрирует и другое
исследование, включившее 3 369 мужчин в возрасте 40–79 лет с сопутствующим
ожирением. На фоне нормализации массы тела у 42,9% мужчин со вторичным
гипогонадизмом отмечалось повышение уровня тестостерона до эугонадных показателей
[22]. При продленной оценке данных в исследовании EMAS снижение ИМТ
> 15% от исходного было связано с достоверным увеличением уровня общего и
свободного тестостерона [7].
Сахарный диабет
Сахарный диабет, прежде
всего 2-го типа (СД2), представляет собой одну из важнейших детерминант ФГГ [23]. Значительное количество исследований показывает, что СД2, особенно
плохо контролируемый, может определять нарушения в структуре гонад
(дегенеративные и апоптотические изменения), а также в синтезе ГнРГ [24].
Действительно, инсулин,
наряду с лептином и другими гормонами, регулирует работу ГГГ-оси, стимулируя
секрецию ГнРГ через повышение экспрессии кисспептина и его рецепторов в
дугообразных ядрах гипоталамуса. Следовательно, как
инсулинопения, так и инсулинорезистентность, которая изменяет активность
рецепторов инсулина в головном мозге, может приводить к центральному функциональному
гипогонадотропному гипогонадизму. Это показано в клинических исследованиях и
работах с экспериментальными моделями, где уставлено, что низкий уровень
лептина (у пациентов в катаболическом состоянии при выраженной декомпенсации
СД) и низкий уровень инсулина либо достаточные его значения в условиях
инсулинорезистентности ингибируют экспрессию кисспептина в центральной нервной
системе [25]. Кроме того, токсическое действие хронической гипергликемии на нейроны
гипоталамуса выступает еще одним вероятным механизмом снижения секреции ГнРГ [26].
Сравнительная оценка нарушений
ГГГ-системы у мужчин с СД1 и СД2 проводилась в крайне ограниченном числе
исследований с относительно небольшими и крайне гетерогенными когортами. Эти
попытки дали неоднозначные и плохо воспроизводимые результаты. Во многом
остается неясным воздействие патофизиологических звеньев сахарного диабета на
состояние гонад, а также характеристики спермы, включая оценку подвижности сперматозоидов
у мужчин с СД1 и СД2 [27].
Следует подчеркнуть, что
правильный образ жизни в сочетании с адекватным фармакологическим контролем
представляет собой основу сохранения репродуктивного здоровья у больных СД,
однако необходимы дальнейшие исследования, которые позволят детализировать влияние
сахарного диабета на ГГГ-ось.
Возрастной гипогонадизм
По данным крупных исследований, уровень общей тестостерона начиная с 30
лет снижается на 0,5–1,5% в год, а темп снижения свободного тестостерона достигает
2–3% в год [28].
Разница между снижением общего и свободного тестостерона объясняется возрастным
увеличением циркулирующей концентрации ГСПГ, что снижает долю свободного
тестостерона.
Вместе с тем объединение данных трех
различных этапов Массачусетского исследования мужского старения (MMAS) указывает на то, что, помимо старения, ожирение и
некоторые хронические сопутствующие заболевания сами по себе нарушают
функционирование ГГГ-системы, приводя к развитию первичного, но чаще вторичного
гипогонадизма у мужчин старшей возрастной группы [29].
Исследование European Male Ageing Study (EMAS) во многом подтвердило эти
выводы. При обследовании около 3,5 тыс. мужчин в возрасте от 40 до 79 лет
распространенность гипогонадизма составила 23,3%; из них у 85,5% мужчин был
выявлен вторичный гипогонадизм, распространенность
которого с возрастом существенно не увеличивалась [30].
Это позволило сделать вывод, что в реальности снижение тестостерона у стареющих
мужчин проявляется как совокупный эффект старения, ожирения и накапливающейся
коморбидной патологии.
Некоторые медицинские сообщества с учетом потенциальной обратимости вторичного
гипогонадизма, обусловленного ожирением, СД2 и другими сопутствующими
заболеваниями, предлагают интерпретировать подобные нарушения как функциональный
гипогонадизм. Вместе с тем в ряде случаев нельзя отрицать формирование в
процессе старения возрастной первичной тестикулярной недостаточности, имеющей
необратимый и, таким образом, органический характер [31].
К ее причинам можно отнести возрастную клеточную дегенерацию, снижение
количества функциональных клеток Лейдига, атеросклероз артериального
сосудистого русла яичек. Разделяющим критерием при общем тестостероне ≤ 12
нмоль/л, позволяющим выделить первичный гипогонадизм, согласно данным ЕMAS, является концентрация ЛГ
≥ 9,4 МЕ/л, в то время как сниженное или низконормальное содержание ЛГ определяет
вторичный гипогонадизм [32].
Эксперты EMAS предложили
классифицировать мужчин с «компенсированным гипогонадизмом» (субклиническим –
по аналогии с заболеваниями щитовидной железы), имеющих нормальное содержание общего
тестостерона (≥12,1 нмоль/л) и повышенный уровень ЛГ (≥9,4 МЕ/л). Таких
пациентов в ЕМАS было
выявлено 10%, и они характеризовались более высоким риском (в 16 раз) прогрессирования
в первичный гипогонадизм по сравнению с эугонадными лицами [33].
Тем не менее современные
данные о долгосрочном клиническом значении компенсированного (субклинического) гипогонадизма
немногочисленны, что делает целесообразным наблюдение за этими пациентами и
изучение перспектив предложенного подхода.
Экзогенные модифицируемые факторы
Острые состояния и экстремальные воздействия
Среди наших соотечественников основоположником научного направления,
посвященного изучению изменениям гипофиз-гонадной системы здоровых мужчин при
воздействии различных экстремальных факторов, явился профессор Д. Шурыгин,
который более полувека назад в Военно-медицинской академии инициировал целый
ряд исследований. Д. Шурыгиным и его учениками в этой серии работ было
показано, что пребывание мужчины в условиях комплекса факторов высокогорья,
высоких широт, при воздействии химических агентов, а также при травматической,
ожоговой, вибрационной болезнях, острой кровопотере, гипокинезии подавляющим
образом влияет на функцию его гипофиз-гонадной системы. Так, в исследовании В. Мазурова
продемонстрировано, что при влиянии длительной гипокинезии в положении
антиортостаза, моделирующей длительный космический полет, а также в условиях
гиперкинеза и при подъеме на горную высоту у здоровых мужчин снижается уровень
ЛГ и тестостерона, т. е. развивается функциональный (транзиторный) гипогонадизм
с последующим самостоятельным восстановлением уровня тестостерона [34].
При изучении здоровья участников нескольких полярных экспедиций на антарктической
станции «Ленинградская» В. Яковлев выявил признаки перестройки ГГГ-системы в
виде повышения средних значений ЛГ зимой, а также ассоциированного снижения
уровня тестостерона осенью, главным образом при сочетания действия
неблагоприятных климатических факторов с интенсивными физическими нагрузками [35].
Эти данные позволили сделать вывод, что у здоровых мужчин, которые
подверглись воздействию экстремальных факторов, в большинстве случаев развивается
функциональный гипогонадизм, который, по-видимому, является адаптивной реакцией
и имеет преходящий характер, самолимитируясь после окончания действия
стрессора.
Одновременно с этим Д. Шурыгин и его школа занимались исследованиями
влияния острых состояний и терапевтических заболеваний на организм и состояние
ГГГ-системы. Так, А. Раков продолжил изучение влияния стрессоров на ГГГ-ось в исследованиях,
касающихся острого состояния – ожоговой болезни. В его работах установлено, что
содержание тестостерона снижено во все периоды ожоговой болезни, а подавление гонадотропной
функции происходит при глубоких ожогах свыше 10% поверхности тела и тем раньше,
чем больше тяжесть поражения. В период реконвалесценции наблюдается
нормализация гонадотропных функций гипофиза и тестостерона, что подтвердил в
своих исследованиях и М. Пугачев [36].
С.
Шустовым было показано, что острый инфаркт миокарда приводит к перестройке гормональной
регуляции у мужчин в виде активации гипофиз-адреналовой системы со значительным
угнетением функции ГГГ-системы. При анализе периода восстановления функции ГГГ-системы
было отмечено, что восстановление уровня тестостерона происходит лишь у части
мужчин (через 30 сут.), а отсутствие восстановления его уровня является предиктором
неблагоприятного течения постинфарктного периода [37].
Авторы
этих исследований пришли к выводу, что затяжной характер гипогонадизма у мужчин
при острых заболеваниях и состояниях может иметь патогенетическое значение и
определять развитие своеобразного преморбидного фона.
Следующим
этапом исследований, выполненных под руководством С. Шустова, стало изучение
влияния хронических заболеваний на развитие и течение гипогонадизма. В этой
области активно работали М. Харитонов, М. Куандыкова, А. Выдрыч, Д. Фролов, А. Макарова,
В. Кицышин и др. В этих исследованиях было показано влияние на ГГГ-систему
таких хронических заболеваний, как бронхиальная астма, пневмония, ИБС и ГБ,
сахарный диабет и диабетическая нефропатия, а также особенности их течения [38–40].
Комплекс
производственных факторов, которые влияют на гипофиз-гонадную систему военнослужащих,
принимающих участие в работах по уничтожению химического оружия, был исследован
в работах Ю.Ш. Халимова и В.А. Зайцева, которые выявили на фоне снижения уровня
тестостерона дисфункцию гонадотропинов и нарушение сперматогенеза [41].
Развитием
подобных исследований стали работы других отечественных ученых. Так, Е. Финагина
установила связь между более высоким темпом возрастного снижения общего и
свободного тестостерона у машинистов локомотивов с влиянием комплекса таких
неблагоприятных профессиональных факторов, как гиподинамия, сменный ритм работы
с ночными сменами и недостатком сна, высокая нагрузка на внимание, воздействие
шума и вибрации [42]. С. Бабанов
и др. установили негативное влияние вибрационной болезни на репродуктивную
систему мужчин с развитием андрогенного дефицита и эректильной дисфункции [43].
Несмотря
на длительное и подробное изучение проблемы гипогонадизма и вклада различных
заболеваний и внешних экстремальных воздействий в его формирование, остается
нерешенным вопрос о необходимости заместительной терапии тестостероном при
функциональном гипогонадизме, а также степени влияния заместительной
гормональной терапии тестостероном на течение основного заболевания.
Высокоинтенсивные психоэмоциональные нагрузки
В эпоху прогресса, высокого информационного потока, многозадачности
организм современного человека испытывает колоссальные нагрузки, при этом очевиден
вклад у мужчин постоянного
психоэмоционального напряжения в развитие гипогонадизма. В связи с этим с
недавнего времени введен термин «стресс-индуцированный гипогонадизм» [44]. Эндокринная система
имеет первенствующее значение в формировании компенсаторных механизмов в ответ
на различные экстремальные
факторы, воздействующие на организм, и от степени гормональной активности
зависит адекватность адаптации всего организма при стрессе [45]. Конечные гормоны
гипоталамо-гипофизарно-адреналовой системы при воздействии экстремальных
факторов адаптируют организм, регулируя множество центральных и периферических
функций. Первоначально при воздействии стрессорных факторов под влиянием
кортикотропин-рилизинг гормона (КРГ), пролактина и тиреотропин-рилизинг гормона
повышается содержание ЛГ и ФСГ, что приводит к выбросу тестостерона [30].
Но в последующем на фоне повышения активности гипоталамо-гипофизарно-адреналовой системы угнетается
секреция ЛГ и ФСГ путем блокирования гонадолибериновых рецепторов [46].
При включении
адренокортикального звена усугубляется снижение тропных гормонов, а также под
действием глюкокортикоидов уменьшается чувствительность рецепторов на клетках
Лейдига, что снижает стероидогенез [47]. В целом стресс-индуцированное
нарушение функционирования ГГГ-оси во многом зависит от продолжительности его
воздействия, а также исходного состояния организма, при этом после прекращения
действия стрессорного фактора и отдыха все показатели нормализуются [45].
Относительный дефицит энергии
Относительный
энергодефицит (низкая доступность энергии) вызывает функциональный
гипогонадизм, обусловленный следующими причинами: высокоинтенсивными физическими
нагрузками с неадекватным и/или сниженным потреблением пищи (голоданием), не
соответствующим энергетическим потребностям [48].
Этот понятие берет
свое начало от «триады спортсменок», выделенной в 1992 г. в спортивной медицине
в отношении женщин, что включало в себя неупорядоченное питание, аменорею и
остеопороз. Гипогонадотропный гипогонадизм у женщин выступает в этом случае как
защитный механизм, предотвращающий «затратную» для организма беременность, ввиду
недостаточного запаса жировой ткани, необходимого для поддержания овуляторной
функции. Мужская репродуктивная ГГГ-ось также оказалась уязвима к интенсивным
физическим нагрузкам, неадекватным потреблению пищи и в 2014 г. Международный
олимпийский комитет сменил термин на «гендерно нейтральный синдром
относительного дефицита энергии в спорте» (RED – S, Relative Energy Deficiency in Sport) [48].
На сегодня
существует два основных объяснения снижения тестостерона, наблюдаемого при
перетренированности. В первом случае обоснованием является множество
исследований, сообщающих о резком повышении кортизола и пролактина, вызванном
интенсивной физической нагрузкой, которые ингибируют выработку ГнРГ и гонадотропинов,
а также обладают прямым супрессивным действием на клетки Лейдига [49].
Второй обсуждаемый механизм связан с краткосрочным или длительным воздействием
дефицита калорий, вызывающим снижение тестостерона у мужчин. Общепризнано, что
перетренированность нередко приводит к потере веса и подавлению
аппетита/склонности к анорексии. Отрицательный энергетический баланс вызывает
гиполептинемию, что в соответствии с вышеизложенным приводит к подавлению ГнРГ
и всей ГГГ-оси. Подобное подавление репродуктивной оси имеет функциональный
характер и будет обратимым при увеличении массы тела, однако сроки нормализации
уровня тестостерона при этом носят индивидуальный характер [50].
Одним из наглядных примеров функционального гипогонадизма, вызванного экстремальными
нагрузками при суммации нескольких действующих факторов, выступило обследование
солдат в условиях полевых учений. Интенсивные тренировки, серьезный
психоэмоциональный стресс и ограничение калорий в суточном рационе привели к
снижению общего тестостерона у молодых мужчин ниже референтных значений [51].
При этом относительный энергодефицит у мужчин может сопровождаться симптомами
манифестного гипогонадизма (т. е. снижения либидо и
сексуальной дисфункции) с быстрым восстановлением ГГГ-оси, часто, в течение
недели после отдыха, возобновления питания и снижения стресса.
Травмы и оперативные вмешательства
Один из самых малоизученных и дискуссионных вопросов в проблеме
функционального гипогонадизма – это воздействие на репродуктивную ось таких
факторов, как полученная травма, включая черепно-мозговую или боевую
огнестрельную травму, хирургический стресс, а также влияние развившегося при
этом транзиторного андрогенодефицита на сроки регенерации.
Вероятность и
выраженность функционального гипогонадизма в этом случае будет определяться
объемом травматического повреждения, уровнем психоэмоционального стресса, а
также величиной катаболических и воспалительных процессов, вызванных поражением.
Наиболее очевидный механизм подавления ГГГ-оси, который определяет развитие
подобного функционального гипогонадизма, очевидно, является кортизол-опосредованным
с вовлечением вышеописанного влияния провоспалительных цитокинов в случае
присоединения иммуновоспалительного синдрома [52]. Подтверждением этого является
недавнее обследование пациентов с минно-взрывными ранениями, у которых ФГГ
встречался в 61% случаев, а уровень снижения тестостерона был тем ниже, чем
тяжелее ранение [53].
Несколько особняком
стоит черепно-мозговая травма (ЧМТ), которая может предопределить повреждение
гипоталамических или гипофизарных структур, приводящее через подавление ГнРГ
или гонадотропинов к более значительному снижению производства тестостерона
и/или более длительному гипогонадизму [54]. Помимо прямого повреждения, в
этом случае выделяют и вторичные эффекты ЧМТ, которые включают гипоксию, снижение мозгового кровотока и метаболизма,
а также повышение внутричерепного давления, которые могут в конечном итоге индуцировать
ишемический аденогипофизарный инфаркт [55] и приводить к стойкому гипопитуитаризму.
Обсуждая травматическую
болезнь, важно подчеркнуть неопределенность современных представлений в
отношении роли и значения функционального гипогонадизма в процессах регенерации
и общего восстановления после повреждения, что требует дальнейших исследований
и осмысления.
Лекарственно-индуцированный
гипогонадизм
Доказана связь между уровнем тестостерона и приемом некоторых
фармакологических препаратов. Глюкокортикоиды, трициклические антидепрессанты,
опиоиды, циметидин, никотин, действуя на всех уровнях ГГГ-оси, могут подавлять
продукцию тестостерона до 12 мес. после прекращения их применения [56].
Остановимся на наиболее встречающихся из них.
Опиоиды широко используются для обезболивания, а также
для детоксикации опиоидной зависимости. Они воздействуют на μ-опиоидные
рецепторы в гипоталамусе и через активацию динорфина приводят к уменьшению
пульсирующего высвобождения ГнРГ, снижению частоты выработки ЛГ (а также ФСГ) и
в конечном итоге к снижению уровня половых гормонов. Распространенность опиоид-индуцированного
гипогонадизма у мужчин оценивается от 19 до 86% и зависит от продолжительности
лечения специфическими опиоидными препаратами и их дозировки [57].
Длительное применение опиоидов вызывает ФГГ, что приводит к сексуальной
дисфункции и нарушению выработки сперматозоидов, поскольку δ-, κ- и μ-опиоидные
рецепторы представлены в сперматозоидах человека [58].
Опиоиды также могут повышать уровень пролактина, тем самым еще больше снижая
уровень тестостерона. За отменой опиоидов обычно следует восстановление уровня
тестостерона в сыворотке крови в течение одного месяца [59].
Анаболические стероиды, применение которых распространено среди
спортсменов и бодибилдеров, нарушает функционирование ГГГ-системы, а их
хроническое применение может вызвать подавление гонадотропинов и даже гипотрофию
яичек с развитием олигозооспермии или азооспермии. Симптомы гипогонадизма во
время применения, как правило, отсутствуют. После прекращения приема ГГГ-ось восстанавливается
в течение нескольких недель или месяцев, однако устойчивое подавление может
длиться до нескольких лет [60].
Глюкокортикоидные препараты при длительном применении
определяют развитие экзогенного гиперкортицизма, который является частой
причиной функционального гипогонадизма. Глюкокортикоиды подавляют секрецию
ГнРГ, что приводит к снижению или низконормальному уровню гонадотропина и в
последующем падению концентрации тестостерона. Вместе с тем при некоторых
условиях они обладают и прямым супрессивным эффектом на функции яичек, вызывая,
таким образом, смешанный (первичный и вторичный) гипогонадизм, при заметном
преобладании случаев вторичного гипогонадизма. При этом глюкокортикоидные
препараты вызывают снижение ГСПГ, что важно учитывать при диагностике биохимического
синдрома гипогонадизма [61].
Биологическое значение феномена функционального гипогонадизма
Общеизвестно, что состояние сердечно-сосудистой, дыхательной, эндокринной
и других основных систем организма определяет выживание организма. Так,
применительно к эндокринной системе гипоталамо-гипофизарно-адреналовая ось [1] или
гипоталамо-гипофизарно-тиреоидная ось [2],
которые регулируют выработку кортизола или гормонов щитовидной железы, играют
важнейшую роль в выживании, в связи с чем функционирование этих систем является
устойчивым и, как правило, поддерживается несмотря на развитие других
заболеваний или состояний [3–5]. В отличии от этих систем уникальность ГГГ-оси позиционирует
ее как важный переключатель между режимом выживания организма и репродуктивной функцией,
на который влияют многие эндогенные и экзогенные факторы. Именно поэтому ГГГ-ось
у обоих полов проявляет высокую чувствительность к огромному множеству сигналов, действуя как система
раннего предупреждения организма, или предвестник болезни или дистресса. По-видимому,
это объясняется тем, что размножение представляет собой факультативный процесс и во время болезни, серьезной травмы
или экстремальных нагрузок за счет подавления ГГГ-оси происходит переориентация
ресурсов на режим выживания с временным отходом от репродуктивных стратегий [7].
Вышеизложенные представления позволяют предположить, что
именно лептин, по-видимому, выступает своего рода привратником между выживанием
и репродуктивным режимом. Для оптимального репродуктивного функционирования
необходим идеальный метаболический статус, который допускает только
эулептинемию (с узким диапазоном уровня лептина в сыворотке крови). Длительное
ограничение в потреблении с уменьшением жировых запасов связано с
гиполептинемией, которая отключает репродуктивную ось и одновременно усиливает
аппетит к еде (важный компонент режима выживания). И наоборот, хронический
переизбыток калорий с увеличением депо жировой ткани связан с гиперлептинемией
и даже резистентностью к лептину, что весьма похожим образом с гиполептинемией подавляет
ГГГ-ось и повышает аппетит [6].
Важно
подчеркнуть при этом эволюционно обусловленную восприимчивость ГГГ-системы к
подавлению, которая, видимо, не была рассчитана на воздействие такого
количества «новых» факторов. Подобная уязвимость ГГГ-оси делает функциональный
гипогонадизм потенциально распространенным клиническим сценарием, особенно в
контексте ожирения, высоких психоэмоциональных нагрузок, нарушений сна и т. д.
[13].
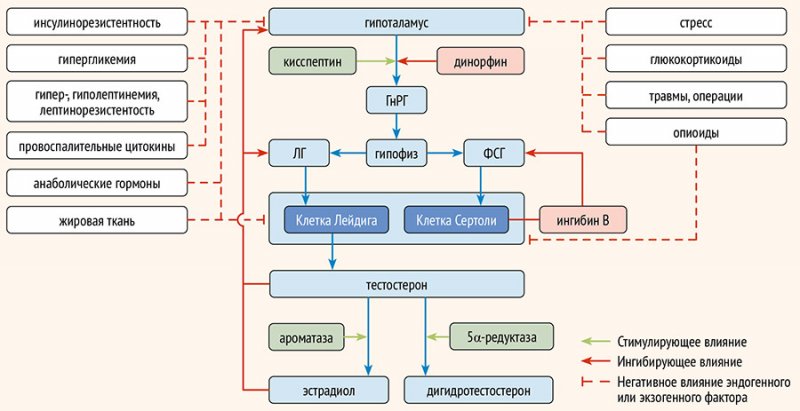
На
рис. 2 резюмированы нарушения на различных уровнях ГГГ-оси, вызывающие функциональный
гипогонадизм у мужчин.
Рисунок 2. Основные
точки приложения нарушений в гипоталамо-гипофизарно-гонадной системе, вызывающих
функциональный гипогонадизм у мужчин
Заключение
Современные представления о гипогонадизме у мужчин
претерпевают существенную трансформацию. Значительную долю всех случаев
снижения продукции тестостерона можно отнести к функциональным, обратимым
состояниям, которые остаются незамеченными, поскольку в отличие от женщин у
мужчин не существует циклического репродуктивного эквивалента. Временное
подавление репродуктивной ГГГ-оси мужчины в долгосрочной перспективе может
реализоваться в негативные эффекты гипотестостеронемии в отношении
костно-мышечной и сердечно-сосудистой систем, может проявиться в когнитивной
дисфункции, а также снижении жизненного тонуса и эмоционального фона.
Это актуализирует поиск критериев к срокам и методам коррекции
функционального гипогонадизма в зависимости от преобладающего механизма его
развития, а также требует при дифференциальной диагностике метаболической
дисфункции у мужчины учитывать причины, вызывающие снижение содержания
тестостерона.
Суммируя
вышеизложенное, можно сделать вывод, что функциональный гипогонадизм у мужчин в
современном научном мире приобретает все большее значение как самостоятельная
нозологическая форма, требующая более детального изучения своей патофизиологии
и необходимости коррекции.
Развернуть
- Nieschlag E, Behre HM, Nieschlag S. (eds.). Andrology: male reproductive health and dysfunction. 3rd ed. Asian J Androl. 2010;12(3):458. https://doi.org/10.1038/aja.2010.27.
- Barber TM, Kyrou I, Kaltsas G, Grossman AB, Randeva HS, Weickert MO. Mechanisms of Central Hypogonadism. Int J Mol Sci. 2021;22(15):8217. https://doi.org/10.3390/ijms22158217.
- Grossmann M, Matsumoto AM. A Perspective on Middle-Aged and Older Men With Functional Hypogonadism: Focus on Holistic Management. J Clin Endocrinol Metab. 2017;102(3):1067-1075. https://doi.org/10.1210/jc.2016-3580.
- Corona G, Goulis DG, Huhtaniemi I, Zitzmann M, Toppari J, Forti G et al. European academy of andrology (EAA) guidelines on investigation, treatment and monitoring of functional hypogonadism in males: endorsing organization: European society of endocrinology. Andrology. 2020;8(5):970-987. https://doi.org/10.1111/andr.12770.
- Corona G, Rastrelli G, Morelli A, Sarchielli E, Cipriani S, Vignozzi L et al. Treatment of functional hypogonadism besides pharmacological substitution. World J Mens Health. 2020;38(3):256-270. https://doi.org/10.5534/wjmh.190061.
- Spaziani M, Carlomagno F, Tarantino C, Angelini F, Vincenzi L, Gianfrilli D. New perspectives in functional hypogonadotropic hypogonadism: beyond late onset hypogonadism. Front Endocrinol (Lausanne). 2023;14:1184530. https://doi.org/10.3389/fendo.2023.1184530.
- Camacho EM, Huhtaniemi IT, O’Neill TW, Finn JD, Pye SR, Lee DM et al. Ageassociated changes in hypothalamic-pituitary-testicular function in middle-aged and older men are modified by weight change and lifestyle factors: longitudinal results from the European Male Ageing Study. Eur J Endocrinol. 2013;168(3):445-455. https://doi.org/10.1530/EJE-12-0890.
- Wu FC, Tajar A, Pye SR, Silman AJ, Finn JD, O’Neill TW et al. Hypothalamicpituitary-testicular axis disruptions in older men are differentially linked to age and modifiable risk factors: the European Male Aging Study. J Clin Endocrinol Metab. 2008;93(7):2737-2745. https://doi.org/10.1210/jc.2007-1972.
- Ide V, Vanderschueren D, Antonio L. Treatment of Men with Central Hypogonadism: Alternatives for Testosterone Replacement Therapy. Int J Mol Sci. 2020;22(1):21. https://doi.org/10.3390/ijms22010021.
- Hackett G, Kirby M, Rees RW, Jones TH, Muneer A, Livingston M et al. The British Society for Sexual Medicine Guidelines on Male Adult Testosterone Deficiency, with Statements for Practice. World J Mens Health. 2023;41(3):508-537. https://doi.org/10.5534/wjmh.221027.
- Di Nisio A, Sabovic I, De Toni L, Rocca MS, Dall’Acqua S, Azzena B et al. Testosterone Is Sequestered in Dysfunctional Adipose Tissue, Modifying Androgen-Responsive Genes. Int J Obes. 2020;44:1617-1625. https://doi.org/10.1038/s41366-020-0568-9.
- Genchi VA, Rossi E, Lauriola C, D’Oria R, Palma G, Borrelli A et al. Adipose Tissue Dysfunction and Obesity-Related Male Hypogonadism. Int J Mol Sci. 2022;23:8194. https://doi.org/10.3390/ijms23158194.
- Lima TFN, Nackeeran S, Rakitina E, Lima GFN, Arora H, Kargi AY, Ramasamy R. Association of Leptin with Total and Free Testosterone: Results from the National Health and Nutrition Examination Surveys. Androg Clin Res Ther. 2020;1(1):94-100. https://doi.org/10.1089/andro.2020.0007.
- Roumaud P, Martin LJ. Roles of leptin, adiponectin and resistin in the transcriptional regulation of steroidogenic genes contributing to decreased Leydig cells function in obesity. Horm Mol Biol Clin Investig. 2015;24(1):25-45. https://doi.org/10.1515/hmbci-2015-0046.
- Choubey M, Ranjan A, Bora PS, Baltazar F, Krishna A. Direct actions of adiponectin on changes in reproductive, metabolic, and anti-oxidative enzymes status in the testis of adult mice. Gen Comp Endocrinol. 2019;279:1-11. https://doi.org/10.1016/j.ygcen.2018.06.002.
- Tremellen K, McPhee N, Pearce K, Benson S, Schedlowski M, Engler H. Endotoxin-initiated inflammation reduces testosterone production in men of reproductive age. Am J Physiol Endocrinol Metab. 2018;314(3):E206-E213. https://doi.org/10.1152/ajpendo.00279.2017.
- Dhillo WS, Chaudhri OB, Patterson M, Thompson EL, Murphy KG, Badman MK et al. Kisspeptin-54 stimulates the hypothalamic-pituitary gonadal axis in human males. J Clin Endocrinol Metab. 2005;90(12):6609-6615. https://doi.org/10.1210/jc.2005-1468.
- Kawai T, Autieri MV, Scalia R. Adipose tissue inflammation and metabolic dysfunction in obesity. Am J Physiol Cell Physiol. 2021;320(3):C375-C391. https://doi.org/10.1152/ajpcell.00379.2020.
- Roychoudhury S, Chakraborty S, Choudhury AP, Das A, Jha NK, Slama P et al. Environmental Factors-Induced Oxidative Stress: Hormonal and Molecular Pathway Disruptions in Hypogonadism and Erectile Dysfunction. Antioxidants (Basel). 2021;10(6):837. https://doi.org/10.3390/antiox10060837.
- Davidson LM, Millar K, Jones C, Fatum M, Coward K. Deleterious effects of obesity upon the hormonal and molecular mechanisms controlling spermatogenesis and male fertility. Hum Fertil (Camb). 2015;18(3):184-193. https://doi.org/10.3109/14647273.2015.1070438.
- Corona G, Rastrelli G, Morelli A, Sarchielli E, Cipriani S, Vignozzi L, Maggi M. Treatment of Functional Hypogonadism Besides Pharmacological Substitution. World J Mens Health. 2020;38(3):256-270. https://doi.org/10.5534/wjmh.190061.
- Yu K, Deng SL, Sun TC, Li YY, Liu YX. Melatonin Regulates the Synthesis of Steroid Hormones on Male Reproduction: A Review. Molecules. 2018;23(2):447. https://doi.org/10.3390/molecules23020447.
- Дзантиева ЕО, Гусова ЗР, Хрипун ИА, Воробьев СВ. Особенности патогенетического влияния андрогенного дефицита на формирование нарушений углеводного обмена у мужчин с ожирением. Эндокринология: новости, мнения, обучение. 2017;(4):84-94. https://doi.org/10.24411/2304-9529-2017-00057.
- Niskanen L, Laaksonen DE, Punnonen K, Mustajoki P, Kaukua J, Rissanen A. Changes in sex hormone-binding globulin and testosterone during weight loss and weight maintenance in abdominally obese men with the metabolic syndrome. Diabetes Obes Metab. 2004;6(3):208-215. Available at: https://pubmed.ncbi.nlm.nih.gov/15056129.
- Castellano JM, Navarro VM, Roa J, Pineda R, Sánchez-Garrido MA, GarcíaGaliano D et al. Alterations in hypothalamic KiSS-1 system in experimental diabetes: early changes and functional consequences. Endocrinology. 2009;150(2):784-794. https://doi.org/10.1210/en.2008-0849.
- Хрипун ИА, Воробьев СВ. Гипогонадизм как коморбидность сахарного диабета 2-го типа. Focus Эндокринология. 2020;(1):16-20. Режим доступа: https://endo-club.ru/upload/iblock/685/68513443192d8137b06982ce3ac7e031.pdf.
- Condorelli RA, La Vignera S, Mongioì LM, Alamo A, Calogero AE. Diabetes mellitus and infertility: different pathophysiological effects in type 1 and type 2 on sperm function. Front Endocrinol (Lausanne). 2018;9:268. https://doi.org/10.3389/fendo.2018.00268.
- Araujo AB, Esche GR, Kupelian V, O’Donnell AB, Travison TG, Williams RE et al. Prevalence of symptomatic androgen deficiency in men. J Clin Endocrinol Metab. 2007;92(11):4241-4247. https://doi.org/10.1210/jc.2007-1245.
- Mohr BA, Guay AT, O’Donnell AB, McKinlay JB. Normal, bound and nonbound testosterone levels in normally ageing men: results from the Massachusetts Male Ageing Study. Clin Endocrinol (Oxf). 2005;62(1):64-73. https://doi.org/10.1111/j.1365-2265.2004.02174.x.
- Wu FC, Tajar A, Pye SR, Silman AJ, Finn JD, O’Neill TW et al. Hypothalamicpituitary-testicular axis disruptions in older men are differentially linked to age and modifiable risk factors: the European Male Aging Study. J Clin Endocrinol Metab. 2008;93(7):2737-2745. https://doi.org/10.1210/jc.2007-1972.
- Один ВИ, Диденко ВИ, Качанова ЕА, Святов ДИ, Цыган ВН, Самойлов АА. Типы старения и вегетативный статус у больных с эректильной дисфункцией в позднем онтогенезе. Вестник Российской Военно-медицинской академии. 2017;(3):105-108. Режим доступа: https://journals.eco-vector.com/1682-7392/article/view/623010/138846.
- Isidori AM, Aversa A, Calogero A, Ferlin A, Francavilla S, Lanfranco F et al. Adult- and late-onset male hypogonadism: the clinical practice guidelines of the Italian Society of Andrology and Sexual Medicine (SIAMS) and the Italian Society of Endocrinology (SIE). J Endocrinol Invest. 2022;45(12):2385-2403. https://doi.org/10.1007/s40618-022-01859-7.
- Eendebak RJAH, Ahern T, Swiecicka A, Pye SR, O’Neill TW, Bartfai G et al. Elevated luteinizing hormone despite normal testosterone levels in older men-natural history, risk factors and clinical features. Clin Endocrinol (Oxf). 2018;88(3):479-490. https://doi.org/10.1111/cen.13524.
- Яковлев ГМ, Мазуров ВИ, Яковлев ВА, и др. Эндокринная регуляция при различных патологических состояниях и воздействии экстремальных факторов. Военно-медицинский журнал. 1988;(4):35-37.
- Шурыгин ДЯ, Рябинин ИФ, Мазуров ВИ, Яковлев ВА. Функциональное состояние эндокринной системы у полярников Антарктиды. Антарктика. 1979;(18):200-209.
- Пугачев МИ, Шустов СБ, Крылов КМ, Орлова ОВ, Матвеенко АВ. Взаимосвязь клинической картины ожоговой болезни с состоянием некоторых звеньев эндокринной системы и показателями вариабельности сердечного ритма. Вестник Российской Военно-медицинской академии. 2014;2(46):13-17. Режим доступа: https://www.vmeda.org/wp-content/uploads/2016/pdf/13-17.pdf.
- Шустов СБ. Состояние гипоталамо-гипофизарно-гонадной системы и андрогенной функции коры надпочечников при остром инфаркте миокарда. Военно-медицинский журнал. 1983;(10):62-63.
- Куандыкова МВ, Баранов ВЛ, Харитонов МА. Влияние бронхиальной астмы и проводимой терапии на состояние гипофизарно-гонадной системы у мужчин. Медико-биологические и социально-психологические проблемы безопасности в чрезвычайных ситуациях. 2009;(1):33-37. Режим доступа: https://nrcerm.ru/files/gurnalMBP/gurnal_mbp1_2009.pdf.
- Выдрыч АН, Шустов СБ. Состояние некоторых звеньев эндокринной системы у мужчин с диабетической нефропатией. Вестник Российской Военно-медицинской академии. 2008;(1):12-15. Режим доступа: https://elibrary.ru/jxgxzd.
- Шустов СБ, Кицышин ВП, Фролов ДС, Макарова АВ. Влияние возрастного андрогенного дефицита на течение ишемической болезни сердца. Вестник Северо-Западного государственного медицинского университета им. И.И. Мечникова. 2017;9(1):28-33. https://doi.org/10.17816/mechnikov20179128-33.
- Халимов ЮШ, Зайцев ВА, Матвеев СЮ. Состояние гипофизарногонадной системы и сперматогенеза у военнослужащих, принимающих участие в работах по уничтожению химического оружия. Эндокринология: новости, мнения, обучение. 2016;(2):74-79. Режим доступа: https://endocrinology-journal.ru/ru/jarticles_endo/286.html?SSr=010134d87a21ffffffff27c__07e8050615012e-516.
- Финагина ЕА, Теодорович ОВ, Цфасман АЗ, Шатохин МН, Шеховцов СЮ. Зависимость уровня тестостерона от профессиональных факторов (на примере машинистов локомотива). Вестник новых медицинских технологий. 2017;24(3):151-155. Режим доступа: https://cyberleninka.ru/article/n/zavisimost-urovnya-testosterona-ot-professionalnyh-faktorov-naprimere-mashinistov-lokomotiva.
- Бабанов СА, Бараева РА. Репродуктивная функция мужчин при сочетанном течении вибрационной болезни и артериальной гипертензии. Наука и инновации в медицине. 2019;4(1):32-36. Режим доступа: https://innoscience.ru/2500-1388/article/view/43748/31489.
- Gray M, Bingham B, Viau V. A comparison of two repeated restraint stress paradigms on hypothalamic-pituitary-adrenal axis habituation, gonadal status and central neuropeptide expression in adult male rats. J Neuroendocrinol. 2010;22(2):92-101. https://doi.org/10.1111/j.1365-2826.2009.01941.x.
- Кубасов РВ. Гормональные изменения в ответ на экстремальные факторы внешней среды. Вестник Российской академии медицинских наук. 2014;69(9-10):102-109. https://doi.org/10.15690/vramn.v69i9-10.1138.
- Sankar BR, Maran RR, Sudha S, Govindarajulu P, Balasubramanian K. Chronic corticosterone treatment impairs Leydig cell 11beta-hydroxysteroid dehydrogenase activity and LH-stimulated testosterone production. Horm Metab Res. 2000;32(4):142-146. https://doi.org/10.1055/s-2007-978609.
- Turner AI, Canny BJ, Hobbs RJ, Bond JD, Clarke IJ, Tilbrook AJ. Influence of sex and gonadal status of sheep on cortisol secretion in response to ACTH and on cortisol and LH secretion in response to stress: importance of different stressors. J Endocrinol. 2002;173(1):113-122. https://doi.org/10.1677/joe.0.1730113.
- Grossmann M, Wittert GA. Dysregulation of the Hypothalamic-PituitaryTesticular Axis due to Energy Deficit. J Clin Endocrinol Metab. 2021;106(12):e4861-e4871. https://doi.org/10.1210/clinem/dgab517.
- Hackney AC. Hypogonadism in Exercising Males: Dysfunction or AdaptiveRegulatory Adjustment? Front Endocrinol (Lausanne). 2020;11:11. https://doi.org/10.3389/fendo.2020.00011.
- Wong HK, Hoermann R, Grossmann M. Reversible male hypogonadotropic hypogonadism due to energy deficit. Clin Endocrinol (Oxf). 2019;91(1):3-9. https://doi.org/10.1111/cen.13973.
- O’Leary TJ, Wardle SL, Greeves JP. Energy Deficiency in Soldiers: The Risk of the Athlete Triad and Relative Energy Deficiency in Sport Syndromes in the Military. Front Nutr. 2020;7:142. https://doi.org/10.3389/fnut.2020.00142.
- Geddes RI, Kapoor A, Hayashi K, Rauh R, Wehber M, Bongers Q et al. Hypogonadism induced by surgical stress and brain trauma is reversed by human chorionic gonadotropin in male rats: A potential therapy for surgical and TBI-induced hypogonadism? Endocrinol Diabetes Metab. 2021;4(3):e00239. https://doi.org/10.1002/edm2.239.
- Манухова ДА, Салухов ВВ, Айсаева СВ. Оценка влияния ранений различной степени тяжести на функцию гипофиз-гонадной системы. В: Итоговая конференция Военно-научного общества курсантов, студентов и слушателей: материалы итоговой конференции. Санкт-Петербург, 19 апреля 2023 г. СПб.: Военно-медицинская академия имени С.М. Кирова; 2023. С. 361-366. Режим доступа: https://www.elibrary.ru/atmeie.
- Barton DJ, Kumar RG, McCullough EH, Galang G, Arenth PM, Berga SL, Wagner AK. Persistent Hypogonadotropic Hypogonadism in Men After Severe Traumatic Brain Injury: Temporal Hormone Profiles and Outcome Prediction. J Head Trauma Rehabil. 2016;31(4):277-287. https://doi.org/10.1097/HTR.0000000000000188.
- Sav A, Rotondo F, Syro LV, Serna CA, Kovacs K. Pituitary pathology in traumatic brain injury: a review. Pituitary. 2019;22(3):201-211. https://doi.org/10.1007/s11102-019-00958-8.
- Corona G, Maggi M. Perspective: regulatory agencies’ changes to testosterone product labeling. J Sex Med. 2015;12(8):1690-1693. https://doi.org/10.1111/jsm.12951.
- Coluzzi F, Billeci D, Maggi M, Corona G. Testosterone deficiency in non-cancer opioid-treated patients. J Endocrinol Invest. 2018;41(12):1377-1388. https://doi.org/10.1007/s40618-018-0964-3.
- Birthi P, Nagar VR, Nickerson R, Sloan PA. Hypogonadism associated with long-term opioid therapy: a systematic review. J Opioid Manag. 2015;11(3):255-278. https://doi.org/10.5055/jom.2015.0274.
- Vuong C, Van Uum SH, O’Dell LE, Lutfy K, Friedman TC. The effects of opioids and opioid analogs on animal and human endocrine systems. Endocr Rev. 2010;31(1):98-132. https://doi.org/10.1210/er.2009-0009.
- Rasmussen JJ, Selmer C, Østergren PB, Pedersen KB, Schou M, Gustafsson F et al. Former Abusers of Anabolic Androgenic Steroids Exhibit Decreased Testosterone Levels and Hypogonadal Symptoms Years after Cessation: A Case-Control Study. PLoS ONE. 2016;11(8):e0161208. https://doi.org/10.1371/journal.pone.0161208.
- Crawford BA, Liu PY, Kean MT, Bleasel JF, Handelsman DJ. Randomized placebo-controlled trial of androgen effects on muscle and bone in men requiring long-term systemic glucocorticoid treatment. J Clin Endocrinol Metab. 2003;88(7):3167-3176. https://doi.org/10.1210/jc.2002-021827.



 1
1 2
2 3
3 4
4


Комментарии (0)