Журнал "Медицинский совет" №9/2024
DOI: 10.21518/ms2024-177
В.В. Наумова, Е.К. Бельтюков, О.П. Ковтун, Г.А. Быкова, О.Г. Смоленская, Г.А. Быкова, Е.С. Клячина, Уральский государственный медицинский университет; 620028, Россия, Екатеринбург, ул. Репина, д. 3
Введение. Эффективность таргетной терапии тяжелой бронхиальной астмы зависит от точного попадания выбранным препаратом в ключевое звено патогенеза. Поэтому вопрос фенотипирования тяжелой бронхиальной астмы в условиях реальной клинической практики является актуальным.
Цель. Определить основные клинико-аллергологические характеристики пациентов с тяжелой бронхиальной астмой и установить важные для фенотипирования признаки, определяющие выбор таргетного препарата для ее лечения.
Материалы и методы. В проспективно-ретроспективном исследовании участвовали пациенты (n = 198) территориального регистра Свердловской области, получающие таргетную терапию тяжелой бронхиальной астмы. С учетом клинико-аллергологической картины выделены фенотипы тяжелой бронхиальной астмы: аллергическая, неаллергическая эозинофильная, смешанная. Описаны клинико-лабораторные характеристики фенотипов. Разработан алгоритм фенотипирования.
Результаты. В регистре пациентов (n = 198) с тяжелой бронхиальной астмой неаллергическая эозинофильная астма составила 46,5%, аллергическая – 34,8%, смешанная – 18,7%. Выделены значимые для фенотипирования признаки: возраст дебюта, доказанная аллергия, уровень аллерготеста ФадиатопТМ и эозинофилов крови, сопутствующий аллергический ринит, хронический риносинусит с полипами носа и гиперчувствительность к нестероидным противовоспалительным препаратам. Основные признаки определения аллергического фенотипа тяжелой бронхиальной астмы: ранний дебют, доказанная аллергия и положительный результат аллерготеста ФадиатопТМ (при результате ≥ 1,53 PAU/l вероятность аллергического фенотипа увеличивается). Характерные признаки неаллергической эозинофильной астмы: эозинофилия ≥ 150 кл/мкл, отсутствие аллергии, сопутствующий хронический риносинусит с полипами носа и гиперчувствительность к нестероидным противовоспалительным препаратам, поздний дебют (после 30 лет). Для смешанной астмы определены признаки: наличие доказанной аллергии или латентной сенсибилизации в сочетании с высоким уровнем аллерготеста ФадиатопТМ, поздний дебют, эозинофилия ≥ 300 кл/мкл, хронический риносинусит с полипами носа, гиперчувствительность к нестероидным противовоспалительным препаратам.
Заключение. Предложен алгоритм фенотипирования тяжелой бронхиальной астмы, основанный на выделении эозинофилии аллергического и неаллергического генеза. Фенотипирование тяжелой бронхиальной астмы, которое можно провести в реальной клинической практике, должно облегчить выбор инициального таргетного препарата.
Для цитирования: Наумова ВВ, Бельтюков ЕК, Ковтун ОП, Смоленская ОГ, Быкова ГА, Клячина ЕС. Клинико-аллергологическая характеристика пациентов с тяжелой бронхиальной астмой в региональном регистре и принципы фенотипирования для выбора таргетной терапии. Медицинский Совет. 2024;(9):47-61. https://doi.org/10.21518/ms2024-177
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Direct comparative study of the effectiveness of mepolizumab and dupilumab in patients with severe non-allergic eosinophilic asthma
Veronika V. Naumova, Еvgeny К. Beltyukov, Оlga P. Kovtun, Galina А. Bykova, Оlga G. Smolenskaya, Galina A. Bykova, Ekaterina S. Klyachina, Urals State Medical University; 3, Repin St., Ekaterinburg, 620028, Russia
Introduction. Severe asthma targeted therapy effectiveness depends on precise targeting of the selected drug to the key link in pathogenesis. Therefore, severe asthma phenotyping in real clinical practice is relevant.
Aim. To determine main clinical and allergological characteristics of patients with severe asthma and to establish important phenotyping signs determined choice of a targeted drug for severe asthma treatment.
Materials and methods. The prospective and retrospective study involved patients (n = 198) of the Sverdlovsk region registry receiving targeted therapy of severe asthma. Considering clinical and allergological picture, allergic, non-allergic eosinophilic and mixed severe asthma phenotypes were identified. Clinical and laboratory characteristics of phenotypes were described. A phenotyping algorithm was developed.
Results. In the register of patients (n = 198) with severe asthma, non-allergic eosinophilic asthma was 46.5%, allergic – 34.8%, mixed – 18.7%. Significant signs for phenotyping were identified: age of asthma onset, proven allergy, Phadiatop ImmunoCAP level and blood eosinophils on baseline, concomitant allergic rhinitis, chronic rhinosinusitis with nasal polyps and hyper-sensitivity to NSAIDs. The main signs of allergic severe asthma determined: early onset, proven allergy and a positive result of Phadiatop ImmunoCAP (the probability of allergic phenotype increases with Phadiatop ≥ 1.53 PAU/l). Signs of non-allergic eosinophilic asthma were eosinophilia ≥ 150 cells/μl, absence of allergy, concomitant chronic rhinosinusitis with nasal polyps and hypersensitivity to NSAIDs, late onset (after 30 years). Signs were identified for mixed asthma: presence of proven allergy or latent sensitization in combination with high level of Phadiatop ImmunoCAP, late onset, eosinophilia ≥ 300 cells/μl, chronic rhinosinusitis with nasal polyps, hypersensitivity NSAIDs.
Conclusions. The algorithm for severe asthma phenotyping based on the isolation of eosinophilia of allergic and non-allergic origin is proposed. Severe asthma phenotyping, which can be carried out in real clinical practice, should facilitate the selection
of an initial targeted drug.
For citation: Naumova VV, Beltyukov EK, Kovtun OP, Smolenskaya OG, Bykova GA, Klyachina ES. Clinical and allergological characteristics of patients with severe bronchial asthma in the regional registry and phenotyping principles for the targeted therapy choice. Meditsinskiy sovet = Medical Council. 2024;(9):47-61. (In Russ.) https://doi.org/10.21518/ms2024-177
Conflict of interest: the authors declare no conflict of interest.
Введение
Использование таргетных препаратов открывает дополнительные возможности для достижения контроля над тяжелой бронхиальной астмой (ТБА). Эффективность данного вида терапии зависит от точного попадания выбранным препаратом в ключевое звено патогенеза. Поэтому вопрос фенотипирования ТБА в условиях реальной клинической практики является актуальным. Ранее проведенные кластерные анализы по клиническим и лабораторным показателям выделяют от 3 до 5 кластеров пациентов [1–6] без четкой привязки к выбору таргетного препарата, высказывая лишь предположения о возможном преимуществе того или иного класса моноклональных антител у разных кластеров. Поэтому до сих пор нет единообразного подхода к выбору первого препарата у пациентов с ТБА. Выбор препарата чаще основан на мнении специалиста [7]. В работах отмечается, что у части пациентов старт биологической терапии возможен с препарата любой доступной сейчас для применения группы [8–10], что затрудняет выбор. Цель исследования – определить основные клинико- аллергологические характеристики пациентов с ТБА и установить важные для фенотипирования признаки, определяющие выбор таргетного препарата для лечения ТБА.
Материалы и методы
Проведено проспективно-ретроспективное исследование. В рамках обсервационного проспективного открытого нерандомизированного исследования наблюдались взрослые пациенты (18 лет и старше) с Т2 ТБА. Пациенты подписывали информированное согласие на обработку персональных данных перед включением в регистр и на использование их данных в научных целях, одобренное локальным этическим комитетом Уральского государственного медицинского университета.
Согласно Письму Министерства здравоохранения Свердловской области №03-01-82/6992 от 18.06.2019 г. «О порядке направления пациентов с неконтролируемой ТБА на лечение генно-инженерными биологическими препаратами»1, больные БА, получающие базисную терапию 4-й и 5-й ступени, направлялись на консилиум во главе с главным внештатным специалистом аллергологом- иммунологом Министерства здравоохранения Свердловской области. По результатам консилиума подтверждался диагноз ТБА, проводилось фенотипирование, выбирался таргетный препарат, определялось медицинское учреждение для инициации терапии. Для фенотипирования астмы применяли сбор аллергоанамнеза, кожные пробы с аллергенами, определение аллерген-специфических IgE (sIgE), общего IgE и уровня эозинофилов периферической крови. Также проводили аллерготест Phadiatop ImmunoCAP (ФадиатопТМ). Определение клинико-аллергологических особенностей ТБА проводилось в 3 группах пациентов:
- аллергической,
- неаллергической эозинофильной,
- смешанной (аллергическая и неаллергическая эозинофильная) ТБА.
Критериями невключения в регистр являлись:
- возраст младше 18 лет;
- ожидаемая продолжительность терапии менее 12 мес.;
- тяжелые сопутствующие заболевания: симптоматическая артериальная гипертензия, ишемическая болезнь сердца, хроническая сердечная недостаточность III и IV функционального класса, цирроз печени, подозрение на онкологические заболевания или верифицированные онкологические заболевания, туберкулез.
Диагнозы аллергического ринита (АР) [11], хронического риносинусита с полипами носа (ХРСсПН) и без полипов носа (ХРСбПН) [12] устанавливались согласно клиническим рекомендациям по соответствующим нозологиям. Определение отягощенной по астме и аллергии наследственности проводилось с использованием 4 вопросов:
1) Были ли у ваших кровных родственников аллергические заболевания? (Если респондент уточнял, какие именно, то перечислялись БА, АР, атопический дерматит (АтД), реакции на пищу.)
2) Была ли у ваших кровных родственников БА?
3) Были ли у ваших кровных родственников АР или АтД (наличие атопии в семье)? 4) Было ли хотя бы у одного вашего кровного родственника сочетание БА и АР/АтД?
Аллергодиагностика проводилась поэтапно. На пер вом этапе подробно собирался аллергоанамнез, т. е. выявлялись клинически значимые проявления при контакте пациентов с разными группами аллергенов. Выделены следующие группы аллергенов: бытовые (домашняя и библиотечная пыль, клещи домашней пыли), эпидермальные (часть результатов этой группы представлена с выделением «кошка», «собака» и «другие животные»), пыльцевые (деревья, луговые и сорные травы), грибковые и пищевые. Наличие реакции на разные виды пыльцевых аллергенов определялось по времени возникновения симптомов: в регионе исследования сезоны цветения растений имеют относительно четкие границы: конец апреля – май – деревья, июнь – середина июля – луговые травы, середина июля – август – сорные травы. Реакция на плесневые грибки предполагалась при наличии симптомов в сырых помещениях. На втором этапе выявляли наличие сенсибилизации с помощью стандартных методов аллергообследования (кожное тестирование и (или) результаты sIgE к ингаляционным и пищевым аллергенам). Аллергообследование было проведено у 89,9% (n = 62) пациентов с аллергической ТБА, у 72,8% (n = 67) пациентов – с неаллергической эозинофильной и 83,8% (n = 31) пациентов – со смешанной астмой. У пациентов, которым не было проведено стандартного аллергообследования (кожные пробы и (или) sIgE), был проведен аллерготест ФадиатопТМ для подтверждения или исключения аллергического компонента. На третьем этапе проводилось сопоставление наличия клинически значимой реакции у пациентов при контакте с разными группами аллергенов и результатов аллергообследования.
По результатам третьего этапа выделены 4 группы пациентов:
1) нет анамнеза и нет сенсибилизации;
2) реакция без подтверждения (реакция есть, нет sIgE); 3) латентная сенсибилизация (реакции нет, sIgE есть);
4) аллергия (реакция есть, sIgE есть).
В ретроспективной части исследования определялись наиболее значимые признаки фенотипов Т2 БА. По итогам ретроспективного анализа предложен алгоритм фенотипирования. В анализе участвовали пациенты (n = 160), у которых был собран аллергоанамнез и проведено аллергообследование. На первом этапе фенотипирования отбирались пациенты с доказанной аллергией (наличие клинически значимой реакции при контакте с аллергеном (аллергенами) и выявленными аллерген-специфическими IgE к этому аллергену (аллергенам)). Таким образом, на первом этапе было выявлено большинство пациентов с клинически значимым аллергическим компонентом, проведен анализ попавших в эту группу пациентов с неаллергической эозинофильной ТБА и выявлены признаки, отличающие аллергическую астму от неаллергической и смешанной. На втором этапе выделены пациенты, не имеющие ни клинически значимых реакций при контакте с аллергенами, ни sIgE при аллергообследовании. На этом этапе определялось большинство пациентов с неаллергической эозинофильной ТБА. На третьем этапе фенотипирования анализировались случаи пациентов, имевших или неподтвержденные реакции, или латентную сенсибилизацию (в эту группу попадали спорные случаи неаллергической эозинофильной и смешанной ТБА). Статистический анализ Статистический анализ проводился с использованием программы StatTech v.4.1.2 (разработчик – ООО «Статтех», Россия). Количественные показатели оценивались на предмет соответствия нормальному распределению с помощью критерия Колмогорова – Смирнова. Количественные показатели, имеющие нормальное распределение, описывались с помощью средних арифметических величин (M) и стандартных отклонений (SD), границ 95% доверительного интервала (ДИ). В случае отсутствия нормального распределения количественные данные описывались с помощью медианы (Me) и нижнего и верхнего квартилей (Q1–Q3). Категориальные данные описывались с указанием абсолютных значений и процентных долей. Сравнение 3 и более групп по количественному показателю, имеющему нормальное распределение, выполнялось с помощью однофакторного дисперсионного анализа, апостериорные сравнения проводились с помощью критерия Тьюки (при условии равенства дисперсий). Сравнение 3 и более групп по количественному показателю, распределение которого отличалось от нормального, выполнялось с помощью критерия Краскела – Уоллиса, апостериорные сравнения – с помощью критерия Данна с поправкой Холма. Сравнение процентных долей при анализе многопольных таблиц сопряженности выполнялось с помощью критерия χ2 Пирсона. Различия считались статистически значимыми при p < 0,05.
Результаты
На декабрь 2023 г. в регистре состояло 198 пациентов, из них 79,3% (n = 157) – женщины. Средний возраст пациентов – 51,50 года (Q1–Q3: 42,25–61,00). По фенотипам ТБА преобладала неаллергическая эозинофильная астма (46,5%, n = 92). Пациенты с аллергической ТБА составили 34,8% (n = 69), со смешанной – 18,7% (n = 37) (табл. 1). Пациенты с аллергической ТБА были значимо моложе пациентов с неаллергической эозинофильной и смешанной астмой (р < 0,001). Также группы пациентов различались возрастом дебюта БА: в среднем в 7 лет дебютировала аллергическая астма, в 30 лет – смешанная, в 39 лет – неал-
лергическая эозинофильная астма (р < 0,001). Индекс массы тела был значимо выше у пациентов с неаллергической эозинофильной астмой (р = 0,010).
Активно курили 20,7% (n = 41) пациентов, из них 34 отказались от курения. Средний индекс курения составил 7,50 (Q 1 –Q 3 : 2,38–20,0) пачка/лет. О пассивном курении в анамнезе сообщили также 20,7% (n = 41) пациентов. Средняя длительность воздействия табачного дыма составила 18,00 (Q1 –Q3: 10,25–20,00) лет. Разницы в фенотипических группах по статусу курения не было (табл. 1).
Таблица 1. Характеристика пациентов с тяжелой бронхиальной астмой, получающих таргетную терапию
Показатели | Всего n=198 | Группа №1 Аллергическая ТБА n=69 | Группа №2 Неаллергическая эозинофильная ТБА n=92 | Группа №3 Смешанная ТБА n=37 | р | |
Женщины, n (%) | 157 (79,3) | 49 (71,0) | 77 (83,7) | 31 (83,8) | 0,110 | |
Мужчины, n (%) | 41 (20,7) | 20 (29,0) | 15 (16,3) | 6 (16,2) | 0,110 | |
Средний возраст, лет, Me (Q1–Q3) / M ± SD (95% ДИ) | 51,50 (42,25 – 61,00) | 42,42 ± 13,45 (39,19 – 45,65) | 55,63 ± 10,40 (53,48 – 57,78) | 52,32 ± 12,94 (48,01 – 56,64) | < 0,001* p1– 2 < 0,001 p1 – 3 < 0,001 | |
Средний возраст дебюта БА, лет, Me (Q1–Q3) | 28,00 (10,00 – 42,50) | 7,00 (3,00 – 19,00) | 39,00 (29,00 – 50,25) | 30,00 (16,00 – 41,00) | < 0,001* p2– 1 < 0,001 p3 – 1 < 0,001 p3 – 2 = 0,015 | |
ИМТ, кг/м2, M ± SD (95% ДИ) / Me (Q1–Q3) | 27,84 ± 5,96 (26,98 – 28,70) | 26,22 (22,17 – 31,44) | 28,84 (25,65 – 31,64) | 24,87 (23,02 – 29,85) | 0,010* p2 – 1 = 0,033 p3 – 2 = 0,033 | |
Наличие АР, n (%) | 100 (50,5) | 65 (94,2) | 2 (2,2) | 33 (89,2) | < 0,001* p1 – 2 < 0,001 p2 – 3 < 0,001 | |
Наличие ХРСсПН, n (%) | 89 (44,9) | 8 (11,6) | 56 (60,9) | 25 (67,6) | < 0,001* p1 – 2 < 0,001 p1 – 3 < 0,001 | |
Наличие ХРСбПН, n (%) | 31 (15,7) | 5 (7,2) | 24 (26,1) | 2 (5,4) | < 0,001* p1 – 2 = 0,006 p2 – 3 = 0,016 | |
Наличие атопического дерматита, n (%) | 31 (15,7) | 22 (31,9) | 5 (5,4) | 4 (10,8) | < 0,001* p1 – 2 < 0,001 p1 – 3 = 0,032 | |
Наличие крапивницы, n (%) | 23 (11,6) | 9 (13,0) | 9 (9,8) | 5 (13,5) | 0,753 | |
Наличие лекарственной гиперчувствительности, n (%) | 104 (52,5%) | 28 (40,6) | 57 (62,0) | 19 (51,4) | 0,027* p1 – 2 = 0,022 | |
Наличие гиперчувствительности к НПВП, n (%) | 59 (29,8) | 2 (2,9) | 45 (48,9) | 12 (32,4) | < 0,001* p1 – 2 < 0,001 p1 – 3 < 0,001 | |
Курение активное, n (%) | 41 (20,7) | 11 (15,9) | 24 (26,1) | 6 (16,2) | 0,220 | |
Курение пассивное, n (%) | 41 (20,7) | 11 (15,9) | 19 (20,7) | 11 (29,7) | 0,248 | |
Наследственность по аллергическим заболеваниям, n (%) | 117 (59,1) | 44 (63,8) | 48 (52,2) | 25 (67,6) | 0,170 | |
Наследственность по БА, n (%) | 75 (50,0) | 25 (51,0) | 35 (47,9) | 15 (53,6) | 0,867 | |
Наследственность по атопии, n (%) | 66 (44,0) | 30 (61,2) | 26 (35,6) | 10 (35,7) | 0,013* p1 – 2 = 0,016 | |
Наследственность по БА и атопии у одного родственника, n (%) | 28 (18,7) | 17 (34,7) | 5 (6,8) | 6 (21,4) | < 0,001* p1 – 2 < 0,001 | |
Общий IgE, МЕ/л, Me (Q1–Q3) | 196,00 (86,00 – 466,00) | 309,00 (134,95 – 687,25) | 106,55 (40,52 – 364,82) | 227,05 (115,07 – 581,00) | < 0,001* p2 – 1 < 0,001 p3 – 2 = 0,003 | |
ФадиатопТМ, PAU/l, Me (Q1–Q3) | 1,02 (0,10 – 6,71) | 6,08 (2,22 – 29,60) | 0,09 (0,02 – 0,29) | 4,66 (1,30 – 10,01) | < 0,001* p2 – 1 < 0,001 p3 – 2 < 0,001 | |
Эозинофилы периферической крови, кл/мкл, Me (Q1–Q3) | 460,00 (284,00 – 840,00) | 310,00 (178,50 – 476,75) | 555,50 (335,00 – 950,00) | 637,00 (403,00 – 936,00) | < 0,001* p2 – 1 < 0,001 p3 – 1 < 0,001 | |
ОФВ1, л, Me (Q1–Q3) / M ± SD (95% ДИ) | 1,65 (1,11 – 2,10) | 1,99 ± 0,90 (1,74 – 2,24) | 1,58 ± 0,67 (1,43 – 1,73) | 1,61 ± 0,69 (1,36 – 1,86) | 0,008* p1 – 2 = 0,008 | |
ОФВ1, %, M ± SD (95% ДИ) | 61,38 ± 21,89 (58,26 – 64,49) | 64,01 ± 22,20 (58,47 – 69,56) | 59,96 ± 20,87 (55,62 – 64,31) | 60,29 ± 23,93 (52,31 – 68,27) | 0,500 | |
БДТ, мл, Me (Q1–Q3) | 240,00 (100,00 – 400,00) | 240,00 (125,00 – 410,00) | 201,00 (90,00 – 370,00) | 280,00 (130,25 – 455,00) | 0,365 | |
БДТ, %, Me (Q1–Q3) | 14,50 (6,00 – 25,80) | 15,60 (7,50 – 26,90) | 14,00 (5,85 – 21,50) | 17,00 (7,88 – 33,62) | 0,644 | |
АСТ, баллы, Me (Q1–Q3) | 11,00 (8,00 – 14,00) | 11,00 (8,00 – 14,00) | 11,00 (9,00 – 14,00) | 8,50 (7,00 – 13,00) | 0,119 | |
AQLQ, баллы, Me (Q1–Q3) | 3,52 (2,80 – 4,54) | 3,48 (2,91 – 4,48) | 3,67 (2,91 – 4,62) | 3,22 (2,71 – 4,08) | 0,321 | |
SNOT22, баллы, M ± SD (95% ДИ) | 46,86 ± 23,08 (43,40 – 50,32) | 40,60 ± 19,01 (35,61 – 45,60) | 48,70 ± 24,77 (43,15 – 54,24) | 52,92 ± 23,48 (44,97 – 60,86) | 0,026* p1 – 3 = 0,031 | |
Обострения БА, в год, M ± SD (95% ДИ) | 2,32 ± 2,36 (1,98 – 2,66) | 1,97 ± 1,50 (1,59 – 2,34) | 2,54 ± 2,79 (1,96 – 3,13) | 2,41 ± 2,43 (1,56 – 3,26) | 0,321 | |
Вызовы СМП, в год, M ± SD (95% ДИ) | 2,03 ± 8,47 (0,81 – 3,26) | 1,97 ± 5,65 (0,56 – 3,38) | 1,38 ± 5,81 (0,16 – 2,61) | 3,87 ± 15,77 (1,64 – 9,37) | 0,348 | |
Госпитализации, в год, M ± SD (95% ДИ) | 0,70 ± 1,04 (0,55 – 0,85) | 0,80 ± 1,24 (0,50 – 1,11) | 0,66 ± 0,92 (0,46 – 0,85) | 0,62 ± 0,95 (0,29 – 0,95) | 0,601 | |
Инвалидность, n (%) | 29 (14,6) | 11 (15,9) | 12 (13,0) | 6 (16,2) | 0,334 | |
Реакция при контакте с респираторными аллергенами, n (%) | 136 (68,7) | 69 (100%) | 35 (38,0) | 33 (89,2) | < 0,001* p1 – 2 < 0,001 p2 – 3 < 0,001 | |
Реакция при контакте с пищевыми аллергенами, n (%) | 76 (38,4) | 33 (47,8) | 25 (27,2) | 18 (48,6) | 0,010* p1 – 2 = 0,021 p2 – 3 = 0,039 | |
Наличие аллерго-обследования (кожные пробы и/или sIgE), n (%) | 160 (80,8) | 62 (89,9) | 67 (72,8) | 31 (83,8) | 0,022* p1 – 2 = 0,022 | |
Положительный результат аллергообследования(кожные пробы и/или sIgE), n (%) | 114 (71,2) | 62 (100,0) | 21 (31,3) | 31 (100,0) | < 0,001* p1 – 2 < 0,001 p2 – 3 < 0,001 | |
Примечание. БА – бронхиальная астма; ИМТ – индекс массы тела; АР – аллергический ринит; АтД – атопический дерматит; ХРСсПН – хронический риносинусит с полипами носа; ХРСбПН – хронический риносинусит без полипов носа; НПВП – нестероидные противовоспалительные препараты; ДИ – доверительный интервал; ОФВ1 – объем форсированного выдоха за 1-ю секунду; БДТ – бронходилатационный тест; АСТ – Asthma Control Test (тест по контролю за астмой); AQLQ – Asthma Quality of Life Quastionnaire (опросник по качеству жизни у больных бронхиальной астмой); SNOT22 – Sinonasal Outcome Test (тест по качеству жизни у пациентов с хроническим риносинуситом); СМП – скорая медицинская помощь; sIgE – специфические иммуноглобулины Е; p1–2 – уровень значимости при сравнении групп (1 – аллергической ТБА, 2 – неаллергической эозинофильной ТБА, 3 – смешанной ТБА). * Различия показателей статистически значимы (p < 0,05).
В целом 59,1% (n=117) пациентов регистра отмечали отягощенную наследственность по аллергическим
заболеваниям, 50,0% (n=75) – по БА. Но статистически значимой разницы между
фенотипическими группами по этим показателям не было (р=0,170 и p=0,867) (табл.
1). Отягощенная наследственность по атопии и БА+атопии встречалась значимо чаще
у пациентов с аллергической ТБА, чем у пациентов с неаллергической
эозинофильной астмой (табл. 1).
На момент
включения в регистр стойкая утрата трудоспособности была зарегистрирована у
14,6% (n=29) пациентов без статистически значимой разницы по группам (табл. 1).
Четыре пациента имели 2 группу инвалидности (по 2 пациента с аллергической и
неаллергической - эозинофильной астмой); 25 пациентов – 3 группу инвалидности
(9 пациентов с аллергической астмой, 10 пациентов с неаллергической
эозинофильной, 6 пациентов со смешанной астмой). На декабрь 2023 г. у 2
пациентов при переосвидетельствовании 3 группа инвалидности снята. Помимо 29
пациентов с установленной инвалидностью на момент включения в регистр, 6
пациентов имели в детстве статус ребенок-инвалид (5 с аллергической астмой, 1
со смешанной). Но при переосвидетельствовании в 18 лет у всех стойкая утрата
трудоспособности не подтверждена.
По опроснику уровня
контроля БА - АСТ среднее количество баллов составило 11,00 (Q1-Q3: 8,00 – 14,00), что
соответствует неконтролируемому течению астмы. По опроснику качества жизни AQLQ средний балл составил
3,52 (Q1-Q3: 2,80 –
4,54). Статистически значимой разницы результатов этих опросников по группам не
зарегистрировано (р=0,119 и р=0,321 соответственно). Опросник SNOT22 показал более значимое влияние назальной
патологии на качество жизни в группе смешанной астмы (средний балл 52,92 ±
23,48 (95% ДИ 44,97 – 60,86)) по сравнению с группой аллергической астмы
(средний балл 40,60 ± 19,01 (95% ДИ 35,61 – 45,60)) (р=0,031) (табл. 1).
Среднее
количество обострений БА, вызовов СМП и госпитализаций по поводу обострений
астмы составило 2,32 ± 2,36 (95% ДИ 1,98 – 2,66), 2,03 ± 8,47 (95% ДИ 0,81 – 3,26), 0,70 ± 1,04 (95% ДИ 0,55 – 0,85) в год соответственно и в фенотипических
группах статистически не отличалось (р=0,321, р=0,348, р=0,601) (табл. 1).
Средний объем
форсированного выдоха за 1-ю секунду составил 1,65 л (Q1-Q3: 1,11 – 2,10) и был значимо ниже в
группе с неаллергической эозинофильной астмой по сравнению c аллергической (р=0,008). Но в
процентном соотношении разницы между группами не зарегистрировано (р=0,500) и
средний показатель ОФВ1 составил 61,38 ± 21,89% (95% ДИ 58,26 – 64,49).
Исходный бронходилатационный тест был положительным во всех группах в
абсолютном и процентном выражении – средние показатели составили 240,00 мл (Q1-Q3: 100,00 – 400,00) и 14,50%
(Q1-Q3: 6,00 – 25,80).
Статистической разницы между группами не было (табл. 1).
Уровень
эозинофилов периферической крови преобладал в группах пациентов со смешанной и
неаллергической эозинофильной ТБА по сравнению с аллергической (р<0,001). Уровни
аллерготеста ФадиатопТМ
и общего IgE были значимо выше в
группах с аллергической и смешанной астмой по сравнению с неаллергической
эозинофильной астмой (р<0,001)
(табл. 1).
Реакцию со
стороны дыхательных путей при контакте с респираторными аллергенами описывали 68,7%
(n=136) пациентов. На различные реакции на пищу жаловались 38,4% (n=76)
пациентов. Чаще всего пациенты отмечали клинические проявления при контакте с
кошками: 87,5% (n=56) пациентов в группе с аллергической астмой, 69,7% (n=23)
пациентов со смешанной астмой и 40,5% (n=15) пациентов с неаллергической
эозинофильной астмой (p<0,001, значимая разница была зарегистрирована между
тремя группами) (рис. 1). На втором месте по частоте жалоб были реакции при
контакте с бытовыми аллергенами (домашняя и библиотечная пыль): 76,9% (n=50)
пациентов в группе с аллергической астмой, 67,7% (n=21) пациентов со смешанной
астмой и 41,7% (n=15) пациентов с неаллергической эозинофильной астмой (p=0,001,
значимая разница между группами аллергической и неаллергической эозинофильной
астмы) (рис. 1). Также значимо чаще пациенты с аллергической и смешанной астмой
по сравнению с неаллергической эозинофильной астмой отмечали реакции при
контакте с собаками, в период цветения деревьев и луговых трав, а также на
пищевые продукты (p<0,001, р=0,040, р=0,006, р=0,010 соответственно) (рис. 1).
Рисунок 1. Частота
клинических реакций на аллергены разных групп у пациентов регистра в
зависимости от фенотипа тяжелой бронхиальной астмы
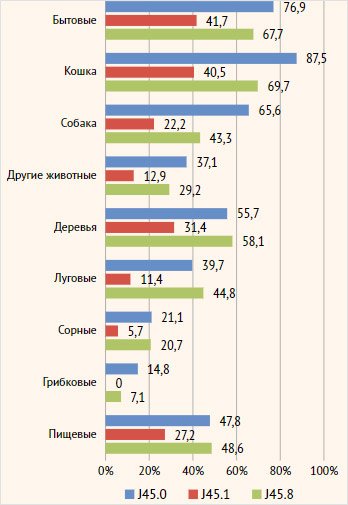
Примечание. На
графике отражена частота реакций, которые сами пациенты связывают с тем или
иным аллергеном (так называемая self-reported распространенность).
J45.0 –
аллергическая астма, J45.1 – неаллергическая эозинофильная астма, J45.8 –
смешанная астма
Аллергообследование было проведено у
80,8% (n=160) пациентов регистра (табл. 1). Пациентам без стандартного
аллергообследования для подтверждения/исключения аллергического компонента
проведен аллерготеста ФадиатопТМ.
Медиана теста составила у «необследованных» пациентов с аллергической ТБА 3,70 PAU/l (1,18-32,60), у пациентов с
неаллергической ТБА – 0,04 PAU/l (Q1-Q3: 0,01-0,16), у пациентов со смешанной
астмой - 4,22 PAU/l (1,72-7,40). Статистически значимой разницы между
«обследованными» и «необследованными» стандартными методами подгруппами
пациентов в пределах одного фенотипа получено не было (р=0,692, р=0,242,
р=0,814 соответственно).
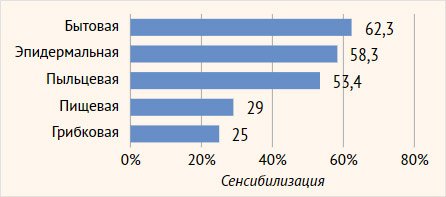
В целом по
регистру чаще встречалась бытовая (62,3%, n=91), эпидермальная (58,3%, n=84), пыльцевая (53,4%, n=62) сенсибилизация (рис. 2).
Рисунок 2. Структура
сенсибилизации к разным группам аллергенов у пациентов регистра (n=160)
Среди пациентов
с аллергической и смешанной астмой положительные результаты кожных проб и/или
специфических IgE зарегиcтрированы в 100% случаев. У пациентов с неаллергической
эозинофильной ТБА положительные результаты аллергообследования выявлялись
значимо реже (31,3%, n=21, р < 0,001). Среди пациентов с аллергической и
смешанной ТБА чаще встречалась сенсибилизация к бытовым аллергенам (95% и 75%
соответственно), кошке (94,3% и 68% соответственно), собаке (84,9% и 59,1%
соответственно) (рис. 3). У пациентов с неаллергической эозинофильной ТБА
сенсибилизация ко всем группам аллергенов выявлялась значимо реже, чем у
пациентов с аллергической и смешанной астмой. В группе неаллергической
эозинофильной астмы наиболее распространенной оказалась сенсибилизация к
бытовым аллергенам, аллергенам собаки и деревьев (22,4%, 15,1%, 11,4% соответственно)
(рис. 3).
Рисунок 3. Структура
сенсибилизации к аллергенам разных групп у пациентов регистра в зависимости от
фенотипа тяжелой бронхиальной астмы
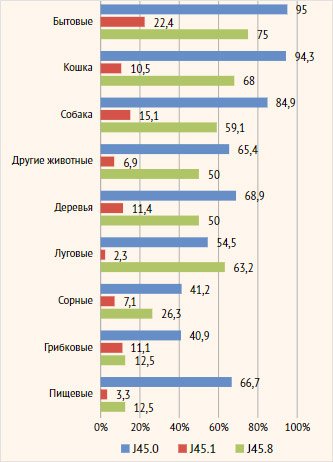
Примечание. J45.0
– аллергическая астма, J45.1 – неаллергическая эозинофильная астма, J45.8 –
смешанная астма
В большинстве
случаев пациенты с аллергической и смешанной ТБА имели сенсибилизацию к более
чем одной группе аллергенов.
70,1% пациентов с неаллергической астмой не имели сенсибилизации ни к одной из
групп аллергенов (р<0,001) (рис. 4). У 21 пациента с неаллергической астмой
были выявлены sIgE к
разным группам аллергенов: у 12 из них была моносенсибилизация, у 3 пациентов –
сенсибилизация к двум группам аллергенов, у 5 пациентов - к 3 группам
аллергенов. Медиана аллерготеста ФадиатопТМ
больных неаллергической астмой, имевших сенсибилизацию, составила 0,1 PAU/l (Q1-Q3:
0,04-0,52).
Рисунок 4. Структура
сенсибилизации у пациентов с аллергическим, неаллергическим эозинофильным и
смешанным фенотипом астмы
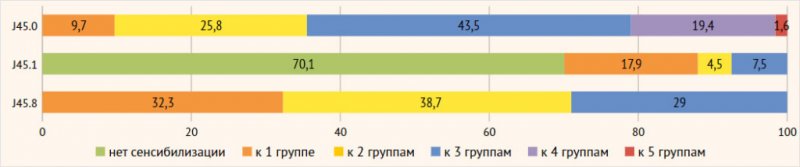
Примечание. J45.0
– аллергическая астма, J45.1 – неаллергическая эозинофильная астма, J45.8 –
смешанная астма
Далее, при сопоставлении аллергоанамнеза и
аллергообследования аллергия выявлена в 100% и 90,3% случаев у пациентов с
аллергической и смешанной астмой. У пациентов с неаллергической эозинофильной
астмой подтвержденные аллергические реакции были выявлены в 13,4% (n=9) случаев. Остальные 12
случаев выявления sIgE
у пациентов с неаллергической ТБА оказались латентной сенсибилизацией. В целом
латентная сенсибилизация, реакции без подтверждения сенсибилизации, отсутствие
аллергоанамнеза и отрицательные результаты аллергообследования преобладали в
группе неаллергической эозинофильной астмы (p<0,001) (рис. 5).
Рисунок 5.
Сопоставление клинической картины с результатами аллергообследования
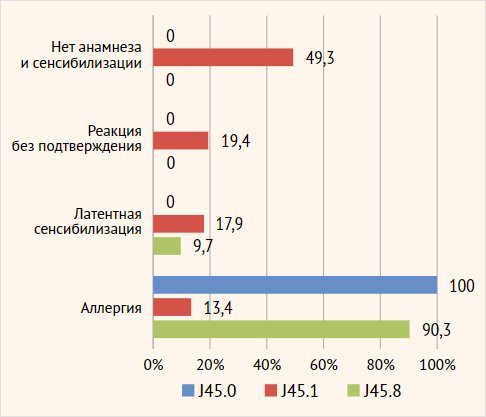
Примечание. J45.0
– аллергическая астма, J45.1 – неаллергическая эозинофильная астма, J45.8 –
смешанная астма
Среди пациентов
с доказанной аллергической реакцией наиболее распространенными
причинно-значимыми аллергенами были аллергены кошки, бытовые аллергены и
аллергены собаки в группе аллергической астмы (88,2%, 74,1%, 70,0%
соответственно), а в группе смешанной астмы – бытовые, аллергены кошки и
деревьев (62,5%, 54,5%, 52,4% соответственно) (рис. 6). Статистически значимые
различия между группами пациентов с астмой с аллергическим компонентом и
группой пациентов с неаллергической эозинофильной были получены по бытовым
аллергенам, аллергенам кошки и собаки, пыльце деревьев и луговых трав. По
группам сорных трав, грибковых аллергенов и аллергенов других животных
статистически значимых различий не было.
Рисунок 6. Структура
доказанной аллергии у пациентов регистра в зависимости от фенотипа тяжелой
бронхиальной астмы
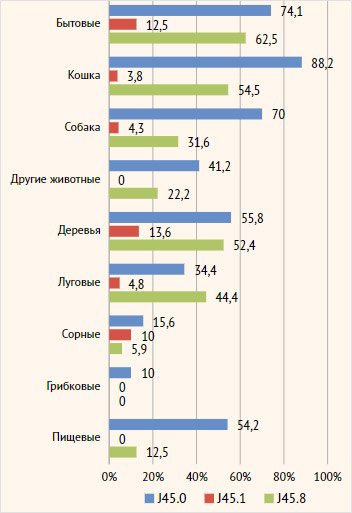
Примечание. J45.0
– аллергическая астма, J45.1 – неаллергическая эозинофильная астма, J45.8 –
смешанная астма
У 9 пациентов с
неаллергической эозинофильной ТБА и наличием доказанной аллергии
причинно-значимыми аллергенами были бытовые (n=3), аллергены деревьев (n=3),
аллергены сорных трав (n=2), аллергены луговых трав (n=1), животных (n=2). У 5 пациентов была
аллергия к одной группе аллергенов, у 2 пациентов – к 2 группам аллергенов и у
2 пациентов – к 3 группам аллергенов. У 5 пациентов уровень аллерготеста ФадиатопТМ был менее 0,35 PAU/L, у 3 пациентов в диапазоне 0,35-0,9 PAU/L.
Базисную терапию
в объеме 4-й ступени терапии по GINA
получали 62,1% (n=123) пациентов, остальные – в объеме 5-й ступени. При анализе
объема терапии в зависимости от фенотипа ТБА статистически значимых различий
получено не было. На 5-й ступени терапии находились 42,0% пациентов с
аллергической ТБА, 37,0% - с неаллергической (эозинофильной), 32,4% - со
смешанной астмой.
Все пациенты
регистра получали базисную ингаляционную комбинированную терапию ИГКС + ДДБА
(68,7%, n=136 средние дозы, 31,3%, n=62 высокие дозы) (рис. 7). АЛП, как
дополнительный препарат, входил в базисную терапию у 56,9% (n=112), длительно
действующий М-холинолитик – у 35,9% (n=71) пациентов. В регистре 70,2% (n=139)
пациентов получали СГКС, из них 22 пациента (11,1% пациентов регистра)
принимали СГКС на постоянной основе, у остальных 117 пациентов требовалось
назначение СГКС курсами при обострениях ТБА и/или ХВЗН (рис. 7). ГКС-зависимость
сформировалась у 29 больных ТБА (14,6%). В дополнение к 22 пациентам,
принимавшим СГКС на постоянной основе, 7 пациентов принимали СГКС курсами при
обострениях, но при их отмене практически сразу наступало ухудшение, которое
требовало возобновления СГКС. Такие пациенты также расценивались как имеющие
ГКС-зависимость. По сопутствующим ХВЗН большая часть пациентов принимала ИнГКС
и неседативные АГП.
Рисунок 7.
Базисная терапия тяжелой бронхиальной астмы и хронический воспалительных заболеваний
носа у пациентов регистра
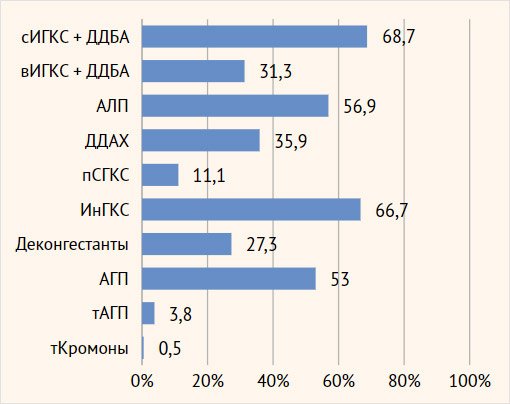
Примечание.
сИГКС – ингаляционные глюкокортикостероды в средней дозе, вИГКС – ингаляционные
глюкокортикостероиды в высокой дозе, ДДБА – длительно действующие
бета-агонисты, АЛП – антилейкотриеновый препарат, ДДХ – длительно действующие холинолитики,
пСГКС – пероральные системные глюкокортикостероиды, ИнГКС – интраназальные
глюкокортикостероиды, АГП – антигистаминные препараты 2-го поколения, тАГП –
топические антигистаминные препараты, тКромоны – топические кромоны
В зависимости от
фенотипа ТБА и сопутствующего ХВЗН значимые различия в принимаемой терапии
выявлены по СГКС (чаще принимали СГКС
пациенты с неаллергической эозинофильной и смешанной астмой по сравнению с
аллергической ТБА, р=0,010), по ИнГКС (чаще принимали пациенты со смешанной
астмой, чем с аллергической, р= 0,006), по АГП 2 п. (чаще принимали пациенты со
смешанной и аллергической по сравнению с неаллергической эозинофильной, р<0,001)
(рис. 8).
Рисунок 8.
Характеристика принимаемой базисной терапии в зависимости от фенотипа тяжелой
бронхиальной астмы
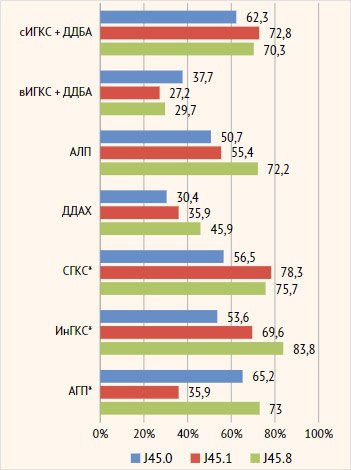
Примечание.
сИГКС – ингаляционные глюкокортикостероды в средней дозе, вИГКС – ингаляционные
глюкокортикостероиды в высокой дозе, ДДБА – длительно действующие
бета-агонисты, АЛП – антилейкотриеновый препарат, ДДХ – длительно действующие
холинолитики, СГКС – системные глюкокортикостероиды, ИнГКС – интраназальные
глюкокортикостероиды, АГП – антигистаминные препараты 2-го поколения, J45.0 – аллергическая
астма, J45.1 – неаллергическая эозинофильная астма, J45.8 – смешанная астма
По комбинациям препаратов принимаемой терапии
выявлено, что большая часть пациентов с аллергической ТБА получала сИГКС+ДДБА
или сИГКС+ДДБА+1 дополнительный препарат базисной терапии (по 24,6%), с неаллергической
эозинофильной и смешанной - сИГКС+ДДБА+1 дополнительный препарат (39,1% и 45,9%
соответственно). Пациенты с неаллергической эозинофильной астмой принимали СГКС
на постоянной основе чаще, чем пациенты со смешанной и аллергической ТБА (16,3%,
8,1%, 5,8% соответственно) (табл. 2).
Таблица 2. Схемы базисной терапии в зависимости от фенотипов тяжелой бронхиальной астмы
Схема терапии | Фенотип ТБА | ||
J45.0 | J45.1 | J45.8 | |
сИГКС+ДДБА, n (%) | 17 (24,6) | 14 (15,2) | 3 (8,1) |
вИГКС+ДДБА, n (%) | 7 (10,1) | 6 (6,5) | 1 (2,7) |
сИГКС+ДДБА+1 доп.препарат, n (%) | 17 (24,6) | 36 (39,1) | 17 (45,9) |
сИГКС+ДДБА+2 доп.препарата, n (%) | 6 (8,7) | 8 (8,7) | 5 (13,5) |
вИГКС+ДДБА+1 доп.препарат, n (%) | 13 (18,8) | 10 (10,9) | 4 (10,8) |
вИГКС+ДДБА+2 доп.препарата, n (%) | 5 (7,2) | 3 (3,3) | 4 (10,8) |
сИГКС+ДДБА+пСГКС, n (%) | 0 (0,0) | 0 (0,0) | 1 (2,7) |
вИГКС+ДДБА+пСГКС, n (%) | 1 (1,4) | 4 (4,3) | 0 (0,0) |
сИГКС+ДДБА+1 доп.препарат+пСГКС, n (%) | 2 (2,9) | 4 (4,3) | 0 (0,0) |
сИГКС+ДДБА+2доп.препарата+пСГКС, n (%) | 0 (0,0) | 4 (4,3) | 0 (0,0) |
вИГКС+ДДБА+1 доп.препарат+пСГКС, n (%) | 0 (0,0) | 2 (2,2) | 0 (0,0) |
вИГКС+ДДБА+2доп.препарата+пСГКС, n (%) | 1 (1,4) | 1 (1,1) | 2 (5,4) |
Примечание.
сИГКС – ингаляционные глюкокортикостероды в средней дозе, вИГКС – ингаляционные
глюкокортикостероиды в высокой дозе, ДДБА – длительно действующие
бета-агонисты, АЛП – антилейкотриеновый препарат, ДДХ – длительно действующие
холинолитики, пСГКС – пероральные системные глюкокортикостероиды, ИнГКС – интраназальные
глюкокортикостероиды, АГП – антигистаминные препараты 2-го поколения, J45.0 – аллергическая
астма, J45.1 – неаллергическая эозинофильная астма, J45.8 – смешанная астма
Ретроспективная
оценка признаков, характерных для разных фенотипов Т2-бронхиальной астмы
привела к выделению этапов фенотипирования.
1 этап
фенотипирования – установление пациентов с доказанной аллергией (совпадение
наличия клинически значимой реакции у пациента с результатами
аллергообследования (кожные пробы и/или sIgE). При анализе базы данных выявлено,
что из 160 обследованных пациентов 60 больных с положительным ответом были
определены нами ранее как пациенты с аллергической ТБА, 9 пациентов – с
неаллергической эозинофильной ТБА, 28 пациентов – со смешанной ТБА. Из 9
пациентов с ранее определенной нами неаллергической эозинофильной астмой 3
имели моноаллергию к бытовым аллергенам, 4 имели моноаллергию к пыльцевым
аллергенам, 1 пациент моноаллергию к кошке, 1 пациент – доказанную аллергию к 3
группам аллергенов (собака, деревья, луговые травы). Также у этих 9 пациентов
возраст дебюта составил 28,00 лет (Q1-Q3: 26,00-30,00), у 6 пациентов сопутствовал ХРСсПН (66,7%), у 4
пациентов - непереносимость НПВП (44,4%), уровень аллерготеста ФадиатопТМ - 0,38 PAU/l (0,10-0,64) (табл. 3).
Таблица 3. Характеристика пациентов, отобранных на 1-м этапе фенотипирования
Показатель | Аллергическая ТБА, n=60 | Неаллергическая эозинофильная ТБА, n=9 | Смешанная ТБА, n=28 | р |
Аллергия, n (%) | 60 (100%) | 9 (100%) | 28 (100%) | |
Наследственность по атопии, n (%) | 27 (60,0) | 3 (37,5) | 7 (33,3) | 0,099 |
Наличие АР, n (%) | 60 (96,8) | 1 (11,1) | 26 (92,9) | < 0,001* p1 – 2 < 0,001 p2 – 3 < 0,001 |
Возраст дебюта, лет, Me (Q₁ – Q₃) | 7,00 (3,00 – 18,50) | 28,00 (26,00 – 30,00) | 28,50 (16,00 – 41,00) | < 0,001* p2 – 1 < 0,001 p3 – 1 < 0,001 |
Наличие ХРСсПН, n (%) | 8 (12,9) | 6 (66,7) | 21 (75,0) | < 0,001* p1– 2 < 0,001 p1– 3 < 0,001 |
Наличие непереносимости НПВП, n (%) | 2 (3,2) | 4 (44,4) | 10 (35,7) | < 0,001* p1– 2 < 0,001 p1– 3 < 0,001 |
Эозинофилы периферической крови, кл/мкл, Me (Q₁ – Q₃) | 310,00 (172,00 – 445,50) | 460,00 (335,00 – 800,00) | 708,40 (479,50 – 978,25) | < 0,001* p3– 1 < 0,001 |
Аллерготест ФадиатопТМ, PAU/L, Me (Q₁ – Q₃) | 6,09 (2,29 – 27,75) | 0,38 (0,10 – 0,64) | 7,10 (1,30 – 10,01) | < 0,001* p2 – 1 < 0,001 p3– 2 = 0,001 |
Примечание. АР –
аллергический ринит, ХРСсПН – хронический риносинусит с полипами носа, НПВП –
нестероидные противовоспалительные препараты.
* – различия показателей статистически значимы (p < 0,05)
p1 – 2 – уровень значимости
при сравнении групп (1 – группа аллергической ТБА, 2 – группа неаллергической
эозинофильной ТБА, 3 – группа смешанной ТБА)
Наличие аллергии
у пациентов с неаллергической эозинофильной астмой не играло большой роли в
патогенезе у данных пациентов. Кроме того, возможны ложно- положительные
результаты кожных проб, когда реакция на один плюс расценивается как
положительная, и при этом пациент
отмечает реакции в пыльном помещении, но на самом деле эта реакция просто связана с неспецифическим раздражением
пылевыми частицами слизистой дыхательных путей. Это предположение и
решение в пользу неаллергической астмы принято и обосновано нами в совокупности
с отрицательным аллерготестом ФадиатопТМ
у 3 пациентов с бытовой сенсибилизацией (у всех ФадиатопТМ был менее 0,35 PAU/l). У пациентов с ТБА и
моноаллергией к животным и пыльцевым аллергенам тяжесть астмы не могла быть
обусловлена сезонными воздействиями и редкими контактами с животными. У двух
пациентов с пыльцевой аллергией уровень аллерготеста
ФадиатопТМ незначительно превышал общепринятый порог 0,35 PAU/l (0,4 и 0,38); у одной из этих
пациенток выявлен АР с дебютом в год старта биологической терапии. Поэтому у
них также был определен
неаллергический эозинофильный фенотип. К тому же выявленный нами уровень аллерготеста ФадиатопТМ ≥
1,53, как показатель значимого аллергического компонента, не позволял установить и смешанную астму [11]. У пациентки
с аллергией к 3 группам аллергенов уровень ФадиатопТМ был 0,04, что может быть ошибкой
лабораторного метода. Пациентка с аллергией к кошке и латентной сенсибилизацией
к грибкам, бытовым аллергенам и
собаке, с аллерготестом ФадиатопТМ
0,89 PAU/l, могла быть расценена как
смешанная астма; к тому же она имела сопутствующие ХРСсПН и непереносимость
НПВП. Таким образом, мы ошиблись с фенотипированием у 2-х пациенток из
160 обследованных, что составило 1,25% от 160 полностью обследованных
пациентов, что не оказало существенного
влияния на предложенные нами принципы фенотипирования пациентов с ТБА при
отборе на таргетную терапию.
Резюмируя
вышесказанное, можно утверждать, что основные признаки аллергического фенотипа ТБА это: доказанная аллергия и
положительный результат аллерготеста
ФадиатопТМ (при результате ≥ 1,53 вероятность аллергического
фенотипа увеличивается). Дополнительными критериями значимого аллергического
компонента могут быть: наличие аллергического ринита, возраст дебюта астмы до
20 лет, отягощенная наследственность по атопии, невысокая эозинофилия (до 450 кл/мкл), отсутствие ХРСсПН и
непереносимости НПВП.
На втором этапе
фенотипирования выделены 33 пациента, имеющие отрицательные результаты
аллергоанамнеза и аллергообследования. Все эти пациенты были определены нами
как пациенты с неаллергической эозинофильной астмой. Характерными признаками
этого фенотипа определены: эозинофилия ≥ 150 кл/мкл, отсутствие аллергии,
сопутствующие ХРСсПН и непереносимость НПВП, поздний дебют (после 30 лет)
(табл. 4).
Таблица 4. Характеристика пациентов, отобранных на 2-м этапе фенотипирования
Показатель | Неаллергическая эозинофильная ТБА, n=33 |
Наследственность по атопии | 10 (37,0) |
Наследственность по атопии+БА | 2 (7,4) |
Возраст дебюта, лет, Me (Q₁ – Q₃) | 48,00 (38,00 – 54,00) |
Наличие ХРСсПН, n (%) | 20 (60,6) |
Наличие непереносимости НПВП, n (%) | 20 (60,6) |
Эозинофилы периферической крови, кл/мкл, Me (Q₁ – Q₃) | 680,00 (389,00 – 1063,00) |
ФадиатопТМ, PAU/L, Me (Q₁ – Q₃) | 0,08 (0,02 – 0,17) |
Примечание. БА –
бронхиальная астма, ХРСсПН – хронический риносинусит с полипами носа, НПВП –
нестероидные противовоспалительные препараты.
На третьем этапе
анализировались оставшиеся пациенты (n=28) с неподтвержденными реакциями и
латентной сенсибилизацией. В этой группе оказались 25 пациентов с ранее
установленной неаллергической эозинофильной астмой, 3 пациента – со смешанной
астмой (табл. 5).
Таблица 5. Характеристика пациентов, отобранных на 3-м этапе фенотипирования
Показатель | Неаллергическая эозинофильная ТБА, n=25 | Смешанная ТБА, n=3 | р |
Наследственность по атопии, n (%) | 7 (36,8) | 1 (33,3) | 0,078 |
Наследственность по БА+атопии, n (%) | 0 (0,0) | 1 (33,3) | 0,136 |
Наличие АР, n (%) | 0 (0,0) | 1 (33,3) | 0,107 |
Возраст дебюта, лет, M ± SD (95% ДИ) | 36,12 ± 13,70 (30,46 – 41,78) | 35,00 ± 5,00 (22,58 – 47,42) | 0,891 |
Наличие ХРСсПН, n (%) | 18 (72,0) | 2 (66,7) | 1,000 |
Наличие непереносимости НПВП, n (%) | 11 (44,0) | 0 (0,0) | 0,258 |
Эозинофилы периферической крови, кл/мкл, Me (Q₁ – Q₃) | 520,00 (330,00 – 950,00) | 360,00 (311,00 – 372,00) | 0,220 |
ФадиатопТМ, PAU/L, Me (Q₁ – Q₃) | 0,09 (0,03 – 0,21) | 3,45 (2,09 – 8,38) | 0,008* |
Примечание. БА –
бронхиальная астма, АР – аллергический ринит, ХРСсПН – хронический риносинусит
с полипами носа, НПВП – нестероидные противовоспалительные препараты.
25 пациентов с
неаллергической астмой, несмотря на реакции при контакте с аллергенами и
латентную сенсибилизацию, имели аллерготест ФадиатопТМ менее пороговых значений (24 пациента <
0,35 PAU/l, 1 пациент 0,65 PAU/l), не имели сопутствующего АР. Эта
совокупность признаков дает возможность исключить значимое участие
аллергического компонента в патогенезе данного
фенотипа ТБА. Также эти пациенты соответствовали вышеперечисленным
признакам 2-го этапа фенотипирования (высокая эозинофилия, сопутствующие ХРСсПН
и непереносимость НПВП).
Анализ пациентов
со смешанной астмой на 1-м и 3-м этапах фенотипирования позволил выделить
необходимую комбинацию признаков: наличие доказанной аллергии или латентной
сенсибилизации в сочетании с высоким уровнем аллерготеста ФадиатопТМ, поздний дебют,
эозинофилию ≥ 300, ХРСсПН, непереносимость НПВП (рис. 9).
Рисунок 9.
Клинико-лабораторная характеристика фенотипов Т2 тяжелой бронхиальной астмы
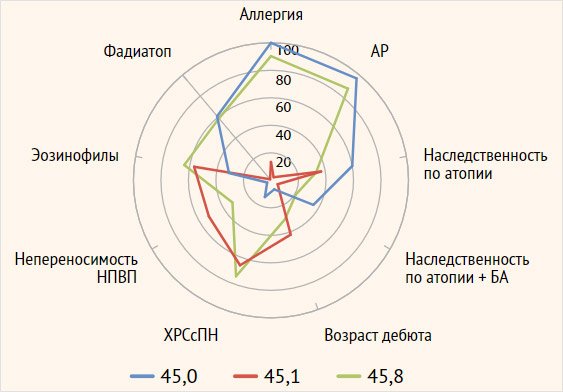
Примечание. АР –
аллергический ринит, ХРСсПН – хронический риносинусит с полипами носа, НПВП –
нестероидные противовоспалительные препараты.
Согласно
полученным фенотипам мы выбирали таргетный препарат первой линии: пациентам с
аллергической астмой преимущественно анти-IgE препарат, пациентам с
неаллергической эозинофильной астмой – анти-IL5 препараты. Анти-IL4R,13 препарат блокирует Th2 и
ILC2 пути Т2-воспаления, поэтому предполагается его эффективность у пациентов
всех трех выделенных нами фенотипов. Пациентам со смешанной астмой с учетом
комбинации Th2 и ILC2 путей выбор препарата был возможен из всех трех доступных
классов моноклональных антител (табл. 6).
Таблица 6. Структура выбора таргетного препарата первой линии у пациентов регистра с учетом
фенотипирования
Препарат | Фенотип ТБА | p | ||
Аллергическая ТБА | Неаллергическая ТБА | Смешанная ТБА | ||
Омализумаб | 53 (76,8) | 1 (1,1) | 9 (24,3) | < 0,001* p1– 2 < 0,001 p1– 3 < 0,001 p2– 3 < 0,001 |
Бенрализумаб | 1 (1,4) | 31 (33,7) | 6 (16,2) | |
Дупилумаб | 15 (21,7) | 29 (31,5) | 18 (48,6) | |
Меполизумаб | 0 (0,0) | 22 (23,9) | 3 (8,1) | |
Реслизумаб | 0 (0,0) | 9 (9,8) | 1 (2,7) | |
Примечание. ТБА – тяжелая бронхиальная астма
* – различия показателей статистически значимы (p < 0,05)
p1 – 2 – уровень
значимости при сравнении групп (1 – группа аллергической ТБА, 2 – группа
неаллергической эозинофильной ТБА, 3 – группа смешанной ТБА)
Обсуждение
Мы проанализировали данные 198 пациентов
с ТБА территориального регистра. Регистр предназначен для назначения таргетной
терапии, направленной на Т2-воспаление, поэтому на данный момент включает
пациентов только с Т2-астмой. Демографические показатели пациентов нашего
регистра совпадают с регистрами других стран (международным, Великобритании,
Германии): преобладание женщин (79,3% vs 61,1%, 61,1%, 49%), средний возраст
пациентов (51,5 лет vs 51,7, 51,3, 53,2), средний возраст дебюта астмы (28,0
лет vs 27,9, 25,4, 32,4), ИМТ (27,8 кг/м2 vs 29,3, 30,9, 27,8) [12, 13,
14].
Мы разделили пациентов на 3
группы по предполагаемому механизму развития эозинофилии: фенотип аллергической
астмы связан с Th2-ответом, неаллергическая эозинофильная астма опосредована
ILC2 и смешанная астма, сочетающая Th2 и ILC2 пути. В нашем регистре
преобладает неаллергическая эозинофильная астма (46,5%). По данным экспертов Global Initiative for Asthma (GINA)[1] эозинофильный
фенотип составляет около 50% всех пациентов с ТБА. Но по мере снижения порогового
уровня эозинофилов с 300 до 150 кл/мкл для определения эозинофильного варианта
астмы доля этого фенотипа увеличилась до 80% и более по данным международного
регистра ТБА (ISAR) [15], включая в себя эозинофилию, обусловленную как ILC2,
так и Th2.
Возраст
дебюта астмы является важным признаком, определяющим фенотип. Но до сих точно
не определен возраст раннего и позднего дебюта. В ISAR точкой раздела принят
возраст 18 лет [15]. Baan E.J. и соавт. предлагают
разделять астму с началом в детском возраста (до 18 лет), во взрослом возрасте
(18-40 лет) и с поздним началом (после 40 лет) [16].
В работе группы авторов рассмотрены точки сut-off возраста дебюта астмы от 12 до 65 лет [17]. По нашим данным
точка раздела раннего и позднего дебюта – 20 лет. Закономерен ранний дебют
аллергической астмы и поздний дебют неаллергической эозинофильной астмы.
Смешанная астма в среднем начиналась в возрасте 29,5 лет (Q1-Q3: 14,50 – 42,75) и это может говорить о том, что механизм
смешанной астмы – не просто сочетание атопии с эозинофилией (если бы это было так, тогда она
начиналась бы в детском возрасте). На данный момент времени мы не можем определенно
ответить на вопрос о патогенезе смешанной астмы.
Выявление
отягощенной наследственности по аллергии, по представленным ранее вопросам (в
большей степени по атопии, т.к. именно атопия носит генетическую
предрасположенность), входит в сбор аллергоанамнеза и помогает в интерпретации
природы заболевания. Мы старались дифференцировать аллергическую (атопическую) J45.0 астму от неаллергической
эозинофильной. Вопрос о наличии аллергических заболеваний в анамнезе не дает полного
представления о наследуемом факторе, т.к. не всегда аллергический процесс носит
характер атопии. К тому же, пациенты не могут отличить истинные аллергические
реакции от псевдоаллергии, а возникающие реакции на неспецифические
раздражители (холодный воздух, пыль, резкие запахи и т.п.) часто называют
аллергическими. Второй вопрос о наличии бронхиальной астмы в семье также не
помог в дифференциальной диагностике фенотипов – примерно около половины
пациентов каждого фенотипа имели родственников, страдающих астмой. Третий
вопрос о наличии атопии (АР и АтД) в семье выявил значимое преобладание
наследственного фактора атопии в группе аллергической астмы. И последний вопрос
также помогает отнести астму к аллергической за счет сопутствующих атопических
заболеваний (в отличие от второго вопроса, потому что неаллергическая астма
также имеет генетические факторы риска). Кроме того, 4-й вопрос уточняет
наличие именно атопической астмы, т.к. ответив положительно на первый вопрос,
пациент может иметь родственников с неаллергической астмой с одной стороны и
атопию с другой.
По сопутствующей назальной
патологии данные разных исследователей расходятся. Так, например, встречаемость
назальных полипов у пациентов с ТБА в Великобритании составила 14,2% [13], в
Германии – 23,3% [14], 74,5% - в международном регистре ISAR [15].
Аллергический ринит сопутствует ТБА в 31,5-65,5% случаев [12, 14, 15, 18]. Но
во всех работах отмечается ассоциация АР с атопическим фенотипом ТБА [19, 20],
назальных полипов – с эозинофильным фенотипом ТБА [6, 12, 21]. По нашим
результатам также оказалась высокая встречаемость АР у пациентов с
аллергическим компонентом (группы аллергической и смешанной астмы), ХРСсПН – у
пациентов с неаллергической эозинофилией (группы 2 и 3). Более высокий балл в
опроснике SNOT22 в
группе смешанной астмы связан с сочетанием АР+ХРСсПН в этой группе пациентов.
Аллергообследование
проводили стандартными методами (кожное тестирование с аллергенами и/или
определение sIgE к аллергенам в крови). Тем пациентам, которым по тем или
иным причинам не провели аллергообследование, наличие или исключение
аллергического компонента устанавливали с помощью аллерготеста ФадиатопТМ. Обоснование
применения этого метода приведено нами в ранее опубликованной работе [11] и
запатентовано[2]. Данные, полученные в
настоящем исследовании, подтверждают соответствие результатов аллерготеста ФадиатопТМ результатам стандартного
аллергообследования (кожные пробы и/или sIgE).
В группе
пациентов с аллергической астмой закономерно 100% пациентов имели доказанную
аллергию. Но мы также получили 9 пациентов с доказанной аллергией в группе с
неаллергической эозинофильной астмой. По данным исследовательской работы по
тяжелой астме (SARP) атопия
подтверждена в 80% случаев БА с ранним началом, но и в кластере неатопической
астмы с поздним началом 64% пациентов имели как минимум один положительный
кожный тест [1]. Mansur A.H. и соавт. при анализе английского регистра тяжелой астмы
(UKSAR) указывают, что 100% пациентов как в группе, получающей анти-IgE препарат,
так и в группе, получающей анти-IL5 препараты, имели положительные результаты
кожного тестирования с аллергенами [13]. Поэтому мы подчеркиваем необходимость
сопоставления результатов аллергодиагностики с клинической картиной и
разграничения при фенотипировании латентной и клинически значимой
сенсибилизации.
Дополнительными
базисными препаратами пациенты регистра Свердловской области получали АЛП
(56,9%) и ДДХ (35,9%). Теофиллины и макролиды не были назначены на длительный
прием ни одному пациенту. В регистрах Великобритании и Кореи активно
используются все дополнительные базисные препараты: ДДХ (53,5%, 38,4%), АЛП
(48,9%, 81,3%), теофиллины (27,2%, 44,1%), макролиды (9,3%, 2,7%) [22, 23].
Разница в назначениях может быть объяснена включением в регистры пациентов с
Т2-низкой астмой, особенностями фармакообеспечения в этих странах.
Постоянный прием
СГКС зарегистрирован у 11,11% (n=22) пациентов регистра. В разных странах ГКС-зависимость
колеблется от 14 до 65% [22, 23, 24, 25, 26, 27, 28]. Для пациентов,
принимающих СГКС на постоянной основе, характерно позднее начало астмы, более
выраженное снижение функции дыхания, в том числе с фиксированной обструкцией,
частые обострения, повышенная тревожность [23]. В нашем регистре значимо чаще
принимали СГКС и имели ГКС-зависимость пациенты с неаллергической эозинофильной
астмой, чем пациенты с аллергической, соответственно, также с более поздним
дебютом астмы.
Фенотипирование
ТБА является актуальной проблемой. На данный момент времени проведено
достаточное количество кластерных анализов для описания фенотипов с
использованием клинических, лабораторных, генетических маркеров [1, 2, 3, 4, 5,
6]. Kaur R. и
соавт. в обзорной работе отмечают, что наиболее важными признаками в кластерных
анализах выступают возраст дебюта, функция внешнего дыхания, атопия, уровень
эозинофилов в периферической крови; пол и статус курения являются менее
значимыми [29]. В нашей поэтапной схеме фенотипирования мы предлагаем начинать
с оценки аллергического статуса пациента в сочетании с возрастом дебюта,
уровнем эозинофилов крови, наличия сопутствующей назальной патологии и
гиперчувствительности к НПВП. В большинстве случаев это идентифицирует пациентов
с аллергическим и неаллергическим эозинофильным фенотипами. При наличии у
пациента признаков аллергического и неаллергического компонентов определяется
смешанный фенотип. Анализ эффективности таргетных препаратов, назначенных
согласно определенным таким образом фенотипов, показал достаточно низкий
процент отмены (17,2%) и смены (12,1%) биологических препаратов, причем
неэффективность терапии была причиной отмены только в 10% случаев (5% по ТБА,
5% по назальной патологии) [30].
Ограничения
исследования связаны с ретроспективной оценкой, использованием эвристического
подхода в анализе данных. Аналитические методы (бинарная логистическая регрессия,
кластерный анализ, дерево решений) оказались непригодны для подтверждения выделенных
нами фенотипов из-за сложного механизма смешанного фенотипа астмы.
Заключение
Таким
образом, исследование клинико-аллергологических особенностей Т2- бронхиальной
астмы у наших больных ТБА, получающих иммунобиологическую терапию, позволило
определить информативные клинико-лабораторные признаки, характерные для
аллергического, неаллергического (эозинофильного) и смешанного фенотипов ТБА. Фенотипирование ТБА, которое можно
провести в реальной клинической практике, способно облегчить выбор ГИБП для инициации
таргетной терапии и минимизировать число ошибок. Пациенты регистра имеют 3 фенотипа Т2-бронхиальной астмы. Для
аллергического фенотипа характерно наличие доказанной аллергии, сопутствующего
аллергического ринита, раннего дебюта (до 20 лет). Маркерами неаллергической
эозинофильной астмы являются эозинофилия ≥ 150 кл/мкл, отсутствие
аллергии, сопутствующие ХРСсПН и непереносимость НПВП, поздний дебют (после 30
лет). Для смешанной астмы определена комбинация признаков: наличие доказанной
аллергии или латентной сенсибилизации в сочетании с высоким уровнем
аллерготеста ФадиатопТМ,
поздний дебют, эозинофилия ≥ 300 кл/мкл, ХРСсПН, непереносимость НПВП.
Предложенный алгоритм фенотипирования для реальной клинической практики
способен облегчить выбор ГИБП для инициации таргетной терапии.
[1] Письмо Министерства здравоохранения Свердловской области №03-01-82/6992 от 18.06.2019 г. «О порядке направления пациентов с тяжелой неконтролируемой бронхиальной астмой на лечение генно-инженерными биологическими препаратами».
[2] Global Initiative for Asthma. Global strategy for asthma management and
prevention. 2020. Available at: https://ginasthma.org/wp-content/uploads/2020/04/GINA-2020-full-report_-final-_wms.pdf
[3] Патент на изобретение
«Способ диагностики аллергической тяжелой бронхиальной астмы» №2786010 от
15.12.2022 г. (заявка №2022100314 от 11.01.2022 г.)
Список литературы / References
Развернуть
- Moore WC, Meyers DA, Wenzel SE, Teague WG, Li H, Li X et al. Identification of asthma phenotypes using cluster analysis in the Severe Asthma Research Program. Am J Respir Crit Care Med. 2010;181(4):315-323. https://doi.org/10.1164/rccm.200906-0896oc.
- Haldar P, Pavord ID, Shaw DE, Berry MA, Thomas M, Brightling CE et al. Cluster analysis and clinical asthma phenotypes. Am J Respir Crit Care Med. 2008;178(3):218-224. https://doi.org/10.1164/rccm.200711-1754OC.
- Lefaudeux D, De Meulder B, Loza MJ, Peffer N, Rowe A, Baribaud F et al. U-BIOPRED clinical adult asthma clusters linked to a subset of sputum omics. J Allergy Clin Immunol. 2017;139(6):1797-1807. https://doi.org/10.1016/j.jaci.2016.08.048.
- Simpson JL, Scott R, Boyle MJ, Gibson PG. Inflammatory subtypes in asthma: assessment and identification using induced sputum. Respirology. 2006;11(1):54-61. https://doi.org/10.1111/j.1440-1843.2006.00784.x.
- Yan X, Chu JH, Gomez J, Koenigs M, Holm C, He X et al. Noninvasive analysis of the sputum transcriptome discriminates clinical phenotypes of asthma. Am J Respir Crit Care Med. 2015;191(10):1116-1125. https://doi.org/10.1164/rccm.201408-1440OC.
- Denton E, Price DB, Tran TN, Canonica GW, Menzies-Gow A, FitzGerald JM et al. Cluster Analysis of Inflammatory Biomarker Expression in the International Severe Asthma Registry. J Allergy Clin Immunol Pract. 2021;9(7):2680-2688.e7. https://doi.org/10.1016/j.jaip.2021.02.059.
- Rupani H, Murphy A, Bluer K, Renwick C, McQuitty P, Jackson DJ et al. Biologics in severe asthma: Which one, When and Where? Clin Exp Allergy. 2021;51(9):1225-1228. https://doi.org/10.1111/cea.13989.
- Nagase H, Suzukawa M, Oishi K, Matsunaga K. Biologics for severe asthma: The real-world evidence, effectiveness of switching, and prediction factors for the efficacy. Allergol Int. 2023;72(1):11-23. https://doi.org/10.1016/j.alit.2022.11.008.
- Ito A, Miyoshi S, Toyota H, Suzuki Y, Uehara Y, Hattori S et al. The overlapping eligibility for biologics in patients with severe asthma and phenotypes. Arerugi. 2022;71(3):210-220. (In Japan.) https://doi.org/10.15036/arerugi.71.210.
- Albers FC, Müllerová H, Gunsoy NB, Shin JY, Nelsen LM, Bradford ES et al. Biologic treatment eligibility for real-world patients with severe asthma: The IDEAL study. J Asthma. 2018;55(2):152-160. https://doi.org/10.1080/02770903.2017.1322611.
- Астафьева НГ, Баранов АА, Вишнева ЕА, Дайхес НА, Жестков АВ, Ильина НИ и др. Аллергический ринит: клинические рекомендации. М.; 2020. 70 с. Режим доступа: https://cr.minzdrav.gov.ru/recomend/261_1.
- Fokkens WJ, Lund VJ, Hopkins C, Hellings PW, Kern R, Reitsma S et al. European Position Paper on Rhinosinusitis and Nasal Polyps 2020. Rhinology. 2020;58(Suppl. 29):1-464. https://doi.org/10.4193/Rhin20.600.
- Naumova V, Beltyukov E, Niespodziana K, Errhalt P, Valenta R, Karaulov A, Kiseleva D. Cumulative IgE-levels specific for respiratory allergens as biomarker to predict efficacy of anti-IgE-based treatment of severe asthma. Front Immunol. 2022;13:941492. https://doi.org/10.3389/fimmu.2022.941492.
- Chen W, Sadatsafavi M, Tran TN, Murray RB, Wong CBN, Ali N et al. Characterization of Patients in the International Severe Asthma Registry with High Steroid Exposure Who Did or Did Not Initiate Biologic Therapy. J Asthma Allergy. 2022;15:1491-1510. https://doi.org/10.2147/JAA.S377174.
- Mansur AH, Gonem S, Brown T, Burhan H, Chaudhuri R, Dodd JW et al. Biologic therapy practices in severe asthma; outcomes from the UK Severe Asthma Registry and survey of specialist opinion. Clin Exp Allergy. 2023;53(2):173-185. https://doi.org/10.1111/cea.14222.
- Korn S, Milger K, Skowasch D, Timmermann H, Taube C, Idzko M et al. The German severe asthma patient: Baseline characteristics of patients in the German Severe Asthma Registry, and relationship with exacerbations and control. Respir Med. 2022;195:106793. https://doi.org/10.1016/j.rmed.2022.106793.
- Heaney LG, Perez de Llano L, Al-Ahmad M, Backer V, Busby J, Canonica GW et al. Eosinophilic and Noneosinophilic Asthma: An Expert Consensus Framework to Characterize Phenotypes in a Global Real-Life Severe Asthma Cohort. Chest. 2021;160(3):814-830. https://doi.org/10.1016/j.chest.2021.04.013.
- Baan EJ, de Roos EW, Engelkes M, de Ridder M, Pedersen L, Berencsi K et al. Characterization of Asthma by Age of Onset: A Multi-Database Cohort Study. J Allergy Clin Immunol Pract. 2022;10(7):1825-1834.e8. https://doi.org/10.1016/j.jaip.2022.03.019.
- Quirce S, Heffler E, Nenasheva N, Demoly P, Menzies-Gow A, Moreira-Jorge A et al. Revisiting Late-Onset Asthma: Clinical Characteristics and Association with Allergy. J Asthma Allergy. 2020;13:743-752. https://doi.org/10.2147/JAA.S282205.
- Principe S, Richards LB, Hashimoto S, Kroes JA, Van Bragt JJMH, Vijverberg SJ et al. Characteristics of severe asthma patients on biologics: a real-life European registry study. ERJ Open Res. 2023;9(3):00586-2022. https://doi.org/10.1183/23120541.00586-2022.
- Lötvall J, Akdis CA, Bacharier LB, Bjermer L, Casale TB, Custovic A et al. Asthma endotypes: a new approach to classification of disease entities within the asthma syndrome. J Allergy Clin Immunol. 2011;127(2):355-360. https://doi.org/10.1016/j.jaci.2010.11.037
- Agache I, Akdis C, Jutel M, Virchow JC. Untangling asthma phenotypes and endotypes. Allergy. 2012;67(7):835-846. https://doi.org/10.1111/j.1398-9995.2012.02832.x.
- Miljkovic D, Bassiouni A, Cooksley C, Ou J, Hauben E, Wormald PJ, Vreugde S. Association between group 2 innate lymphoid cells enrichment, nasal polyps and allergy in chronic rhinosinusitis. Allergy. 2014;69(9):1154-1161. https://doi.org/10.1111/all.12440.
- Наумова ВВ, Бельтюков ЕК, Киселева ДВ, Абдуллаев ВХ. Способ диагностики аллергической тяжелой бронхиальной астмы. Патент RU 2786010 C1, 24.12.2022. Режим доступа: https://new.fips.ru/registers-docview/fips_servlet?DB=RUPAT&DocNumber=2786010&TypeFile=html.
- Jackson DJ, Busby J, Pfeffer PE, Menzies-Gow A, Brown T, Gore R et al. Characterisation of patients with severe asthma in the UK Severe Asthma Registry in the biologic era. Thorax. 2021;76(3):220-227. https://doi.org/10.1136/thoraxjnl-2020-215168.
- Lee JH, Kim HJ, Park CS, Park SY, Park SY, Lee H et al. Clinical Characteristics and Disease Burden of Severe Asthma According to Oral Corticosteroid Dependence: Real-World Assessment From the Korean Severe Asthma Registry (KoSAR). Allergy Asthma Immunol Res. 2022;14(4):412-423. https://doi.org/10.4168/aair.2022.14.4.412.
- Tran TN, King E, Sarkar R, Nan C, Rubino A, O’Leary C et al. Oral corticosteroid prescription patterns for asthma in France, Germany, Italy and the UK. Eur Respir J. 2020;55(6):1902363. https://doi.org/10.1183/13993003.02363-2019.
- Tran TN, MacLachlan S, Hicks W, Liu J, Chung Y, Zangrilli J et al. Oral Corticosteroid Treatment Patterns of Patients in the United States with Persistent Asthma. J Allergy Clin Immunol Pract. 2021;9(1):338-346.e3. https://doi.org/10.1016/j.jaip.2020.06.019.
- Taube C, Bramlage P, Hofer A, Anderson D. Prevalence of oral corticosteroid use in the German severe asthma population. ERJ Open Res. 2019;5(4):00092-2019. https://doi.org/10.1183/23120541.00092-2019.
- Graff S, Vanwynsberghe S, Brusselle G, Hanon S, Sohy C, Dupont LJ et al. Chronic oral corticosteroids use and persistent eosinophilia in severe asthmatics from the Belgian severe asthma registry. Respir Res. 2020;21(1):214. https://doi.org/10.1186/s12931-020-01460-7.
- Wang E, Wechsler ME, Tran TN, Heaney LG, Jones RC, Menzies-Gow AN et al. Characterization of Severe Asthma Worldwide: Data From the International Severe Asthma Registry. Chest. 2020;157(4):790-804. https://doi.org/10.1016/j.chest.2019.10.053.
- Kaur R, Chupp G. Phenotypes and endotypes of adult asthma: Moving toward precision medicine. J Allergy Clin Immunol. 2019;144(1):1-12. https://doi.org/10.1016/j.jaci.2019.05.031.
- Наумова ВВ, Бельтюков ЕК, Киселева ДВ, Быкова ГА, Смоленская ОГ, Штанова АА, Степина ДА. Таргетная терапия тяжёлой бронхиальной астмы: смена биологического препарата в реальной клинической практике - причины и следствие. Российский аллергологический журнал. 2024;20(4):439-454. https://doi.org/10.36691/RJA15993.



 1
1 2
2 3
3 4
4


Комментарии (0)