
Фото: Fantastic Studio/FOTODOM/Shutterstoсk
Журнал "Медицинский совет" №13/2025
DOI: 10.21518/ms2025-323
Д.В. Черкашин1, https://orcid.org/0000-0003-1363-6860
В.В. Салухов1, https://orcid.org/0000-0003-1851-0941
Ю.Ш. Халимов2, https://orcid.org/0000-0002-7755-7275
1 Военно-медицинская академия имени С.М. Кирова; 194044, Россия, Санкт-Петербург, ул. Академика Лебедева, д. 6
2 Первый Санкт-Петербургский государственный медицинский университет имени академика И.П. Павлова; 197022, Россия, Санкт-Петербург, ул. Льва Толстого, д. 6–8
Ожирение
и сахарный диабет приводят к метаболическим изменениям, которые вызывают
морфологические и функциональные трансформации в сердечно-сосудистой системе.
Патогенез поражения сердечно-сосудистой системы при ожирении многосторонен.
Сердечно-сосудистые осложнения, связанные с ожирением, вызываются процессами с
участием гормонов и пептидов, когда включаются воспаление, инсулинорезистентность,
эндотелиальная дисфункция, коронарный кальциноз, активация коагуляции,
ренин-ангиотензин-альдостероновой и симпатической нервной систем, приводя к
развитию сердечной недостаточности как с сохраненной, так и со сниженной
фракцией выброса. Инициация эффективных, безопасных и доступных терапевтических
интервенций может иметь решающее значение для управления кардиометаболическим
здоровьем. Настоящий обзор имеет цель обобщить результаты проведенных
исследований, подтверждающих эффективность и безопасность препаратов с инкретиновой активностью: одного из самых назначаемых
препаратов из класса агонистов рецепторов глюкагоноподобного пептида 1 семаглутида
и первого двойного агониста рецепторов глюкозозависимого
инсулинотропного полипептида/глюкагоноподобного
пептида 1 тирзепатида. Подробно рассмотрены
патогенетические механизмы поражения сердечно-сосудистой системы при ожирении
на основании последних фундаментальных исследований и механизмы, реализуемые в
сердце и сосудах, глюкагоноподобным пептидом 1 и глюкозозависимым
инсулинотропным полипептидом. Акцент делается на возможностях
инкретиномиметиков, помимо гипогликемического действия, снижать воспаление
сосудистой стенки, массу жировой ткани и способствовать улучшению липидного
профиля, что проявляет их метаболизм-модифицирующие качества. При этом
инкретины могут быть отнесены к препаратам болезнь-модифицирующей терапии,
поскольку воздействуют на сердечно-сосудистую систему, улучшая функциональное
состояние эндотелия, снижая артериальное давление, замедляя агрегацию
тромбоцитов, ингибируя апоптоз кардиомиоцитов, улучшая утилизацию глюкозы и
оказывая вазодилатирующее действие. Это объясняет наблюдаемое в клинических
исследованиях снижение риска сердечно-сосудистых осложнений, а в
экспериментальных исследованиях – уменьшение зоны некроза при моделировании
инфаркта миокарда и применении инкретиномиметиков.
Для цитирования: Черкашин ДВ, Салухов ВВ, Халимов ЮШ. Сердечно-сосудистые эффекты агонистов рецепторов глюкагоноподобного пептида 1 и глюкозозависимого инсулинотропного полипептида и их потенциал в кардиопротекции. Медицинский совет. 2025;19(13): https://doi.org/10.21518/ms2025-323.
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Cardiovascular effects of semaglutide and tirzepatide and their potential for cardioprevention
Dmitriy V. Cherkashin1, https://orcid.org/0000-0003-1363-6860
Vladimir V. Salukhov1, https://orcid.org/0000-0003-1851-0941
Iurii Sh. Khalimov2, https://orcid.org/0000-0002-7755-7275
¹ Military Medical Academy named after S.M. Kirov; 6, Akademik Lebedev St., St Petersburg, 194044, Russia
² Pavlov First Saint Petersburg State Medical University; 6–8, Lev Tolstoy St., St Petersburg, 197022, Russia
Obesity and diabetes mellitus lead to metabolic changes that cause morphological and functional transformations in the cardiovascular system. The pathogenesis of cardiovascular damage in obesity is multifaceted. Cardiovascular complications associated with obesity are caused by processes involving hormones and peptides, when inflammation, insulin resistance, endothelial dysfunction, coronary calcification, activation of coagulation, renin-angiotensin-aldosterone and sympathetic nervous systems are included, leading to the development of heart failure with both preserved ejection fraction and reduced ejection fraction. Initiation of effective, safe and affordable therapeutic interventions may be crucial for managing cardiometabolic health. This review aims to summarize the results of studies confirming the efficacy and safety of drugs with incretin activity – one of the most prescribed drugs from the class of glucagon-like peptide 1 receptor agonists – semaglutide and the first dual agonist of glucose-dependent insulinotropic polypeptide/glucagon-like peptide 1 receptors – tirzepatide. Pathogenesis mechanisms of cardiovascular damage in obesity are considered in detail based on the latest fundamental studies and the mechanisms implemented in the heart and blood vessels by glucagon-like peptide 1 and glucose-dependent insulinotropic polypeptide. Emphasis is placed on the capabilities of incretin mimetics, in addition to the hypoglycemic effect, to reduce vascular inflammation, adipose tissue mass and contribute to the improvement of the lipid profile, which demonstrates their metabolism-modifying properties. Incretins can be classified as disease-modifying therapy drugs, since they affect the cardiovascular system, improving the functional state of the endothelium, reducing blood pressure, slowing platelet aggregation, inhibiting cardiomyocyte apoptosis, improving glucose utilization, and exerting a vasodilating effect. This explains the reduction in the risk of cardiovascular complications observed in clinical studies, and in experimental studies, a decrease in the necrosis zone during modeling of myocardial infarction and the use of incretin mimetics.
For citation: : Cherkashin DV, Salukhov VV, Khalimov IuSh. Cardiovascular effects of glucagon-like peptide 1 and glucose-dependent insulinotropic polypeptide receptor agonists and their potential for cardioprevention. Meditsinskiy Sovet. 2025;19(13): (In Russ.) https://doi.org/10.21518/ms2025-323.
Conflict of interest: the authors declare no conflict of interest.
Введение
Прогнозируется,
что к 2035 г. более половины населения мира будет страдать избыточной массой
тела или ожирением [1].
По
оценкам, высокий индекс массы тела (ИМТ) стал причиной 4 млн смертей во всем
мире в 2015 г., более двух третей из которых были вызваны сердечно-сосудистыми
заболеваниями (ССЗ) [2]. В 2019 г. превышение оптимальных значений ИМТ стало
причиной 5 млн случаев смерти от неинфекционных заболеваний (НИЗ), таких как
ССЗ, диабет, рак, неврологические расстройства, хронические респираторные
заболевания и расстройства пищеварения [3].
Прогрессирование
ожирения способствует развитию многих заболеваний кардиоваскулярной системы,
СД2, желчнокаменной болезни, онкологических заболеваний, бронхиальной астмы,
болезней опорно-двигательного аппарата, синдрома обструктивного апноэ сна (СОАС)
и других гиповентиляционных синдромов, отрицательно влияющих на функцию
сердечно-сосудистой системы (ССС). Патогенез поражения ССС при ожирении
многосторонен. Сердечно-сосудистые осложнения, связанные с ожирением,
вызываются процессами с участием гормонов и пептидов, когда включаются
воспаление, инсулинорезистентность, эндотелиальная дисфункция, коронарный
кальциноз, активация коагуляции, ренин-ангиотензин-альдостероновой и
симпатической нервной систем. Имеются данные об увеличении частоты развития артериальной
гипертензии (АГ), ишемической болезни сердца (ИБС), сердечной недостаточности
(СН), гиперхолестеринемии, нарушений реологии крови, тромбоэмболических
осложнений у больных с избыточной массой тела [4].
Избыточная
масса тела и ожирение независимо связаны с повышенным риском
сердечно-сосудистых событий, даже после того, как было учтено влияние
метаболических факторов риска ССЗ, связанных с избыточной массой тела [5–8].
У
метаболически здоровых людей с ожирением риск ишемической болезни сердца (ИБС),
цереброваскулярных заболеваний и сердечной недостаточности (СН) выше, чем у
метаболически здоровых людей с нормальной массой тела. Наличие метаболических
нарушений даже у людей с нормальной массой тела может обеспечивать схожий риск
ССЗ [9].
Хотя
снижение риска ССЗ путем лечения дислипидемии [10], артериальной гипертензии
(АГ) [11] и диабета [12, 13] является стандартной практикой, основанной на
фактических данных, концепция лечения ожирения с целью снижения риска
сердечно-сосудистых осложнений в последнее время также приобрела доказательную
базу, основанную на рандомизированных клинических исследованиях (РКИ),
указывающих на то, что образ жизни или фармакологические вмешательства при
избыточной массе тела или ожирении улучшают сердечно-сосудистые исходы [14, 15].
Учитывая
неуклонный рост распространенности хронических заболеваний, основанных на
кардиометаболических процессах, существует потребность в новых эффективных
методах терапии СД2, которые бы не только обеспечивали адекватный гликемический
контроль, но и устраняли сопутствующие метаболические нарушения и позволяли
достигать более значимых целей по снижению массы тела в рамках индивидуальных
планов лечения [16]. Широкое применение инкретинов в клинической практике не
только эндокринологами обеспечивает основу раннего и эффективного
терапевтического таргетирования для улучшения кардиометаболического здоровья и
влияния на развитие и прогрессирование драматических последствий
сердечно-сосудистых заболеваний.
Инкретины
влияют на широкий спектр метаболических путей, связанных с метаболизмом
глюкозы, энергетическим гомеостазом и воспалением, что также улучшает
сердечно-сосудистые исходы у людей без диабета [17]. Особый интерес
представляют данные, объясняющие механизмы влияния инкретинов на
сердечно-сосудистую систему, которые приводят к снижению сердечно-сосудистого
риска, связанного с избыточной массой тела и ожирением, что, безусловно,
обеспечивает неуклонный интерес к этим препаратам со стороны кардиологов,
терапевтов, гастроэнтерологов, хирургов, гинекологов.
Механизмы
поражения сердца и сосудов при ожирении
Сердечно-сосудистые
заболевания (ССЗ) включают в себя широкий спектр нозологий, при которых
происходит поражение сердца и сосудов. Особого внимания заслуживают
метаболические изменения, которые можно сгруппировать в отдельные стадии
хронического заболевания, поддающиеся профилактическому лечению, с целью
улучшения клинических результатов ИБС, СН и фибрилляции предсердий (ФП). Общее
число смертей, связанных с ССЗ, в последние годы увеличилось не только из-за
роста населения, старения, но и в связи с траекторий развития ожирения и СД2 [18,
19].
С
2011 г. в мире наблюдается рост смертности от сердечно-сосудистых заболеваний
(за исключением ИБС) [20]. При этом, однако, тенденции к улучшению выживаемости
наблюдаются тогда, когда осуществляются масштабные усилия по модификации
факторов риска в рамках интегрированной системы здравоохранения [21].
Имеются
доказательства, подтверждающие причинно-следственную связь между ожирением и
риском развития ССЗ [22, 23].
Так,
данные, полученные в ходе исследований Framingham и Nurses’ Health Study,
подтверждают взаимосвязь между увеличением индекса массы тела (ИМТ) и
смертностью, которая начиналась с ИМТ > 25 кг/м2 в качестве
маркера избыточной массы или ожирения. При этом в одном из исследований
выявлено, что что связь между ИМТ и смертностью от ССЗ не зависит от других
метаболических маркеров, таких как артериальное давление (АД), повышение уровня
глюкозы, холестерина [24].
У
многих пациентов лечение ССЗ начинается после манифестации таких событий, как
стенокардия, острый коронарный синдром (ОКС), инсульт, СН или симптоматическое
заболевание периферических сосудов. Исключениями являются отказ от курения и
снижение уровня холестерина липопротеинов низкой плотности (ЛПНП) в рамках
профилактических мероприятий для снижения риска. Однако уменьшение уровня ЛПНП
с помощью терапии статинами в исследованиях сердечно-сосудистых исходов привело
к среднему снижению риска лишь на 30%, оставляя преобладающую степень неконтролируемого
остаточного риска в плане ожирения [25]. Это укладывается в концепцию остаточного
риска сердечно-сосудистых заболеваний, согласно которой у пациентов с
установленным ССЗ и у пациентов с установленными факторами риска ССЗ, несмотря
на применение современных методов лечения, сохраняется остаточный риск
возникновения сосудистых осложнений или прогрессирования установленного
сосудистого повреждения в случае отсутствия лечебных и профилактических
мероприятий, направленных на борьбу с избыточной массой тела и ожирением [26]. То
есть избыточная масса тела или ожирение повышают риск сердечно-сосудистых
осложнений даже при отсутствии других метаболических нарушений (сахарный
диабет, АГ и гиперлипидемия) [9].
В
этой связи важным моментом является то, что ССЗ представляют собой хронический
патологический процесс, начинающийся в раннем возрасте, с возможностями
первичной и вторичной профилактики, которая может смягчить возникновение
событий на поздних стадиях сердечно-сосудистого континуума. При этом процесс
хронического заболевания неразрывно включает СД2 и ожирение, которые являются
проявлениями и движущими силами этого процесса. В таком случае CCЗ можно представить как
кардиометаболическое хроническое заболевание (КМХЗ), при этом центральным
нарушением, способствующим прогрессированию, является инсулинорезистентность.
Становится понятно, почему остаточный риск после терапии статинами может быть в
значительной степени обусловлен инсулинорезистентностью [27].
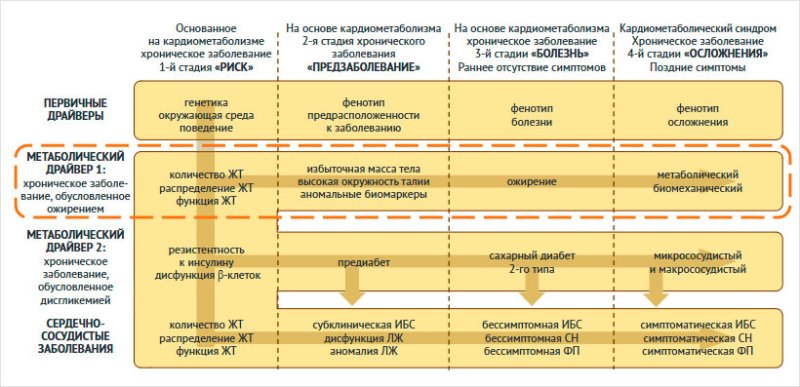
Инсулинорезистентность
находится на стыке ожирения и дисгликемии (рис. 1), которые являются
метаболическими драйверами, обусловленными первичными факторами генетики,
окружающей среды и образа жизни и приводят к прогрессированию КМХЗ. Значимым
для инициации профилактических и лечебных мероприятий является выделение
первичного метаболического драйвера: для ожирения – хроническое заболевание,
основанное на ожирении (Adiposity-Based Chronic Disease, ABCD) [27], а
дисгликемия прогрессирует в соответствии с моделью, определяемой хроническим
заболеванием, основанным на дисгликемии (Dysglycemia-Based Chronic Disease, DBCD) [28]. ABCD и DBCD пересекаются на
уровне инсулинорезистентности, что объясняет прогрессирование КМХЗ. В
совокупности этот подход объясняет значимость патофизиологических взаимосвязей
между инсулинорезистентностью, метаболическим синдромом, ожирением, СД2 и ССЗ.
Рисунок 1. Хронические заболевания,
обусловленные кардиометаболическими нарушениями: факторы, способствующие
ожирению и дисгликемии (адаптировано по [27])
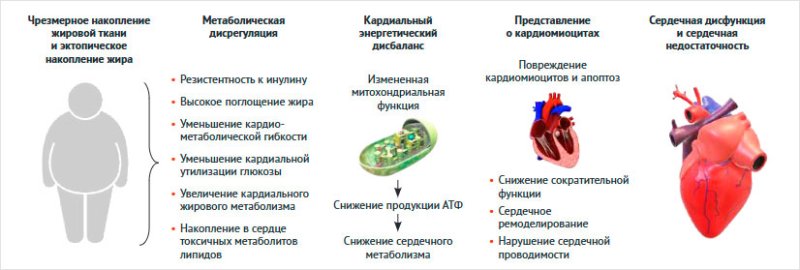
Эти патофизиологические связи усиливают липогенез
и способствуют накоплению липидов не только в периферических тканях, но и в
миокарде. Избыточное накопление жиров в сердце ведет к липотоксичности,
митохондриальной дисфункции и нарушению энергетического обмена в
кардиомиоцитах, что ухудшает сократительную функцию миокарда и способствует
развитию СН (рис. 2) [29].
Рисунок 2. Ожирение и его последствия для
сердечного метаболизма и функций (адаптировано по [29])
Жировая ткань, особенно висцеральный жир,
является активным эндокринным органом, который продуцирует различные провоспалительные
цитокины, такие как интерлейкин-6 (IL-6), фактор некроза опухоли альфа (TNF-α)
и лептин. Эти цитокины способствуют развитию системного воспаления, что
повреждает эндотелий сосудов и вызывает ремоделирование миокарда. Хроническое
воспаление также связано с развитием фиброза миокарда, что ухудшает
диастолическую функцию сердца и способствует развитию СН [30].
Ожирение вызывает повышенный уровень оксидативного стресса, что приводит к
повреждению эндотелиальных клеток и снижению биодоступности оксида азота (NO).
Это ухудшает сосудистую функцию и способствует развитию АГ и гипертрофии левого
желудочка (ЛЖ). При ожирении возникает периваскулярная дисфункция жировой ткани
и сосудистая дисфункция. Периваскулярная жировая ткань (PVAT) секретирует
широкий спектр биологически активных молекул, включая адипокины, которые
модулируют сосудистый тонус, миграцию и пролиферацию гладкомышечных клеток,
неоинтимальную гиперплазию, воспалительные реакции и окислительный стресс.
Ожирение связано со структурными и функциональными изменениями PVAT, что
приводит к дисбалансу в пользу вазоконстрикторов и провоспалительных веществ,
гипертрофии адипоцитов, а также к изменениям сигнальных путей инсулина.
Возникающее нарушение эндотелиальной функции также повышает риск тромбозов и
атеросклероза, которые могут способствовать прогрессированию СН [31].
Результаты
различных исследований [32, 33] свидетельствуют о том, что ожирение (ИМТ ≥ 30
кг/м2) и метаболический синдром значительно связаны с риском
развития СН, причем более сильная ассоциация была с СНсФВ, чем СНнФВ.
При
ожирении повышенный уровень лептина, секретируемого жировой тканью (в частности,
эпикардиальным жиром), активирует минералокортикоидные рецепторы сердца, что
дополнительно способствует синтезу Gal-3. Все эти молекулы способствуют тому,
что орган-мишень повреждается из-за нарушения экстрацеллюлярного матрикса и
коллагена [34].
У лиц с
выраженным и продолжительным (более 15 лет) ожирением развиваются
гемодинамические сдвиги, приводящие к морфологическим и функциональным
изменениям левого желудочка (ЛЖ). Выявлено, что у больных ожирением, даже при
отсутствии у них СД, артериальной гипертензии АГ и каких-либо других
заболеваний сердца, сердечный выброс (СВ) и ударный объем (УО) значительно
увеличены и коррелируют с массой тела больных [35]. Нарастание СВ при ожирении
физиологически связано с удовлетворением метаболических потребностей возросшей
тканевой массы тела. При сохранении прежней частоты сердечных сокращений (ЧСС)
повышение СВ происходит за счет увеличения УО сердца. По мере накопления
жировой ткани ЧСС в покое растет, что связывают с сопутствующим увеличением
активности симпатической нервной системы (СНС) и снижением активности
парасимпатической нервной системы (ПНС). Увеличение ЧСС способствует
дальнейшему нарастанию СВ. Повышение УО и СВ происходит в результате
постепенного увеличения объема циркулирующей крови (ОЦК). Увеличение ОЦК при
ожирении носит адаптивный характер в ответ на расширение объема сосудистого
русла при увеличении массы тела. При этом происходит снижение периферического
сопротивления [36].
Таким
образом, один из механизмов, ведущих к развитию СН при ожирении, связан с
истощением компенсаторных механизмов миокарда, обусловленным увеличением ОЦК.
Избыток жировой ткани с ее дополнительной сосудистой сетью усугубляет
гемодинамическую нагрузку на ЛЖ. Структурные изменения ЛЖ ассоциированы с
продолжительностью и степенью ожирения. Было показано, что у больных с
ожирением III степени, особенно при физических нагрузках, происходит увеличение
ОЦК на 20%, конечно-диастолического давления ЛЖ на 50%. При проведении патолого-анатомических
исследований у всех умерших с ожирением III степени была увеличена масса
сердца, толщина стенок ЛЖ. А в ходе проведения эхокардиографических
исследований у больных с ожирением III степени с нормальным уровнем АД было
выявлено увеличение ЛЖ у 40% пациентов, увеличение толщины стенки ЛЖ у 56%,
увеличение массы ЛЖ у 64%, увеличение левого предсердия (ЛП) у 50% и увеличение
правого желудочка (ПЖ) у 33% обследованных пациентов [37].
При
ожирении ОЦК растет значительно больше, чем объем кровообращения в нежирной
массе тела, пропорционально которому увеличиваются размеры сердца. Это вызывает
более быстрое истощение физиологического резерва пропорционально увеличению ЛЖ.
Повышение ОЦК при ожирении сопровождается нарастанием ригидности миокарда ЛЖ,
ростом давления наполнения ЛЖ и нарастанием УО. С нарастанием ожирения могут
изменяться другие показатели внутрисердечной гемодинамики: нарастают
конечно-диастолическое давления в ПЖ, среднее давление в легочной артерии,
давление заклинивания в легочных капиллярах и конечно-диастолическое давление в
ЛЖ. Эти изменения вызывают расширение полостей сердца ЛП, правого предсердия
(ПП) и ПЖ [37]. Расширение полости ЛЖ приводит к увеличению напряжения его
стенок. Первоначально развивается концентрическое ремоделирование ЛЖ с
последующим развитием концентрической гипертрофии и в конечном счете
эксцентрической гипертрофии [38]. Если утолщение стенки неадекватно мало по
сравнению с нарастанием дилатации полости ЛЖ, то напряжение стенки ЛЖ
длительное время остается повышенным. Это ведет к развитию систолической дисфункции
и появлению признаков СН [39].
Таким образом, существует
бесспорная связь между ожирением и поражением
сердечно-сосудистой системы, что определяет таких пациентов как тех,
кто находится в группе высокого риска по траектории СН. Ожирение
основано на сложном патогенетическом процессе, при котором включаются
клеточные, молекулярные, гемодинамические и другие механизмы, что провоцирует
метаболические и структурные изменения в сердечно-сосудистой системе,
хроническое воспаление, ремоделирование миокарда и дисфункцию левого желудочка.
Механизмы
действия глюкагоноподобного пептида 1 (ГПП-1) и глюкозозависимого
инсулинотропного пептида (ГИП) на сердечно-сосудистую систему
В последние годы
интенсивно развивается метаболическая медицина – направление, связанное с
профилактикой, диагностикой и лечением заболеваний, основанное на биохимических
представлениях, а также генетической и молекулярной биологии, метаболических
процессах в норме и при патологии. Метаболические заболевания — болезни или
синдромы, при которых ведущим проявлением является нарушение обмена веществ, в т.
ч. и преобразование энергетических субстратов в энергию в клетке, а также
влияющие на течение внутриклеточных биохимических процессов энергообмена. К
числу т. н. метаболических болезней относят СД и ожирение [40].
Метаболические
заболевания связаны со значительно повышенным риском развития атеросклероза,
почечной недостаточности и смерти от инфаркта миокарда или инсульта.
Недавние
исследования сердечно-сосудистых исходов неожиданно подтвердили благоприятные
эффекты инкретинов – агонистов рецепторов глюкагоноподобного пептида 1 (аГПП-1)
и агониста глюкозозависимого инсулинотропного пептида (ГИП) у пациентов с СД2 с
высоким сердечно-сосудистым риском, принимающих стандартную терапию, которая не
зависела от контроля гликемии. Эти результаты побудили к проведению множества
исследований, направленных на выяснение основных механизмов и значимости этих
эффектов. В совокупности имеющиеся данные убедительно подтверждают потенциал
использования препаратов арГПП-1 и ГИП для улучшения сердечно-сосудистых
исходов у пациентов с ожирением без диабета.
Инкретины,
обладая глюкозозависимым механизмом действия, способны устранять
постпрандиальную гипергликемию. И ранее считалось, что позитивное действие
инкретиномиметиков в отношении профилактики микро- и макрососудистых осложнений
может быть связано именно с более строгим контролем гликемии, в т. ч. и с
устранением постпрандиального скачка концентрации глюкозы в крови и
предупреждением ее глюкозотоксичности. Однако накопленные за последнее
десятилетие экспериментальные и клинические данные свидетельствуют о целом ряде
плейотропных эффектов, присущих инкретиномиметикам, которые расширяют их
терапевтический потенциал. Основой для этого является широкое распространение рецепторов
ГПП-1 и ГИП во многих органах и тканях.
Активация
сигнального пути рецептора ГПП-1 вызывает широкий спектр уникальных реакций со
стороны ССС. Рецептор ГПП-1 экспрессируется повсеместно и находится не только в
клетках поджелудочной железы, но и в легких, почках, кишечнике, жировой ткани,
макрофагах и моноцитах, а также в нейронах и глиальных клетках периферической и
центральной нервной системы [41, 42]. Кроме того, рецепторы ГПП-1
экспрессируются в ССС и распределены в тканях миокарда (левый и правый
желудочки, перегородка и в меньшей степени предсердия), эндокарде, эндотелии
микрососудов, гладкомышечных и эндотелиальных клетках коронарных артерий [43, 44].
При
этом не исключаются и независимые от рецептора эффекты ГПП-1, в частности
способность к активации АТФ-зависимых К+(КАТФ)-каналов и
β2-адренорецепторов [45, 46].
Ряд
доклинических работ продемонстрировал вазодилатирующий и эндотелийпротективный
эффект ГПП-1 [47], опосредованный в т. ч. КАТФ-каналами митохондрий.
Известно, что задействованность КАТФ-каналов является ключевым
звеном в феномене ишемического прекондиционирования [48]. В результате открытие
митохондриальных КАТФ-каналов запускает несколько протективных
механизмов, таких как расширение матрикса митохондрий, оптимизация выработки энергии,
ускорение утилизации реактивного кислорода и поддержание гомеостаза
митохондриального кальция. При этом активация ГПП-1-рецептора способна
индуцировать механизмы прекондиционирования [49].
Кроме
того, метаболиты инкретинов обладают собственными физиологическими эффектами.
Интересно, что в ходе доклинических исследований с нокаутом рецептора ГПП-1
наблюдался кардиопротекторный эффект, что подтверждает гипотезу о том, что
некоторые кардиопротекторные действия ГПП-1 осуществляются через пути, не зависящие
от рецептора ГПП-1 [50].
Результаты
доклинических и клинических исследований эндотелийпозитивного действия
агонистов рецептора ГПП-1 свидетельствуют о наличии у них вазодилатирующего,
противовоспалительного, антиапоптотического и антипролиферативного действия [50].
Доказано,
что ГПП-1 обладает прямым противоапоптотическим действием. Агонисты
рецепторов ГПП-1 стимулируют пролиферацию и дифференциацию эндотелиальных
клеток-предшественников, а также секрецию ими фактора роста эндотелия сосудов
(VEGF). Наблюдаемый эффект сопровождался активацией важнейших внутриклеточных
сигнальных каскадов в эндотелиоцитах и повышением активности eNOS [51].
Выявлено
прямое влияние ГПП-1 на иммунные клетки, участвующие в атеросклеротическом
поражении сосудов. ГПП-1 ингибируют хемокининдуцированную миграцию CD4+, а
также способствуют приобретению тканевыми макрофагами противовоспалительного
фенотипа, что приводит к снижению воспаления в стенке сосуда и замедлению
процесса формирования атеросклеротической бляшки. При исследовании механизмов
противовоспалительного действия инкретиномиметиков на моноциты/макрофаги
отмечено, что их применение ассоциируется с супрессией NF-κB сигнального пути и
последующим снижением экспрессии провоспалительных цитокинов (TNF-α, IL-6),
некоторых рецепторов (toll-like-рецептор 2 и 4), активности матриксной
металлопротеиназы-9 (MMP-9), а также экспрессии эндотелиоцитами белка MCP-1 (monocyte chemoattractant protein 1) — мощного фактора хемотаксиса
моноцитов [52].
В
клинических исследованиях показано, что у пациентов, получавших арГПП-1, наряду
с метаболическими улучшениями наблюдалось снижение плазменной концентрации
маркеров воспаления и атеросклеротического процесса, таких как
высокочувствительный С-реактивный белок (снижение до 20%), основной ингибитор
фибринолитической системы – ингибитор активатора плазминогена PAI-1 (снижение
на 25−29%), а также маркера СН – натрийуретического пептида B (снижение до 38%)
[53].
Учитывая
широкую экспрессию рецепторов ГПП-1 в CCC, большое количество исследований
посвящено влиянию ГПП-1 на АД. Активация ГПП-1 приводит к замедлению развития
гипертензии, фиброза и гипертрофии миокарда, что обусловлено
натрийуретическим/диуретическим действием, не зависящим от уровня глюкозы [54].
В ряде исследований была показана способность агонистов ГПП-1 замедлять рост
тромба и снижать агрегацию тромбоцитов [55].
Цитопротекторное
действие на миокард у инкретиномиметиков сопровождается
активацией аденилатциклазы (АЦ) с последующим повышением уровня цАМФ и
активацией ряда киназ (PI3K/Akt, p44/42 и PKA), предупреждая апоптоз и гибель кардиомиоцитов [56].
Исследования
последних лет были преимущественно направлены на изучение свойств ГПП-1, однако
работы, оценивавшие эффекты ГИП, также позволили открыть возможности гормона,
продемонстрировав наличие рецепторов к нему не только в ткани поджелудочной
железы и тонкой кишки, но и жировой ткани, коре надпочечников, легких,
гипофизе, миокарде, костной ткани, некоторых структурах головного мозга и др. [57].
Обнаружение
рецепторов к ГИП на поверхности адипоцитов позволило предположить наличие у
гормона эффектов, связанных с жировым обменом, и прямого влияния на жировую
ткань, которого не было отмечено для ГПП-1 [58]. Влияние на ССС продолжает
активно изучаться. Активация рецепторов ГИП в
адипоцитах регулирует метаболизм липидов, способствуя увеличению
липопротеинлипазной активности, что ведет к улучшению клиренса триглицеридов.
Кроме того, ГИП модулирует функцию адипоцитов, улучшая их способность к поглощению и
высвобождению жирных кислот в зависимости от метаболических потребностей
организма [59].
Точный
механизм влияния агонистов рецептора ГПП-1 и ГИП на липидный профиль остается
не до конца раскрытым [60], но известно, что инкретины влияют на липидный обмен
посредством замедления всасывания питательных веществ и снижения количества
потребляемой пищи, модифицируя липидный профиль. При ожирении активация
рецептора ГПП-1 приводит к снижению абсорбции липидов, снижению в плазме уровня
триглицеридов, липопротеинов очень низкой плотности, снижению синтеза
аполипопротеина B
и экспрессии генов, отвечающих за липогенез в печени.
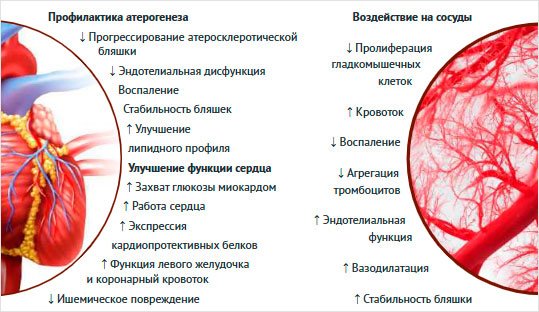
Таким образом,
инкретины, прежде всего агонисты рецепторов ГПП-1, способны оказывать
эндотелио- и кардиопротективное действие: улучшать функциональное состояние
эндотелия, снижать воспаление сосудистой стенки, ингибировать апоптоз
эндотелиоцитов и кардиомиоцитов, оптимизировать утилизацию глюкозы и оказывать
вазодилатирующее действие, улучшая кровоснабжение сердца. Агонисты рецепторов
ГПП-1 замедляют пролиферацию ГМК и утолщение интимы – медии, а также
препятствуют атеросклеротическому поражению сосудов (рис. 3).
Рисунок 3. Положительные воздействия
агонистов рецепторов глюкагоноподобного пептида 1 (адаптировано по [61])
При терапии
ожирения с СД2 или без него агонисты рецепторов ГПП-1 и ГИП, помимо
гипогликемического действия, вызывают снижение АД, массы жировой ткани,
замедляют агрегацию тромбоцитов и способствуют улучшению липидного профиля. Это
может объяснить наблюдаемое в клинических исследованиях снижение риска
сердечно-сосудистых осложнений, а в экспериментальных исследованиях – уменьшение
зоны некроза при моделировании инфаркта миокарда и применении
инкретиномиметиков.
Кардиоваскулярные эффекты
инкретиномиметиков
Подходы к лечению ожирения
значительно изменились в последние десятилетия. Это связано в т. ч. и с
получением новых данных, касающихся понимания механизмов развития ожирения, и
появлением препаратов, способных при этом воздействовать на метаболизм [62].
В связи с этим обоснованно возник
интерес к метаболической терапии – комплексному
подходу к лечению и профилактике заболеваний, основанному на коррекции
метаболических процессов в организме. Он включает в себя диетические
рекомендации, изменение образа жизни, физические упражнения и при необходимости
медикаментозное вмешательство [40]. При этом
модификация образа жизни, здоровое питание и увеличение физической активности,
к сожалению, обладают невысокой эффективностью и неустойчивостью достигнутых
результатов [63].
Понимание тесной связи ожирения с
развитием сердечно-сосудистых осложнений привело к введению рекомендаций по
включению медикаментозных методов для пациентов с ИМТ более 30 кг/м2
или более 27 кг/м2 при наличии коморбидных заболеваний [62, 64, 65].
Прорывом
в терапии ожирения, обеспечивающей эффективный и безопасный подход, стало
создание и введение в клиническую практику инкретинов – гормонов
пищеварительного тракта человека, имитирующих действие одного из них –
глюкагоноподобного пептида 1 (ГПП-1).
Агонисты рецепторов ГПП-1 (арГПП-1) были разработаны для лечения
СД2. Однако проявили способность значительно снижать массу тела у пациентов,
что позволило расширить показания к их применению [66].
Агонисты рецепторов ГПП-1 продемонстрировали не только высокую
эффективность в коррекции массы тела и нормализации углеводного и липидного
профилей (как у пациентов с СД2, так и без него), но и выраженное влияние на
снижение кардиоваскулярных рисков, благодаря чему входят в современные клинические
рекомендации по терапии ожирения [62,
65].
Особого внимания среди арГПП-1 заслуживает семаглутид,
обладающий уникальными плейотропными эффектами, значительной доказательной
базой, высокой метаболической эффективностью и безопасностью.
Представленные результаты
крупных РКИ свидетельствуют о том, что у этого препарата, кроме влияния на
гликемический контроль и снижение массы тела, имеются и значительные кардио- и
нефропротективные свойства по сравнению с другими препаратами этого класса. Так,
семаглутид продемонстрировал благоприятное влияние на конечные точки MACE,
течение и риск развития атеросклеротических ССЗ (АССЗ) и ХСН как у пациентов с
СД2, так и у больных с ожирением.
Безопасность и эффективность семаглутида продемонстрированы в
исследовательской программе SUSTAIN [67], включившей 10 исследований и более 10
000 пациентов с СД2. При этом семаглутид продемонстрировал значимое
преимущество в снижении уровня HbA1с и массы тела не только перед инсулином.
Улучшение кардиоваскулярных исходов представила программа
SUSTAIN-6, в рамках которой изучалось влияние семаглутида на основные
сердечно-сосудистые конечные точки МАСЕ. В этой программе приняли участие 3 297
пациентов с СД2, а в качестве основной конечной точки была определена смерть от
сердечно-сосудистых причин, нефатальный инфаркт и нефатальный инсульт. В
исследование были включены пациенты старше 50 лет с установленным ССЗ, ХСН
(II–III функциональный класс по NYHA) и ХБП 3-й стадии или выше и пациенты
старше 60 лет при наличии хотя бы одного фактора риска ССЗ. Терапия
семаглутидом привела к значимому снижению главной конечной точки на 26%
(относительный риск (ОР) 0,74; 95% ДИ: 0,58–0,95; р < 0,001) [68].
Результаты, полученные в исследования SUSTAIN, позволили
инициировать программы, направленные на оценку влияния семаглутида на основные
конечные точки и уменьшение кардиоваскулярного риска у пациентов с ожирением
без нарушения углеводного обмена.
Первым крупным многоцентровым плацебо-контролируемым
исследованием стало SELECT, в рамках которого были изучены кардиопротективные
возможности семаглутида у пациентов без СД2, имеющих избыточную массу тела или
ожирение и ССЗ в анамнезе [69].
Всего в исследование вошли 17 604 человека (средний возраст 61,6
лет; ИМТ больше 27 кг/м2; в анамнезе ССЗ – инфаркт, инсульт,
заболевания артерий нижних конечностей), которые были рандомизированы на 2
группы: 1-я группа получала терапию семаглутидом в дозе 2,4 мг 1 раз в неделю,
2-я группа – плацебо. Первичной конечной точкой – смерть по сердечно-сосудистым
причинам, нефатальный инсульт и нефатальный инфаркт.
Результаты исследования позволили установить значимое снижение
главной конечной точки на 20% (ОР 0,80; 95% ДИ: 0,72–0,90; р < 0,001),
комбинированной точки по СН на 18% (ОР 0,82; 95% ДИ: 0,71–0,96), риска смерти
от всех причин на 19% (ОР 0,81; 95% ДИ: 0,71–0,93) [69]. Дополнительный
субанализ выявил отсутствие зависимости эффектов семаглутида от тяжести и
фенотипа ХСН. При этом в группе семаглутида среднее снижение массы тела
составило 15,2% от исходного.
Таким образом, результаты исследовательской программы SELECT
убедительно продемонстрировали, что терапия семаглутидом позволяет улучшить
долгосрочный сердечно-сосудистый прогноз у лиц с ожирением и установленными
ССЗ, независимо от наличия нарушений углеводного обмена.
Наиболее ранним и распространенным осложнением у пациентов с
СД2, а также у людей с ожирением является ХСН. Наиболее характерным в этой
когорте пациентов является фенотип ХСН с сохраненной фракцией выброса (ХСНсФВ),
которая принципиально отличается по патогенетическим механизмам развития, а
также имеет неблагоприятный прогноз [70].
По современным представлениям в основе патогенеза ХСНсФВ лежит
вялотекущий провоспалительный процесс на уровне микроциркуляторного русла
миокарда с последующим диффузным интерстициальным фиброзом, повышением давления
наполнения ЛЖ и развитием диастолической дисфункции миокарда. Метаболические
нарушения имеют значимую роль в развитии этого фенотипа ХСН, прежде всего при
СД2 и ожирении, которые запускают каскад локальных и системных изменений,
активируют провоспалительные цитокины и способствуют поддержанию
низкоинтенсивного воспаления, эндотелиальной дисфункции коронарных сосудов,
уменьшению биодоступности оксида азота, развитию фиброза миокарда, жесткости ЛЖ
и нарушению расслабления миокарда [71, 72].
За последние годы были получены впечатляющие результаты крупных
РКИ, в которых кардио- и нефропротективные свойства позволили благоприятно
повлиять на прогноз пациентов с ХСН двух классов антидиабетических препаратов –
арГПП-1 и иНГЛТ-2.
Это позволяет отнести их к истинным
кардиопротекторам, которые по определению являются лекарственными веществами,
способными влиять на клеточный метаболизм, ионный гомеостаз, структуру и
функцию мембран клеток, препятствуя развитию необратимого их повреждения [73].
В рамках исследовательской программы SELECT [74] были впервые продемонстрированы благоприятные эффекты семаглутида у пациентов с ХСН и ожирением. Согласно ее
результатам, применение семаглутида ассоциировалось со снижением составной
конечной точки по СН (смерть от сердечно-сосудистых причин или госпитализация
по поводу сердечной недостаточности) на 18% (ОР 0,82; 95% ДИ: 0,71–0,96).
Кардиопротективные свойства семаглутида также изучались в исследованиях
STEP-HFpEF (семаглутид у пациентов с ХСНсФВ и ожирением) [75] и STEP-HFpEF DM (семаглутид у пациентов с ХСНсФВ, ожирением и СД2) [76].
В этих программах в т. ч. исследовалось влияние семаглутида на
качество жизни пациентов с ХСН, что является важным аспектом в лечении данного
синдрома.
В исследовании
STEP-HFpEF среднее изменение по шкале KCCQ-CSS в группе семаглутида составило
16,6 балла против 8,7 в группе плацебо (р < 0,001), масса тела в среднем
снизилась на 13,3 и 2,6% соответственно (р < 0,001). Кроме того, терапия
семаглутидом способствовала увеличению расстояния, которое пациенты могли
пройти за 6 мин на 20,3 м, тогда как в группе плацебо аналогичное значение
составило всего 1,2 м (р < 0,001). На фоне применения семаглутида
наблюдалось более значительное снижение уровня СРБ, составившее -43,5 против
-7,3% в группе плацебо [75]. Применение семаглутида привело к снижению уровня
N-терминального фрагмента предшественника мозгового натрийуретического пептида
(NT-proBNP) у пациентов с ожирением на 52-й нед. (p = 0,0002).
Аналогичные
результаты были получены и в анализе STEP-HFpEF DM: расчетная разница значений
по шкале KCCQ-CSS между группами составила 7,3 балла в пользу семаглутида (р
< 0,001) Процентное изменение массы тела на 52-й нед. наблюдения составило
-9,8% в группе семаглутида и -3,4% в группе плацебо. Среднее изменение
расстояния 6-минутной ходьбы на 52-й нед. наблюдения равнялось +12,7 м в группе
семаглутида и -1,6 м в группе плацебо (р = 0,008).
При вторичном
анализе объединенных данных исследований STEP-HFpEF и STEP-HFpEF DM
положительная динамика в увеличении дистанции ТШХ и улучшение по
комбинированной конечной точке (смерть от всех причин, события ХСН, изменения
результатов по шкале KCCQ-CSS, дистанции ТШХ, динамика СРБ) проявились
независимо от пола (р > 0,05) [76].
Следовательно,
терапия семаглутидом (2,4 мг) у больных ХСНсФВ и ожирением как с наличием СД2,
так и без него привела к улучшению качества жизни в виде увеличения
толерантности к физическим нагрузкам, улучшению симптомов СН, уменьшению риска
нежелательных событий, связанных с ХСН, а также сопровождалась снижением массы тела
и уровня маркеров воспаления.
Таким образом,
применение семаглутида у пациентов с ХСН и ожирением как с наличием, так и
отсутствием СД2 продемонстрировало не только значимые кардиопротективные
эффекты, но и существенное улучшение качества жизни, что является одной из
целей лечения СН.
Результаты
исследований с семаглутидом отразились в рекомендациях Американской
диабетической ассоциации 2025 г., которые рекомендуют семаглутид пациентам с
симптоматической ХСНсФВ и ожирением как для гликемического контроля, так и
уменьшения симптомов, связанных с СН, независимо от уровня HbA1c (уровень
доказательности – А) [77].
Отдельного
внимания заслуживает возможность семаглутида улучшать липидный профиль крови,
повышая уровень липопротеидов высокой плотности (ХС ЛПВП) и снижая содержание
триглицеридов. Во всех исследованиях, посвященных сердечно-сосудистым исходам (CVOT), наблюдалось улучшение липидного метаболизма. Механизм
этого действия связан с обнаруженным противовоспалительным эффектом
семаглутида, в частности, с влиянием на процессы аутофагии и апоптоза, а также
антиатерогенными эффектами, связанными со снижением активности матриксных
металлопротеиназ и стабилизацией атеросклеротических бляшек [78].
Предполагается, что эти положительные эффекты определяются как прямым
воздействием препарата на сосудистую функцию и воспаление, так и косвенными
эффектами, опосредованными снижением массы тела и улучшением гликемического
контроля. При этом выявленное уменьшение площади атеросклеротических бляшек в
аорте не зависело от уровня дозы. Клинические исследования подтвердили
антиатеросклеротический эффект семаглутида в виде уменьшения средней толщины
интимы – медии сонной артерии, размеров атеросклеротических бляшек и торможения
пролиферации гладкомышечных клеток сосудов [79].
Влияние на гемодинамику при применении семаглутида отмечено в
отношении величины АД: снижение этого показателя в среднем составляет 3,4 мм
рт. ст. при использовании дозы 0,5 мг и 5,4 мм рт. ст. – 1,0 мг. Механизмы
гипотензивного действия семаглутида связывают с вазодилатацией, обусловленной
секрецией оксида азота и увеличением натрийуреза. Кроме того, натрийуретический
эффект арГПП-1 происходит из-за ингибирования активности 3-й изоформы кишечного
натрий-водородного обменника (NHE3) в проксимальном канальце почек. Имеются
указания, что натрийуретические эффекты арГПП-1 до некоторой степени связаны с
активацией почечных афферентных нервов, локализованных в почечной лоханке [80].
Согласно данным исследований STEP, у взрослых, получавших
семаглутид для лечения ожирения, вероятность снижения дозы или прекращения
антигипертензивной или гиполипидемической терапии была выше, чем у тех, кто
получал плацебо.
Исследователи объединили данные об использовании
антигипертензивных препаратов и средств для снижения уровня липидов из
исследований STEP 1, 2, 3, 6 и 8 в ретроспективном анализе. Было обнаружено,
что у большего числа взрослых, получавших семаглутид в дозировке 2,4 мг,
интенсивность антигипертензивной терапии или терапии для снижения уровня
липидов снизилась или они полностью прекратили их прием через 68 нед. по
сравнению с плацебо. С другой стороны, на 68-й нед. процент участников,
принимавших плацебо, увеличил интенсивность антигипертензивной или
гиполипидемической терапии по сравнению с теми, кто принимал семаглутид.
На 68-й нед. липидснижающая терапия была прекращена у 10,1%
взрослых с ожирением и без диабета, получавших семаглутид, и у 4,5% взрослых,
получавших плацебо. Доля взрослых, у которых липидснижающая терапия была
отменена, была одинаковой в группах семаглутида (4%) и плацебо (3,9%). Усиление
терапии произошло у 9,7% пациентов в группе плацебо по сравнению с 2,1%
пациентов, получавших семаглутид.
Среди взрослых с ожирением и СД2 10,1%, получавших семаглутид, и
5,4%, получавших плацебо, прекратили прием гиполипидемической терапии через 68
нед. Процент взрослых, у которых наблюдалось снижение интенсивности
гиполипидемической терапии, был выше в группе семаглутида по сравнению с
группой плацебо (4,6% по сравнению с 0,9%) [81].
Среди взрослых пациентов с ожирением и без диабета 17,7%
участников, принимавших семаглутид, прекратили прием антигипертензивных
препаратов через 68 нед. по сравнению с 9% участников, принимавших плацебо.
Дозировка антигипертензивных препаратов была снижена у 16,5% участников,
принимавших семаглутид, и у 4,8% участников, принимавших плацебо. Дозировка
препаратов была увеличена у 14,2% участников, принимавших плацебо, по сравнению
с 8,3% участников, принимавших семаглутид.
Среди взрослых пациентов с ожирением и СД2 9,8% пациентов, получавших
семаглутид, прекратили прием антигипертензивных препаратов через 68 нед. по
сравнению с 7,3% пациентов, получавших плацебо. Интенсивность
антигипертензивной терапии была снижена у 14,7% пациентов, получавших
семаглутид, и у 5,7% пациентов, получавших плацебо, в то время как у 11,5%
пациентов, получавших плацебо, и у 7,9% пациентов, получавших семаглутид,
терапия была усилена.
У взрослых с ожирением и без диабета, получавших семаглутид,
ремиссия гипертонии наблюдалась в 13,7% случаев через 68 нед. по сравнению с
6,2% в группе плацебо. В ходе анализа данных взрослых с ожирением и СД2 ремиссия
гипертонии наблюдалась у 5,7% взрослых, получавших семаглутид, и у 3,4%
взрослых, получавших плацебо [81].
Стоит особо отметить, что плейотропное действие семаглутида
обладает положительным воздействием на ССС при ишемии миокарда. Так, метаанализ
РКИ по поиску в PubMed, Web of Science, EBSCO, Scopus и Кокрейновской
библиотеке показал, что ГПП-1 был связан с улучшением ФВ ЛЖ и уменьшением
размера инфаркта у пациентов с ОИМ, перенесших ЧКВ и АКШ, хотя механизм, каким
образом препарат обеспечивает это преимущество, неясен [82].
Описан
цитопротективный эффект ГПП-1 при ишемически-реперфузионном повреждении
миокарда, ассоциированный с активацией ряда киназ пути RISK (Reperfusion Injury Salvage Kinase Pathway). Эти механизмы
способствуют снижению проницаемости митохондриальной мембраны и защищают
кардиомиоциты от апоптоза в условиях реперфузии [83].
Опыт
применения первых инкретиновых препаратов имел несомненный успех, что послужило
поводом для дальнейших исследований в этой области. Возможность одновременно
воздействовать на разнообразные пути метаболизма углеводов, белков и липидов
была реализована при разработке двойных агонистов инкретиновых рецепторов,
которые связываются с рецепторами ГПП-1 и с рецепторами глюкозозависимого
инсулинотропного полипептида (ГИП) [84, 85].
Двойные агонисты (твинкретины) обладают дополнительными
преимуществами, обеспечиваемыми синергическими эффектами для лечения ожирения и
СД2 [86].
Тирзепатид – первый агонист рецепторов
ГИП/ГПП-1 был одобрен для лечения СД2 в 2022 г., а для лечения ожирения – в
2023 г. [87].
Серия клинических исследований тирзепатида продемонстрировала
чрезвычайную эффективность в отношении снижения массы тела при положительном
профиле безопасности, что позволило широко использовать препарат в клинической
практике [88–93].
Чтобы
оценить частоту развития сердечно-сосудистых и цереброваскулярных событий у
пациентов, принимавших тирзепатид, по сравнению с контрольной группой, был
проведен метаанализ с использованием данных 7 778 пациентов, участвовавших в
исследовании SURPASS-4, программе клинических исследований SURPASS (которая
включает 7 рандомизированных клинических исследований) и SURMOUNT-1. Общий
коэффициент риска (HR) составил 0,59 (95% ДИ 0,40–0,79), что указывает на
значительное снижение риска развития МАСЕ при применении тирзепатида по
сравнению с контрольной группой [94]. При сравнении тирзепатида с контрольной
группой коэффициент риска для MACE
составил 0,80 (95% доверительный интервал [ДИ] 0,57–1,11), для смерти от ССЗ —
0,90 (95% ДИ 0,50–1,61), а для смерти от всех причин — 0,80 (95% ДИ 0,51–1,25)
[95]. Важно помнить, что, согласно имеющимся данным, тирзепатид может снижать
риск инсульта [96].
Влияние
тирзепатида на сердечно-сосудистую систему, риски развития СС осложнений и
летальных исходов представлено в результатах исследования SUMMIT, в котором
приняли участие более 700 пациентов с ожирением и СН с сохраненной фракцией
выброса (СНсФВ). Результаты исследования свидетельствуют о том, что лечение
тирзепатидом (в течение 52 нед.) приводило к снижению комбинированного риска
сердечно-сосудистой смерти или ухудшения СН на 38% по сравнению с плацебо.
Пациенты при применении тирзепатида отмечали улучшение общего состояния
здоровья (изменение суммарного клинического балла по шкале KCCQ-CSS),
толерантности к физическим нагрузкам (проходили примерно в 5 раз больше за 6
мин, чем пациенты, принимавшие плацебо) и уменьшение систолического АД
(примерно на 5 мм рт. ст.) [97, 98].
Результаты
исследования свидетельствуют, что в клетках сердечной мышцы при применении
тирзепатида происходят изменения в регуляции кальциевых сигналов, при этом
эффективно снижается перегрузка кальцием кардиомиоцитов. Кроме того,
исследование показало, что тирзепатид коррелировал с заметным снижением уровней
ключевых маркеров, связанных с фиброзом и гипертрофией, таких как TGF-β,
матриксная металлопротеиназа-9 (MMP9), коллаген I типа альфа 1 (COLIA1) [94].
После
26 нед. лечения тирзепатидом в различных дозах наблюдалось снижение уровня
нескольких биомаркеров, связанных с воспалением и эндотелиальной дисфункцией.
При этом тирзепатид более значимо снижает воспаление по сравнению с агонистами
рецепторов ГПП-1 [99]. Недавние исследования показали, что тирзепатид помогает
снизить окислительный стресс в эндотелиальных клетках человека и предотвращает
высвобождение воспалительных цитокинов в висцеральной жировой ткани [100].
Описаны возможности тирзепатида уменьшать воспаление и апоптоз, вызванные
липополисахаридами в сердце, что является свидетельством подавления сигнальных
путей инфламмасомы TLR4/NLRP3/NF-κB, что в свою очередь приводит к
снижению риска желудочковых аритмий [101].
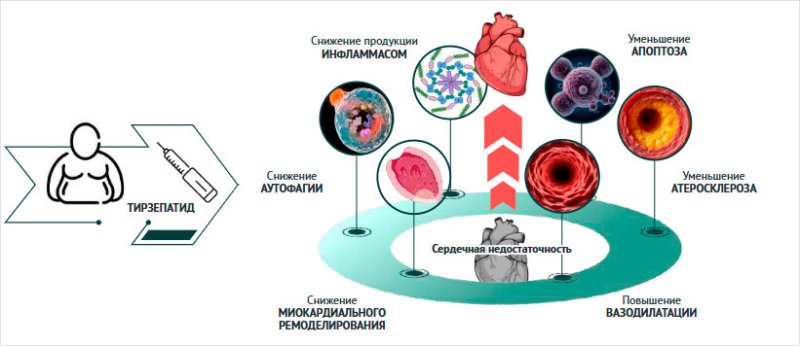
В
исследованиях было показано, что терапия тирзепатидом изменяет уровни маркеров
апоптоза и аутофагии в клетках сердца человека при СН, что указывает на
усиление процесса аутофагии (рис. 4) [94].
Рисунок 4. Механизм действия тирзепатида
(адаптировано по [94])
Тирзепатид
продемонстрировал положительное влияние на сердечно-сосудистую систему и у
пациентов без СН. По данным исследования SURMOUNT-1, на фоне терапии тирзепатидом
отмечалось снижение систолического АД на 7,2 мм рт. ст. (по сравнению с
уменьшением на 1 мм рт. ст. в группе плацебо), улучшение липидного профиля,
включая снижение уровней общего холестерина, холестерина ЛПНП, триглицеридов, апоВ
и апоС-III,
а также повышение уровня холестерина ЛПВП [88]. Наиболее значительные изменения
наблюдались при применении тирзепатида в самых высоких дозах, т. е. 10 и
15 мг [102].
Согласно
результатам исследования SURPASS-2 тирзепатид, вводимый раз в неделю в
дозировке 10 или 15 мг, более эффективен в снижении АД, чем семаглутид,
вводимый раз в неделю в дозировке 1 мг. Разница в эффективности может быть
обусловлена агонизмом тирзепатида в отношении ГИП и его более выраженной
способностью способствовать снижению массы тела. Среднее снижение
систолического АД составило 5,3 мм рт. ст. при приеме семаглутида, 6,5 мм рт.
ст. при приеме тирзепатида в дозе 15 мг и 3,6 мм рт. ст. при приеме тирзепатида
в дозе 10 мг. Считается, что снижение АД, вызванное приемом тирзепатида,
обусловлено различными факторами, такими как масса тела, расширение сосудов,
натрийурез, одновременный прием других препаратов и уменьшение внеклеточного
объема. К механизмам положительного влияния тирзепатида на АД относят также
улучшение функции эндотелия и снижение уровня воспаления [103].
Проведенный
метаанализ 7 исследований подтвердил благоприятное воздействие терапии
твинкретином на показатели АД и липидного профиля [104].
2025 г. был ознаменован тем, что FDA
одобрило первое лекарство от обструктивного апноэ сна, и им был тирзепатид.
Основой этому послужили результаты исследования тирзепатида у участников с
обструктивным апноэ во сне (SURMOUNT-OSA). У пациентов с умеренным или тяжелым
обструктивным апноэ во сне и ожирением тирзепатид снижал индекс апноэ во сне,
массу тела, гипоксическую нагрузку, концентрацию высокочувствительного
С-реактивного белка и систолическое АД. Снижение массы тела не единственное
преимущество тирзепатида для людей с апноэ во сне. Обеспечивая контроль уровня
сахара в крови и уменьшая воспаление, улучшая общее качество сна, тирзепатид
потенциально может и улучшить метаболическое здоровье [105].
В настоящее время признано, что арГПП-1 и ГИП
могут быть эффективными в лечении ожирения, особенно у пациентов с
множественными сердечно-сосудистыми факторами риска. В связи с этим инкретины
выступают в качестве инструмента для активного модулирования кардио-рено-метаболического
заболевания начиная уже с ранних этапов кардиометаболического континуума.
Инкретины, помимо гипогликемического
действия, снижают воспаление сосудистой стенки, массу жировой ткани и
способствуют улучшению липидного профиля, обеспечивая, таким образом,
метаболизм-модифицирующий поход (рис. 5).
Рисунок
5. Применение арГПП1 и ГИП обеспечивает метаболическое
перепрограммирование и болезнь-модифицирующий подход
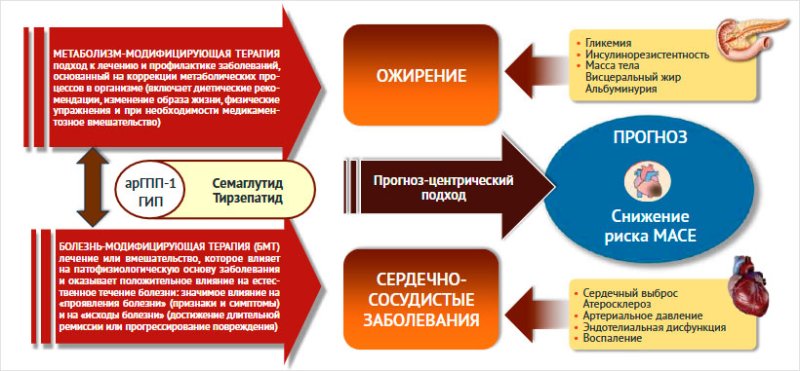
Инкретины воздействуют на сердечно-сосудистую
систему: улучшают функциональное состояние эндотелия, снижают АД и замедляют
агрегацию тромбоцитов, ингибируют апоптоз кардиомиоцитов, улучшают утилизацию
глюкозы и оказывают вазодилатирующее действие, улучшая кровоснабжение сердца.
Это объясняет наблюдаемое в клинических исследованиях снижение риска
сердечно-сосудистых осложнений, а в экспериментальных исследованиях –
уменьшение зоны некроза при моделировании инфаркта миокарда и применении
инкретиномиметиков. В связи с эти инкретины можно с полной уверенностью отнести
к препаратам болезнь-модифицирующей терапии (рис. 5).
Возможности
применения российских препаратов – аналогов инкретинов в клинической практике
Важной
и актуальной задачей является увеличение доступности к эффективным методам
профилактики и лечения ССЗ у пациентов с метаболическими нарушениями.
Российская компания «Герофарм» успешно разработала и выпустила в гражданский
оборот воспроизведенные препараты, содержащие семаглутид и тирзепатид.
На
российском фармацевтическом рынке представлены биоаналоги семаглутида компании
«Герофарм», в частности препарат Семавик® и Семавик Некст® в различных дозировках. Согласно
инструкции по применению Семавик® и Cемавик® Некст показаны взрослым пациентам
с исходным индексом массы тела (ИМТ) ≥ 30 кг/м2 (ожирение) или ≥ 27,
но < 30 кг/м2 (избыточная масса тела) при наличии по крайней мере
одной сопутствующей патологии: дисгликемии (предиабета или СД2), АГ,
дислипидемии, обструктивного апноэ во сне или сердечно-сосудистых заболеваний [106].
Показана
высокая степень сопоставимости биоэквивалента препарату сравнения в отношении
характеристик действующего вещества, примесей и состава вспомогательных веществ
[107].
В
настоящее время проведены сравнительные исследования фармакокинетики,
биоэквивалентности, безопасности и переносимости содержащих семаглутид
препаратов Семавик® Некст (ООО «Герофарм», Россия) и Вегови® (компания «Ново Нордиск», Дания) в концентрациях
0,68 и 3,2 мг/мл (дозы 0,25 и 0,50 мг соответственно), а также препарата
Семавик®, раствор для подкожного введения, 1,34 мг/мл (ООО «Герофарм», Россия),
с препаратом сравнения Оземпик®, раствор для подкожного введения, 1,34 мг/мл
(компания «Ново Нордиск А/С», Дания).
Был
сделан вывод, что препараты Семавик®, Семавик® Некст (ООО «Герофарм», Россия) и
Оземпик®, Вегови® (компания «Ново Нордиск», Дания) могут быть признаны
биоэквивалентными и одинаково безопасными [108, 109].
Полученные
данные свидетельствуют о возможности применения препаратов Семавик® и Семавик®
Некст в качестве альтернативы оригинальному семаглутиду. Наличие отечественного
препарата семаглутида в широкой линейке концентраций позволит обеспечить более
широкий доступ пациентов к эффективному лечению при ожирении и избыточной массе
тела, осуществляя раннюю профилактику кардио-рено-метаболического синдрома.
Компания
«Герофарм» в апреле 2025 г. получила также регистрационное удостоверение на
препарат Седжаро® – аналог средства, содержащего тирзепатид (Mounjaro®), который производится
американской компанией Eli Lilly. В России оригинальное средство не было
зарегистрировано и теперь обеспечивает бесперебойный доступ населения Российской
Федерации к новому терапевтическому решению проблемы сахарного диабета,
избыточной массы тела и ожирения. Новый препарат полностью биоэквивалентен Mounjaro®.
Седжаро® представлен в форме шприц-ручки с
раствором для подкожного введения в 6 дозировках: 2,5, 5, 7,5, 10, 12,5 и 15
мг.
Особое
внимание заслуживает эффективность препарата при абдоминальном висцеральном
ожирении – наиболее распространенной форме заболевания, характеризующейся
накоплением жировой ткани в области живота.
Появление Седжаро® (тирзепатид) в
клинической практике является новым этапом в терапии ожирения в России.
Уникальный механизм двойного агонизма рецепторов ГПП-1 и ГИП обеспечивает
препарату высокую эффективность при терапии ожирения и СД2, оказывая
многогранное воздействие на метаболические процессы, включая улучшение
гликемического контроля, модуляцию метаболизма липидов и противовоспалительное
действие в жировой ткани, что способствует снижению риска развития артериальной
гипертензии и сердечно-сосудистых заболеваний.
Заключение
Современная
стратегия профилактики неблагоприятных сердечно-сосудистых исходов базируется
на признании роли ожирения как ключевого раннего триггера
кардио-рено-метаболического заболевания, который можно модулировать с помощью
современных фармакологических инструментов.
Внедрение инкретинов в клиническую практику
представляет собой новый этап в терапии ожирения и СД2. Благодаря своему
механизму препараты демонстрируют высокую эффективность, оказывая
разностороннее воздействие на метаболические процессы, включая улучшение гликемического
контроля, модуляцию метаболизма липидов и противовоспалительное действие в
жировой ткани и сосудах. Возможность сокращать риски сердечно-сосудистых
осложнений и благотворно влиять на состояние и прогноз пациентов с уже
имеющимися коморбидными патологиями открывает новые перспективы в лечении
метаболических нарушений, предоставляя врачам и пациентам дополнительные
инструменты для достижения оптимальных результатов. Поэтому их в полной мере
можно отнести к средствам метаболической, или кардиопротекторной, или
кардиоцитопротекторной терапии, что, по определению Роберто Феррари,
представляет лечение, которое путем прямого влияния на кардиомиоцит
способствует его выживаемости в условиях ишемии (гипоксии) .
Появление
на фармрынке отечественного семаглутида (Семавик® и Семавик Некст®) и
тирзепатида (Седжаро®) в обширной гамме концентраций значимо расширит
доступность эффективного лечения пациентов с избыточной массой тела и
ожирением. Дальнейшие исследования помогут более детально раскрыть механизмы их
протективного действия на ССС при лечении СД2 и ожирения, а также подобрать
оптимальные комбинации инкретинов с другими препаратами.
Список литературы / References
Развернуть
- Ng M, Fleming T, Robinson M, Thomson B, Graetz N, Margono C et al. Global, regional, and national prevalence of overweight and obesity in children and adults during 1980-2013: a systematic analysis for the Global Burden of Disease Study 2013. Lancet. 2014;384(9945):766-781. https://doi.org/10.1016/S0140-6736(14)60460-8.
- GBD 2015 Obesity Collaborators; Afshin A, Forouzanfar MH, Reitsma MB, Sur P, Estep K, Lee A et al. Health Effects of Overweight and Obesity in 195 Countries over 25 Years. N Engl J Med. 2017;377(1):13-27. https://doi.org/10.1056/NEJMoa1614362.
- GBD 2019 Risk Factors Collaborators. Global burden of 87 risk factors in 204 countries and territories, 1990-2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet. 2020;396(10258):1223-1249. https://doi.org/10.1016/S0140-6736(20)30752-2.
- Маматов АУ, Орозматов ТТ, Мадаминов ЖБ, Абдыманап кызы А, Чубашева НД. Ожирение и риск развития сердечно-сосудистых заболеваний: взгляд на современную проблему. The Scientific Heritage. 2021;(64):35-42. https://doi.org/10.24412/9215-0365-2021-64-2-35-42.
- Bogers RP, Bemelmans WJ, Hoogenveen RT, Boshuizen HC, Woodward M, Knekt P et al.; BMI-CHD Collaboration Investigators. Association of overweight with increased risk of coronary heart disease partly independent of blood pressure and cholesterol levels: a meta-analysis of 21 cohort studies including more than 300 000 persons. Arch Intern Med. 2007;167(16):1720-1728. https://doi.org/10.1001/archinte.167.16.1720.
- Hubert HB, Feinleib M, McNamara PM, Castelli WP. Obesity as an independent risk factor for cardiovascular disease: a 26-year follow-up of participants in the Framingham Heart Study. Circulation. 1983;67(5):968-977. https://doi.org/10.1161/01.cir.67.5.968.
- The Global Burden of Metabolic Risk Factors for Chronic Diseases Collaboration (BMI Mediated Effects); Lu Y, Hajifathalian K, Ezzati M, Woodward M, Rimm EB, Danaei G. Metabolic mediators of the effects of body-mass index, overweight, and obesity on coronary heart disease and stroke: a pooled analysis of 97 prospective cohorts with 1·8 million participants. Lancet. 2014;383(9921):970-983. https://doi.org/10.1016/S0140-6736(13)61836-X.
- Wilson PW, Bozeman SR, Burton TM, Hoaglin DC, Ben-Joseph R, Pashos CL. Prediction of first events of coronary heart disease and stroke with consideration of adiposity. Circulation. 2008;118(2):124-130. https://doi.org/10.1161/CIRCULATIONAHA.108.772962.
- Caleyachetty R, Thomas GN, Toulis KA, Mohammed N, Gokhale KM, Balachandran K, Nirantharakumar K. Metabolically Healthy Obese and Incident Cardiovascular Disease Events Among 3.5 Million Men and Women. J Am Coll Cardiol. 2017;70(12):1429-1437. https://doi.org/10.1016/j.jacc.2017.07.763.
- Cholesterol Treatment Trialists’ (CTT) Collaboration; Baigent C, Blackwell L, Emberson J, Holland LE, Reith C, Bhala N et al. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170,000 participants in 26 randomised trials. Lancet. 2010;376(9753): 1670-1681. https://doi.org/10.1016/S0140-6736(10)61350-5.
- SPRINT Research Group; Wright JT Jr, Williamson JD, Whelton PK, Snyder JK, Sink KM, Rocco MV et al. A Randomized Trial of Intensive versus Standard Blood-Pressure Control. N Engl J Med. 2015;373(22):2103-2116. https://doi.org/10.1056/NEJMoa1511939.
- McGuire DK, Shih WJ, Cosentino F, Charbonnel B, Cherney DZI, Dagogo-Jack S et al. Association of SGLT2 Inhibitors With Cardiovascular and Kidney Outcomes in Patients With Type 2 Diabetes: A Meta-analysis. JAMA Cardiol. 2021;6(2):148-158. https://doi.org/10.1001/jamacardio.2020.4511.
- Sattar N, Lee MMY, Kristensen SL, Branch KRH, Del Prato S, Khurmi NS et al. Cardiovascular, mortality, and kidney outcomes with GLP-1 receptor agonists in patients with type 2 diabetes: a systematic review and metaanalysis of randomised trials. Lancet Diabetes Endocrinol. 2021;9(10):653-662. https://doi.org/10.1016/S2213-8587(21)00203-5.
- Ma C, Avenell A, Bolland M, Hudson J, Stewart F, Robertson C et al. Effects of weight loss interventions for adults who are obese on mortality, cardiovascular disease, and cancer: systematic review and meta-analysis. BMJ. 2017;359:j4849. https://doi.org/10.1136/bmj.j4849.
- Look AHEAD Research Group; Wing RR, Bolin P, Brancati FL, Bray GA, Clark JM, Coday M et al. Cardiovascular effects of intensive lifestyle intervention in type 2 diabetes. N Engl J Med. 2013;369(2):145-154. https://doi.org/10.1056/NEJMoa1212914.
- Lingvay I, Sumithran P, Cohen RV, le Roux CW. Obesity management as a primary treatment goal for type 2 diabetes: Time to reframe the conversation. Lancet. 2022;399(10322):394-405. https://doi.org/10.1016/S0140-6736(21)01919-X.
- Drucker DJ. The Cardiovascular Biology of Glucagon-like Peptide-1. Cell Metab. 2016;24(1):15-30. https://doi.org/10.1016/j.cmet.2016.06.009.
- Roth GA, Forouzanfar MH, Moran AE, Barber R, Nguyen G, Feigin VL et al. Demographic and epidemiologic drivers of global cardiovascular mortality. N Engl J Med. 2015;372(14):1333-1341. https://doi.org/10.1056/NEJMoa1406656.
- Roth GA, Johnson C, Abajobir A, Abd-Allah F, Abera SF, Abyu G et al. Regional, and National Burden of Cardiovascular Diseases for 10 Causes, 1990 to 2015. J Am Coll Cardiol. 2017;70(1):1-25. https://doi.org/10.1016/j.jacc.2017.04.052.
- Murphy SL, Xu J, Kochanek KD, Arias E. Mortality in the United States, 2017. NCHS Data Brief. 2018;(328):1-8. Available at: https://pubmed.ncbi.nlm.nih.gov/30500322.
- Sidney S, Sorel ME, Quesenberry CP, Jaffe MG, Solomon MD, NguyenHuynh MN et al. Comparative Trends in Heart Disease, Stroke, and AllCause Mortality in the United States and a Large Integrated Healthcare Delivery System. Am J Med. 2018;131(7):829-836.e1. https://doi.org/10.1016/j.amjmed.2018.02.014.
- Bombelli M, Facchetti R, Fodri D, Brambilla G, Sega R, Grassi G, Mancia G. Impact of body mass index and waist circumference on the cardiovascular risk and all-cause death in a general population: data from the PAMELA study. Nutr Metab Cardiovasc Dis. 2013;23(7):650-656. https://doi.org/10.1016/j.numecd.2012.01.004.
- Дружилов МА, Дружилова ОЮ, Кузнецова ТЮ. и др. Ожирение как фактор сердечно-сосудистого риска: акцент на качество и функциональную активность жировой ткани. Российский кардиологический журнал. 2015;(4):111-117. https://doi.org/10.15829/1560-4071-2015-4-111-11.
- Jindal A, Whaley-Connell A, Sowers JR. Obesity and heart failure as a mediator of the cerebrorenal interaction. Contrib Nephrol. 2013;179:15-23. https://doi.org/10.1159/000346718.
- Baigent C, Keech A, Kearney PM, Blackwell L, Buck G, Pollicino C et al.; Cholesterol Treatment Trialists’ (CTT) Collaborators. Efficacy and safety of cholesterol-lowering treatment: prospective meta-analysis of data from 90,056 participants in 14 randomised trials of statins. Lancet. 2005;366(9493):1267-1278. https://doi.org/10.1016/S0140-6736(05)67394-1.
- Lawler PR, Bhatt DL, Godoy LC, Lüscher TF, Bonow RO, Verma S, Ridker PM. Targeting cardiovascular inflammation: next steps in clinical translation. Eur Heart J. 2021;42(1):113-131. https://doi.org/10.1093/eurheartj/ehaa099.
- Mechanick JI, Farkouh ME, Newman JD, Garvey WT. Cardiometabolic-Based Chronic Disease, Adiposity and Dysglycemia Drivers: JACC State-of-the-Art Review. J Am Coll Cardiol. 2020;75(5):525-538. https://doi.org/10.1016/j.jacc.2019.11.044.
- Mechanick JI, Garber AJ, Grunberger G, Handelsman Y, Garvey WT. Dysglycemia-based chronic disease: an American Association of Clinical Endocrinologists position statement. Endocr Pract. 2018;24(11):995-1011. https://doi.org/10.4158/PS-2018-0139.
- Piché ME, Poirier P. Obesity, ectopic fat and cardiac metabolism. Expert Rev Endocrinol Metab. 2018;13(4):213-221. https://doi.org/10.1080/17446651.2018.1500894.
- Packer M, Butler J, Filippatos GS, Jamal W, Salsali A, Schnee J, Kimura K et al.; EMPEROR-Reduced Trial Committees and Investigators. Evaluation of the effect of sodium-glucose co-transporter 2 inhibition with empagliflozin on morbidity and mortality of patients with chronic heart failure and a reduced ejection fraction: rationale for and design of the EMPEROR-Reduced trial. Eur J Heart Fail. 2019;21(10):1270-1278. https://doi.org/10.1002/ejhf.1536.
- Koliaki CC, Katsilambroset NL. Are the Modern Diets for the Treatment of Obesity Better than the Classical Ones? Endocrines. 2022;(3):603-623. https://doi.org/10.3390/endocrines3040052.
- Savji N, Meijers WC, Bartz TM, Bhambhani V, Cushman M, Nayor M et al. The association of obesity and cardiometabolic traits with incident HFpEF and HFrEF. JACC Heart Fail. 2018;6:701-709. https://doi.org/10.1016/j.jchf.2018.05.018.
- Liu L, Lima JAC, Post WS, Szklo M. Associations of time-varying obesity and metabolic syndrome with risk of incident heart failure and its subtypes: Findings from the Multi-Ethnic Study of Atherosclerosis. Int J Cardiol. 2021;338:127-135. https://doi.org/10.1016/j.ijcard.2021.05.051.
- Филинюк ПЮ, Шишкин АН, Пчелин ИЮ, Худякова НВ, Воловникова ВА, Кулибаба ТГ. Некоторые особенности коррекции дисфункции жировой ткани. Juvenis Scientia. 2023;9(6):6-17. https://doi.org/10.32415/jscientia2023966-17.
- Lavie CJ, Milani RV, Ventura HO. Obesity and cardiovascular disease: risk factor, paradox, and impact of weight loss. J Am Coll Cardiol. 2009;53:1925-1932. https://doi.org/10.1016/j.jacc.2008.12.068.
- Ashrafian H, le Roux CW, Darzi A, Athanasiou T. Effects of Bariatric Surgery on Cardiovascular Function. Circulation. 2008;118(20):2091-2102. https://doi.org/10.1161/CIRCULATIONAHA.107.721027.
- Ebong IA, Goff DC, Rodriges CJ, Chen H, Bertoni AG. Mechanisms of Heart Failure in Obesity. Obes Res Clin Pract. 2014;8(6):540-548. https://doi.org/10.1016/j.orcp.2013.12.005.
- Kim M, Oh JK, Sakata S, Liang I, Park W, Hajjar RJ, Lebeche D et al. Role of resistin in cardiac contractility and hypertrophy. J Mol Cell Cardiol. 2008;45(2):270-280. https://doi.org/10.1016/j.yjmcc.2008.05.006.
- Дедов ИИ, Александров АА, Кухаренко СС. Сердце и ожирение. Ожирение и метаболизм. 2006;3(1):14-20. https://doi.org/10.14341/2071-8713-4938.
- Древаль АВ, Нечаева ОА, Древаль ОА, Бритвин ТА, Габриелян АР. Метаболическая медицина. РМЖ. Медицинское обозрение. 2024;8(9):518-525. https://doi.org/10.32364/2587-6821-2024-8-9-3.
- Baggio LL, Drucker DJ: Biology of incretins: GLP-1 and GIP. Gastroenterology. 2007;132:2131-2157. https://doi.org/10.1053/j.gastro.2007.03.054.
- Anagnostis P, Athyros VG, Adamidou F, Panagiotou A, Kita M, Karagiannis A, Mikhailidis DP. Glucagon-like peptide-1-based therapies and cardiovascular disease: looking beyond glycaemic control. Diab Obes Metab. 2011;13:302-312. https://doi.org/10.1111/j.1463-1326.2010.01345.x.
- Ban K, Noyan-Ashraf MH, Hoefer J, Bolz SS, Drucker DJ, Husain M. Cardioprotective and vasodilatory actions of glucagon-like peptide 1 receptor are mediated through both glucagon-like peptide 1 receptor-dependent and -independent pathways. Circulation. 2008;117:2340-2350. https://doi.org/10.1161/CIRCULATIONAHA.107.739938.
- Erdogdu O, Nathanson D, Sjöholm A, Nyström T, Zhang Q. Exendin-4 stimulates proliferation of human coronary artery endothelial cells through eNOS-, PKAand PI3K/Akt-dependent pathways and requires GLP-1 receptor. Mol Cell Endocrinol. 2010;325(1-2):26-35. https://doi.org/10.1016/j.mce.2010.04.022.
- Green BD, Hand KV, Dougan JE, McDonnell BM, Cassidy RS, Grieve DJ. GLP1 and related peptides cause concentration-dependent relaxation of rat aorta through a pathway involving KATP and cAMP. Arch Biochem Biophys. 2008;478(2):136-142. https://doi.org/10.1016/j.abb.2008.08.001.
- Kuc RE, Maguire JJ, Siew K, Patel S, Derksen DR, Margaret Jackson V et al. Characterization of [¹²⁵I]GLP-1(9-36), a novel radiolabeled analog of the major metabolite of glucagon-like peptide 1 to a receptor distinct from GLP1-R and function of the peptide in murine aorta. Life Sci. 2014;102(2):134-138. https://doi.org/10.1016/j.lfs.2014.03.011.
- Eriksson L, Nystrom T. Antidiabetic agents and endothelial dysfunction - beyond glucose control. Basic Clin Pharmacol Toxicol. 2015;117(1):15-25. https://doi.org/10.1111/bcpt.12402.
- Ha SJ, Kim W, Woo JS. Preventive effects of exenatide on endothelial dysfunction induced by ischemia-reperfusion injury via KATP channels. Arterioscler Thromb Vasc Biol. 2012;32(2):474−480. https://doi.org/10.1161/atvbaha.110.222653.
- Basu A, Charkoudian N, Schrage W, Rizza RA, Basu R, Joyner MJ. Beneficial effects of GLP-1 on endothelial function in humans: dampening by glyburide but not by glimepiride. Am J Physiol Endocrinol Metab. 2007;293(5):1289−1295. https://doi.org/10.1152/ajpendo.00373.2007.
- Тюренков ИН, Бакулин ДА, Куркин ДВ, Волотова ЕВ. Кардиоваскулярные эффекты инкретиномиметиков и их терапевтический потенциал. Вестник Российской академии медицинских наук. 2017;72(1):66-75. https://doi.org/10.15690/vramn732.
- Xiao-Yun X, Zhao-Hui M, Ke C. Glucagon-like peptide-1 improves proliferation and differentiation of endothelial progenitor cells via upregulating VEGF generation. Med Sci Monit. 2011;17(2):BR35−41. https://doi.org/10.12659/msm.881383.
- Hogan AE, Gaoatswe G, Lynch L, Corrigan MA, Woods C, O’Connell J, O’Shea D. Glucagon-like peptide 1 analogue therapy directly modulates innate immune-mediated inflammation in individuals with type 2 diabetes mellitus. Diabetologia. 2014;57(4):781-784. https://doi.org/10.1007/s00125-013-3145-0.
- Lorber D. GLP-1 Receptor Agonists: Effects on Cardiovascular Risk Reduction. Cardiovasc Ther. 2013;31(4):238-249. https://doi.org/10.1111/1755-5922.12000.
- Tate M, Chong A, Robinson E, Green BD, Grieve DJ. Selective targeting of glucagon-like peptide-1 signalling as a novel therapeutic approach for cardiovascular disease in diabetes. Br J Pharmacol. 2015;172(3):721-736. https://doi.org/10.1111/bph.12943.
- Cameron-Vendrig A, Reheman A, Siraj MA, Xu XR, Wang Y, Lei X et al. Glucagon-like peptide 1 receptor activation attenuates platelet aggregation and thrombosis. Diabetes. 2016;65(6):1714−1723. https://doi.org/10.2337/db15-1141.
- Khedr RM, Ahmed AAE, Kamel R, Raafat EM. Sitagliptin attenuates intestinal ischemia/reperfusion injury via cAMP/PKA, PI3K/Akt pathway in a glucagon-like peptide 1 receptor-dependent manner. Life Sci. 2018;211:31-39. https://doi.org/10.1016/j.lfs.2018.09.013.
- Шестакова ЕА, Ильин АВ, Шестакова МВ, Дедов ИИ. Глюкозозависимый инсулинотропный полипептид - новое звено в развитии ожирения. Ожирение и метаболизм. 2015;12(1):16-19. https://doi.org/10.14341/omet2015116-19.
- Holst JJ. On the physiology of GIP and GLP-1. Horm Metab Res. 2004;36(11-12): 747-754. https://doi.org/10.1055/s-2004-826158.
- Vergès B. Do antiobesity medical treatments have a direct effect on adipose tissue? Ann Endocrinol. 2024;85(3):179-183. https://doi.org/10.1016/j.ando.2024.05.021.
- Lorber D. GLP-1 Receptor Agonists: Effects on Cardiovascular Risk Reduction. Cardiovasc Ther. 2013;31(4):238-249. https://doi.org/10.1111/1755-5922.12000.
- Manna P, Jain SK. Obesity, Oxidative Stress, Adipose Tissue Dysfunction, and the Associated Health Risks: Causes and Therapeutic Strategies. Metab Syndr Relat Disord. 2015;13(10):423-444. https://doi.org/10.1089/met.2015.0095.
- Дедов ИИ, Шестакова МВ, Мельниченко ГА, Мазурина НВ, Андреева ЕН, Бондаренко ИЗ и др. Междисциплинарные клинические рекомендации «Лечение ожирения и коморбидных заболеваний». Ожирение и метаболизм. 2021;18(1):5-99. https://doi.org/10.14341/omet12714.
- Бирюкова ЕВ, Маркина НВ, Арбузова МА. Эффективная и гибкая фармакотерапия ожирения сегодня - залог успешной профилактики сахарного диабета 2 типа в будущем. Сахарный диабет. 2007;10(4):23-28. https://doi.org/10.14341/2072-0351-5862.
- Valenzuela PL, Carrera-Bastos P, Castillo-García A, Lieberman DE, SantosLozano A, Lucia A. Obesity and the risk of cardiometabolic diseases. Nat Rev Cardiol. 2023;20:475-494. https://doi.org/10.1038/s41569-023-00847-5.
- Дедов ИИ, Мокрышева НГ, Мельниченко ГА, Трошина ЕА. Ожирение у взрослых: клинические рекомендации. 2024. Режим доступа: https://diseases.medelement.com/disease/ожирение-у-взрослых-кр-рф-2024/18475?ysclid=mdr0saztbl647599587.
- Цыганкова ОВ, Веретюк ВВ, Аметов АС. Инкретины сегодня: множественные эффекты и терапевтический потенциал. Сахарный диабет. 2019;22(1):70-78. https://doi.org/10.14341/DM9841.
- Marso SP, Bain SC, Consoli A, Eliaschewitz FG, Jódar E, Leiter LA et al.; SUSTAIN-6 Investigators. Semaglutide and cardiovascular outcomes in patients with type 2 diabetes. N Engl J Med. 2016;375(19):1834-1844. https://doi.org/10.1056/NEJMoa1607141.
- Blundell J, Finlayson G, Axelsen M, Flint A, Gibbons C, Kvist T, Hjerpsted JB. Effects of once-weekly semaglutide on appetite, energy intake, control of eating, food preference and body weight in subjects with obesity. Diabetes Obes Metab. 2017;19(9):1242-1251. https://doi.org/10.1111/dom.12932.
- Lincoff AM, Brown-Frandsen K, Colhoun HM, Deanfield J, Emerson SS, Esbjerg S et al.; SELECT Trial Investigators. Semaglutide and cardiovascular outcomes in obesity without diabetes. N Engl J Med. 2023;389(24):2221-2232. https://doi.org/10.1056/NEJMoa2307563.
- Birkeland KI, Bodegard J, Eriksson JW Norhammar A, Haller H, Linssen GCM et al. Heart failure and chronic kidney disease manifestation and mortality risk associations in type 2 diabetes: A large multinational cohort study. Diabetes Obes Metab. 2020;22(9):1607-1618. https://doi.org/10.1111/dom.14074.
- Wang Q, Cao H, Li P, Li C, Shi Z, Ren J. New approach to heart failure: Integrated traditional Chinese with Western medicine. Advanced Chinese Medicine. 2024;1(1):19-39. https://doi.org/10.1002/acm4.10.
- Демидова ТЮ, Измайлова МЯ, Алиева МА. Сердечно-сосудистые эффекты семаглутида: многогранные механизмы системной органопротекции. FOCUS Эндокринология. 2025;6(2):47-56. https://doi.org/10.62751/2713-0177-2025-6-2-06.
- Ferrari R, Curello SA. Pathophysiology of serve ischemic myocardial injury. Netherlands: Kluwer Academic Publishers; 1990, pp. 221-238. https://doi.org/10.1007/978-94-009-0475-0.
- Ryan DH, Lingvay I, Colhoun HM, Deanfield J, Emerson SS, Kahn SE et al. Semaglutide Effects on Cardiovascular Outcomes in People With Overweight or Obesity (SELECT) rationale and design. Am Heart J. 2020;229:61-69. https://doi.org/10.1016/j.ahj.2020.07.008.
- Kosiborod MN, Abildstrøm SZ, Borlaug BA, Butler J, Rasmussen S, Davies M et al.; STEP-HFpEF Trial Committees and Investigators. Semaglutide in Patients with Heart Failure with Preserved Ejection Fraction and Obesity. N Engl J Med. 2023;389(12):1069-1084. https://doi.org/10.1056/NEJMoa2306963.
- Kosiborod MN, Petrie MC, Borlaug BA, Butler J, Davies M, Hovingh G et al.; STEP-HFpEF DM Trial Committees and Investigators. Semaglutide in patients with obesity-related heart failure and type 2 diabetes. N Engl J Med. 2024;390(15):1394-13407. https://doi.org/10.1056/NEJMoa2313917.
- American Diabetes Association Professional Practice Committee. 9. Pharmacologic approaches to glycemic treatment: Standards of Care in Diabetes-2025. Diabetes Care. 2025;48(Suppl. 1):S181-S206. https://doi.org/10.2337/dc25-S009.
- Yaribeygi H, Maleki M, Jamialahmadi T, Sahebkar A. Anti-inflammatory benefits of semaglutide: State of the art. J Clin Transl Endocrinol. 2024;36:100340. https://doi.org/10.1016/j.jcte.2024.100340.
- Lam S. American Diabetes Association - 77th Scientific Sessions (June 9-13, 2017 - San Diego, California, USA). Drugs Today. 2017;53(7):405-413. https://doi.org/10.1358/dot.2017.53.7.2669148.
- Katsurada K, Nandi SS, Sharma NM Zheng H, Liu X, Patel KP. Does glucagon-like peptide-1 induce diuresis and natriuresis by modulating afferent renal nerve activity? Am J Physiol Renal Physiol. 2019;317(4):F1010-F1021. https://doi.org/10.1152/ajprenal.00028.2019.
- Tchang BG, Knight MG, Adelborg K, Clements JN, Iversen AT, Traina A. Effect of semaglutide 2.4 mg on use of antihypertensive and lipidlowering treatment in five randomized controlled STEP trials. Obesity. 2025;33(2):267-277. https://doi.org/10.1002/oby.24202.
- Ogbu IR, Ngwudike C, Lal K, Danielian A, Daoud SN. Role of glucagon-like peptide-1 agonist in patients undergoing percutaneous coronary intervention or coronary artery bypass grafting: A meta-analysis. Am Heart J Plus. 2021;11:100063. https://doi.org/10.1016/j.ahjo.2021.100063.
- Тарасова АП, Покровский МВ, Даниленко ЛМ. Инкретиновые пептиды: новые мишени в коррекции ишемически-реперфузионных повреждений миокарда. Курский научно-практический вестник «Человек и его здоровье». 2020;(1):29-36. https://doi.org/10.21626/vestnik/2020-1/04.
- Gallwitz B. Clinical perspectives on the use of the GIP/GLP-1 receptor agonist tirzepatide for the treatment of type-2 diabetes and obesity. Front Endocrinol. 2022;13:1004044. https://doi.org/10.3389/fendo.2022.1004044.
- Tall Bull S, Nuffer W, Trujillo JM. Tirzepatide: A novel, first-in-class, dual GIP/GLP-1 receptor agonist. J Diabetes Complications. 2022;36(12):108332. https://doi.org/10.1016/j.jdiacomp.2022.108332.
- Karagiannis T, Avgerinos I, Liakos A, Del Prato S, Matthews DR, Tsapas A, Bekiari E. Management of type 2 diabetes with the dual GIP/GLP-1 receptor agonist tirzepatide: a systematic review and meta-analysis. Diabetologia. 2022;65(8):1251-1261. https://doi.org/10.1007/s00125-022-05715-4.
- Титова ВВ, Ушанова ФО, Демидова ТЮ. Медикаментозная терапия ожирения: современные подходы и перспективы. FOCUS Эндокринология. 2024;5(4):40-48. https://doi.org/10.62751/2713-0177-2024-5-4-18.
- Jastreboff AM, Aronne LJ, Ahmad NN, Wharton S, Connery L, Alves B et al.; SURMOUNT-1 Investigators. Tirzepatide once weekly for the treatment of obesity. N Engl J Med. 2022;387(3):205-216. https://doi.org/10.1056/NEJMoa2206038.
- Garvey WT, Frias JP, Jastreboff AM, le Roux CW, Sattar N, Aizenberg D et al.; SURMOUNT-2 investigators. Tirzepatide once weekly for the treatment of obesity in people with type 2 diabetes (SURMOUNT-2): a double-blind, randomized, multicentre, placebo-controlled, phase 3 trial. Lancet. 2023;402(10402):613-626. https://doi.org/10.1016/S0140-6736(23)01200-X.
- Wadden TA, Chao AM, Machineni S, Kushner R, Ard J, Srivastava G et al. Tirzepatide after intensive lifestyle intervention in adults with overweight or obesity: the SURMOUNT-3 phase 3 trial. Nat Med. 2023;29(11):2909-2918. https://doi.org/10.1038/s41591-023-02597-w.
- Aronne LJ, Sattar N, Horn DB, Bays HE, Wharton S, Lin WY et al.; SURMOUNT-4 Investigators. Continued Treatment With Tirzepatide for Maintenance of Weight Reduction in Adults With Obesity: The SURMOUNT-4 Randomized Clinical Trial. JAMA. 2024;331(1):38-48. https://doi.org/10.1001/jama.2023.24945.
- Packer M, Zile MR, Kramer CM, Baum SJ, Litwin SE, Menon V et al.; SUMMIT Trial Study Group. Tirzepatide for Heart Failure with Preserved Ejection Fraction and Obesity. N Engl J Med. 2025;392(5):427-437. https://doi.org/10.1056/NEJMoa2410027.
- Borlaug BA, Zile MR, Kramer CM, Baum SJ, Hurt K, Litwin SE et al. Effects of tirzepatide on circulatory overload and end-organ damage in heart failure with preserved ejection fraction and obesity: a secondary analysis of the SUMMIT trial. Nat Med. 2025;31(2):544-551. https://doi.org/ 10.1038/s41591-024-3374-z.
- Taktaz F, Scisciola L, Fontanella RA, Pesapane A, Ghosh P, Franzese M et al. Evidence that tirzepatide protects against diabetes-related cardiac damages. Cardiovasc Diabetol. 2024;23(1):112. https://doi.org/10.1186/s12933-024-02203-4.
- Sattar N, McGuire DK, Pavo I, Weerakkody GJ, Nishiyama H, Wiese RJ, Zoungas S. Tirzepatide cardiovascular event risk assessment: a prespecified meta-analysis. Nat Med. 2022;28(3):591-598. https://doi.org/10.1038/s41591-022-01707-4.
- Garvey WT, Frias JP, Jastreboff AM, le Roux CW, Sattar N, Aizenberg D et al.; SURMOUNT-2 investigators. Tirzepatide once weekly for the treatment of obesity in people with type 2 diabetes (SURMOUNT-2): a double-blind, randomised, multicentre, placebo-controlled, phase 3 trial. Lancet. 2023;402(10402):613-626. https://doi.org/10.1016/S0140-6736(23)01200-X.
- Packer M, Zile MR, Kramer CM, Baum SJ, Litwin SE, Menon V et al.; SUMMIT Trial Study Group. Tirzepatide for Heart Failure with Preserved Ejection Fraction and Obesity. N Engl J Med. 2025;392(5):427-437. https://doi.org/10.1056/NEJMoa2410027.
- Borlaug BA, Zile MR, Kramer CM, Baum SJ, Hurt K, Litwin SE et al. Effects of tirzepatide on circulatory overload and end-organ damage in heart failure with preserved ejection fraction and obesity: a secondary analysis of the SUMMIT trial. Nat Med. 2025;31(2):544-551. https://doi.org/10.1038/s41591-024-03374-z.
- Mori Y, Matsui T, Hirano T, Yamagishi SI. GIP as a Potential Therapeutic Target for Atherosclerotic Cardiovascular Disease-A Systematic Review. Int J Mol Sci. 2020;21(4):1509. https://doi.org/10.3390/ijms21041509.
- Theofilis P, Sagris M, Oikonomou E, Antonopoulos AS, Siasos G, Tsioufis K, Tousoulis D. The Anti-Inflammatory Effect of Novel Antidiabetic Agents. Life. 2022;12(11):1829. https://doi.org/10.3390/life12111829.
- Liu Q, Zhu J, Kong B, Shuai W, Huang H. Tirzepatide attenuates lipopolysaccharide-induced left ventricular remodeling and dysfunction by inhibiting the TLR4/NF-kB/NLRP3 pathway. Int Immunopharmacol. 2023;120:110311. https://doi.org/10.1016/j.intimp.2023.110311.
- Fisman EZ, Tenenbaum A. The dual glucose-dependent insulinotropic polypeptide (GIP) and glucagon-like peptide-1 (GLP-1) receptor agonist tirzepatide: a novel cardiometabolic therapeutic prospect. Cardiovasc Diabetol. 2021;20(1):225. https://doi.org/10.1186/s12933-021-01412-5.
- Kido K, Carey B, Caccamo M, Bianco C, Sokos G. Call to action for drug interactions between tirzepatide and heart failure guideline-directed medical therapy. J Am Pharm Assoc. 2024;64(1):169-173. https://doi.org/10.1016/j.japh.2023.09.011.
- Kanbay M, Copur S, Siriopol D, Yildiz AB, Gaipov A, van Raalte DH, Tuttle KR. Effect of tirzepatide on blood pressure and lipids: A metaanalysis of randomized controlled trials. Diabetes Obes Metab. 2023;25(12):3766-3778. https://doi.org/10.1111/dom.15272.
- Malhotra A, Grunstein RR, Fietze I, Weaver TE, Redline S, Azarbarzin A et al.; SURMOUNT-OSA Investigators. Tirzepatide for the Treatment of Obstructive Sleep Apnea and Obesity. N Engl J Med. 2024;391(13):1193-1205. https://doi.org/10.1056/NEJMoa2404881.
- Занозина ОВ, Сорокина ЮА, Калугина ЕВ, Жук СД, Пластова НН, Тарадайко НЮ и др. Опыт применения российского препарата семаглутида в реальной клинической практике. Эффективная фармакотерапия. 2024;20(52):6-12. https://doi.org/10.33978/2307-3586-2024-20-52-6-12.
- Демидова ТЮ, Ушанова ФО, Богачева ТЛ. Семаглутид в терапии сахарного диабета 2 типа: обзор накопленных данных от идеи создания до настоящего времени. FOCUS Эндокринология. 2023;4(3):13-28. https://doi.org/10.15829/2713-0177-2023-3-11.
- Носков СМ, Арефьева АН, Банко ВВ, Радаева КС, Гефен МЛ, Арчакова ОА и др. Препарат семаглутида для лечения ожирения: результаты двух открытых рандомизированных исследований фармакокинетики. Медицинский совет. 2024;18(16):216-222. https://doi.org/10.21518/ms2024-346.
- Каронова ТЛ, Мурашева АВ., Тимкина НВ, Фукс ОС, Шляхто ЕВ и др. Сравнительное исследование нейропротективного потенциала инъекционных препаратов семаглутида при экспериментальном ишемическом инсульте. Медицинский совет. 2024;18(16):163-170. https://doi.org/10.21518/ms2024-404.
Фото:
Fantastic Studio/FOTODOM/Shutterstoсk



 1
1 2
2 3
3 4
4


Комментарии (0)