
Фото: Kmpzzz/FOTODOM/Shutterstoсk
Журнал "Медицинский совет" №15/2025
DOI: 10.21518/ms2025-391
И.Г. Пахомова, ORCID: 0000-0002-3125-6282
Национальный медицинский исследовательский центр имени В.А. Алмазова; 197341, Россия, Санкт-Петербург, ул. Аккуратова, д. 2
Абдоминальная боль (АБ) – серьезная проблема внутренних болезней и гастроэнтерологии. Точность диагностики причин АБ к началу 21 в. составляла чуть более 50%. При их выявлении врач сталкивается с определенными сложностями, т. к. необходимо исключить широкий спектр гастроэнтерологических и негастроэнтерологических заболеваний. Часто АБ протекает как спастическая. АБ как проявление синдрома раздраженного кишечника (СРК) в первую очередь связана со спазмом гладкой мускулатуры кишечника. Для СРК, хронического функционального заболевания кишечника, именно АБ является основным проявлением и может сочетаться с нарушением дефекации, изменением частоты и характера стула. Механизм формирования болевого абдоминального синдрома обусловлен нарушением взаимодействия по оси «мозг – кишечник», что приводит к изменению регуляции моторной функции кишечника и развитию висцеральной гиперчувствительности (ВГЧ). С клинической точки зрения АБ при СРК относится к висцеральной, т. е. возникающей при раздражении болевых рецепторов кишечника (ноцицепторов), расположенных в мышечной стенке. Важно отметить многокомпонентный характер интеграции ноцицептивной информации при СРК, что объясняет изменчивость восприятия и обработки АБ и, как следствие, трудности в подборе эффективной фармакотерапии. Препаратами первой линии в купировании АБ являются спазмолитики, которые снижают тонус и сократительную способность гладкой мускулатуры кишечника. Отечественный фармацевтический рынок представлен разными группами спазмолитиков, среди которых можно выделить селективные блокаторы кальциевых каналов. Представителем последних является препарат отилония бромид, широко использующийся в мире, эффективный и безопасный. Он хорошо переносится и превосходит плацебо в снижении выраженности симптомов и предотвращении рецидивов боли у пациентов с СРК. Эффективность отилония бромида обусловлена тройным механизмом действия: блокадой кальциевых каналов (купирование спазма), антагонизмом в отношении тахикиноновых рецепторов NK2 (влияние на ВГЧ) и ингибированием ацетилхолиновых мускариновых рецепторов (М3-ХР) (уменьшение кишечной секреции). Важны селективность действия и низкая абсорбция препарата в кишечнике, обуславливающие минимальное количество побочных эффектов и возможности применения отилония бромида у коморбидных пациентов.
Для цитирования: Пахомова ИГ. Абдоминальная боль как основной симптом синдрома раздраженного кишечника: обоснование выбора отилония бромида. Медицинский совет. 2025;19(15):156–162. https://doi.org/10.21518/ms2025-391.
Конфликт интересов: автор заявляет об отсутствии конфликта интересов.
Abdominal pain as the main symptom of irritable bowel syndrome: Rationale for the choice of otilonium bromide
Inna G. Pakhomova, ORCID: 0000-0002-3125-6282
Almazov National Medical Research Centre; 2, Akkuratov St., St Petersburg, 197341, Russia
Abdominal pain is a serious problem of internal medicine and gastroenterology. The accuracy of diagnosing the causes of abdominal pain by the beginning of the 21st century was slightly more than 50%. Identifying them the doctor faces certain difficulties when it is necessary to exclude a wide range of gastroenterological and non-gastroenterological diseases. Often abdominal pain occurs in a spastic form. Abdominal pain, as a manifestation of irritable bowel syndrome (IBS), is primarily associated with spasm of the smooth muscles of the intestine. IBS is a chronic functional bowel disease, for which abdominal pain is the main manifestation, and can be combined with changes in bowel movements, frequency and nature of stool. The mechanism of formation of abdominal pain syndrome is due to a disruption in the interaction along the brain-gut axis, which leads to changes in the regulation of intestinal motor function and the development of visceral hypersensitivity (VH). From a clinical point of view, abdominal pain in IBS is visceral, that is, it occurs when the pain receptors of the intestine (nociceptors) located in the muscular wall are irritated. It is important to note the multicomponent integration of nociceptive information in IBS, which explains the variability in the perception and processing of abdominal pain, and, as a result, the difficulties in selecting effective pharmacotherapy. The first-line drugs for the relief of abdominal pain are antispasmodics, which reduce the tone and contractility of the smooth muscles of the intestine. The domestic pharmaceutical market is represented by various groups of antispasmodics, among which selective calcium channel blockers can be distinguished. Representative of the latter is the drug Otilonium bromide, which is widely used throughout the world, is effective and safe, well tolerated and superior to placebo in reducing symptoms and preventing relapse of pain in patients with IBS. The effectiveness of otilonium bromide is due to a triple mechanism of action: blockade of calcium channels (relief of spasm), antagonism of tachykinone NK2 receptors (effect on HHV) and inhibition of acetylcholine muscarinic receptors (M3-ChR) (reduction of intestinal secretion). It is also important to emphasize the selectivity of action and low absorption of the drug in the intestine, which determines the minimal number of side effects and the possibility of using otilonium bromide in comorbid patients.
For citation: Pakhomova IG. Abdominal pain as the main symptom of irritable bowel syndrome: Rationale for the choice of otilonium bromide. Meditsinskiy Sovet. 2025;19(15):156–162. (In Russ.) https://doi.org/10.21518/ms2025-391.
Conflict of interest: the author declares no conflict of interest.
Введение
Абдоминальная боль (АБ) является ведущей в клинике большинства заболеваний органов пищеварения. Поскольку большинство органов пищеварения – это полые органы, механизм формирования боли в значительной степени связан с нарушением тонуса их гладкой мускулатуры с преобладанием гипертонуса. Ведущие механизмы АБ – это спазм и растяжение полого органа (спастическая АБ и дистензионная боль). Также важно подчеркнуть, что АБ является субъективным ощущением человека, при этом уровень и порог восприятия боли у всех разный. Субъективное восприятие боли обусловлено целым рядом сложных генетических факторов, поскольку один и тот же стимул может вызывать совершенно разные ощущения у пациента. Перед врачом стоит задача правильно интерпретировать АБ, понять возможный механизм ее возникновения, что будет влиять на выбор тактики ведения пациента и фармакотерапии. Сложности возникают при выявлении причин хронической АБ, что требует исключения широкого спектра гастроэнтерологических и негастроэнтерологических заболеваний [1, 2].
В клинической практике врач-терапевт или гастроэнтеролог чаще сталкивается с хронической АБ, которая часто встречается у пациентов с функциональными заболеваниями желудочно-кишечного тракта (ЖКТ), самым распространенным среди которых является синдром раздраженного кишечника (СРК). Частота встречаемости СРК широко варьирует между разными странами, что может объясняться использованием как Римских критериев III, так и Римских критериев IV, поскольку исследования проводились в разное время. В среднем распространенность СРК среди населения развитых стран, по данным систематического обзора и метаанализа, при использовании Римских критериев IV составила 3,8%, тогда как при применении Римских критериев III этот показатель был значительно выше – 9,2% [3]. Вместе с тем доля лиц, испытывающих симптомы, соответствующие СРК, вероятно, выше, однако лишь 25–30% из них обращаются за медицинской помощью [1, 4].
Особенности болевого синдрома при синдроме раздраженного кишечника
Основным клиническим проявлением СРК является АБ. Согласно Римским критериям IV, боль носит рецидивирующий характер, возникает по меньшей мере 1 раз в неделю и характеризуется следующими признаками (двумя или более) [5]:
- Связана с дефекацией.
- Связана с изменением частоты стула.
- Связана с изменением формы стула.
Данные симптомы должны отмечаться у больного на протяжении последних 3 мес. при общей продолжительности не менее 6 мес.
АБ при СРК имеет свои особенности [6, 7]:
- Боль при СРК может ощущаться в любом месте брюшной полости (живота), хотя чаще всего она возникает в нижней части живота.
- Боль может возникать вскоре после еды, при нарушении диеты и облегчаться или иногда ухудшаться после дефекации и/или отхождения газов, и данная особенность боли не всегда предсказуема. При этом характер боли и ее особенности могут меняться со временем.
- Боль часто усиливается при всплеске эмоций, на фоне нервного и физического переутомления.
- Боль не беспокоит в ночное время.
Важно отметить, что частота появления боли у пациентов с СРК может варьировать. Одни пациенты жалуются на ежедневные симптомы, другие сообщают о периодических болях с интервалом в недели и даже месяцы [8].
Для уточнения функционального характера боли необходимо исключить у пациентов так называемые «симптомы тревоги», или «красные флаги» [5]:
- при сборе жалоб и анамнеза: немотивированное уменьшение массы тела, начало заболевания в пожилом возрасте, сохранение симптомов в ночные часы (в период сна), постоянная интенсивная боль в животе как единственный и основной симптом, прогрессирование выраженности симптомов, онкология толстой кишки у родственников;
- при физикальном обследовании: лихорадка, гепато-, спленомегалия;
- при лабораторном обследовании: кровь в кале, лейкоцитоз, анемия, увеличение СОЭ, изменения биохимических показателей крови.
Патогенетические и физиологические особенности формирования абдоминальной боли при синдроме раздраженного кишечника
Выделяют 4 основных механизма формирования АБ: висцеральный, париетальный (соматический), иррадиирующий и психогенный. Висцеральная боль возникает при наличии патологических стимулов во внутренних органах (повышение давления в полом органе и растяжение его стенок и др.) и определяется порогом висцеральной чувствительности [7].
При функциональных расстройствах кишечника патогенетические механизмы формирования боли могут быть различными и носить изолированный или сочетанный характер: висцеральный генез нередко сочетается с иррадиирующим и/или психогенным механизмами [9]. Этиопатогенез СРК до сих пор изучается, несмотря на дополнения, касающиеся этиопатогенетических взаимосвязей, согласно данным Римского консенсуса IV (рисунок).
Рисунок. Этиопатогенетические взаимосвязи при функциональных нарушениях желудочно-кишечного тракта (в соответствии с Римскими критериями IV)
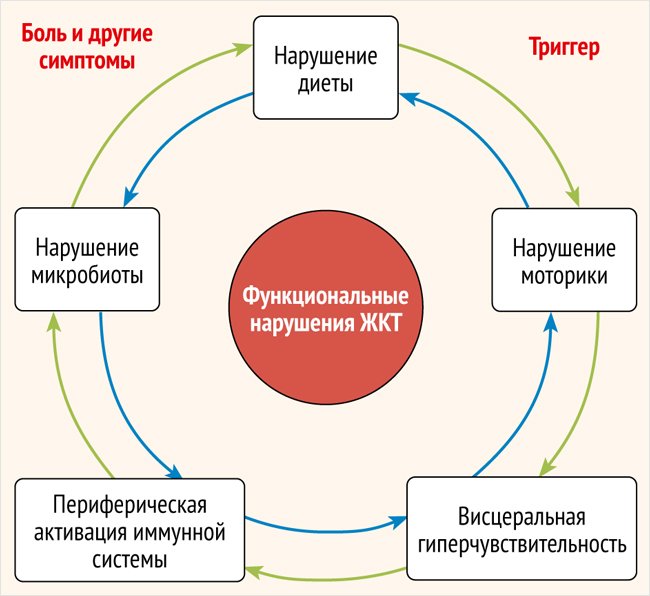
Известно, что центральная нервная регуляция, в частности ось «мозг – кишечник» (brain–gut axis), играет важную роль в функционировании кишечника как в норме, так и при патологии. С одной стороны, повторяющиеся стрессы сопровождаются моторными расстройствами кишечника, с другой – на фоне повышенной рецепторной чувствительности в кишечнике вырабатываются афферентные стимулы, достигающие по чревному и блуждающему нервам центральных подкорковых и корковых отделов центральной нервной системы (ЦНС), что, в свою очередь, приводит к изменению их функциональной деятельности [10, 11].
Особое место в формировании СРК отводится сенсорно-моторной дисфункции, в основе которой лежит изменение висцеральной чувствительности, которая в настоящее время рассматривается в качестве первичного механизма, отвечающего за возникновение и интенсивность болевого синдрома при СРК [12]. Важную роль в развитии данного механизма играют рецепторы NK2 (тахикининовые рецепторы), которые локализуются в ЖКТ и экспрессируются в клетках мышечного слоя, мышечной пластинки слизистой оболочки, в энтероцитах и иммунных клетках, а также в возбуждающих и тормозящих нейронах подслизистой оболочки и мышечного сплетения [13]. Активация рецепторов NK2 происходит в ответ на механическое растяжение кишки, что усиливает чувствительность висцеральных афферентов к раздражителям, в результате чего происходит усиление рефлекторных висцеромоторных реакций на кишечное растяжение. Также может происходить сенситизация нейронов дорсального рога спинного мозга (центральная сенситизация) и повышение уровней их спонтанной и вызванной висцеральными стимулами активности. Именно висцеральная гиперчувствительность, связанная с работой рецепторов NK2, характерна для СРК [14]. У пациентов с СРК повышена чувствительность рецепторов кишечной стенки к растяжению, что проявляется АБ и другими неприятными ощущениями при более низком пороге возбудимости.
Возникновение АБ при СРК связывают не только с усилением восприятия боли в головном мозге за счет избыточной восходящей афферентной импульсации, но также с нарушением работы антиноцицептивной системы и недостаточным нисходящим ингибированием висцеральных болевых сигналов [15–17].
В патогенезе развития АБ при СРК важную роль играет сенсибилизация периферических нервов, обусловленная субклиническим иммунным воспалением [18]. Нарушение состава кишечной микробиоты через механизм развития синдрома повышенной эпителиальной проницаемости слизистой оболочки кишечника способствует проникновению бактериальных антигенов и продуктов микробного метаболизма через слизистую оболочку кишечника с последующей активацией иммунных клеток (чаще всего с участием повышенного количества тучных клеток), запуском воспалительного каскада, раздражением афферентных нервных окончаний подслизистого нервного сплетения и возникновением АБ [19–21].
Немаловажное значение в формировании боли при СРК имеют различные биохимические посредники, представленные большим количеством (табл. 1). Висцеральные ноцицептивные сигналы, идущие от периферии к ЦНС, опосредуются действием нейротрансмиттеров, нейропептидов и цитокинов [22]. Также ряд медиаторов и их рецепторов участвуют в обработке висцеральной АБ.
Таблица 1. Биохимические посредники абдоминальной боли
| • ацетилхолиновые, • серотониновые, • каннабиноидные, • опиоидные, • GABA, • глутаматные (ионотропные и метаботропные), • глюкокортикоидные | • брадикининовые, • холецистокининовые, • цитокиновые, • лейкотриеновые, • простаноидные, • тахикининовые, • липоксигеназные | • ваниллоидные TRPV, • пуринергические P2X, • кальциевые CaV, • калиевые KV, • натриевые NaV |
Важно подчеркнуть особую роль энтеральной нервной системы (ЭНС) в регуляции основных функций кишечника [23]. Основным каналом связи ЭНС с головным мозгом является блуждающий нерв. При этом около 90% сигналов по блуждающему нерву поступают не сверху (от головного мозга), а снизу от ЭНС. Все звенья рефлекторных путей ЭНС начинаются и заканчиваются на уровне кишечника, что лежит в основе формирования своеобразных «механизмов памяти», способствующих хронизации симптомов при СРК.
Хроническая АБ при СРК зависит не только от конкретных факторов заболевания, но и от общих механизмов обработки боли, присущих мозгу, на которые в дальнейшем могут влиять психологические факторы. При этом сосуществование психологического дистресса при СРК вместе с другими патофизиологическими механизмами связано с более высокой интенсивностью симптомов [24].
Общие подходы к купированию боли при синдроме раздраженного кишечника
Согласно национальным клиническим рекомендациям по синдрому раздраженного кишечника, залогом успешного лечения СРК, прежде всего купирования АБ, является создание терапевтического союза между врачом и пациентом с общим взглядом для врача и пациента на природу симптомов заболевания и диагноз, соглашением в отношении лечебной стратегии (выбор препарата, ожидание формирования эффекта, терпение при смене лекарств, адаптация к нежелательным эффектам), соглашением в отношении границы терапевтических ресурсов [25]. Конечно, немаловажное значение в купировании боли при СРК имеет коррекция образа жизни, включая определенные физические нагрузки и диетические рекомендации. У большинства пациентов с СРК определенные продукты питания вызывают симптомы (боль) со стороны ЖКТ [26]. Примерами продуктов, вызывающих симптомы СРК, являются молочные продукты, продукты, содержащие неполностью усвоившиеся углеводы, острая и жирная пища, продукты, содержащие пшеницу, а также продукты, которые связаны с высвобождением гистамина [27]. Определенный успех у части пациентов с СРК имеет диета с низким содержанием FODMAP – группы ферментируемых (F) углеводов: олиго- (O), ди- (D) и моносахаридов (M), а также полиолов (P) (Fermentable Oligosaccharides, Disaccharides, Monosaccharides And Polyols). Этот подход включает трехэтапный процесс, при котором первоначально все содержание FODMAP выводится из организма в течение 4–6 нед. [28].
Возможные подходы к купированию АБ при СРК должны включать не только нефармакологические методы, но и применение лекарственных препаратов.
Фармакологическая коррекция боли при синдроме раздраженного кишечника: место отилония бромида
В терапии СРК важное значение имеет не только краткосрочное купирование симптомов, в первую очередь боли в животе, но и долгосрочная терапия, которая направлена на поддержание контроля над симптомами и предотвращение рецидивов. Помимо диетических вмешательств, рекомендаций по изменению образа жизни и психосоциальных стратегий, при СРК одобрен широкий спектр фармакологических методов лечения.
Препаратами первой линии в купировании болевого абдоминального синдрома при СРК являются спазмолитики [29, 30]. Эффективность данной группы препаратов в сравнении с плацебо (58 и 46% соответственно) подтверждена в метаанализе 29 исследований, в которых приняли участие 2 333 пациента. Показатель NNT (количество пациентов, которых необходимо пролечить, чтобы добиться положительного результата у одного больного) при применении спазмолитиков оказался равным 7. На российском фармацевтическом рынке представлены различные по своему механизму действия группы спазмолитиков (табл. 2).
Таблица 2. Механизм действия основных мышечных релаксантов
| Активация М-холинорецепторов мышечного волокна | М-холиноблокаторы • с воздействием на ЦНС: атропин, платифилин, метацин, гастроцепин • без воздействия на ЦНС: гиосцина бутилбромид |
| Открытие Na+-каналов и поступление Na+ в клетку | Блокаторы Na+-каналов (мебеверин, гимекромон) |
| Открытие Ca++-каналов и поступление Ca++ в клетку (из вне-/внутриклеточного депо), выход K+ из клетки | Блокаторы Ca++-каналов (отилония бромид, пинаверия бромид, альверин) |
| Активация ФДЭ, распад цАМФ, обеспечение энергией сокращения МВ | Блокаторы ФДЭ (папаверин, дротаверин) |
| Комбинированные спазмолитики | Альверин + симетикон |
| Регуляция транспорта ионов Ca++ в клетку с участием серотониновых рецепторов | Антагонисты 5-НT3-, 5-НT4-рецепторов (ондансетрон, гранисетрон и трописетрон) |
| Регуляция сокращения МВ с участием опиоидных рецепторов | Агонист мю-/дельта-/каппа-рецепторов (тримебутин) |
Примечание. ФДЭ – фосфодиэстераза; цАМФ – циклический аденозинмонофосфат; МВ – мышечные волокна.
Спазмолитики – это группа препаратов, которые десятилетиями используются для лечения СРК. Механизм действия спазмолитика обусловлен влиянием на тот или иной компонент сокращения гладкомышечной клетки, сократительная активность которой достаточно сложна. На нее оказывают влияние центральные (цефалические) рефлексы, локальные рефлексы, вызываемые растяжением полого органа и воздействием компонентов пищи, а также гуморальные факторы [31].
Как уже отмечалось выше, в основе возникновения болевого абдоминального синдрома лежит нарушение регуляции моторики ЖКТ и спастические изменения гладкомышечных волокон. Моторная функция ЖКТ определяется активностью гладкомышечных клеток, находящейся в прямой пропорциональной зависимости от концентрации цитозольного Са2+. Потенциал-зависимые кальциевые каналы являются ионными каналами, опосредующими приток кальция в ответ на деполяризацию мембраны, и они регулируют внутриклеточные процессы, такие как сокращение, секреция, нейротрансмиссия и экспрессия генов, в различных клетках. Следовательно, эффективной группой спазмолитиков для купирования боли у пациентов с СРК могут быть блокаторы Са2+-каналов, представителем которых является отилония бромид (на отечественном фармацевтическом рынке представлен препаратом Спазмомен).
Механизм действия отилония бромида комплексный и преимущественно состоит из блокирования кальциевых каналов L-типа; также отилоний связывается с мускариновыми рецепторами М1, М2, М4 и М51. Антагонизм в отношении М3-ассоциированных кальциевых сигналов в клетках крипт толстой кишки человека объясняет антисекреторное действие отилония бромида, что особенно актуально у пациентов с диарейным вариантом СРК.
Известно, что стимуляция рецепторов NK2 подавляет перистальтику кишечника, активируя экстраинтрамуральные симпатические пути или интрамуральные тормозящие компоненты нейроэндокринной системы, в то время как модуляторное воздействие на холинергические нервы или прямое воздействие на гладкую мускулатуру приводит к усилению перистальтики кишечника, опосредованному рецепторами NK2 [14]. Соответственно, селективные антагонисты рецепторов NK2 могут реактивировать подавленную моторику или снизить гипермоторику, вызванную воспалением или стрессом. Отилония бромид, являясь антагонистом рецепторов NK2, не только оказывает спазмолитическое действие, но и снижает периферическую сенсорную афферентную трансмиссию в ЦНС (т. е. влияет на висцеральную гиперчувствительность).
Как четвертичное аммониевое соединение, отилония бромид слабо абсорбируется в кишечнике и практически полностью выводится в неизмененном виде с калом. В экспериментальных исследованиях отилоний после перорального приема накапливался в кишечной стенке и проявлял минимальную системную абсорбцию.
Эффективность отилония бромида (препарат Спазмомен) в достижении контроля АБ и других симптомов СРК подтверждена в многоцентровом рандомизированном двойном слепом плацебо-контролируемом исследовании в параллельных группах OBIS [32]. В исследовании принимало участие 355 человек. Дизайн включал 2-недельный вводный период односторонне слепого применения плацебо, после чего пациенты были рандомизированы в группы лечения Спазмоменом в дозе 40 мг 3 раза в сутки перед едой или плацебо по одной таблетке перед едой в течение 15 нед. Пациенты, которые достигли «успешных результатов лечения» в конце 15-недельного периода лечения, перешли в 10-недельный период последующего наблюдения без какого-либо дополнительного лечения. В рамках данного исследования запрещалось применять препараты экстренной помощи. Согласно полученным результатам, было установлено, что и отилония бромид, и плацебо достоверно уменьшали частоту АБ в период лечения по сравнению с исходным уровнем. В конце периода лечения терапевтический эффект отилония бромида был достоверно больше, чем плацебо (первичная конечная точка исследования OBIS, p = 0,0376). К концу периода лечения отилония бромид достоверно снижал выраженность вздутия живота (р = 0,0209). Общая эффективность лечения, по мнению пациентов, значительно улучшилась в обеих группах лечения на 5-й нед. с преобладанием отилония бромида на 15-й нед. (р = 0,0473) по сравнению с плацебо.
При рассмотрении всего периода наблюдения вероятность отсутствия рецидивов была значимо выше в группе отилония бромида (p = 0,038), что может объясняться пролонгированным нахождением отилония в стенке кишки благодаря его липофильным свойствам. Побочные эффекты регистрировались редко; среди них встречались сухость во рту, тошнота и головокружение, что, вероятно, было обусловлено способностью препарата связываться с периферическими и центральными мускариновыми рецепторами. Оптимальная переносимость отилония бромида была установлена в ходе коротких и длительных клинических исследований, в рамках которых пациенты принимали препарат в течение периода от 2 нед. до 2 лет [33].
Следует отметить, что применение отилония бромида у пациентов с СРК присутствует в клинических рекомендациях различных стран мира [34–40] (табл. 3).
Таблица 3. Рекомендации по лечению болей в животе при синдроме раздраженного кишечника
| США | Отилония бромид, пинаверия бромид, гиосцина бромид, циметропия бромид, дротаверин, дицикломин, масло перечной мяты | A.C. Ford et al. [35] |
| Мексика | Мебеверин, тримебутин, бутилскополамин, гиосциамин, циметропия бромид, отилония бромид, пинаверия бромид, альверина цитрат, феноверин, роциверин, пирензепин, масло перечной мяты | R. Carmona-Sánchez et al. [36] |
| Корея | Альверина цитрат, мебеверин, отилония бромид, пинаверия бромид, масло перечной мяты, гиосцина бромид, циметропия бромид, тримебутин, флороглюцин | K.H. Song et al. [37] |
| Германия | Бутилскополамин, мебеверин, отилония бромид, масло перечной мяты | P. Layer et al. [38] |
| Польша | Масло перечной мяты, гиосцина бромид, дротаверин, отилония бромид, циметропия бромид, пинаверия бромид, дицикломин | A. Pietrzak et al. [39] |
| Испания | Отилония бромид, гиосцина бромид, циметропия бромид, пинаверия бромид, дицикломина гидрохлорид, масло перечной мяты | F. Mearin et al. [40] |
| Англия | Спазмолитики | Irritable bowel syndrome. NICE, 2017* |
* Available at: https://www.nice.org.uk/
В исследовании М.С. Хруцкой и соавт. [41] по оценке эффективности спазмолитиков у пациентов с хронической АБ было показано, что пациенты с СРК, принимавшие Спазмомен (n = 37), отмечали уменьшение АБ, метеоризма, урчания и частоты стула значительно чаще, чем те, кто принимал мебеверин и дротаверин.
В этиопатогенезе СРК важное значение имеет острая кишечная инфекция. Интересно отметить, что отилония бромид обладает также антибактериальной способностью и бактерицидной активностью против Staphylococcus aureus с минимальными ингибирующими концентрациями 4–8 мкг/ мл [42]. Отилония бромид оказывал мощное действие на биопленку при концентрациях от 16 до 64 мкг/мл. В то же время отилония бромид имел низкую тенденцию к развитию резистентности и обладал ограниченной цитотоксичностью.
Также описано и противогрибковое действие отилония бромида, которое заключается в подавлении филаментации и образования биопленки Candida albicans. Отилония бромид препятствует перемещению эргостерола через мембраны и запускает цитотоксическую аутофагию, а также нарушает нормальную локализацию белка Sip3, связываясь с белком Sec31 [43].
Профиль безопасности отилония бромида изучен. Благодаря своим специфическим фармакокинетическим свойствам, а именно практически отсутствующей системной абсорбции и быстрому накоплению в тканях-мишенях, отилония бромид эффективен и хорошо переносится [44]. Его оптимальная переносимость была установлена в ходе коротких и длительных клинических исследований, в рамках которых пациенты принимали Спазмомен в течение периода от 2 нед. до 2 лет [33].
Заключение
Таким образом, АБ при СРК является основным проявлением заболевания и часто влияет на качество жизни пациентов. Безусловно, для купирования боли при СРК необходим индивидуальный подход, включающий как фармакологические, так и нефармакологические методы терапии. Среди фармакологических методов лечения АБ терапией первой линии с учетом механизма развития данного проявления являются миотропные спазмолитики. Препаратом выбора у пациентов с СРК может быть отилония бромид (Спазмомен), который оказывает не только спазмолитическое действие через селективную блокаду Са2+-каналов L-типа, но также является антагонистом NK2-рецепторов, уменьшая тем самым проявления висцеральной гиперчувствительности, а блокада М3-ассоциированных кальциевых сигналов в клетках крипт толстой кишки (антисекреторный эффект) позволяет минимизировать проявления диареи у пациентов с СРК. При этом отилония бромид (Спазмомен) является не только эффективным, но и безопасным лекарственным средством (обладает минимальной абсорбцией), в том числе и при длительном применении.
1 Инструкция по медицинскому применению препарата Спазмомен от 14.06.2022. Режим доступа: https://berlin-chemie.ru/.
Список литературы / References
Развернуть
- Sperber AD, Bangdiwala SI, Drossman DA, Ghoshal UC, Simren M, Tack J et al. Worldwide Prevalence and Burden of Functional Gastrointestinal Disorders, Results of Rome Foundation Global Study. Gastroenterology. 2021;160(1):99–114.e3. doi: 10.1053/j.gastro.2020.04.014.
- Ивашкин ВТ, Шептулин АА. Боли в животе. М.: МЕДпресс-информ; 2012. 112 с.
- Oka P, Parr H, Barberio B, Black CJ, Savarino EV, Ford AC. Global prevalence of irritable bowel syndrome according to Rome III or IV criteria: a systematic review and meta-analysis. Lancet Gastroenterol Hepatol. 2020;5(10):908–917. doi: 10.1016/S2468-1253(20)30217-X.
- Tornkvist NT, Aziz I, Whitehead WE, Sperber AD, Palsson OS, Hreinsson JP et al. Health care utilization of individuals with Rome IV irritable bowel syndrome in the general population. United European Gastroenterol J. 2021;9(10):1178–1188. doi: 10.1002/ueg2.12153.
- Drossman DA. Functional Gastrointestinal Disorders: History, Pathophysiology, Clinical Features and Rome IV. Gastroenterology. 2016;150(6):1262–1279.e2. doi: 10.1053/j.gastro.2016.02.032.
- Nozu T, Kudaira M. Altered rectal sensory response induced by balloon distention in patients with functional abdominal pain syndrome. Biopsychosoc Med. 2009;3:13. doi: 10.1186/1751-0759-3-13.
- Шульпекова ЮВ, Ивашкин ВТ. Симптом висцеральной боли при патологии органов пищеварения. Врач. 2008;(9):12–16. Режим доступа: https://elibrary.ru/. / Shulpekova YuV, Ivashkin VT. Symptom of visceral pain in pathology of the digestive organs. Vrach. 2008;(9):12–16. (In Russ.) Available at: https://elibrary.ru/.
- Clouse RE, Mayer EA, Aziz Q, Drossman DA, Dumitrascu DL, Mönnikes H, Naliboff BD. Functional abdominal pain syndrome. Gastroenterology. 2006;130(5):1492–1497. doi: 10.1053/j.gastro.2005.11.062.
- Пахомова ИГ. Заболевания толстой кишки: от функциональных расстройств к органической патологии. Медицинский совет. 2013;(5):46–53. Режим доступа: https://www.med-sovet.pro/. / Pakhomova IG. Pathology of the colon: from functional to organic. Meditsinskiy Sovet. 2013;(5):46–53. (In Russ.) Available at: https://www.med-sovet.pro/.
- Drossman DA, Tack J, Ford AC, Szigethy E, Törnblom H, Van Oudenhove L. Neuromodulators for Functional Gastrointestinal Disorders (Disorders of Gut-Brain Interaction): A Rome Foundation Working Team Report. Gastroenterology. 2018;154(4):1140–1171.e1. doi: 10.1053/j.gastro.2017.11.279.
- Mayer EA, Labus J, Aziz Q, Tracey I, Kilpatrick L, Elsenbruch S et al. Role of brain imaging in disorders of brain-gut interaction: a Rome Working Team Report. Gut. 2019;68(9):1701–1715. doi: 10.1136/gutjnl-2019-318308.
- Simren M, Tornblom H, Palsson OS, van Tilburg MAL, Van Oudenhove L, Tack J, Whitehead WE. Visceral hypersensitivity is associated with GI symptom severity in functional GI disorders: consistent findings from five different patient cohorts. Gut. 2018;67(2):255–262. doi: 10.1136/gutjnl-2016-312361.
- Barrett J, Canning B, Coulson J, Dombrowsky E, Douglas SD, Fong TM et al. Tachykinin receptors in GtoPdb v.2023.1. IUPHAR/BPS Guide to Pharmacology CITE. 2023;2023(1). doi: 10.2218/gtopdb/F62/2023.1.
- Lecci A, Capriati A, Maggi CA. Tachykinin NK2 receptor antagonists for the treatment of irritable bowel syndrome. Br J Pharmacol. 2004;141(8):1249–1263. doi: 10.1038/sj.bjp.0705751.
- Almeida TF, Roizenblatt S, Tufik S. Afferent pain pathways: a neuroanatomical review. Brain Res. 2004;1000(1-2):40–56. doi: 10.1016/j.brainres.2003.10.073.
- Johnson AC, Greenwood-Van Meerveld B. Stress-induced pain: a target for the development of novel therapeutics. J Pharmacol Exp Ther. 2014;351(2):327–335. doi: 10.1124/jpet.114.218065.
- Гаус ОВ, Ливзан МА. СРК: что мы знаем о симптомах сегодня? Consilium Medicum. 2019;21(8):42–48. Режим доступа: https://www.elibrary.ru/. / Gaus OV, Livzan MA. Irritable bowel syndrome: what do we know about symptoms today? Consilium Medicum. 2019;21(8):42–48. (In Russ.) Available at: https://www.elibrary.ru/.
- Robles A, Perez Ingles D, Myneedu K, Deoker A, Sarosiek I, Zuckerman MJ et al. Mast cells are increased in the small intestinal mucosa of patients with irritable bowel syndrome: A systematic review and meta-analysis. Neurogastroenterol Motil. 2019;31(12):e13718. doi: 10.1111/nmo.13718.
- Kanazawa M, Hongo M, Fukudo S. Visceral hypersensitivity in irritable bowel syndrome. J Gastroenterol Hepatol. 2011;26(Suppl. 3):119–121. doi: 10.1111/j.1440-746.2011.06640.x.
- Öhman L, Törnblom H, Simrén M. Crosstalk at the mucosal border: importance of the gut microenvironment in IBS. Nat Rev Gastroenterol Hepatol. 2015;12(1):36–49. doi: 10.1038/nrgastro.2014.200.
- Bischoff SC, Barbara G, Buurman W, Ockhuizen T, Schulzke JD, Serino M et al. Intestinal permeability – a new target for disease prevention and therapy. BMC Gastroenterol. 2014;14:189. doi: 10.1186/s12876-014-0189-7.
- Moloney RD, O’Mahony SM, Dinan TG, Cryan JF. Stress-induced visceral pain: toward animal models of irritable-bowel syndrome and associated comorbidities. Front Psychiatr. 2015;6:15. doi: 10.3389/fpsyt.2015.00015.
- McCann CJ, Alves MM, Brosens E, Natarajan D, Perin S, Chapman C et al. Neuronal Development and Onset of Electrical Activity in the Human Enteric Nervous System. Gastroenterology. 2019;156(5):1483–1495.e6. doi: 10.1053/j.gastro.2018.12.020.
- Simren M, Tornblom H, Palsson OS, Van Oudenhove L, Whitehead WE, Tack J. Cumulative Effects of Psychologic Distress, Visceral Hypersensitivity, and Abnormal Transit on Patient-reported Outcomes in Irritable Bowel Syndrome. Gastroenterology. 2019;157(2):391–402.e2. doi: 10.1053/j.gastro.2019.04.019.
- Ивашкин ВТ, Шелыгин ЮА, Баранов АА, Намазова-Баранова ЛС, Ачкасов СИ, Алексеева ОП и др. Синдром раздраженного кишечника: клинические рекомендации. М.; 2024. 64 с. Режим доступа: https://cr.minzdrav.gov.ru/.
- Colomier E, Melchior C, Algera JP, Hreinsson JP, Störsrud S, Törnblom H et al. Global prevalence and burden of meal-related abdominal pain. BMC Med. 2022;20(1):71. doi: 10.1186/s12916-022-02259-7.
- Böhn L, Störsrud S, Törnblom H, Bengtsson U, Simrén M. Self-reported food-related gastrointestinal symptoms in IBS are common and associated with more severe symptoms and reduced quality of life. Am J Gastroenterol. 2013;108(5):634–641. doi: 10.1038/ajg.2013.105.
- Staudacher HM, Rossi M, Kaminski T, Dimidi E, Ralph FSE, Wilson B et al. Long-term personalized low FODMAP diet improves symptoms and maintains luminal Bifidobacteria abundance in irritable bowel syndrome. Neurogastroenterol Motil. 2022;34(4):e14241. doi: 10.1111/nmo.14241.
- Ивашкин ВТ, Маев ИВ, Шелыгин ЮА, Баранская ЕК, Белоус СС, Белоусова ЕА и др. Диагностика и лечение синдрома раздраженного кишечника (Клинические рекомендации Российской гастроэнтерологической ассоциации и Ассоциации колопроктологов России). Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2021;31(5):74–95. doi: 10.22416/1382-4376-2021-31-5-74-95. / Ivashkin VT, Maev IV, Shelygin YuA, Baranskaya EK, Belous SS, Belousova EA et al. Diagnosis and Treatment of Irritable Bowel Syndrome: Clinical Recommendations of the Russian Gastroenterological Association and Association of Coloproctologists of Russia. Russian Journal of Gastroenterology, Hepatology, Coloproctology. 2021;31(5):74–95. (In Russ.) doi: 10.22416/1382-4376-2021-31-5-74-95.
- Ruepert L, Quartero AO, de Wit NJ, van der Heijden GJ, Rubin G, Muris JW. Bulking agents, antispasmodics and antidepressants for the treatment of irritable bowel syndrome. Cochrane Database Syst Rev. 2011;2011(8):CD003460. doi: 10.1002/14651858.CD003460.pub3.
- Минушкин ОН, Елизаветина ГА, Иванова ОИ, Ардатская МД. Современная спазмолитическая терапия в практике врача-терапевта. Кремлевская медицина. Клинический вестник. 2013;(4):78–83. Режим доступа: https://kremlin-medicine.ru/. / Minushkin ON, Yelizavetina GA, Ivanova OI, Ardatskaya MD. Modern spasmolytic therapy in the therapeutist’s practice. Kremlin Medicine Journal. 2013;(4):78–83. (In Russ.) Available at: https://kremlin-medicine.ru/.
- Clavé P, Acalovschi M, Triantafillidis JK, Uspensky YP, Kalayci C, Shee V, Tack J. Randomised clinical trial: otilonium bromide improves frequency of abdominal pain, severity of distention and time to relapse in patients with irritable bowel syndrome Aliment Pharmacol Ther. 2011;34(4):432–442. doi: 10.1111/j.1365-2036.2011.04730.x.
- Glende M, Morselli-Labate AM, Battaglia G, Evangelista S. Extended analysis of a double-blind, placebo-controlled, 15-week study with otilonium bromide in irritable bowel syndrome. Eur J Gastroenterol Hepatol. 2002;14(12):1331–1338. doi: 10.1097/00042737-200212000-00008.
- Weiser T. Guideline recommendations for the treatment of abdominal pain (in irritable bowel syndrome). EFSM. 2021;1:210010. doi: 10.52778/efsm.21.0010.
- Ford AC, Moayyedi P, Chey WD, Harris LA, Lacy BE, Saito YA, Quigley EMM. American College of Gastroenterology Monograph on Management of Irritable Bowel Syndrome. Am J Gastroenterol. 2018;113(Suppl. 2):1–18. doi: 10.1038/s41395-018-0084-x.
- Carmona-Sánchez R, Icaza-Chávez ME, Bielsa-Fernández MV, Gómez-Escudero O, Bosques-Padilla F, Coss-Adame E et al. Consenso mexicano sobre el síndrome de intestino irritable. The Mexican consensus on irritable bowel syndrome. Rev Gastroenterol Mex. 2016;81(3):149–167. doi: 10.1016/j.rgmx.2016.01.004.
- Song KH, Jung HK, Kim HJ, Koo HS, Kwon YH, Shin HD et al. Clinical Practice Guidelines for Irritable Bowel Syndrome in Korea, 2017 Revised Edition. J Neurogastroenterol Motil. 2018;24(2):197–215. doi: 10.5056/jnm17145.
- Layer P, Andresen V, Pehl C, Allescher H, Bischoff SC, Classen M et al. Irritable bowel syndrome: German consensus guidelines on definition, pathophysiology and management. Z Gastroenterol. 2011;49(2):237–293. (In German) doi: 10.1055/s-0029-1245976.
- Pietrzak A, Skrzydło-Radomańska B, Mulak A, Lipiński M, Małecka-Panas E, Reguła J, Rydzewska G. Guidelines on the management of irritable bowel syndrome: In memory of Professor Witold Bartnik. Prz Gastroenterol. 2018;13(4):259–288. doi: 10.5114/pg.2018.78343.
- Mearin F, Ciriza C, Mínguez M, Rey E, Mascort JJ, Peña E et al. Clinical Practice Guideline: Irritable bowel syndrome with constipation and functional constipation in the adult. Rev Esp Enferm Dig. 2016;108(6):332–363. doi: 10.17235/reed.2016.4389/2016.
- Хруцкая МС, Семеняко СВ, Бобровская ЕИ, Парфёненко ТВ. Влияние отилония бромида на интенсивность хронической АБ. Медицинские новости. 2014;(3):59–61. Режим доступа: https://elibrary.ru/. / Khrutskaya MS, Semenyako SV, Bobrovskaya EI, Parfenenko TV. Effect of otilonium bromide on intensity of chronic abdominal pain. Meditsinskie novosti. 2014;(3):59–61. (In Russ.) Available at: https://elibrary.ru/.
- Zhou L, She P, Tan F, Li S, Zeng X, Chen L et al. Repurposing Antispasmodic Agent Otilonium Bromide for Treatment of Staphylococcus aureus Infections. Front Microbiol. 2020;11:1720. doi: 10.3389/fmicb.2020.01720.
- Zhen C, Wang L, Feng Y, Whiteway M, Hang S, Yu J et al. Otilonium Bromide Exhibits Potent Antifungal Effects by Blocking Ergosterol Plasma Membrane Localization and Triggering Cytotoxic Autophagy in Candida Albicans. Adv Sci. 2024;11(35):e2406473. doi: 10.1002/advs.202406473.
- Annaházi A, Róka R, Rosztóczy A, Wittmann T. Role of antispasmodics in the treatment of irritable bowel syndrome. World J Gastroenterol. 2014;20(20):6031–6043. doi: 10.3748/wjg.v20.i20.6031.
Фото:
Kmpzzz/FOTODOM/Shutterstoсk



 1
1 2
2 3
3 4
4


Комментарии (0)