
Фото: Denis_Komarov/FOTODOM/Shutterstoсk
Журнал "Медицинский совет" №14/2025
DOI: 10.21518/ms2025-338
М.М. Тлиш, ORCID: 0000-0001-9323-4604
М.Е. Шавилова, ORCID: 0000-0002-5776-6221
Кубанский государственный медицинский университет; 350063, Россия, Краснодар, ул. Митрофана Седина, д. 4
Возрастные изменения в организме – это сложный биологический процесс, требующий проведения исследований на стыке различных научных дисциплин. Современная наука добилась существенного прогресса в изучении молекулярных, клеточных, генетических и биохимических механизмов старения. Это позволило сформулировать концепции, описывающие влияние внешних факторов на геном и открывающие перспективы для создания методов функционального омоложения. Особое место среди них занимают исследования, направленные на изучение системы регуляции генной активности, не связанной с изменением нуклеотидной последовательности ДНК, но оказывающей существенное влияние на экспрессию генов. Данными вопросами занимается активно развивающаяся научная дисциплина – эпигенетика. Эпигеномные процессы отражают взаимодействие генотипа и фенотипа, играя ключевую роль в адаптации процессов старения в ответ на воздействие окружающей среды. При этом кожа представляет собой уникальную модель для изучения данных механизмов благодаря своей сложной структуре, постоянному обновлению и непосредственному взаимодействию с внешними факторами. В статье приводится анализ современной концепции старения кожи, в которой идея о ведущей роли наследственности сочетается с новыми научными данными о значении эпигенетической регуляции. Рассматриваются ключевые эпигенетические изменения, такие как нарушения метилирования ДНК, модификации гистонов и дисрегуляция генов, опосредованная микроРНК. Подчеркивается, что изучение механизмов влияния факторов окружающей среды на эпигеном открывает перспективы для поиска терапевтических подходов, способствующих коррекции и профилактике возрастных изменений. Описывается влияние на эпигенетические процессы старения модификации образа жизни, методов физиотерапии и различных химических соединений. Отмечено, что коррекция молекулярных механизмов старения кожи способна обеспечить устойчивый клинический эффект и представляет особый интерес в разработке косметических средств для эпигенетического ухода за кожей. Акцентировано внимание на том, что интеграция эпигенетических исследований в эстетическую дерматологию позволяет не только корректировать внешние признаки старения, но и воздействовать на их глубинные биологические механизмы.
Для цитирования: Тлиш ММ, Шавилова МЕ. Эпигенетика старения кожи: от механизмов к поиску способов коррекции. Медицинский совет. 2025;19(14):193–200. https://doi.org/10.21518/ms2025-338.
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Согласие пациентов на публикацию: пациенты подписали информированное согласие на публикацию своих данных.
Epigenetics of skin aging: from mechanisms to the search for methods of correction
Marina M. Tlish, ORCID: 0000-0001-9323-4604
Marina E. Shavilova, ORCID: 0000-0002-5776-6221
Kuban State Medical University; 4, Mitrofan Sedin St., Krasnodar, 350063, Russia
Age-related changes in the body are a complex biological process that requires research at the intersection of various scientific disciplines. Modern science has made significant progress in the study of molecular, cellular, genetic and biochemical mechanisms of aging. This has allowed us to formulate concepts that describe the influence of external factors on the genome and open up prospects for creating methods of functional rejuvenation. A special place among them is occupied by studies aimed at studying the system of regulation of gene activity that is not associated with a change in the nucleotide sequence of DNA, but has a significant impact on gene expression. These issues are addressed by an actively developing scientific discipline – epigenetics. Epigenomic processes reflect the interaction of genotype and phenotype, playing a key role in the adaptation of aging processes in response to environmental influences. At the same time, the skin is a unique model for studying these mechanisms due to its complex structure, constant renewal and direct interaction with external factors. The article provides an analysis of the modern concept of skin aging, in which the idea of the leading role of heredity is combined with new scientific data on the importance of epigenetic regulation. Key epigenetic changes, such as DNA methylation disorders, histone modifications and gene dysregulation mediated by microRNA are considered. It is emphasized that the study of the mechanisms of the influence of environmental factors on the epigenome opens up prospects for finding therapeutic approaches that contribute to the correction and prevention of age-related changes. The effect of lifestyle modification, physiotherapy methods and various chemical compounds on the epigenetic processes of aging is described. It is noted that the correction of the molecular mechanisms of skin aging can provide a sustainable clinical effect and is of particular interest in the development of cosmetics for epigenetic skin care. Attention is focused on the fact that the integration of epigenetic research into aesthetic dermatology allows not only to correct the external signs of aging, but also to influence their deep biological mechanisms.
For citation: Tlish MM, Shavilova ME. Epigenetics of skin aging: from mechanisms to the search for methods of correction. Meditsinskiy Sovet. 2025;19(14):193–200. (In Russ.) https://doi.org/10.21518/ms2025-338.
Conflict of interest: the authors declare no conflict of interest.
Basic patient privacy consent: patients signed informed consent regarding publishing their data.
Введение
Увеличение продолжительности жизни и устойчивый рост доли пожилого населения в демографической структуре общества определяют особую актуальность проблемы возрастных изменений. Старение обусловлено сложным набором биологических механизмов, характеризующихся снижением функций клеток различных тканей, что сопровождается значительным повышением риска развития нейродегенеративных и сердечно-сосудистых заболеваний, патологии обмена веществ, иммунной системы и опорно-двигательного аппарата [1]. Изменения, происходящие в организме с течением времени, представляют собой комплексный биологический процесс, требующий изучения на междисциплинарном уровне. Современные исследования уже достигли значительных успехов в понимании молекулярных, клеточных, генетических и биохимических путей, лежащих в основе возрастных изменений. При этом важной задачей становится интеграция полученных результатов в целостную систему научных знаний о процессе старения [2].
Дерматология играет особую роль в этом интегративном подходе. Кожа, являясь не только самым крупным органом человеческого тела, но и главным барьером, контактирующим с внешней средой, представляет собой уникальную модель для изучения старения. Возрастные изменения кожных покровов, включающие снижение регенеративной способности, истончение эпидермиса, ухудшение защитной функции и признаки фотостарения, служат видимыми маркерами общесоматических процессов старения [3, 4]. Известно, что данные изменения не только влияют на эстетический вид кожи, но и повышают риск развития инфекционных и воспалительных процессов [3].
Современные методы исследования старения кожи охватывают широкий спектр подходов – от гистологического анализа до молекулярно-генетических технологий, что позволяет глубже понять механизмы этого процесса.
Биологические механизмы старения
Морфологические изменения в хронологически состарившейся коже включают ряд характерных нарушений ее структуры. С возрастом в эпидермисе наблюдается уменьшение количества кератиноцитов и замедление их пролиферативной активности, что приводит к истончению рогового слоя и нарушению барьерной функции [3, 5]. Снижение синтеза липидов рогового слоя усугубляет трансэпидермальную потерю влаги, способствуя сухости и повышенной чувствительности кожи [6]. В дерме ключевые изменения связаны с деградацией внеклеточного матрикса вследствие уменьшения коллагена I и III типов, накопления в эластине структурных аномалий [7]. Фибробласты, ответственные за продукцию этих белков, снижают свою активность, что приводит к уменьшению плотности и упругости кожи. Одновременно повышается активность матриксных металлопротеиназ (англ. matrix metalloproteinases, MMPs), разрушающих коллагеновые и эластиновые волокна [8]. Нарушение дермального каркаса способствует формированию морщин и потере эластичности. Параллельно наблюдается дезорганизация волокон соединительной ткани в гиподерме, что способствует потере структурной поддержки и усугубляет возрастные изменения рельефа кожи [9]. Важную роль в старении кожи играют нарушения микроциркуляции, обусловленные редукцией капиллярной сети и уменьшением синтеза сосудорасширяющих факторов. Это явление приводит к снижению доставки кислорода и питательных веществ, замедляя процессы регенерации [7]. Кроме того, с возрастом снижается функциональная активность сальных и потовых желез, что дополнительно нарушает гидролипидный баланс и терморегуляцию кожи [5, 10].
Процесс старения регулируется сложными молекулярными механизмами, отличающимися на различных этапах жизни. Описаны многочисленные факторы, оказывающие влияние на физиологию старения и продолжительность жизни, среди которых укорочение теломер, митохондриальная дисфункция и окислительный стресс, нарушение репарации ДНК и изменения в гомеостазе белков [11–13]. В научной литературе сформировались концепции, объясняющие влияние факторов окружающей среды на геном и открывающие перспективы для создания методов функционального омоложения. Особое место среди них занимает активно развивающееся направление – эпигенетика, исследования которой направлены на изучение системы регуляции генной активности, не связанной с изменением нуклеотидной последовательности ДНК, но оказывающей существенное влияние на экспрессию генов [11, 14]. Эпигеномные механизмы отражают взаимодействие генотипа и фенотипа, играя ключевую роль в адаптации процессов старения в ответ на воздействие окружающей среды [11].
Эпигенетика старения
Эпигенетические предикторы широко применяются в качестве биомаркеров для оценки биологического возраста человека, при этом для построения многих моделей биологических часов использовались результаты геномных исследований дермальных образцов [15]. Кожа представляет собой уникальную систему для изучения эпигенетических механизмов старения благодаря своей сложной структуре, постоянному обновлению и непосредственному взаимодействию с внешними факторами. В 2013 г. S. Horvath создал модель оценки биологического возраста, работа которой была основана на анализе более 300 эпигенетических биомаркеров (последовательность «цитозин – фосфат – гуанин», CpG), полученных при изучении 8 000 образцов различных тканей и клеток, включая кожу [16]. В 2020 г. M. Boroni et al. на основе анализа 2 266 CpG-сайтов рассчитали возраст ДНК-мРНК культивируемых клеток и биоптатов кожи человека [17]. В обоих исследованиях модели строились на основе оценки изменений в паттернах процесса метилирования ДНК – наиболее изученной эпигенетической метки на данный момент [14].
Изменения метилирования ДНК, наблюдаемые при старении млекопитающих, характеризуются перестройками различного масштаба, при этом основные эпигенетические маркеры данного процесса находятся в положении С5 в составе CpG-динуклеотидов [14]. Данная ковалентная модификация ДНК катализируется консервативным классом ДНК-метилтрансфераз (англ. DNA methyltransferases, DNMT). Именно DNMT1, DNMT3A и DNMT3B добавляют метильные группы к нуклеотидам, что сопровождается подавлением генов [18, 19]. Совместная деятельность этих ферментов приводит к обширному метилированию генома. При этом известно, что все три активные ДНК-метилтрансферазы участвуют в процессах эпидермального гомеостаза. Метилирование ДНК может быть удалено ферментами транслокации TET (англ. ten-eleven translocation) [20]. Последние, являясь мишенями транскрипционных факторов, проявляют наибольшую активность в регуляторных элементах генома [21], что обусловливает высокую динамику метилирования в этих областях [22]. Поскольку регуляторные элементы содержат множественные сайты связывания транскрипционных факторов, а метилирование ДНК модулирует их взаимодействие, данный механизм объясняет эпигенетическую регуляцию экспрессии генов [22, 23]. В исследованиях показано, что гиперметилирование промоторной области, как правило, вызывает подавление генной активности, что негативно сказывается на состоянии кожи [24]. Например, возрастное гиперметилирование гена COL1A1, ответственного за выработку коллагена I типа, приводит к уменьшению его синтеза, что способствует образованию морщин и потере эластичности кожи [25].
Среди других эпигенетических механизмов старения в последние годы обсуждаются модификации гистонов и регуляция генов, опосредованная микроРНК [26].
Модификация гистонов, обусловленная ацетилированием или метилированием, играет значимую роль в регуляции структуры хроматина [25]. Ацетилирование гистонов, катализируемое ацетилтрансферазами (англ. istone acetyltransferase, HATs), способствует раскрытию хроматина, тогда как деацетилирование под действием гистоновых деацетилаз (histone deacetylases, HDACs) приводит к его конденсации и подавлению транскрипции. При фотостарении кожи увеличивается ацетилирование гистона H3 наряду со снижением экспрессии HDAC4 и HDAC11, что усиливает активность MMPs, разрушающих коллаген [27]. Установлено также, что возрастное снижение уровня деацетилазой, зависящей от НАД+ (никотинамидадениндинуклеотид), способствует повышению активности MMPs и поддержанию окислительного стресса [28]. Исследования демонстрируют, что помимо метилирования и ацетилирования гистонов важную роль в процессах старения играют их фосфорилирование и убиквитинирование. Эти модификации могут взаимодействовать с другими гистоновыми метками, образуя сложную сеть эпигенетической регуляции [11].
МикроРНК – короткие некодирующие молекулы РНК, играющие важную роль в регуляции экспрессии генов. Одна микроРНК может влиять на продукцию сотен различных белков [26, 29]. Отдельные микроРНК (например, miR-146a) регулируют экспрессию генов, модулирующих синтез коллагена и воспалительные процессы. Возрастное снижение уровня miR-146a в фибробластах ассоциировано с подавлением пролиферации и накоплением повреждений ДНК [30]. При этом метилирование ДНК и модификации гистонов оказывают существенное влияние на экспрессию микроРНК. Существует сложное двунаправленное взаимодействие между микроРНК и эпигенетической регуляцией, работающее по принципу обратной связи. Это играет важную роль в контроле таких клеточных процессов, как пролиферация, апоптоз и дифференцировка [26, 31].
Воздействие эпигенетических изменений способствует прогрессированию механизмов клеточного старения кожи. При этом клетки не только теряют способность к росту, но и претерпевают характерные фенотипические изменения, включающие перестройку хроматина, изменения метаболизма и формирование сложного провоспалительного секретома. Последний состоит из множества провоспалительных молекул – цитокинов, хемокинов, факторов роста и протеаз, которые в совокупности называются секреторным фенотипом, ассоциированным со старением (англ. Senescence-Associated Secretory Phenotype, SASP). Считается, что SASP служит ключевым фактором в формировании inflammaging (англ. inflammation – воспаление, aging – старение) – хронического, стерильного, слабовыраженного воспаления, возникающего с возрастом [32]. Стареющие клетки через SASP могут оказывать биологическое действие на соседние клетки, тем самым способствуя возрастному снижению функции тканей и развитию болезней, связанных со старением [33]. Однако в физиологическом контексте SASP оказывает не только отрицательное влияние, но и выполняет важную сигнальную роль, регулируя активность иммунных клеток. Участвуя в иммуноопосредованном разрушении стареющих клеток, SASP подавляет образование опухолей, способствует их регрессии и поддерживает ключевые процессы развития организма. SASP также ускоряет заживление ран и восстановление тканевого гомеостаза [32, 34].
Предполагается, что факторы внешней среды могут влиять на эпигенетические изменения [14]. В этом контексте описан ряд терапевтических подходов, способствующих потенциальному обращению эпигенетических возрастных изменений. Исследования подтвердили роль таких факторов, как регулярная физическая активность, соблюдение низкокалорийной диеты и поддержание стабильного циркадного ритма [35]. Несмотря на то что степень их воздействия обычно невелика, полученные результаты поддерживают концепцию, согласно которой эпигенетические механизмы обеспечивают адаптацию к изменяющимся внешним условиям [36]. Важно отметить, что эпигеном млекопитающих в целом характеризуется высокой устойчивостью [14]. Это соответствует необходимости сохранения стабильности ключевых эпигенетических процессов.
Коррекция возрастных изменений
Согласно накопленным научным данным, с помощью эстетических вмешательств возможно воздействовать на эпигенетические маркеры старения, что особенно актуально в условиях значительного роста спроса на косметологические услуги [37–39]. Экспериментальные исследования показали, что лазерные, радиочастотные и ультразвуковые технологии способны влиять на процессы метилирования ДНК [37, 40]. Лазеры, широко применяемые в дерматологической практике для коррекции поствоспалительных и возрастных изменений [37, 41], индуцируют синтез коллагена и активируют процессы клеточной регенерации. Данная методика способна снижать биологический возраст кожи, определяемый с помощью эпигенетических часов [37, 42].
В настоящее время ведется активный скрининг химических соединений с целью обнаружения антивозрастных эффектов на кожу [35, 43]. Эти вещества известны как геропротекторы – термин, впервые был использован нобелевским лауреатом И.И. Мечниковым для описания соединений, обладающих свойством «защиты от старения». В настоящее время выявлено более 200 веществ, способных замедлять возрастные изменения [35, 44]. Среди них как известные лекарственные препараты, так и соединения, находящиеся на стадии изучения. Наиболее обсуждаемыми в научных публикациях являются предшественники никотинамидадениндинуклеотида (НАД+), ингибиторы HDAC, метформин, рапамицин, ретиноиды, полисахариды, сеноморфные средства, полифенолы и фитоэстрогены.
Предшественники НАД+ включают никотинамид, никотинамидмононуклеотид и никотинамидрибозид. НАД+ является регулятором активности сиртуинов – ферментов, которые обеспечивают стабильность хроматина. НАД+ непосредственно влияет на функциональное состояние кожи, поддерживая активность рогового слоя и клеточную биоэнергетику, что препятствует старению. С возрастом уровень НАД+ в коже снижается, однако применение его предшественников способно восполнять запасы [35]. В экспериментах было показано, что предшественники НАД+ модулируют метилирование ДНК, подавляют злокачественную трансформацию клеток и замедляют старение [45]. Так, согласно накопленным данным, использование никотинамида не только защищает дермальные фибробласты от окислительного повреждения, поддерживая гликолиз и окислительное фосфорилирование, но и повышает функциональность митохондрий за счет активации сиртуин-зависимого механизма избирательной митофагии [46].
Ингибиторы HDAC (реметиностат, субероиланилид гидроксамовой кислоты), воздействуя на механизмы посттранскрипционной модификации, способны останавливать отдельные процессы клеточного цикла, а также ингибировать пролиферацию клеток, в т. ч. блокируя злокачественную дифференцировку [47]. M. Majora et al. показали, что применение субероиланилида гидроксамовой кислоты на модели мышей с мутациями, характерными для синдрома Коккейна (наследственная форма преждевременного старения), сопровождалось противовоспалительным действием, угнетением фиброза и эпидермальной гиперплазии, препятствовало потери воды и подкожного жира [47].
Метформин – гипогликемическое средство из группы бигуанидов, также проявляет геропротекторные эффекты. Обнаружено, что данный препарат может воздействовать на эпигенетические механизмы, включающие снижение активности транскрипционного ядерного фактора (nuclear factor kappa-lightchain-enhancer of activated B cells, NF-κB), метилирование гистонов и экспрессию микроРНК, что замедляет естественное и фотостарение кожи [48].
Рапамицин – иммунодепрессант, используемый после трансплантации органов, влияет на возрастную динамику метилирования ДНК [49]. Доказано, что он замедляет процесс старения кожи, способствуя увеличению концентрации коллагена VII типа, стабилизируя роговой слой и, таким образом, поддерживая барьерную функцию кожи [35, 50].
Ретиноиды (третиноин, ретинол, адапален), действуя через рецепторы ретиноевой кислоты, модулируют экспрессию генов, связанных с выработкой коллагена и обновлением клеток. Есть исследования, свидетельствующие о том, что ретиноиды также влияют на паттерны метилирования ДНК [37]. Данные препараты восстанавливают дифференцировку кератиноцитов, а в фибробластах повышают выработку коллагена, эластина, фибронектина и гликозаминогликанов, одновременно подавляя активность коллагеназы. Ретиноиды также уменьшают активность тирозиназы и синтез меланина, а их топические формы продемонстрировали многообещающие результаты в коррекции мелких морщин и увеличении толщины как эпидермального, так и дермального слоя кожи [51].
Полисахариды, особенно растительного происхождения, демонстрируют значительный потенциал в регуляции старения за счет влияния на метилирование ДНК, снижения окислительного стресса и восстановления метаболизма глюкозы [52]. Было показано, что β-глюкан – полисахарид, присутствующий в морских водорослях, злаках и грибах, – способен модулировать эпигенетические процессы, выступая в роли своеобразного тренажера для иммунных клеток. Это сопровождается активацией иммунных защитных механизмов, регулированием метилирования гистонов и изменением общего паттерна метилирования [35]. Исследования демонстрируют, что β-глюкан при большой молекулярной массе способен глубоко проникать в кожу, что клинически сопровождается сокращением морщин [35, 53].
Сеноморфные препараты – класс биологически активных соединений, специфически нацеленных на стареющие клетки. А. Zonari был проведен скрининг 1 000 пептидов с целью выявления сеноморфных (подавляющих рост стареющих клеток) молекул, среди которых пептид Pep 14 был идентифицирован как наиболее безопасный. В экспериментах на 2D- и 3D-моделях стареющей кожи было показано, что Pep 14 способствует омоложению тканей. При местном применении он увеличивал толщину эпидермиса, снижал уровень маркеров старения и воспаления, а также стимулировал пролиферацию клеток и выработку коллагена [54].
Полифенолы – группа органических веществ с антиоксидантной активностью, которые содержатся в большинстве растений. Среди полифенольных соединений с антивозрастным действием наиболее активно изучаются полифенолы чая, куркумин, флавоноиды, силимарин и виноградный ресвератрол. Их антиоксидантные свойства обусловлены способностью замедлять разрушение коллагена, возникающее при воспалительных процессах вследствие активации матриксных металлопротеиназ, цитокинов и специфических сигнальных путей (например, NF-κB). Полифенолы поддерживают действие обратной транскриптазы теломеразы человека, что защищает митохондриальные мембраны от активных форм кислорода (англ. Reactive Oxygen Species, ROS) и препятствует накоплению повреждений генетического материала [55]. В ходе исследований in vivo было установлено, что полифенольные соединения, полученные из стеблей Spatholobus suberectus, способны защищать эпидермальные кератиноциты человека за счет снижения выработки ROS и подавления фосфорилирования митоген-активируемой протеинкиназы [56].
Фитоэстрогены (например, соевые белковые изофлавоны), широко известные своими гормоноподобными эффектами, могут воздействовать на рецепторы ER-α и ER-β, модулировать конфигурации хроматина и метилирование ДНК. В исследованиях показано, что изофлавоны способствуют повышению уровня гиалуроновой кислоты, восстанавливают структуру коллагена, обладают антиоксидантным действием и стимулируют выработку белков внеклеточного матрикса [35].
Эпицеллин (дигидромирицетин) – флавоноид из листьев Ampelopsis grossedentata, который способен ингибировать активность DNMT1 (ДНК метил-трансферазы 1). DNMT1 осуществляет гиперметилирование регуляторных участков ДНК, что приводит к снижению активности генов, ответственных за обновление клеток, синтез коллагена и регенерацию. Это один из ключевых механизмов, лежащих в основе старения кожи [57]. Исследования in vitro показали, что эпицеллин снижает скорость метилирования ДНК в культивируемых кератиноцитах человека. Наружное применение эпицеллина также продемонстрировало влияние на связанное с возрастом подавление экспрессии генов in vivo. Данный эффект был зафиксирован для генов, участвующих в различных биологических процессах, что свидетельствует о его комплексном воздействии на механизмы старения кожи [58]. Таким образом, действие эпицеллина обусловлено модуляцией экспрессии генов, участвующих в процессах старения, модификацией эпигенетического метилирования ДНК и индукцией регенеративных процессов в клетках дермы и эпидермиса.
Таким образом, результаты исследований последних лет показывают, что внедрение эпигенетических подходов в дерматологию открывает новые возможности для повышения эффективности методов профилактики старения кожи. Открытие взаимосвязи процессов метилирования ДНК и модификации гистонов с экзогенными факторами позволяет создавать терапевтические стратегии, направленные на снижение негативного влияния внешней среды на процессы старения. При этом коррекция молекулярных механизмов старения кожи способна обеспечить устойчивый клинический эффект. В этом контексте особый интерес представляет эпигенетический уход за кожей как область исследований, нацеленная на создание топических средств, способных влиять на экспрессию генов с целью профилактики старения кожи [43].
В 2025 г. было проведено мультицентровое исследование в клиниках Москвы и Санкт-Петербурга по оценке эффективности наружного средства – сыворотки, содержащей эпицеллин1, в течение 8 нед. в монои комбинированной терапии в сочетании с эстетическими процедурами (таблица).
Таблица. Оценка эффективности эпигенетической сыворотки с эпицеллином. Результаты экспертной оценки через 8 нед. терапии
| Комбинированная терапия с эстетическими процедурами (БТА, RF-лифтинг, филлеры, коллагеностимуляторы) | n = 48 |
| Сыворотка идеально подходит для использования в комплексной терапии с эстетическими процедурами | 96% |
| Сыворотка улучшает видимые эффекты и результаты эстетических процедур | 92% |
| Сыворотка заметно улучшает следующие признаки возраста: | |
| • мелкие морщины | 92% |
| • тон кожи | 98% |
| • овал лица | 25% |
| • глубокие морщины | 27% |
| • упругость | 63% |
| • текстура кожи | 98% |
| • сияние | 100% |
| • гладкость | 94% |
| Монотерапия – применение сыворотки с эпицеллином 2 раза в день в сочетании с мягким очищением и защитой от солнца | n = 127 |
| Сыворотка позволяет коже выглядеть моложе, чем до ее использования | 96% |
| Сыворотка обладает сильным омолаживающим эффектом | 73% |
| Общая экспертная оценка | 45 врачей (процент врачей, которые ответили «Да») |
| Готовы рекомендовать эпигенетическую сыворотку Eucerin в сочетании с эстетическими антивозрастными процедурами | 100% |
| Готовы рекомендовать эпигенетическую сыворотку Eucerin в монотерапии в качестве антивозрастного ухода | 98% |
Исследование завершили 45 врачей и 175 пациентов. Средний возраст пациентов составил 45,8 года (25–79 лет): 66% из них имели нормальный/ комбинированный тип кожи, 27% – сухой тип кожи, 96% – II–III фототип кожи по Фитцпатрику. Протокол исследования включал самооценку пациентов и экспертную оценку врачей с заполнением опросника и фотофиксацией результатов на 1, 4 и 8-й нед. терапии (рис. 1–4).
Рисунок 1. Оценка эффективности монотерапии эпигенетической сывороткой с эпицеллином до и через 8 нед. терапии
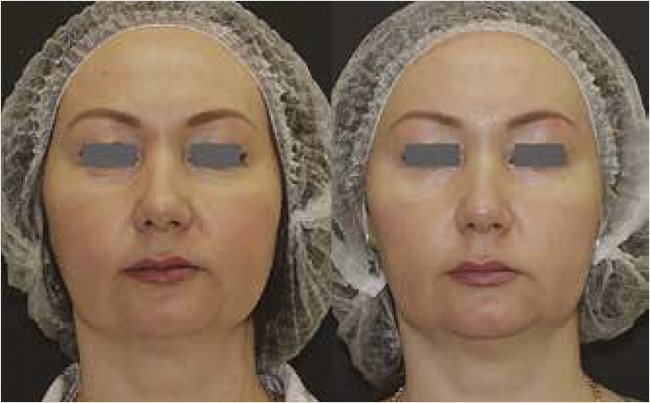
Фото предоставлено и публикуется с согласия Санчес Е.А. (г. Москва).
Рисунок 2. Оценка эффективности монотерапии эпигенетической сывороткой с эпицеллином до и через 8 нед. терапии
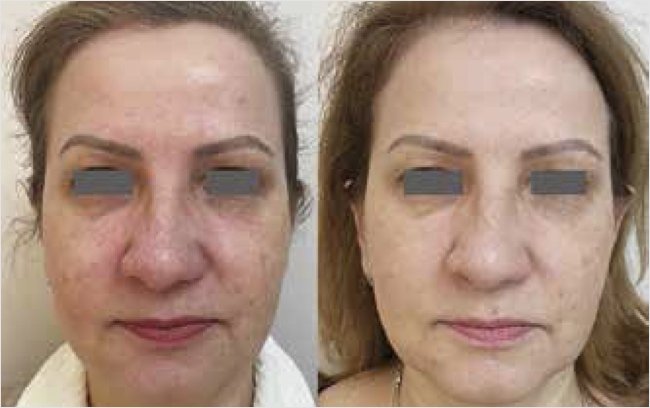
Фото предоставлено и публикуется с согласия Лапиной Е.С. (г. Санкт-Петербург).
Рисунок 3. Оценка эффективности комбинированной терапии микроигольчатым RF-лифтингом (Exion) и эпигенетической сывороткой с эпицеллином до и через 8 нед. терапии
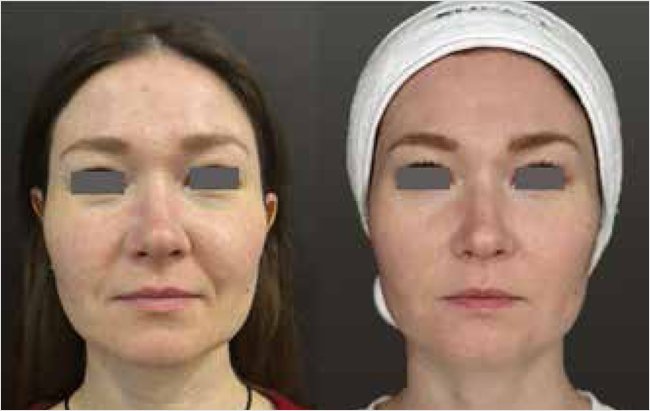
Фото предоставлено и публикуется с согласия Лемытской В.Е. (Москва).
Рисунок 4. Оценка эффективности комбинированного протокола ботулинотерапии и эпигенетической сыворотки с эпицеллином до и через 8 нед. терапии
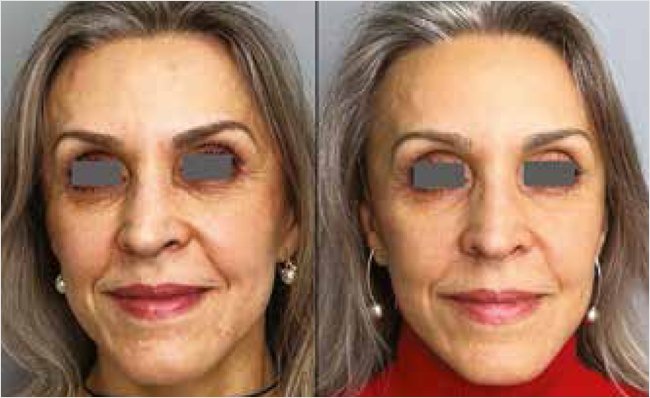
Фото предоставлено и публикуется с согласия Аглеевой И.Р. (Москва).
По результатам исследования 90% пациентов отметили очень хорошую и хорошую переносимость сыворотки, 8% оценили переносимость как нормальную, 2% как удовлетворительную. В среднем пациенты выглядели моложе, по экспертной оценке, на 2,3 года через 4 нед. и на 2,9 года через 8 нед. терапии.
По результатам исследования через 8 нед. применения сыворотка с эпицеллином значительно выравнивает тон и текстуру кожи, разглаживает мелкие морщины, придает гладкость и сияние, за счет чего позволяет пациентам выглядеть моложе.
Заключение
В современной концепции старения идея о доминирующей роли наследственности сочетается с расширением научных представлений о значимости эпигенетической регуляции. Это открывает новые возможности для объективной оценки биологического возраста и углубленного изучения фундаментальных механизмов старения на молекулярно-клеточном уровне. Эпигенетические изменения, такие как нарушение паттернов метилирования ДНК, посттрансляционные модификации гистонов и дисрегуляция некодирующих РНК, влияя на ключевые аспекты физиологии кожи, вносят существенный вклад в процесс ее старения. Понимание механизмов воздействия факторов окружающей среды на геном интенсифицирует поиск химических соединений с антивозрастным эффектом, что создает предпосылки для разработки новых методов функционального омоложения кожи, объединяющих эпигенетическую коррекцию с традиционными anti-age-технологиями. Таким образом, интеграция достижений эпигенетики в практику эстетической дерматологии позволяет вывести антивозрастные методики на новый уровень, позволяя воздействовать не только на внешние проявления возрастных изменений, но и на их биологические причины.
1 Эпигенетическая сыворотка Эуцерин (Германия). INCI: Aqua, Alcohol Denat, Butylene Glycol, Glycerin, Ricinus Communis Seed Oil, Octyldodecanol, Dibutyl Adipate, Glyceryl Stearate Citrate, Cetearyl Alcohol, Dihydromyricetin, Sodium Hyaluronate, Glycine Soja Germ Extract, Glycyrrhetinic Acid, Tocopherol, Propylheptyl Caprylate, Caprylic/Capric Triglyceride, Distarch Phosphate, Glyceryl Stearate, Lauroyl Lysine, Succinoglycan, Xanthan Gum, Gellan Gum, Diethylhexyl Syringylidenemalonate, Citric Acid, Trisodium Ethylenediamine Disuccinate, Sodium Hydroxide, Ethylhexylglycerin, Sodium Metabisulfite, Phenoxyethanol, Parfum, Epicelline, Dihydromyricetin, Succinoglycan.
Список литературы / References
Развернуть
- Guo J, Huang X, Dou L, Yan M, Shen T, Tang W, Li J. Aging and aging-related diseases: from molecular mechanisms to interventions and treatments. Sig Transduct Target Ther. 2022;7(1):391. doi: 10.1038/s41392-022-01251-0.
- Cohen AA, Ferrucci L, Fülöp T, Gravel D, Hao N, Kriete A et al. A complex systems approach to aging biology. Nat Aging. 2022;2(7):580–591. doi: 10.1038/s43587-022-00252-6.
- Agrawal R, Hu A, Bollag WB. The Skin and Inflamm-Aging. Biology. 2023;12(11):1396. doi: 10.3390/biology12111396.
- Lee H, Hong Y, Kim M. Structural and functional changes and possible molecular mechanisms in aged skin. Int J Mol Sci. 2021;22:12489. doi: 10.3390/ijms222212489.
- Arnal-Forne M, Molina-Garcia T, Ortega M, Marcos-Garces V, Molina P, Ferrandez-Izquierdo A et al. Changes in human skin composition due to intrinsic aging: a histologic and morphometric study. Histochem Cell Biol. 2024;162(4):259–271. doi: 10.1007/s00418-024-02305-w.
- Csekes E, Rackova L. Skin Aging, Cellular Senescence and Natural Polyphenols. Int J Mol Sci. 2021;22(23):12641. doi: 10.3390/ijms222312641.
- Russell-Goldman E, Murphy GF. The pathobiology of skin aging: new insights into an old dilemma. Am J Pathol. 2020;190(7):1356–1369. doi: 10.1016/j.ajpath.2020.03.007.
- Kumper M, Steinkamp J, Zigrino P. Metalloproteinases in dermal homeostasis. Am J Physiol Cell Physiol. 2022;323(4):C1290–C1303. doi: 10.1152/ajpcell.00450.2021.
- Liu M, Lu F, Feng J. Aging and homeostasis of the hypodermis in the age-related deterioration of skin function. Cell Death Dis. 2024;15:443. doi: 10.1038/s41419-024-06818-z.
- Hou X, Wei Z, Zouboulis CC, Ju Q. Aging in the sebaceous gland. Front Cell Dev Biol. 2022;10:909694. doi: 10.3389/fcell.2022.909694.
- Wang K, Liu H, Hu Q, Wang L, Liu J, Zheng Z et al. Epigenetic regulation of aging: implications for interventions of aging and diseases. Sig Transduct Target Ther. 2022;7:374. doi: 10.1038/s41392-022-01211-8.
- Cai Y, Song W, Li J, Jing Y, Liang C, Zhang L et al. The landscape of aging. Sci China Life Sci. 2022;65(12):2354–2454. doi: 10.1007/s11427-022-2161-3.
- Song S, Tchkonia T, Jiang J, Kirkland JL, Sun Y. Targeting senescent cells for a healthier aging: challenges and opportunities. Adv Sci. 2020;7(23):2002611. doi: 10.1002/advs.202002611.
- Grönniger E, Max H, Lyko F. Skin Rejuvenation by Modulation of DNA Methylation. Exp Dermatol. 2024;33(10):e70005. doi: 10.1111/exd.70005.
- Vladimir K, Perisic MM, Storga M, Mostashari A, Khanin R. Epigenetics insights from perceived facial aging. Clinical Epigenetics.2023;15(1):176. doi: 10.1186/s13148-023-01590-x.
- Horvath S. DNA methylation age of human tissues and cell types. Genome Biol. 2013;14(10):3156. doi: 10.1186/gb-2013-14-10-r115.
- Boroni M, Zonari A, Oliveira C, Alkatib K, Ochoa Cruz EA, Brace LE, Carvalho J. Highly accurate skin-specific methylome analysis algorithm as a platform to screen and validate therapeutics for healthy aging. Clin Epigenetics. 2020;12(1):1–16. doi: 10.1186/s13148-020-00899-1.
- Adhikari S, Curtis PD. DNA methyltransferases and epigenetic regulation in bacteria. FEMS Microbiology Reviews. 2016;40(5):575–591. doi: 10.1093/femsre/fuw023.
- Li Y, Zhang Z, Chen J, Liu W, Lai W, Liu B et al. Stella safeguards the oocyte methylome by preventing de novo methylation mediated by DNMT1. Nature. 2018;564:136–140. doi: 10.1038/s41586-018-0751-5.
- Verma N, Pan H, Dore LC, Shukla A, Li QV, Pelham-Webb B et al. TET proteins safeguard bivalent promoters from de novo methylation in human embryonic stem cells. Nat Genet. 2018;50:83–95. doi: 10.1038/s41588-017-0002-y.
- Ginno PA, Gaidatzis D, Feldmann A, Hoerner L, Imanci D, Burger L et al. A genome-scale map of DNA methylation turnover identifies site-specific dependencies of DNMT and TET activity. Nat Commun. 2020;11(1):2680. doi: 10.1038/s41467-020-16354-x.
- Schübeler D. Function and information content of DNA methylation. Nature. 2015;517(7534):321–326. doi: 10.1038/nature14192.
- Yin Y, Morgunova E, Jolma A, Kaasinen E, Sahu B, Khund-Sayeed S et al. Impact of cytosine methylation on DNA binding specificities of human transcription factors. Science. 2017;356(6337):eaaj2239. doi: 10.1126/science.aaj2239.
- Grönniger E, Weber B, Heil O, Peters N, Stab F, Wenck H et al. Aging and chronic sun exposure cause distinct epigenetic changes in human skin. PLoS Genetics. 2010;6(5):e1000971. doi: 10.1371/journal.pgen.1000971.
- Liamry JN, Humardani F, Chandra G, Mulyanata LT, Kok T, Irawati F et al. Exploring the impact of diabetes on aging: insights from TERT and COL1A1 methylation. Turk J Biol. 2024;48(4):257–266. doi: 10.55730/1300-0152.2701.
- Dermitzakis I, Kyriakoudi SA, Chatzianagnosti S, Chatzi D, Vakirlis E, Meditskou S et al. Epigenetics in skin homeostasis and ageing. Epigenomes. 2025;9(1):3. doi: 10.3390/epigenomes9010003.
- Shin N-H, Trang DT, Hong W-J, Kang K, Chuluuntsetseg J, Moon J-K et al. Increased histone acetylation and decreased expression of specific histone deacetylases in ultraviolet-irradiated and intrinsically aged human skin in vivo. Int J Mol Sci. 2020;21(1):260. doi: 10.3390/ijms21010260.
- Bielach-Bazyluk A, Zbroch E, Mysliwiec H, Rydzewska-Rosolowska A, Kakareko K, Flisiak I, Hryszko T. Sirtuin 1 and Skin: Implications in Intrinsic and Extrinsic Aging – A Systematic Review. Cells. 2021;10(4):813. doi: 10.3390/cells10040813.
- Reolid A, Munoz-Aceituno E, Abad-Santos F, Ovejero-Benito MC, Dauden E. Epigenetics in non-tumor immune-mediated skin diseases. Mol Diagn Ther. 2021;25(2):137–161. doi: 10.1007/s40291-020-00507-1.
- Stafa K, Rella A, Eagle W, Dong K, Morris K, Layman D et al. miR-146a is a critical target associated with multiple biological pathways of skin aging. Front Physiol. 2024;15:1291344. doi: 10.3389/fphys.2024.1291344.
- Morales S, Monzo M, Navarro A. Epigenetic regulation mechanisms of microRNA expression. Biomol Concepts. 2017;8(5-6):203–212. doi: 10.1515/bmc-2017-0024.
- Dasgupta N, Arnold R, Equey A, Gandhi A, Adams PD. The role of the dynamic epigenetic landscape in senescence: orchestrating SASP expression. npj Aging. 2024;10:48. doi: 10.1038/s41514-024-00172-2.
- Chin T, Lee XE, Ng PY, Lee Y, Dreesen O. The role of cellular senescence in skin aging and age-related skin pathologies. Front Physiol. 2023;14:1297637. doi: 10.3389/fphys.2023.1297637.
- Birch J, Gil J. Senescence and the SASP: many therapeutic avenues. Genes Dev. 2020;34:1565–1576. doi: 10.1101/gad.343129.120.
- Dal Pozzo L, Xu Z, Lin S, Wang J, Wang Y, Enechojo OS et al. Role of epigenetics in the regulation of skin aging and geroprotective intervention: a new sight. Biomed Pharmacother. 2024;174:116592. doi: 10.1016/j.biopha.2024.116592.
- Carneiro VC, Lyko F. Rapid Epigenetic Adaptation in Animals and Its Role in Invasiveness. Integr Comp Biol. 2020;60(2):267–274. doi: 10.1016/j.cell.2014.02.045.
- Haykal D, Flament F, Mora P, Balooch G, Cartier H. Unlocking Longevity in Aesthetic Dermatology: Epigenetics, Aging, and Personalized Care. Int J Dermatol. 2025. doi: 10.1111/ijd.17725.
- Тлиш ММ, Сашко МИ, Шавилова МЕ, Болтава АЮ, Псавок ФА. Отсроченное осложнение после контурной пластики губ препаратом на основе гиалуроновой кислоты: клинический случай. Consilium Medicum. 2025;27(6):333–336. doi: 10.26442/20751753.2025.6.203309. / Tlish MM, Sashko MI, Shavilova ME, Boltava AY, Psavok FA. Delayed complication after lip contour plasticity with a hyaluronic acid-based product: a case report. Consilium Medicum. 2025;27(6):333–336. (In Russ.) doi: 10.26442/20751753.2025.6.203309.
- Тлиш ММ, Сашко МИ, Шавилова МЕ, Кац ЮИ, Псавок ФА. Ботулотоксин в современной косметологической практике: от высокой эффективности к проблеме осложнений (анализ клинического наблюдения). Врач. 2024;(4):67–71. doi: 10.29296/25877305-2024-04-13. / Tlish MM, Sashko MI, Shavilova MЕ, Katz YuI, Psavok FA. Botulinum toxin in modern cosmetology practice: from high efficiency to the problem of complications (analysis of clinical observation). Vrach. 2024;(4):67–71. (In Russ.) doi: 10.29296/25877305-2024-04-13.
- Haykal D, Will F, Cartier H, Dahan S. Epigenetic Modifications and the Role of Medical Lasers in Enhancing Skin Regeneration. Int J Dermatol. 2025;24(1):16780. doi: 10.1111/jocd.16780.
- Тлиш ММ, Сашко МИ, Шавилова МЕ, Псавок ФА. Возможности комбинированного калийтитанилфосфатного и неодимового (КТР 532 нм и Nd:YAG 1064 нм) лазерного излучения в комплексной терапии акне. Лечащий врач. 2022;11(25):11–15. doi: 10.51793/OS.2022.25.11.002. / Tlish MM, Sashko MI, Shavilova ME, Psavok FA. Possibilities of combined (KTP 532 nm and Nd: YAG 1064 nm) laser radiation in complex acne therapy. Lechaschi Vrach. 2022;11(25):11–15. (In Russ.) doi: 10.51793/OS.2022.25.11.002.
- Kokikian N, Arenzo J, Gasilla J, Shahabi L, Wanagat J, Kim J, Vandiver A. 857 Fractional non-ablative laser has a divergent impact on molecular markers of aging. J Invest Dermatol. 2024;144(8):S149. doi: 10.1016/j.jid.2024.06.873.
- Minoretti P, Emanuele E. Clinically Actionable Topical Strategies for Addressing the Hallmarks of Skin Aging: A Primer for Aesthetic Medicine Practitioners. Cureus. 2024;16 (1):e52548. doi: 10.7759/cureus.52548.
- Moskalev A, Chernyagina E, de Magalhães JP, Barardo D, Thoppil H, Shaposhnikov M et al. Geroprotectors.org: a new, structured and curated database of current therapeutic interventions in aging and age-related disease. Aging. 2015;7(9):616–628. doi: 10.18632/aging.100799.
- Ummarino S, Hausman C, Gaggi G, Rinaldi L, Bassal MA, Zhang Y et al. NAD modulates DNA methylation and cell differentiation. Cells. 2021;10(11):2986. doi: 10.3390/cells10112986.
- Oblong JE. The evolving role of the NAD+/nicotinamide metabolome in skin homeostasis, cellular bioenergetics, and aging. DNA Repair. 2014;23:59–63. doi: 10.1016/j.dnarep.2014.04.005.
- Majora M, Sondenheimer K, Knechten M, Uthe I, Esser C, Schiavi A et al. HDAC inhibition improves autophagic and lysosomal function to prevent loss of subcutaneous fat in a mouse model of Cockayne syndrome. Sci Transl Med. 2018;10(456):eaam7510. doi: 10.1126/scitranslmed.aam7510.
- Gouveri E, Papanas N. Τhe endless beauty of metformin: does it also protect from skin aging? A narrative review. Adv Ther. 2023;40(4):1347–1356. doi: 10.1007/s12325-023-02434-z.
- Yin Z, Guo X, Qi Y, Li P, Liang S, Xu X, Shang X. Dietary Restriction and Rapamycin Affect Brain Aging in Mice by Attenuating Age-Related DNA Methylation Changes. Genes. 2022;13(4):699. doi: 10.3390/genes13040699.
- Chung CL, Lawrence I, Hoffman M, Elgindi D, Nadhan K, Potnis M et al. Topical rapamycin reduces markers of senescence and aging in human skin: an exploratory, prospective, randomized trial. GeroScience. 2019;41(6):861–869. doi: 10.1007/s11357-019-00113-y.
- Quan T. Human Skin Aging and the Anti-Aging Properties of Retinol. Biomolecules. 2023;13(11):1614. doi: 10.3390/biom13111614.
- Lovegrove A, Edwards CH, De Noni I, Patel H, El SN, Grassby T et al. Role of polysaccharides in food, digestion, and health. Crit Rev Food Sci Nutr. 2017;57(2):237–253. doi: 10.1080/10408398.2014.939263.
- Feng X, Shang J, Wang Y, Chen Y, Liu Y. Exploring the Properties and Application Potential of β‐Glucan in Skin Care. Food Sci Nutr. 2025;13(4):e70212. doi: 10.1002/fsn3.70212.
- Zonari A, Brace LE, Al-Katib K, Porto WF, Foyt D, Guiang M et al. Senotherapeutic peptide treatment reduces biological age and senescence burden in human skin models. NPJ Aging. 2023;9(1):10. doi: 10.1038/s41514-023-00109-1.
- Jacczak B, Rubis B, Totoń E. Potential of Naturally Derived Compounds in Telomerase and Telomere Modulation in Skin Senescence and Aging. Int J Mol Sci. 2021;22(12):6381. doi: 10.3390/ijms22126381.
- Tarwadi KV, Agte VV. Effect of micronutrients on methylglyoxal-mediated in vitro glycation of albumin. Biol Trace Elem Res. 2011;143(2):717–725. doi: 10.1007/s12011-010-8915-7.
- Raddatz G, Hagemann S, Aran D, Söhle J, Kulkarni PP, Kaderali L et al. Aging is associated with highly defined epigenetic changes in the human epidermis. Epigenetics Chromatin. 2013;6(1):36. doi: 10.1186/1756-8935-6-36.
- Falckenhayn C, Bienkowska A, Söhle J, Wegner K, Raddatz G, Kristof B et al. Identification of dihydromyricetin as a natural DNA methylation inhibitor with rejuvenating activity in human skin. Front Aging. 2024;4:1258184. doi: 10.3389/fragi.2023.1258184.
Фото:
Denis_Komarov/FOTODOM/Shutterstoсk



 1
1 2
2 3
3 4
4


Комментарии (0)