Журнал "Медицинский совет" №3/2020
DOI: 10.21518/2079-701X-2020-3-160-163
Э.Ф. Хамидуллина, e-mail: khamidullina2012@mail.ru
Л.Ю. Давидян, ORCID: 0000-0002-1049-1830, e-mail: dliana2009@mail.ru
Ульяновский государственный университет; 432017, Россия, Ульяновск, ул. Льва Толстого, д. 42
Введение. В последние годы доброкачественные опухоли матки существенно «помолодели», и все больше женщин, имеющих миому матки, пытаются выносить беременность.
Цель и задачи: проанализировать содержание гомоцистеина и тиреоидных гормонов в первом триместре беременности у женщин с миомой матки.
Материал и методы. Обследованы 182 беременные женщины, из которых основную группу составили 98 беременных с верифицированным диагнозом «миома матки», имевшим место до гестации, но не препятствующим наступлению беременности. В группу сравнения вошли 84 беременные женщины без анамнестических указаний на гинекологическую патологию и признаков фетоплацентарной недостаточности.
Результаты. Мутация C677T (Ala222Val) Т/Т у женщин с миомой матки была выявлена только в 14,3% случаев, индивидуальные показатели гомоцистеина в основной группе женщин (все 98 беременных) колебались от 3,1 до 27 мкмоль/л. В группе сравнения (без миомы матки – 84 женщины) разброс индивидуальных показателей содержания гомоцистеина регистрировался от 3,5 до 5,8 мкмоль/л, что соответствовало лабораторным нормам. Было установлено, что у 50/98 (51,1%) женщин индивидуальные уровни гомоцистеина в крови были в переделах от 16 до 27 мкмоль/л, у 48/98 (48,9%) беременных индивидуальные показатели находились в пределах референсных значений для беременных 3,1–5,0 мкмоль/л, в основной группе индивидуальные показатели ТТГ колебались от 0,9 до 4,9 мЕд/л, в группе сравнения – от 1,5 до 2,8 мЕд/л, свободного тироксина в основной группе – от 7,1 до 12,5 пмоль/л, в группе сравнения – от 14,6 до 17,2 пмоль/л, содержание Ат ТПО варьировало в основной группе от 14,3 до 65,5 Ед/мл, в группе сравнения – от 0 до 41 Ед/мл.
Заключение. У половины женщин с миомой матки, вынашивающих беременность, в начале гестации выявлена гипергомоцистеинемия в сочетании с субклиническим гипотиреозом.
Для цитирования: Хамидуллина Э.Ф., Давидян Л.Ю. Особенности течения беременности у женщин с миомой матки и гипергомоцистеинемией. Медицинский совет. 2020;(3):160–163. doi: 10.21518/2079-701X-2020-3-160-163.
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Features of the content of homocysteine and thyroid hormones in pregnant women with uterine myoma
Elmira F. Khamidullina, e-mail: khamidullina2012@mail.ru
Liana Yu. Davidyan, ORCID: 0000-0002-1049-1830, e-mail: dliana2009@mail.ru
Ulyanovsk State University; 42, L’va Tolstogo St., Ul’yanovsk, 432017, Russia
The purpose and objectives of the study is to assess the effect of hyperhomocysteinemia on the first trimester of gestation in women with uterine myoma.
Relevance. Biochemical and hormonal changes that occur in the myometrium and the body of a woman as a whole, without preventing the onset of pregnancy, can have a significant effect on the formation of the chorion and the clinical course of the gestational process, provoking complications such as miscarriage.
Material and research methods. To achieve this goal, we examined 182 pregnant women, of which the main group was 98 pregnant women with a verified diagnosis of uterine fibroids, which took place before gestation, but did not prevent pregnancy. The comparison group included 84 pregnant women without anamnestic indications of gynecological pathology and signs of fetoplacental insufficiency.
Results. We made an attempt to highlight the features of the content of homocysteine and thyroid hormones in pregnant women with uterine myoma and the influence of these indicators on the onset of gestation. Considering the results obtained, we indicate that pregnant women with uterine fibroids and without a tumor had significant differences in individual values.
Conclusions. In women with benign tumors of the uterus that are pregnant, the most common conditions in the first trimester are mild anemia and genital tract bleeding. Half of the observed pregnant women with uterine myoma have hyperhomocysteinemia and, in some of them, subclinical hypothyroidism. This must be considered when preparing for the pregnancy of these women.
For citation: Khamidullina E.F., Davidyan L.Y. Features of the content of homocysteine and thyroid hormones in pregnant women with uterine myoma. Meditsinskiy sovet = Medical Council. 2020;(3):160–163. (In Russ.) doi: 10.21518/2079-701X-2020-3-160-163.
Conflict of interest: the authors declare no conflict of interest.
Введение
Влияние гинекологической патологии на характер течения беременности достаточно широко обсуждается в литературе [1–3]. В последние годы доброкачественные опухоли матки существенно «помолодели», и все больше женщин, имеющих миому матки, пытаются выносить беременность [4]. Биохимические и гормональные изменения, происходящие в миометрии и организме женщины в целом, не препятствуя наступлению беременности, существенно влияют на формирование хориона и клиническое течение гестационного процесса, провоцируя такие осложнения, как невынашивание беременности [5, 6]. Отметим, что гипергомоцистеинемия может быть одним из патогенетических путей развития миомы матки, поскольку высокие уровни гомоцистеина, вызывая «окислительный стресс», усиливают агрегацию тромбоцитов и активируют коагуляционный каскад, ведущий к нарушению эндотелий-зависимой вазодилатации и стимуляции пролиферации гладкомышечных клеток [7], что может, в свою очередь, приводить к образованию первичного миоматозного узла. У женщин с гипергомоцистеинемией и миомой матки, вступающих в беременность, изменена активация эндотелиальных клеток, что обусловливает повышенный риск тромбозов [8]. При формировании хориона изначальное повреждение сосудистого эндотелия может привести к развитию недостаточности фето-плацентарного комплекса (как следствие – к прерыванию беременности или плацентарной недостаточности). Кроме гипергомоцистеинемии, существенное влияние на течение гестационного процесса у женщин с миомой матки оказывает состояние щитовидной железы, поскольку доказано, что на метаболизм гомоцистеина непосредственно влияют тиреоидные гормоны [9, 10]. В литературе рассматриваются два основных пути влияния тиреоидных гормонов на уровень гомоцистеина.
Во-первых, тироксин и трийодтиронин могут влиять на активность печеночных ферментов, участвующих в пути реметилирования гомоцистеина, метионинсинтазы и метилентетрагидрофолатредуктазы.
Во-вторых, низкий уровень гормонов щитовидной железы, вероятно, снижает скорость клубочковой фильтрации, что приводит к увеличению уровней креатинина и гомоцистеина даже у эутиреоидных субъектов с нормальными гормональными показателями, что также приводит к гипергомоцистеинемии.
В связи с изложенным нами была проведена попытка выделить особенности течения гестационного процесса и изменения, происходящие в организме женщины с миомой матки, развивающиеся с началом беременности.
Цель исследования: проанализировать содержание гомоцистеина и тиреоидных гормонов в первом триме- стре беременности у женщин с миомой матки.
Материал и методы. Для выполнения поставленной цели нами были обследованы 182 беременные женщины, из которых основную группу составили 98 беременных с верифицированным диагнозом «миома матки», имевшим место до гестации, но не препятствующим наступлению беременности. Группу сравнения составили 84 беременные женщины без анамнестических указаний на гинекологическую патологию. Средний возраст составил 26,3(0,3) года в основной группе и 27,1(0,5) года в группе сравнения. После проведенного обследования женщины основной группы были распределены на подгруппы: первая основная подгруппа пациенток – с миомой матки и гипергомоцистеинемией, вторая основная подгруппа – с миомой матки и без гипергомоцистеинемии. В подгруппах был проведен анализ течения гестационного процесса в первом триместре.
Обследование проводилось на клинических базах ФБГОУ ВО «Ульяновский государственный университет» с 2015 по 2019 г.
Все женщины состояли на диспансерном учете по беременности и были обследованы в соответствии с действующим приказом МЗ РФ 572 от 01.11.2012 «Об утверждении Порядка оказания медицинской помощи по профилю „акушерство и гинекология (за исключением использования вспомогательных репродуктивных технологий)“» (с изменениями и дополнениями). Дополнительно в комплекс обследований было включено исследование на гомоцистеин и метилентетрагидрофолатредуктазу (MTHFR) с выявлением мутации A1298C (Glu429Ala), что было одобрено этическим комитетом и подтверждено добровольным информированным согласием пациенток, вошедших в исследование. Отметим, что женщины, вошедшие в группы, были полностью сопоставимы по возрасту и медико-социальным критериям, за исключением наличия опухоли матки. Обработка полученных материалов осуществлялась с использованием стандартного программного пакета Statistica версии 6.0 (рус).
Результаты исследования
Клинико-лабораторные исследования состояния здоровья женщин выделенных групп в первом триместре беременности указывали на то, что у части женщин с миомой матки имела место генетическая мутация C677T (Ala222Val) Т/Т, влияющая на обмен фолатов и содержание гомоцистеина. Было установлено, что в основной группе беременных у 14/98 (14,3%) женщин была выявлена мутация C677T (Ala222Val) Т/Т, в то время как в группе сравнения генетическое снижение ферментной активности было определено только у 2/84 (2,4%) пациенток.
Вместе с тем, несмотря на то, что мутация C677T (Ala222Val) Т/Т у женщин с миомой матки была выявлена только в 14,3% случаев, индивидуальные показатели гомоцистеина в основной группе женщин (все 98 беременных) колебались от 3,1 до 27 мкмоль/л. В группе сравнения (без миомы матки – 84 женщины) разброс индивидуальных показателей содержания гомоцистеина регистрировался от 3,5 до 5,8 мкмоль/л, что соответствовало лабораторным нормам.
Что касается исследования гормонов щитовидной железы, то в основной группе индивидуальные показатели ТТГ колебались от 0,9 до 4,9 мЕд/л, в группе сравнения – от 1,5 до 2,8 мЕд/л, свободного тироксина в основной группе – от 7,1 до 12,5 пмоль/л, в группе сравнения – от 14,6 до 17,2 пмоль/л, содержание Ат ТПО варьировало в основной группе от 14,3 до 65,5 Ед/мл, в группе сравнения – от 0 до 41 Ед/мл.
Учитывая полученные данные, мы распределили всех пациенток основной группы по уровням содержания гомоцистеина. Было установлено, что у 50/98 (51,1%) женщин индивидуальные уровни гомоцистеина в крови были в переделах от 16 до 27 мкмоль/л, у 48/98 (48,9%) беременных индивидуальные показатели находились в пределах референсных значений для беременных 3,1–5,0 мкмоль/л (рис.).
Рисунок. Среднее содержание гомоцистеина у женщин основной группы (мкмоль/л)
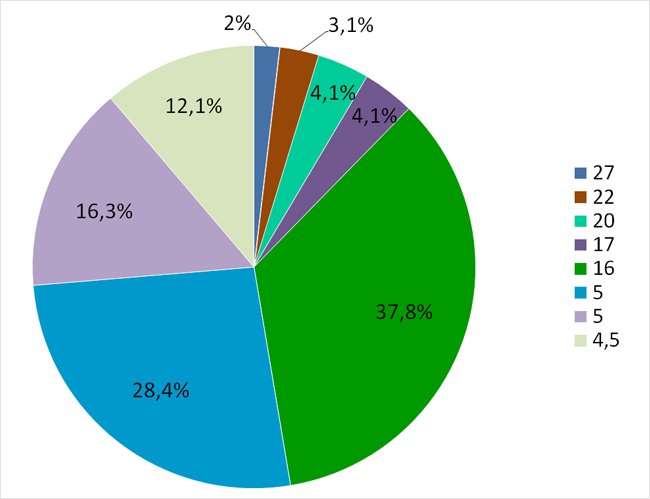
Что касается группы сравнения, то показатели гомоцистеина у всех женщин находились в физиологических пределах и не превышали 6,0 мкмоль/л.
Сопоставление индивидуальных показателей содержания тиреоидных гормонов с результатами обследования на гомоцистеин свидетельствовало о том, что почти у всех пациенток с ГГЦ имел место субклинический гипотиреоз (по заключению эндокринолога): таких женщин в основной группе было 47/98 (47,9%), в группе сравнения – только 2/84 (2,4%).
Далее нами были проанализированы патологические состояния, имевшие место у женщин сравниваемых групп в первом триместре беременности (табл.).
Таблица. Осложнения первого триместра беременности, %
| Основная группа (n = 98) | Группа сравнения (n = 84) | ||||||
| Подгруппа 1 (с ГГЦ) (n = 50) | Подгруппа 2 (без ГГЦ) (n = 48) | ||||||
| Абс. число | % | Абс. число | % | Абс. число | % | ||
| Анемия беременных: | О 99.0 | 47 | 94,0 | 3 | 6,3 | 2 | 2,3 |
| Легкой степени | 47 | 94,0 | 3 | 6,3 | 2 | 2,3 | |
| Кровотечения в ранние сроки беременности | О 20.0 | 42 | 84,0 | 15 | 31,3 | 1 | 1,2 |
| Рвота беременных легкая или умеренная | О 21.0 | 41 | 82,0 | 27 | 56,3 | 12 | 14,3 |
| Инфекции половых путей при беременности (кандидозный вульвовагинит) | О 23.5 | 43 | 86,0 | 34 | 70,9 | 7 | 8,3 |
| Нет осложнений | О 80 | – | – | 4 | 8,4 | 72 | 84,7 |
Проведенный анализ имеющихся осложнений беременности свидетельствовал о том, что у всех беременных с миомой матки и ГГЦ имелись те или иные осложнения беременности. На первом месте по частоте была анемия легкой степени 47/50 (94,0% женщин), у 42/50 (84,0%) пациенток имели место кровянистые выделения в начале беременности, связанные с угрозой прерывания беременности и частичной отслойкой плодного яйца (подтвержденного ультразвуковыми исследованиями – констатация ретрохориальной гематомы), по поводу чего все женщины получали сохраняющую терапию в условиях стационара. Ранний токсикоз легкой степени был диагностирован у 41/50 (82,0%) беременных. Кроме того, у 43/50 (86,0%) беременных был выявлен кандидозный вульвовагинит и проведено его лечение.
Что касается женщин с миомой матки без ГГЦ, то в этой подгруппе структура осложнений первого триместра беременности была несколько иной. 15/48 (31,3%) женщин получали стационарное лечение в связи с угрозой прерывания беременности. Анемия легкой степени была выявлена только у 3/48 (6,3%) женщин этой подгруппы.
В группе сравнения физиологическое начало беременности отметили 72/84 (85,7%) женщин, 12/84 (14,3%) жаловались на проявления раннего токсикоза – тошноту и однократную рвоту в начале гестации, что не требовало терапевтических вмешательств. При обследовании у 7/84 (8,3%) был выявлен кандидозный вульвовагинит.
Заключение
Таким образом, наш опыт показал, что у половины женщин с миомой матки, вынашивающих беременность, в начале гестации выявлена гипергомоцистеинемия в сочетании с субклиническим гипотиреозом. Возможно, это оказало влияние на течение беременности. Нами выявлена анемия легкой степени, кровотечения из половых путей, клинически отражающие угрозу прерывания беременности.
Полученные данные подтвердили особенности течения беременности у женщин с миомой матки.
Список литературы / References
- Агеева Л.И., Александрова Г.А., Зайченко Н.М., Кириллова Г.Н., Леонов С.А., Мухина Т.В. и др. Здравоохранение в России 2015. М.: Росстат; 2015. 174 с. Режим доступа: https://psychiatr.ru/download/2555?view=1&name=zdrav15.pdf / Ageeva L.I., Aleksandrova G.A., Zaychenko N.M., Kirillova G.N., Leonov S.A., Mukhina T.V. et al. Healthcare in Russia 2015. Moscow: Rosstat; 2015, 174 p. (In Russ.) Available at: https://psychiatr.ru/download/2555?view=1&name=zdrav15.pdf.
- Баженова Л.Г., Шрамко С.В., Сабанцев М.А., Гуляева Л.Ф. Современный взгляд на патогенез пролиферативных заболеваний матки. Российский вестник акушера-гинеколога. 2018;(6):31–40. doi: 10.17116/rosakush20181806131. / Bazhenova L.G., Shramko S.V., Sabantsev M.A., Gulyaeva L.F. Modern view on the pathogenesis of proliferative diseases of the uterus. Rossiyskiy vestnik akushera-ginekologa = Russian Bulletin of Obstetrician-Gynecologist. 2018;(6):31–40. (In Russ.) doi: 10.17116/rosakush20181806131.
- Baird D.D., Dunson D.B., David B. Why is parity protective for uterine fibroids? Epidemiology. 2003;14(2):247–250. doi: 10.1097/01.EDE.0000054360.61254.27.
- Щукина Н.А., Шеина Е.Н., Баринова И.В. Клинико-морфологические особенности миомы матки у молодых женщин. Российский вестник акушера-гинеколога. 2014;14(5):28–31. Режим доступа: https://www.mediasphera.ru/. / Shchukina N.A., Sheina E.N., Barinova I.V. Clinical and morphological features of uterine myoma in young women. Rossiyskiy vestnik akushera-ginekologa = Russian Bulletin of Obstetrician-Gynecologist. 2014,14(5):28–31. (In Russ.) Available at: https://www.mediasphera.ru/.
- Липатов И.С., Тезиков Ю.В., Кутузова О.А., Приходько А.В., Фролова Н.А., Рябова С.А. Клинико-патогенетические варианты дезадаптации беременных на ранних сроках гестации. Акушерство, гинекология и репродукция. 2017;11(1):5–13. doi: 10.17749/23137347.2017.11.1.005-013. / Lipatov I.S., Tuzikov Yu.V., Kutuzova O.A., Prikhod’ko A.V., Frolova N.A., Ryabova S.A. Clinical and pathogenetic variants of maladaptation to pregnancy at early stages of gestation. Akusherstvo, ginekologiya i reproduktsiya = Obstetrics, Gynecology and Reproduction. 2017;11(1):5–13. doi: 10.17749/23137347.2017.11.1.005-013.
- Герилович Л.А., Салмина А.Б., Егорова А.Т., Жирова Н.В. Роль гипергомоцистеинемии в реализации репродуктивных потерь и методы ее коррекции. Акушерство и гинекология. 2013;(4):84–88. Режим доступа: https://aig-journal.ru/. / Gerilovich L.A., Salmina A.B., Egorova A.T., Zhirova N.V. The role of hyperhomocysteinemia in reproductive losses and the methods of its correction. Akusherstvo i ginekologiya = Obstetrics and Gynecology. 2013;(4):84– 88. (In Russ.) Available at: https://aig-journal.ru/.
- Костюченко Г.И. Гипергомоцистеинемия: клиническое значение, возрастные особенности, диагностика и коррекция. Клиническая геронтология. 2007;(4):32–40. Режим доступа: https://elibrary.ru/item.asp?id=11018354. / Kostyuchenko G.I. Hyperhomocysteinemia: clinical significance, age cheracteristics, diagnosis and correction. Klinicheskaya gerontologiya = Clinical Gerontology. 2007;(4):32–40. (In Russ.) Available at: https://elibrary.ru/item.asp?id=11018354.
- Den Heijer M., Miranda B.A.J. Keijzer. Hyperhomocysteinemia as a risk factor for venous thrombosis. Clin Chem Lab Med. 2001;39(8):710–713. doi: 10.1515/CCLM.2001.117.
- Nair C.P., Vishwanathan G., Noronha J.M. Folate-mediated incorporation of ring-2-carbon of histidine into nucleic acids: influence of thyroid hormone. Metabolism: clinical and experimental. 1994;43(12):1575–1578. doi: 10.1016/0026-0495(94)90019-1.
- Ayav A., Alberto J.M., Barbe F., Brunaud L., Gerard P., Merten M., Gueant J.L. Defective remethylation of homocysteine is related to decreased synthesis of coenzymes B2 in thyroidectomized rats. Amino Acids. 2005;28:37–43. doi: 10.1007/s00726-004-0151-z.




 1
1 2
2 3
3 4
4


Комментарии (0)