Журнал "Медицинский совет" №10/2021
DOI: 10.21518/2079-701X-2021-10-10-20
Р.А. Якубов1, А.И. Хайрутдинов1, Ю.В. Тарасов1, Д.Х. Валиуллин1, В.Т. Якубова1, Р.Н. Комаров2, И.Н. Щаницын3, С.П. Бажанов3
1 Больница скорой медицинской помощи; 423803, Россия, Республика Татарстан, Набережные Челны, Набережночелнинский проспект, д. 18
2 Институт клинической медицины имени Н.В. Склифосовского Первого Московского государственного медицинского университета имени И.М. Сеченова (Сеченовский Университет); 119435, Россия, Москва, ул. Большая Пироговская, д. 6, стр. 1
3 Научно-исследовательский институт травматологии, ортопедии и нейрохирургии Саратовского государственного медицинского университета имени В.И. Разумовского; 410012, Россия, Саратов, ул. Чернышевского, д. 148
Введение. В настоящее время каротидная эндартерэктомия (КЭЭ) рекомендуется в сроки до 14 дней после неинвалидизирующего инсульта с целью профилактики повторного инсульта.
Цель. Сравнить непосредственные и отдаленные (1 год) результаты ранней (до 30 дней) и отсроченной (30–180 дней) КЭЭ у больных, перенесших инсульт с различной степенью его тяжести. Материалы и методы. В исследование включены 88 пациентов, перенесших КЭЭ в ранний период (1-я группа), и 88 пациентов, перенесших КЭЭ в поздний период (2-я группа). Оценивали первичные конечные точки: ипсилатеральный инсульт, инфаркт миокарда, 30-дневную летальность, 30- дневную летальность после операции и любой инсульт или инфаркт (MACE). Вторичные конечные точки: те же показатели через 1 год после операции, а также послеоперационные местные и системные осложнения, рестеноз, изменения неврологического и когнитивного статуса. Результаты. В сроки до 30 дней ипсилатеральный инсульт наблюдался у 3 пациентов в группе 1 (3,4%), в одном случае он был летальным (1,1%). В течение 12 мес. прослежено 170 из 176 пациентов (96%). Отмечен один летальный инсульт в группе 2 (1,1%). По результатам лечения в раннем и отдаленном периоде группы статистически значимо не различались. В группе 1 выявлено значимое уменьшение выраженности инвалидности (по шкале mRS) при выписке и через год после операции.
Выводы. Не выявлено различий в послеоперационной 30-дневной и отдаленной летальности, в развитии инсульта или инфаркта миокарда при ранней и отсроченной КЭЭ, что подтверждает целесообразность раннего выполнения КЭЭ. Через год после операции значимое улучшение неврологического статуса по шкале mRS отмечено только в группе ранних операций.
Для цитирования: Якубов Р.А., Хайрутдинов А.И., Тарасов Ю.В., Валиуллин Д.Х., Якубова В.Т., Комаров Р.Н., Щаницын И.Н., Бажанов С.П. Эффективность и безопасность каротидной эндартерэктомии в остром периоде ишемического инсульта. Медицинский совет. 2021;(10):10–20. https://doi.org/10.21518/2079-701X-2021-10-10-20
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Efficacy and safety of carotid endarterectomy in the acute phase of ischemic stroke
Ramis A. Yakubov1, Artur I. Khayrutdinov1, Yuriy V. Tarasov1, Damir Kh. Valiullin1, Venera T. Yakubova1, Roman N. Komarov2, Ivan N. Shchanitsyn3, Sergey P. Bazhanov
1 Regional Emergency Medical Center; 18, Naberezhnochelninskiy Prospekt, Naberezhnye Chelny, the Republic of Tatarstan, 423803, Russia
2 Sklifosovsky Institute of Clinical Medicine, Sechenov First Moscow State Medical University of the Ministry of Health of the Russian Federation (Sechenov University); 6, Bldg. 1, B. Pirogovskaya St., Moscow, 119991, Russia
3 Research Institute of Traumatology, Orthopedics and Neurosurgery, Saratov State Medical University named after V. I. Razumovsky; 148, Chernyshevskogo St., Saratov, 410012, Russia
Introduction. Nowadays it’s recommended to perform carotid endarterectomy (CEA) in up to 14 days after nondisabling stroke; the procedure is aimed at the prevention of recurrent stroke. The objective of this research was the comparison of short-term and long-term (12 months) outcomes with early (in up to 30 days) and delayed (30-180 days) CEA in patients who suffered strokes of various severities.
Materials and methods. The research involved 88 patients who underwent CEA in the early stage (Group 1) and 88 patients who underwent CEA in their late period (Group 2). We assessed primary endpoints: ipsilateral stroke, myocardial infarction, 30-day lethality, 30-day lethality after the surgery, any stroke or infarction (MACE). Secondary endpoints: the same parameters within 12 months after the surgery, post-surgery local or systemic complications, restenosis, changes in neurologic or cognitive status. Results. In 30 days we observed ipsilateral strokes in 3 patients in Group 1 (3.4 percent), it was lethal in 1 patient (1.1 percent). 170 of 176 (96 percent) patients were followed up for 12 months. One lethal stroke was registered in the group of late interventions (1.1 percent). No statistically significant differences were observed between the outcomes in early and late treatment groups. The severity of disability (mRS) in patients of the early intervention group was significantly smaller at discharge and in 12 months after surgery.
Conclusion. The advisability of early CEA performance was proven by the absence of differences in post-surgery 30-day and longterm lethality as well as the progress of stroke or infarction with early or late CEA. In 12 months after the surgeries, significant improvement in neurologic status by mRS was only observed in the group of early interventions.
For citation: Yakubov R.A., Khayrutdinov A.I., Tarasov Yu.V., Valiullin D.Kh., Yakubova V.T., Komarov R.N., Shchanitsyn I.N., Bazhanov S.P. Efficacy and safety of carotid endarterectomy in the acute phase of ischemic stroke. Meditsinskiy sovet = Medical Council. 2021;(10):10–20. (In Russ.) https://doi.org/10.21518/2079-701X-2021-10-10-20.
Conflict of interest: the authors declare no conflict of interest.
Введение
В настоящий момент после малого инсульта при атеросклеротическом поражении сонной артерии рекомендуется выполнение каротидной эндартерэктомии (КЭЭ) в сроки до 14 дней (модифицированная шкала Рэнкин, mRS ≤ 3) и в ближайшие дни после транзиторной ишемической атаки (ТИА) при отсутствии противопоказаний (уровень доказательности IIb) [1, 2]. Не установлено четкой целесообразности экстренной (первые часы после инсульта) или неотложной (первые 2 суток после инсульта) КЭЭ или КС (каротидное стентирование) после малого инсульта [1]. Кроме того, мало исследований посвящено ранним операциям при умеренном и тяжелом неврологическом дефиците [1]. В российских национальных рекомендациях нет информации о времени операции при нестабильном течении (повторные ТИА, инсульт «в развитии»), а для больших инсультов рекомендована выжидательная тактика, с проведением операции через 6–8 нед. после инсульта [2]. Тем не менее в России в настоящее время даже при ТИА и малых инсультах КЭЭ проводится в более поздние сроки. В ежегодных отчетах Российского общества ангиологов и сосудистых хирургов не уделяется внимания срокам выполнения КЭЭ и КС после инсульта, поэтому нельзя объективно оценить сроки операций в России [3].
В странах Европы и в США отмечается постепенное снижение сроков выполнения КЭЭ после ишемического инсульта. Исследования 1960–1970-х годов показали высокую частоту геморрагических инсультов после ранних операций [4]. Долгое время считалось, что КЭЭ безопасно выполнять через 3–6 мес. после инсульта. После исследований NASCET, ECST, VA в конце XX века рекомендации изменились в сторону более ранних операций (через 6 нед. после инсульта) [4]. Существенное изменение подхода к времени выполнения операции произошло после публикации Rothwell et al. в 2004 г. обобщенного анализа исследований ECST и NASCET [5]. Авторы выявили значимое преимущество выполнения КЭЭ в течение 14 дней после инсульта. В ряде крупных исследований показано, что риск развития инсульта в период ожидания операции после ТИА и малого инсульта составляет 11–26% [5, 6]. С 2006–2007 гг. изменились рекомендации Американского и Европейского обществ сердечно-сосудистых хирургов. И в дальнейшем наблюдается тренд снижения медианы времени операции после инсульта с 2005 г. по 2013 г. с 25 до 6 дней [7]. Большое количество исследований, опубликованных за последнее десятилетие, подтвердили безопасность КЭЭ при ТИА и малом инсульте в случае выполнения операций до 14 дней [8], до 7 дней [9] и даже до 2 суток после инсульта при тщательном отборе пациентов [6, 10]. Однако практически все исследования включали в себя только ТИА и малые инсульты, совсем мало опубликовано данных по результатам ранних операций при большом инсульте и особенно при тяжелом (mRS ≥ 3), инсульте «в развитии», повторных ТИА [6, 11].
Цель исследования. Сравнение результатов КЭЭ, выполненных в раннем (1–14 дней и 15–30 дней) и отсроченном (30–180 дней) периодах, у стабильных пациентов после инсульта разной степени тяжести (mRS 0–4).
Материалы и методы
В исследование были включены последовательно пролеченные после КЭЭ за 10-летний период с января 2009 г. по декабрь 2019 г. Данные пациентов включались в базу данных, и в дальнейшем был проведен ретроспективный анализ. Все пациенты дали свое информированное согласие на участие в исследовании. Критерием включения в исследование был перенесенный в течение 6 мес. инсульт, стеноз внутренней сонной артерии (ВСА) более 50% (NASCET). Критериями исключения были: возраст <18 лет и >85 лет; бессимптомный стеноз ВСА и перенесенный инсульт более 6 мес.; ТИА; тяжелый инвалидизирующий инсульт (NIHSS > 22, mRS > 4); обширный инсульт по данным МРТ и КТ (по шкале ASPECTS < 6, зона ишемии более «одной трети» бассейна васкуляризации средней мозговой артерии по данным КТ или МРТ); инфаркт головного мозга с геморрагическим компонентом; геморрагический инсульт в течение последних 6 мес.; инсульт, манифестирующий эпилептическими припадками; ранее перенесенный инсульт с выраженными остаточными нарушениями (mRS > 2); другие заболевания центральной нервной системы с выраженными неврологическими нарушениями (опухоль, травма, артериовенозные мальформации и аневризмы интракраниальных сосудов, демиелинизирующие заболевания); сопутствующая выраженная кардиальная патология (инфаркт миокарда в течение 1 мес.) или полиорганная недостаточность (ASA > 4); операции по поводу рестеноза, аневризмы и патологической извитости внутренней сонной артерии, по поводу стеноза менее 50% с изъязвленной бляшкой и окклюзии ипсилатеральной ВСА и средней мозговой артерии; каротидное стентирование. Всего за 10 лет выполнено более 1 200 открытых операций по поводу стеноза ВСА. Из них 693 операций у пациентов с инсультом или ТИА. Начиная с 2009 г. отмечается увеличение количества «ранних операций» (до 30 дней после инсульта). В 2009 г. частота ранних операций составляла лишь 6,5%, в 2019 г. – уже 19,7% (p = 0,061, точный критерий Фишера).
В итоге в группу «ранние операции» (сроки операции от 0 до 30 дней после инсульта) было включено 88 пациентов (группа 1). К каждому представителю основной группы случайным образом был подобран один «контроль» того же пола и возраста, оперированный в этот же год в сроки от 30 до 180 дней после инсульта. Группу контроля составили 88 пациентов (группа 2). Кроме того, группу ранних операций разделили на две подгруппы:
1А-группа – пациенты, которым КЭЭ выполнена в сроки от 0 до 14 дней после инсульта (24 пациента), 1Б-группа – от 15 до 30 дней (64 пациента).
Оценивали первичные конечные точки: ипсилатеральный инсульт, инфаркт миокарда, 30-дневную летальность, а также комбинированный показатель (MACE):
30-дневную летальность после операции, любой инсульт или инфаркт. В качестве вторичных конечных точек использовали те же показатели через 1 год, послеоперационные местные (гематома, периферическая нейропатия) и системные (почечная недостаточность, легочная недостаточность, пневмония, инфекция мочевыводящих путей), осложнения, рестеноз.
Перед операцией оценивали сопутствующую патологию, индекс коморбидности Charlson и анестезиологический риск по классификации Американского общества анестезиологов (ASA). Неврологический статус оценивался при поступлении, после операции и через 12 мес. после операции. По шкале тяжести инсульта NIHSS 0–5 баллов расценивали как малый инсульт, 6–15 баллов как умеренный, более 15 баллов как большой инсульт. По шкале инвалидности mRS 0–2 балла расценивали как малый инсульт, 3–5 баллов как большой инсульт. По данным УЗИ оценивали степень и протяженность стеноза сонной артерии (NASCET). По данным МРТ и КТ – расположение и размер очага инфаркта по его максимальному диаметру (в мм). Объем инфаркта оценивали по формуле расчета объема усеченного эллипса:
V = π/6 x (A x B x C), где A, B и C – три размера очага в разных плоскостях. Признаками большого очага считали максимальный диаметр более 30 мм и объем более 4000 мм³. Также оценивали по шкале ASPECTS степень поражения головного мозга.
Хирургическое лечение проводилось под эндотрахеальным наркозом. Для нейромониторинга исследовали церебральную оксиметрию (ЦО) (оксиметр Equanox) и характер ретроградного кровотока. При снижении ЦО на 20% или в абсолютных значениях ниже 45% применяли временное внутрипросветное шунтирование.
При сравнении групп применяли методы непараметрической статистики: U-критерий Манна – Уитни (двусторонний тест), критерий Хи-квадрат (точный критерий Фишера при частоте наблюдений менее 5, двусторонний тест), критерий знаковых рангов Вилкоксона и Q-критерий Кохрена для связанных выборок. Для оценки отношения шансов развития осложнений проводилась проверка нулевой статистической гипотезы о равенстве частот в зависимости от времени операции. Применялся анализ таблиц сопряженности 2 х 2 при помощи точного критерия Фишера. Для всех используемых методов оценивали двустороннюю значимость (р < 0,05).
Результаты
Предоперационные данные пациентов в группах ранних и поздних операций представлены в табл. 1. Группы не различались по основным параметрам. Медиана времени после перенесенного инсульта до хирургического лечения в 1-й группе составила 20 дней (квартили, 14–25), во 2-й группе – 61 день (44–165). В подгруппе 1А – 12 (10–14), в подгруппе 1Б–22 дня (19–26). В группе 1 среди сопутствующей патологии чаще встречались артериальная гипертензия, стенокардия напряжения и ХСН. Однако по шкале риска ASA и индексу коморбидности Charlson группы не различались.
Таблица 1. Предоперационные данные пациентов в группах ранних и поздних операций
Медиана времени после инсульта, Me (квартили), дни | 12 (10–14) | 22 (19–26) | 20 (14–25) | 61 (44–165) | 0,035 |
Возраст, Me (квартили) | 64 (57–71) | 65 (60–72) | 65 (60–71) | 66 (60–72) | 0,813 |
Пол (мужской), n (%) | 18 (75) | 51 (80) | 69 (78) | 71 (81) | 0,852 |
ИМТ, Me (квартили) | 25 (23–29) | 27 (25–30) | 27 (24–30) | 27 (24–31) | 0,414 |
Ожирение (ИМТ > 30 кг/м2) | 6 (25) | 17 (27) | 23 (26) | 29 (33) | 0,409 |
Артериальная гипертензия 3-й ст | 15 (62) | 46 (72) | 61 (69) | 28 (32) | <0,001 |
ИБС, n (%) | 15 (62) | 28 (44) | 43 (49) | 62 (70) | 0,007 |
ПИКС, n (%) | 0 | 4 (6) | 4 (4) | 8 (9) | 0,371 |
ХСН, n(%) | 16 (66) | 24 (37) | 40 (45) | 62 (70) | 0,001 |
Нарушение ритма сердца n (%) | 1 (4) | 5 (8) | 6 (7) | 3 (3) | 0,496 |
Сахарный диабет, n (%) | 3 (12) | 9 (14) | 12 (14) | 10 (11) | 0,82 |
ХОБЛ, n (%) | 2 (8) | 9 (14) | 11 (12) | 6 (7) | 0,307 |
ХБП, n (%) | 1 (4) | 1 (2) | 2 (2) | 2 (2) | 0,69 |
Атеросклероз артерий н/к | 0 | 2 (3) | 2 (2) | 0 | 0,252 |
Аневризма аорты, n (% | 1 (4) | 0 | 1 (4) | 0 | |
Расслоение аорты, n (%) | 1 (4) | 0 | 1 (4) | 0 | |
ASA 2, n (%) | 4 (17) | 12 (19) | 16 (18) | 16 (18) | 0,131 |
ASA 3, n (%) | 18 (75) | 41 (64) | 59 (67) | 67 (76) | |
ASA 4, n (%) | 2 (8) | 11 (17) | 13 (15) | 5 (6) | |
Индекс коморбидности Charlson, Me (квартили) | 5 (4–6) | 5 (4–6) | 5 (4–6) | 5 (4–6) | 0,166 |
ХБП – хроническая болезнь почек, ХОБЛ – хроническая обструктивная болезнь легких, ХСН – хроническая сердечная недостаточность, ВСА – внутренняя сонная артерия, ИМТ – индекс массы тела, Me – медиана, ИБС – ишемическая болезнь сердца, ПИКС – постинфарктный кардиосклероз, СН – стенокардия напряжения, ASA – American Society of Anaesthesiologists. * – Критерий Хи-квадрат (точный критерий Фишера при значении <5), критерий U Манна –Уитни (сравнение 1-й и 2-й группы).
Результаты инструментальных методов обследования представлены в табл. 2. Предоперационные КТ и МРТ исследования головного мозга были доступны для анализа у 98% (172/176) пациентов. В 63% (111/176) исследований инфаркт головного мозга не определили, несмотря на стабильный неврологический дефицит. Группы статистически значимо отличались только по степени стеноза ипсилатеральной ВСА и изменениям по данным КТ/МРТ.
Таблица 2. Инструментальные дооперационные данные УЗИ и КТ/МРТ
Инструментальные данные | Группа 1А 0–14 дней (n = 24) | Группа 1Б 15–30 дней (n = 64) | Группа 1 0–30 дней (n = 88) | Группа 2 0 дней (n = 88) | p (1–2-я группы)* |
УЗИ | |||||
Сторона операции (слева), n (%) | 16 (67) > | 33 (52) | 49 (56) | 53 (60) | 0,647 |
Степень стеноза (NASCET), %, Me (квартили) | 80 (70–90) | 80 (70–90) | 80 (70–90) | 72 (65–90) | 0,035 |
Протяженность бляшки, мм, Me (квартили) | 16 (11–20) | 15 (15–20) | 16 (15–20) | 15 (15–20) | 0,409 |
Контралатеральная ВСА | |||||
стеноз < 50%, n (%) | 13 (54) | 23 (36) | 36 (41) | 43 (49) | 0,363 |
стеноз > 50%, n (%) | 11 (46) | 41 (64) | 52 (59) | 45 (51) | |
окклюзия, n (%) | 2 (8) | 6 (9) | 8 (9) | 2 (2) | 0,099 |
Патологическая извитость ВСА | 1 (4) | 1 (2) | 2 (2) | 1 (1) | 0,56 |
Интракраниальный стеноз ВСА | 0 | 1 (2) | 1 (1) | 2 (2) | 0,56 |
КТ/МРТ, n (%) | 22 (92) | 64 (100) | 86 (98) | 88 (100) | |
ASPECTS < 8, n (%) | 5 (21) | 15 (23) | 20 (23) | 5 (6) | 0,002 |
Нет очаговых поражений, n (%) | 9 (37) | 22 (34) | 31 (35) | 49 (56) | < 0,001 |
Очаговые изменения, n (%) | 9 (37) | 38 (59) | 47 (53) | 19 (22) | |
Кистозно-глиозные изменения | 4 (17) | 4 (6) | 8 (9) | 20 (23) | |
Макс. размер очага, мм, Me (квартили) | 23 (11–36) | 27 (12–47) | 26 (12–45) | 11 (6–42) | 0,185 |
Макс. размер очага > 30 мм | 1 (4) | 10 (16) | 11 (12) | 4 (4) | 0,265 |
Объем очага > 4000 мм3, n (%) | 1 (4) | 10 (16) | 11 (12) | 6 (7) | 0,785 |
Множественные очаги, n (%) | 2 (8) | 9 (14) | 11 (12) | 9 (10) | 0,635 |
Зона ишемии головного мозга | |||||
бассейн ПМА, n (%) | 8 (33) | 30 (47) | 38 (43) | 24 (27) | 0,628 |
бассейн СМА, n (%) | 5 (21) | 6 (9) | 11 (12) | 10 (11) | |
ВББ, n (%) | 0 | 5 (8) | 5 (6) | 2 (2) | |
В группе 1 чаще выявляли больший объем поражения (менее 8 баллов по шкале оценки признаков ишемии головного мозга ASPECTS). Также в группе 1 чаще выявляли очаговое поражение головного мозга, чем в группе поздних операций.
При оценке неврологического статуса медиана баллов по шкале NIHSS до оперативного лечения составила 7 (3–20, квартили) в группе раннего вмешательства и 3 (1–6) в группе поздних операций (табл. 3). В группе 1Б (14–30 дней после инсульта) пациенты с умеренным и тяжелым инсультом встречались в 58% (37/64). Мы выявили значимое улучшение по шкале NIHSS во всех группах (рис. 1).
Рисунок 1. Динамика неврологического статуса после операции в группах 1А, 1Б и 2 по шкале NIHSS. Значимое улучшение отмечено во всех группах (критерий знаковых рангов Вилкоксона для связанных выборок)
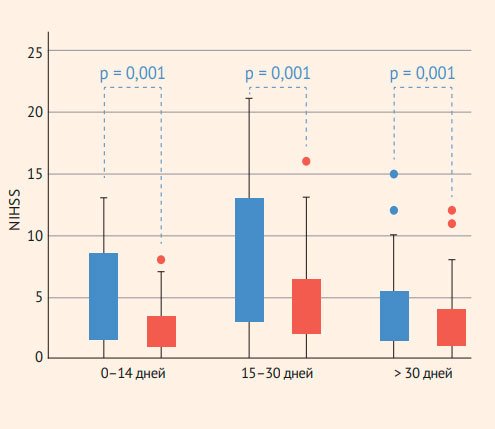
Таблица 3. Динамика неврологического статуса после операции в 1-й и 2-й группах по шкалам NIHSS, mRS, MoCa
Неврологический статус до и после операции | Группа 1А 0–14 дней (n = 24) | Группа 1Б 15–30 дней (n = 64) | Группа 1 0–30 дней (n = 88) | Группа 2 > 30 дней (n = 88) | p (1–2-я группы)* |
NIHSS | |||||
NIHSS до операции (n = 176) | 4 (1–9) | 9 (3–13) | 7 (3–12) | 3 (1–6) | < 0,001 |
NIHSS (0–5), n (%) | 15 (62) | 27 (42) | 42 (48)> | 66 (75) | < 0,001 |
NIHSS (6–15), n (%) | 9 (38) | 27 (42) | 36 (41) | 22 (25) | |
NIHSS (>15), n (%) | 0 | 10 (16) | 10 (11) | 0 | |
NIHSS при выписке (n = 175) | 2 (1–4) | 5 (2–7) | 4 (2–6) | 2 (1–4) | 0,003 |
mRS | |||||
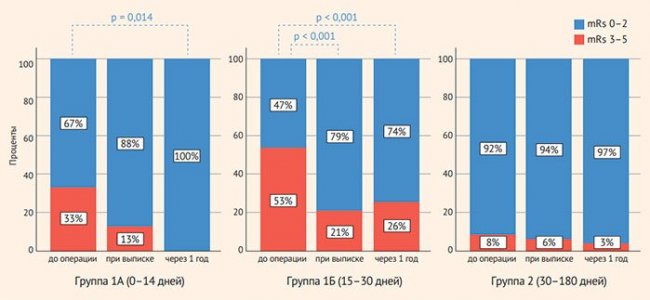
mRS до операции (n = 176), Me (квартили) | 2 (1–3) | 3 (2–3) | 2 (1–3) | 1 (1–2) | < 0,001 |
mRS до операции 0–2, n (%) | 16 (67) | 30 (47) | 46 (52) | 81 (92) | < 0,001 |
mRS до операции 3–5, n (%) | 8 (33) | 34 (53) | 42 (48) | 7 (8) | |
mRS при выписке (n = 175), Me (квартили) | 1 (1–1,7) | 2 (1–2) | 2 (1–2) | 1 (1) | < 0,001 |
mRS после операции 1 год (n = 104), Me (квартили) | 1 (1–1,2) | 2 (1–3) | 2 (1–2) | 1 (1) | 0,001 |
MoCa | |||||
MoCa до операции (n = 138), Me (квартили) | 22 (19–25) | 19 (21–25) | 23 (20–25) | 21 (19–25) | 0,331 |
MoCa после операции 1 год (n = 80), Me (квартили) | 24 (21–25) | 25 (22–27) | 24 (22–26) | 23 (20–25) | 0,961 |
В группе ранних операций значительно чаще наблюдались тяжелые инсульты (mRS 3–5), чем в группе поздних операций, 48 и 8% соответственно (табл. 3, рис. 2).
Рисунок 2. Динамика неврологического статуса после операции в группах 1А, 1Б и 2 по данным шкалы mRs. Указаны только значимые различия (Q-критерий Кохрена для связанных выборок, парные сравнения)
Значимое улучшение неврологического статуса при выписке отмечено только в подгруппе 1Б (15–30 дней). Через год после операции значимое улучшение отмечено только в группе ранних операций. Оценку когнитивного статуса по шкале MoCa проводили у 78% (138/176) пациентов до операции и у 45% (80/176) через 1 год после операции. Исходно медиана значений не различалась и составила 23 (20–25) и 21 (19–25) в группах ранних и поздних вмешательств соответственно (табл. 4). Во всех группах отмечено значимое улучшение через 1 год после операции. В раннем послеоперационном периоде не было выявлено системных осложнений. Среди местных осложнений с одинаковой частотой в группах раннего и позднего вмешательства встречались кровотечение и ревизия, а также преходящая периферическая невропатия (табл. 4).
Таблица 4. Осложнения, основные нежелательные клинические явления (MACE)
Результаты лечения | Группа 1А 0–14 дней (n = 24) | Группа 1Б 15–30 дней (n = 64) | Группа 1 0–30 дней (n = 88) | Группа 2 >30 дней (n = 88) | p (1–2 группа)* |
Местные осложнения | |||||
Кровотечение/ревизия, n (%) | 0 | 2 (3,1) | 2 (2,3) | 0 | 0,497 |
Периферическая невропатия, n (%) | 2 (8) | 8 (12,5) | 10 (11,3) | 9 (10,2) | 0,635 |
Системные осложнения | 0 | 0 | 0 | 0 | |
Рестеноз через 1 год | 0 | 0 | 0 | 0 | |
Инсульт ипсилатеральный (30 дней), n (%) | 0 | 3 (4,7) | 3 (3,4) | 0 | 0,246 |
Летальность (30 дней), n (%) | 0 | 1 (1,6) | 1 (1,1) | 0 | 0,316 |
Инсульт ипсилатеральный (1 год), n (%) | 0 | 0 | 0 | 1 (1,1) | 0,316 |
Летальность (1 год), n (%) | 0 | 0 | 0 | 1 (1,1) | 0,316 |
Инсульт любой, инфаркт миокарда, смерть (MACE) через 30 дней, n (%) | 0 | 3 (4,7) | 3 (3,4) | 0 | 0,246 |
Инсульт любой, инфаркт миокарда, смерть (MACE) через 1 год, n (%) | 0 | 0 | 0 | 1 (1,1) | 0,316 |
В раннем послеоперационном периоде наблюдения ипсилатеральный инсульт наблюдался у 3 пациентов в группе 1Б (КЭЭ в сроки 15–20 дней после инсульта). В одном случае инсульт был летальным. Таким образом, частота MACE через 30 дней после операции составила 3,4% и 0% в группах раннего и позднего вмешательства. В отдаленном периоде прослежено 96% (170/176) пациентов. Один летальный инсульт наблюдался в группе отсроченных вмешательств. По результатам лечения в раннем и отдаленном периоде показатели группы не имели значимого различия. Ни у одного из пациентов, включенных в исследование, через 1 год по данным УЗИ не было выявлено рестеноза оперированной ВСА.
Обсуждение
За последние 20 лет существенно изменилась парадигма оптимального времени выполнения КЭЭ у пациентов после ТИА или инсульта. Если в конце XX в. считалось, что безопасно выполнять операцию только спустя 3–6 мес. после операции, то сейчас КЭЭ рекомендуется через 7–14 дней [8, 9]. В последнее время в России увеличилось количество учреждений, которые продемонстрировали отличные результаты раннего вмешательства у пациентов после стабильного инсульта легкой и умеренной степени (NIHSS менее 15) при стенозе ипсилатеральной ВСА более 50% [12–14]. За последние 10 лет в региональном центре скорой медицинской помощи (г. Набережные Челны) отметилось увеличение количества «ранних операций» (до 30 дней после инсульта) с 6,5% до 19,7%. Основная цель нашего исследования состояла в том, чтобы сравнить результаты ранних и поздних КЭЭ у пациентов не только с малым, но и большим инсультом (NIHSS 5–22, mRS 3–5).
В нашем исследовании 30-дневный комбинированный показатель инсульта, инфаркта и смертности (MACE) после 176 КЭАЭ составил 1,7%, что значительно ниже рекомендуемого порога согласно текущим рекомендациям [2]. В нашем исследовании медиана срока от инсульта до операции составила 20 дней (квартили, 14–25). Мы выделили отдельную подгруппу пациентов, оперированных в сроки 0–14 дней, медиана и квартили составили 12 дней (10–14). В данной группе не было периоперационных инсультов и смертей, несмотря на то что исходный соматический статус не отличался от пациентов из группы поздних операций, а неврологический статус по данным шкал NIHSS и mRS был хуже. В группе ранних операций отмечено более значимое улучшение неврологического статуса по шкале mRS при выписке и через год после операции. Одним из факторов, влияющих на выбор ранних операций, является более быстрая и полная реабилитация после инсульта [12]. В настоящем исследовании улучшение клинического состояния и достижение хороших функциональных результатов наблюдались даже в подгруппе пациентов с тяжелым инсультом.
Улучшение когнитивного статуса по шкале MoCa отмечено в группе ранних и поздних операций в одинаковой степени. Эти результаты не противоречат данным предыдущих исследований [15].
Мы не включили в исследование пациентов с изолированным стентированием ВСА. По данным ряда исследований КС сопровождается большей частотой инсульта в периоперационном периоде, чем КЭЭ [16]. В метаанализе 2015 г. при логистической регрессии продемонстрирован в 4,7 раза более высокий риск осложнений при КС, чем при КЭЭ (95% ДИ, 1,4–16) [17]. Однако плохие результаты могут быть связаны с отбором пациентов. У пациентов, отобранных на КС, либо одновременно выполняли тромбэктомию из интракраниальных артерий, либо у них были противопоказания к КЭЭ в связи с большим анестезиологическим риском. Кроме того, за последнее десятилетие значительно улучшилась технология КС и появились исследования, показывающие сходные результаты КАС и КЭАЭ, в т. ч. и после тяжелого инвалидизирующего инсульта [18]. Необходимы дальнейшие исследования для оценки результатов КС в раннем периоде после инсульта.
Ранее считалось, что риск повторного инсульта невысок, но высок риск геморрагического инсульта после операции в ранние сроки ишемического инсульта и риск осложнений при ранних операциях в связи с «нестабильностью» атеросклеротической бляшки. На самом деле оказалось, что риск повторного инсульта в первые несколько дней после инсульта значительно выше, чем считалось ранее. По оценкам опубликованного Tsantilas et al. в 2015 г. метаанализа, общий риск повторного инсульта в течение 14 дней после малого инсульта и ТИА составляет 26,1% (95% ДИ 20,6–32,5) [6]. Второй аргумент, основанный на высокой частоте геморрагического перерождения острого ишемического инсульта и риска церебральной гиперперфузии после ранних операций, также оказался несостоятельным в наше время. Анализ ранних сообщений о частоте внутримозгового кровоизлияния после ранних КЭЭ показал, что неадекватная предоперационная идентификация тяжести повреждения головного мозга была ответственна за высокий процент осложнений, особенно у пациентов с глубоким предоперационным неврологическим дефицитом и окклюзии ВСА [17]. Интенсивная терапия и контроль артериального давления, а также улучшение верификации объема и тяжести поражения по данным КТ и МРТ привели к снижению частоты этих осложнений.
Третий, часто цитируемый аргумент против ранней КЭЭ основывался на мнении о повышенной уязвимости ткани головного мозга после недавно перенесенного инсульта к церебральной ишемии во время пережатия сонной артерии, а также о «нестабильности» атеросклеротической бляшки в ранней стадии инсульта и, следовательно, высокого риска дистальной эмболизации во время операции [19]. Однако ранние исследования, на которых основывалось это мнение, имели ряд существенных ограничений, исследования были очень разнородны по срокам операции, локализации и тяжести инсульта, размера очага поражения. Кроме того, исследования включали такие прогрессирующие состояния, как «крещендо» ТИА и инсульт «в ходу», которые, как известно, несут более высокий риск послеоперационного инсульта или смерти [20]. В проведенном метаанализе 47 исследований, опубликованных с 1980 по 2008 г., не выявлено повышения операционного риска при ранней КЭЭ по сравнению с отсроченной КЭЭ [21]. Более поздний метаанализ (исследования 2008–2015 гг.) показал, что 30-дневный риск развития инсульта и смерти после ранней КЭЭ (<15 дней после инсульта) составляет всего 3,6% (2,1–5,8) [17]. Успехи в технологиях МРТ и КТ, применение более эффективных диагностических алгоритмов и более тщательный отбор пациентов привели к значительному снижению периоперационного риска [22].
ВСА у пациентов с ТИА или малым инсультом в настоящий момент подтверждается большим количеством исследований, и данный алгоритм включен практически во все рекомендации. Тем не менее из-за отсутствия прямого сравнения нельзя сделать вывод о преимуществе реваскуляризации по сравнению с агрессивной медикаментозной терапией (двойная антиагрегантная терапия и статины) в острой фазе появления симптомов (до 48 ч) [24]. Кроме того, тактика лечения пациентов после тяжелого инвалидизирующего инсульта с большим объемом поражения головного мозга до конца не определена.
Известно, что увеличение тяжести инсульта связано с периоперационным риском после КЭЭ, а увеличение очага поражения на дополнительный сантиметр связан со значительным увеличением послеоперационных осложнений [11]. Фактически в рандомизированные контролируемые исследования были включены только неинвалидизирующие инсульты или ТИА, тогда как более тяжелые случаи, которые больше всего выиграют от вмешательства на сонной артерии, были исключены из исследований и оценки результатов. Лишь в нескольких исследованиях проведена оценка результатов ранних вмешательств при больших инсультах (NIHSS 5–22, mRS 3–5) [11, 13]. Были получены противоречивые результаты, однако в большинстве работ сделан вывод о невысоком риске ранних операций при учете объема поражения и риска геморрагической трансформации. Необходимы дальнейшие крупные проспективные рандомизированные исследования для сравнения медикаментозной терапии с активным хирургическим подходом в ранних сроках после тяжелых инвалидизирующих инсультов. Однако будущий результат исследований пока не ясен. Отмечается значительное снижение осложнений не только при медикаментозном, но и при хирургическом лечении, что связано с более высоким техническим уровнем операций, увеличением использования статинов и двойной антиагрегантной терапии, послеоперационной коррекции артериальной гипертензии, более тщательным отбором пациентов при оценке поражения головного мозга по КТ и МРТ, централизацией хирургии сонных артерий, а также отказом от КЭЭ в пользу КС у пациентов высокого соматического риска. Важным представляются полученные данные о положительном влиянии КЭЭ на когнитивные функции, оцениваемые по шкале MoCa, учитывая, что результаты наблюдения пациентов, перенесших инсульт и получающих консервативную терапию, указывают на постепенное ухудшение когнитивных функций, оцениваемых по нескольким нейропсихологическим тестам [25].
Основным ограничением является ретроспективный дизайн и относительно небольшой размер выборки. Оцениваемая выборка включала данные из одного регионального центра, и результаты, соответственно, не могут быть обобщены для населения в целом. Нужны большие рандомизированные исследования с объемом выборки не менее 880 пациентов [19]. В нашем исследовании возможна систематическая ошибка при определении репрезентативности группы «контроля» при подборе случайной пары. Поскольку оценивали результаты лечения только прооперированных пациентов, также возможна систематическая ошибка отбора.
Выводы
Не выявлено различий в послеоперационной 30-дневной и отдаленной летальности, инсульте или инфаркте миокарда при ранней и отсроченной КЭ после инсульта, в т. ч. умеренной и тяжелой степени. Важен тщательный отбор тех пациентов, которым раннее вмешательство принесет наибольшую пользу. Результаты ранних операций у таких пациентов не отличаются от результатов отсроченных операций, но при этом существенно снижается риск повторного инсульта в период ожидания операции. В данном исследовании отмечен больший реабилитационный потенциал ранних вмешательств. Выявление пациентов с наибольшим риском повторного инсульта и наименьшим риском послеоперационных осложнений на основе прогностических факторов в настоящее время является одной из приоритетных научных задач. Результаты нашего исследования подтверждают рекомендацию о необходимости раннего выполнения КЭЭ после инсульта.
Список литературы / References
- Powers W.J., Rabinstein A.A., Ackerson T., Adeoye O.M., Bambakidis N.C., Becker K. et al. Guidelines for the early management of patients with acute ischemic stroke: 2019 update to the 2018 guidelines for the early management of acute ischemic stroke a guideline for healthcare professionals from the American Heart Association/American Stroke A. Stroke. 2019;50(12):344–418. https://doi.org/10.1161/STR.0000000000000211.
- Покровский А.В., Абугов С.А., Алекян Б.Г., Аракелян В.С., Белов Ю.В., Белоярцев Д.Ф. и др. Национальные рекомендации по ведению пациентов с заболеваниями брахиоцефальных артерий. М.; 2013. 70 с. Режим доступа: http://www.angiolsurgery.org/recommendations/2013/ recommendations_brachiocephalic.pdf.
- Покровский А.В., Головюк А.Л. Состояние сосудистой хирургии в Российской Федерации в 2018 году. Ангиология и сосудистая хирургия. 2019;25(2):1–49. Режим доступа: http://www.angiolsurgery.org/ society/situation/2018.pdf.
- Savardekar A.R., Narayan V., Patra D.P., Spetzler R.F., Sun H. Timing of Carotid Endarterectomy for Symptomatic Carotid Stenosis: A Snapshot of Current Trends and Systematic Review of Literature on Changing Paradigm towards Early Surgery. Neurosurgery. 2019;85(2):214–225. https://doi.org/10.1093/neuros/nyy557
- Rothwell P.M., Eliasziw M., Gutnikov S.A., Warlow C.P., Barnett H.J. Endarterectomy for symptomatic carotid stenosis in relation to clinical subgroups and timing of surgery. Lancet. 2004;363(9413):915–924. https://doi.org/10.1016/S0140-6736(04)15785-1.
- Tsantilas P., Kühnl A., Kallmayer M., Knappich C., Schmid S., Kuetchou A. et al. Stroke risk in the early period after carotid related symptoms: A systematic review. J Cardiovasc Surg (Torino). 2015;56(6):845–852. Available at: https://pubmed.ncbi.nlm.nih.gov/26399273/.
- Reznik M., Kamel H., Gialdini G., Pandya A., Navi B.B, Gupta A. Timing of carotid revascularization procedures after ischemic stroke. Stroke. 2017;48(1):225–228. https://doi.org/10.1161/STROKEAHA.116.015766.
- Nordanstig A., Rosengren L., Strömberg S., Österberg K., Karlsson L., Bergström G. et al. Editor’s Choice – Very Urgent Carotid Endarterectomy is Associated with an Increased Procedural Risk: The Carotid Alarm Study. Eur J Vasc Endovasc Surg. 2017;54(3):278–286. https://doi.org/10.1016/j. ejvs.2017.06.017.
- Avgerinos E.D., Farber A., Abou Ali A.N., Rybin D., Doros G., Eslami M.H. Early carotid endarterectomy performed 2 to 5 days after the onset of neurologic symptoms leads to comparable results to carotid endarterectomy performed at later time points. J Vasc Surg. 2017;66(6):1719–1726. https://doi.org/10.1016/j.jvs.2017.05.101.
- Jankowitz B.T., Tonetti D.A., Kenmuir C., Rao R., Ares W.J., Zussman B. et al. Urgent treatment for symptomatic carotid stenosis: The Pittsburgh revascularization and treatment emergently after stroke (PIRATES) protocol. Neurosurgery. 2020;87(4):811–815. https://doi.org/10.1093/neuros/nyaa096.
- Pini R., Faggioli G., Vacirca A., Dieng M., Goretti M., Gallitto E. et al. The benefit of deferred carotid revascularization in patients with moderate-severe disabling cerebral ischemic stroke. J Vasc Surg. 2021;73(1):117–124. https://doi.org/10.1016/j.jvs.2020.03.043.
- Дуданов И.П., Васильченко Н.О., Белинская В.Г., Ордынец С.В., Бергер М.М., Азиева А.З., Коблов Е.С. Каротидная эндартерэктомия у пациентов с малым стенозом сонных артерий в остром периоде ишемического инсульта. Нейрохирургия. 2014;(3):30–34. Режим доступа: https://www.therjn.com/jour/article/view/108.
- Шатравка А.В., Сокуренко Г.Ю., Суворов С.А., Ризаханова М.Р., Логинов И.А., Алексеева Н.В. Результаты операций каротидной эндартерэктомии выполненных в остром периоде ишемического инсульта. Ангиология и сосудистая хирургия. 2016;22(2):133–136. Режим доступа: http://www.angiolsurgery.org/magazine/2016/2/18.htm.
- Хрипун А.И., Прямиков А.Д., Миронков А.Б., Тюрин И.Н., Асратян С.А., Суряхин В.С. и др. Результаты открытых и эндоваскулярных операций на внутренней сонной артерии в острой стадии ишемического инсульта. Ангиология и сосудистая хирургия. 2017;23(3):112–117. Режим доступа: http://www.angiolsurgery.org/ magazine/2017/3/14.htm.
- Watanabe J., Ogata T., Hamada O., Nonaka M., Abe H., Higashi T. et al. Improvement of cognitive function after carotid endarterectomy – A new strategy for the evaluation of cognitive function. J Stroke Cerebrovasc Dis. 2014;23(6):1332–1336. https://doi.org/10.1016/j.jstrokecerebrovasdis.2013.11.004.
- Mihindu E., Mohammed A., Smith T., Brinster C., Sternbergh W.C. 3rd, Bazan H.A. Patients with moderate to severe strokes (NIHSS score >10) undergoing urgent carotid interventions within 48 hours have worse functional outcomes. J Vasc Surg. 2019;69(5):1471–1481. https://doi.org/ 10.1016/j.jvs.2018.07.079.
- De Rango P., Brown M.M., Chaturvedi S., Howard V.J., Jovin T., Mazya M.V. et al. Summary of evidence on early carotid intervention for recently symptomatic stenosis based on meta-analysis of current risks. Stroke. 2015;46(12):3423–3436. https://doi.org/10.1161/STROKEAHA.115.010764.
- Rocco A., Sallustio F., Toschi N., Legramante J., Ippoliti A., Ascoli Marchetti A. et al. Carotid Artery Stent Placement and Carotid Endarterectomy: A Challenge for Urgent Treatment after Stroke—Early and 12-Month Outcomes in a Comprehensive Stroke Center. J Vasc Interv Radiol. 2018;29(9):1254–1261. https://doi.org/10.1016/j.jvir.2018.03.025.
- Vasconcelos V., Cassola N., da Silva E.M.K., Baptista-Silva J.C. Immediate versus delayed treatment for recently symptomatic carotid artery stenosis. Cochrane Database Syst Rev. 2016;9(9):CD011401. https://doi.org/10.1002/ 14651858.CD011401.pub2.
- Barbetta I., Carmo M., Mercandalli G., Lattuada P., Mazzaccaro D., Settembrini A.M. et al. Outcomes of urgent carotid endarterectomy for stable and unstable acute neurologic deficits. J Vasc Surg. 2014;59(2):440– 446. https://doi.org/10.1016/j.jvs.2013.08.035.
- Rerkasem K., Rothwell P.M. Temporal Trends in the Risks of Stroke and Death due to Endarterectomy for Symptomatic Carotid Stenosis: An Updated Systematic Review. Eur J Vasc Endovasc Surg. 2009;37(5):504–511. https://doi.org/10.1016/j.ejvs.2009.01.011.
- Blay E., Balogun Y., Nooromid M.J., Eskandari M.K. Early Carotid Endarterectomy after Acute Stroke Yields Excellent Outcomes: An Analysis of the Procedure-Targeted ACS-NSQIP. Ann Vasc Surg. 2019;57:194–200. https://doi.org/10.1016/j.avsg.2018.10.023.
- Tanious A., Pothof A.B., Boitano L.T., Pendleton A.A., Wang L.J., de Borst G.J. et al. Timing of Carotid Endarterectomy After Stroke: Retrospective Review of Prospectively Collected National Database. Ann Surg. 2018;268(3):449– 456. https://doi.org/10.1097/SLA.0000000000002933.
- Shahidi S., Owen-Falkenberg A., Hjerpsted U., Rai A., Ellemann K. Urgent best medical therapy may obviate the need for urgent surgery in patients with symptomatic carotid stenosis. Stroke. 2013;44(8):2220–2225. Available at: https://pubmed.ncbi.nlm.nih.gov/23760213/.
- Вербицкая С.В., Парфенов В.А., Решетников В.А., Козлов В.В., Кабаева А.Р. Постинсультные когнитивные нарушения (результаты 5-летнего наблюдения). Неврология, нейропсихиатрия, психосоматика. 2018;10(1):37–42. https://doi.org/10.14412/2074-2711-2018-1-37-42.




 1
1 2
2 3
3 4
4


Комментарии (0)