
Журнал "Медицинский совет" №1/2023
DOI: 10.21518/ms2022-011
С.Г. Быстрова1,2, https://orcid.org/0000-0003-3037-9384
О.И. Симонова1,2, https://orcid.org/0000-0002-2367-9920
Э.Э. Ахмедова2, https://orcid.org/0000-0002-7529-2541
О.В. Кустова2, https://orcid.org/0000-0002-6668-0761
1Московский государственный медико- стоматологический университет имени А.И. Евдокимова; 127473, Россия, Москва, ул. Делегатская, д. 20, стр. 1
2 Национальный медицинский исследовательский центр здоровья детей; 119296, Россия, Москва, Ломоносовский проспект, д. 2, стр. 1
Введение. Прогрессирование легочной и сердечной недостаточности является самой частой причиной смерти пациентов с муковисцидозом (95%). В связи с этим для пациентов с муковисцидозом (МВ) очень важен мониторинг состояния бронхолегочной системы. Структурные изменения визуализируются по компьютерной томографии органов грудной клетки, а для их оценки применяется балльная шкала Броди. У детей старше 5 лет функциональные показатели легких определяют по спирометрии, бодиплетизмографии, исследованию диффузионной способности легких, а результаты оценивают в процентах от должных (%Д) значений. При тесте диффузионной способности легких по монооксиду углерода (СО) с однократным вдохом (single-breath, SB) определяют легочную диффузию (diffusion capacity of the lungs) – DLCO-SB, альвеолярный объем (VA-SB) и их отношение (KCO-SB). При наличии недоступных для перфузии газа зон VA-SB может не отражать истинный VA. Для пациентов с муковисцидозом предложено при расчете KCO использовать VA, определяемый по бодиплетизмографии, или проводить коррекцию DLCO-SB (%Д) и KCO-SB (%Д) по VA.
Цель. Оценить информативность нескорректированных DLCO-SB и KCO-SB, информативность этих показателей с поправкой на VA, а также KCO с расчетом VA по бодиплетизмографии у детей с муковисцидозом.
Материалы и методы. В пульмонологическом отделении ФГАУ «НМИЦ здоровья детей» обследованы 28 детей с муковисцидозом (8–18 лет), которым проводились тест диффузионной способности легких, спирометрия, бодиплетизмография, лабораторные и антропометрические измерения и компьютерная томография органов грудной клетки.
Результаты и обсуждение. Выявлено, что у большинства пациентов показатели теста диффузионной способности легких были в пределах нормы, а снижение наблюдалось у детей старше 14 лет на фоне выраженной бронхоэктазии.
Выводы. Диффузионная способность легких у детей с муковисцидозом является информативным исследованием, однако для этого необходимо проводить корректировку на альвеолярный объем.
Для цитирования: Быстрова С.Г., Симонова О.И., Ахмедова Э.Э., Кустова О.В. Исследование диффузионной способности легких методом однократного вдоха монооксида углерода с задержкой дыхания (DLCO-SB) при муковисцидозе у детей: методы интерпретации результатов. Медицинский Совет. 2023;(1):172-181. https://doi.org/10.21518/ms2022-011
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Single-breath diffusion capacity of the lungs for carbon monoxide in children with cystic fibrosis: methods of interpreting results
Serafima G. Bystrova1,2, https://orcid.org/0000-0003-3037-9384
Olga I. Simonova1,2, https://orcid.org/0000-0002-2367-9920
Elina E. Akhmedova2, https://orcid.org/0000-0002-7529-2541
Olga V. Kustova2, https://orcid.org/0000-0002-6668-0761
1 Sechenov First Moscow State Medical University (Sechenov University); 8, Bldg. 2, Trubetskaya St., Moscow, 119991, Russia
2 National Medical Research Center for Children’s Health; 2, Bldg. 1, Lomonosovsky Ave, Moscow, 119296, Russia
Introduction. Progression of pulmonary and heart failure often causes death in patients with cystic fibrosis (95%). Therefore, monitoring of lung condition is very important for patients with cystic fibrosis (CF). Structural changes are visualized by computed tomography of the chest (CT) and are scored using the Brody scale. For children older than 5 years, pulmonary function tests (PFTs) tests (which are evaluated in percent of predicted (%) values) are available, such as spirometry, body plethysmography (BP), diffusion capacity of the lungs (DL) test. The results of the single-breath (SB) DL for carbon monoxide test are DLCO-SB, alveolar volume (VA-SB) and their ratio (KCO-SB). In the presence of non-communicative zones for gas perfusion, VA-SB may not present true VA. For patients with CF, it is proposed to use VA determined by BP for calculating KCO-BP, or to adjust the predicted DLCO-SB and KCO-SB for VA.
Aim. To assess the informativeness DLCO-SB, KCO-SB and KCO-BP in children with CF.
Materials and methods. 28 children with CF (8–18 years old) were examined in the department of pulmonology of the National Research Center for Children's Health. PFTs included DLCO-SB, spirometry and BP. Additionally, we evaluated the data of the blood gas and acid-base values, age, body mass index and CT scores.
Results and discussion. We found that in most patients DLCO-SB and KCO-SB were within the normal range, and decreased in children older than 14 years with background of severe bronchiectasis.
Conclusion. Thus, in children with CF the DL test is informative, and adjustment for VA is useful.
For citation: Bystrova S.G., Simonova O.I., Akhmedova E.E., Kustova O.V. Single-breath diffusion capacity of the lungs for carbon monoxide in children with cystic fibrosis: methods of interpreting results. Meditsinskiy sovet = Medical Council. 2023;(1):172-181. (In Russ.) https://doi.org/10.21518/ms2022-011
Conflict of interest: the authors declare no conflict of interest.
Введение
Муковисцидоз (МВ) или кистозный фиброз (Cystic fibrosis) – одно из самых частых орфанных заболеваний. МВ является моногенным, наследуемым по аутосомно-рецессивному типу, полисистемным заболеванием, которое характеризуется распространенным поражением всех экзокринных желез организма, в частности, кистозным перерождением поджелудочной железы (ПЖ) и поражением дыхательной системы вследствие нарушения функции и структуры хлорных каналов мембран эпителиальных клеток [1]. Это вызывается мутациями (вариантами нуклеотидной последовательности) в гене трансмембранного регулятора проводимости муковисцидоза (МВТР или CFTR, Cystic Fibrosis Transmembrane conductance Regulator). На данный момент выявлен 401 патогенный вариант, из которых наиболее часто в России встречаются: F508del (52,79%), СFTRdele2,3 (6,32%), E92K (2,65%), 2184insA (2,02%), 2143delT (1,65%), 3849+10kbC>T (1,65%), N1303K (1,33%), G542X (1,33%), W1282X (1,11%), L138ins (1,06%) [1]. Различные мутации объединяют в 6 классов, отражающих их функциональные последствия, а те из них, которые ассоциируются с панкреатической недостаточностью и выраженным поражением легких (I–III классы), относят к «тяжелым». В свою очередь, прогрессирование легочной и сердечной недостаточности является самой частой причиной смерти пациентов (95%) [1].
В связи с этим для пациентов с МВ в клинической практике очень важен мониторинг состояния бронхолегочной системы. Дети старше 5–6 лет способны выполнять различные дыхательные маневры, необходимые для проведения спирометрии (СПМ), бодиплетизмографии (БПГ), а также исследования диффузионной способности легких по монооксиду углерода методом однократного вдоха с задержкой дыхания [2].
Результатом исследования диффузионной способности легких по монооксиду углерода (СО) является определение двух основных показателей: диффузионной способности легких (DLCO-SB, Single breath diffusing capacity for CO) и отношения этого показателя к доступному для исследования альвеолярному объему (VA-SB, alveolar volume) – DLCO/VA, который, в свою очередь, принято обозначать KCO. Последний показатель позволяет оценивать газотранспортную способность единицы альвеолярного объема, VA-SB – это показатель, который также определяется в ходе проведения исследования диффузионной способности легких при помощи физиологически инертного газа (гелия или метана) [3]. В клинической практике у детей показатели СПМ и БПГ, DLCO-SB и KCO-SB часто оцениваются в процентах по отношению к должным значениям (%Д), а сниженным считается показатель < 80 %Д [4, 5].
При наличии обструкции дыхательных путей, а также недоступных для перфузии тестового газа (смеси инертного газа, CO и воздуха) зон или «воздушных ловушек» метод однократного вдоха с 10-секундной задержкой дыхания может не отражать истинный альвеолярный объем, а низкий VA-SB может изменить KCO-SB, который будет нормальным или повышенным [6]. У пациентов с МВ хронический бронхит характеризуется сочетанием бронхоэктатической болезни и паренхиматозного фиброза, в связи с чем логично предположить влияние этих факторов на диффузионную способность легких. Несмотря на это, российские и зарубежные исследования, посвященные оценке диффузионной способности легких (DLCO) у больных МВ, показали противоречивые результаты: выявлялись повышенные, пониженные и нормальные значения [7–11]. Так, например, в исследовании Е.Л. Амелиной с соавт. в 55% случаев (у 12 из 22 пациентов, 15 мужчин и 18 женщин в возрасте от 18 до 27 лет) диффузионная способность легких была снижена и в среднем составляла 75,34 ± 24,94 %Д, а снижение KCO было выявлено в 14% случаев, однако без падения показателей в целом по группе (84,98 ± 16,78 %Д) [11]. В других исследованиях у детей и взрослых были получены данные о незначительном повышении DLCO на ранних стадиях МВ и его снижении на поздних стадиях заболевания [12, 13]. Кроме того, в исследовании 21 взрослого пациента с МВ обнаружено, что корреляция между DLСО и изменениями по данным компьютерной томографии органов грудной клетки (КТ ОГК), измеренными в баллах (по шкале Броди), была более сильной, чем для показателей СПМ и БПГ [14]. А.В. Черняк с соавт. обследовали 54 (34 с «тяжелыми» генотипами) взрослых больных МВ с медианным возрастом 25 лет (20 мужчин и 34 женщины), находящихся в состоянии клинической ремиссии, что определялось отсутствием изменений клинических симптомов и ОФВ1 ≥ 90% от лучших значений за последний год [11]. В этой группе пациентов исследование диффузионной способности легких, которое проводилось после физиотерапии и ингаляционной лекарственной терапии, выявило снижение DLCO (M = 79,9 ± 16,1, Me = 79,3 [70,5; 91,1] (%Д)) в 23 (42,6%) случаях, пропорциональное таковому альвеолярного объема, но не KCO, который был сохранным у всех больных (M = 98,4 ± 11,7, Me = 97,2 [90,4; 105,8] (%Д)). Авторами количественно оценивались структурные изменения по КТ ОГК с применением шкалы Балла, показаны значимые корреляции средней силы DLCO (%Д) с количеством бронхоэктазов и суммарным баллом, слабые значимые корреляции – с показателями выраженности бронхоэктазов, перибронхиальной инфильтрации, генерации пораженных бронхов, количества мукоидных пробок, а также булл, при этом KCO (%Д) имел слабую значимую связь только с количеством булл. Следует отметить, что в исследовании с участием 48 детей с МВ продемонстрирована полная воспроизводимость шкал количественной оценки структурных изменений по КТ ОГК (Кастиль, Броди, Хелбих, Сантамария и Балла) [15].
В недавнем ретроспективном поперечном исследовании, в котором анализировали данные 74 пациентов с МВ в возрасте 26 ± 10 года с различной степенью тяжести заболевания легких (76% обследованных имели как минимум одну «тяжелую» мутацию), авторы использовали альтернативный KCO, который они обозначили как KCO-BP (BP – Body plethysmography) [6]. Рассчитывалось отношение DLCO-SB к VA-BP, который, в свою очередь, определяли методом вычитания анатомического мертвого пространства из общей емкости легких (ОЕЛ) по данным БПГ и оценивали отношение DLCO к альвеолярному объему, рассчитанному данным способом. KCO-BP коррелировал с объемом форсированного выдоха за 1 сек (ОФВ1) и с парциальным давлением углекислого газа в артериальной крови, а также был снижен, в то время как KCO-SB был нормальным или повышенным. В свою очередь, анатомическое мертвое пространство (объем газа в дыхательных путях, которые не участвуют в газообмене) в мл у пациентов с индексом массы тела (ИМТ) < 30 кг/м2 может быть получено по формуле J. Cotes из расчета 2,2 мл на 1 кг массы тела [16] или 1,32 х рост (в см) + 0,86 х возраст (в годах) - 110 на основании уравнения E. Harris et al. [17].
Однако текущие рекомендации по проведению теста диффузионной способности легких постулируют, что, если VA-SB замещается другой величиной, например VA-BP, применение эталонных (должных) уравнений для расчета DLCO становится сомнительным [18]. Важно отметить, что ранее описана важность корректировки должных значений DLCO-SB и KCO-SB как для здоровых лиц, так и для пациентов с такими заболеваниями, как астма, эмфизема, саркоидоз и внелегочные патологии [19], а также у взрослых больных МВ [7]. Уравнения для корректировки [19]:
DLCO-SBдолжн. с поправкой на VA = DLCO-SBдолжн. х [0,58 + 0,42 х (VA-SB / VA-BP должн.)]
KCO-SBдолжн. с поправкой на VA = KCO-SBдолжн. х [0,42 + 0,58 / (VA-SB / VA-BP должн.)].
Так, в исследовании 52 взрослых пациентов с МВ эти показатели с поправкой на альвеолярный объем были ниже нескорректированных значений и достоверно коррелировали с показателями СПМ и БПГ [7].
Учитывая различные подходы к интерпретации результатов исследования диффузионной способности легких у пациентов с МВ, а также отсутствие данных о скорректированных по альвеолярному объему значениях этих показателей у детей с МВ и их корреляции с показателями КТ ОГК, мы проанализировали DLCO и KCO несколькими методами.
Цель – оценить информативность нескорректированных DLCO-SB и KCO-SB, информативность этих показателей с поправкой на альвеолярный объем, а также KCO-BP у детей с МВ.
Материалы и методы
Было обследовано 28 детей (12 мальчиков и 16 девочек) с МВ в возрасте от 8 до 18 лет, находившихся на госпитализации в отделении пульмонологии ФГАУ «НМИЦ здоровья детей» МЗ РФ в 2020–2022 гг. Для всех пациентов было получено информированное добровольное согласие родителей и детей в возрасте 15 лет и старше. Исследование одобрено локальным этическим комитетом. Всем детям проводилось исследование диффузионной способности легких по монооксиду углерода с задержкой дыхания на 10 сек с помощью современного газоанализатора быстрого реагирования, который позволяет более точно определять альвеолярный объем, чем классические системы. Также в рамках стандартного обследования всем пациентам проводились СПМ, БПГ, определение уровня гемоглобина (Hb), антропометрические измерения (рост, масса тела, ИМТ, стандартизированная оценка (z-score) ИМТ по программе WHO Anthro), 22 пациентам – КТ ОГК с оценкой по шкале Броди в баллах (6 пациентам КТ ОГК проводилось в предыдущую госпитализацию, однако эти данные не учитывались). Для 25 детей были проанализированы газовый состав и кислотно-щелочное состояние капиллярной крови, у 3 пациентов данный анализ был выполнен, однако его результаты оказались неинформативными в результате нарушения преаналитического этапа. KCO-BP рассчитывали, как описано выше, на основании отношения DLCO-SB к альвеолярному объему по БПГ.
Следует отметить, что нами оценивались показатели диффузионной способности легких в процентах от должных значений, а не стандартизированная оценка их отклонения (z-score) от нижней границы нормы, в связи с тем что нам были доступны только аналогичные результаты СПМ и БПГ. При оценке показателей диффузионного теста %Д рассчитывали по данным эталонных значений Y. Kim et al. [20] и А. Thomas et al. [21], рекомендованным Американским торакальным и Европейским респираторным обществами [18]. Для проведения статистических расчетов мы выбрали первые, в связи с тем что они были получены на большей выборке и включали пациентов старше 17 лет (n = 497 против n = 297, возраст 5–19 лет против возраста 5–17 лет соответственно). К недостаткам исследования Y. Kim, по мнению А. Thomas, относится то, что данные были получены с использованием двух различных приборов для измерения, однако недавнее российское исследование сравнительной оценки определения диффузионной способности легких с помощью приборов MasterScreen Jaeger и Easy OnePro значимых различий не выявило [22]. В свою очередь, показатели СПМ и БПГ представлены в %Д на основании текущих норм (прогнозируемых значений) Европейского респираторного общества. Также нами проанализированы результаты функциональных легочных тестов в %Д по нормам А. Zapletal et al. [23], предустановленных в программном обеспечении аппаратов. Исследование СПМ, БПГ и DLCO проводилось на аппарате MasterScreen Jaeger (Германия).
Поскольку связь монооксида углерода с Hb является важным фактором переноса CO, мы использовали значение DLCO с коррекцией по гемоглобину согласно рекомендациям [18]. Бронхолитической ингаляционной терапии непосредственно перед проведением теста диффузионной способности легких не проводилось, т. к. по данным ранее опубликованных работ у здоровых добровольцев и пациентов с обратимой и необратимой обструкцией сальбутамол не оказывал значительного влияния на DLCO [18].
Статистическая обработка результатов проводилась с помощью программы “Statistica 6”. Проводился корреляционный анализ, также для сравнения групп использовали непараметрические критерии Манна – Уитни и Уилкоксона для независимых и зависимых выборок соответственно, различия в группах были представлены в виде медиан и межквартильного размаха в группах (Me [Q0,25–Q0,75]), в т. ч. для баллов по шкале Броди, что сделано для упрощения представления данных. Полученные результаты считали статистически значимыми при р < 0,05.
Результаты и обсуждение
Средний возраст пациентов составил 14,5 (8,2–17,9) лет, медианный возраст – 14,9 ± 2,8 года. «Тяжелый» генотип имели 24 пациента, 8 пациентов (29%) были гомозиготны по мутации F508del. Распространенность различных комбинаций мутаций представлена на рис. 1.
Рисунок 1. Генотип (мутации в гене МВТР) у обследованных пациентов Количество детей

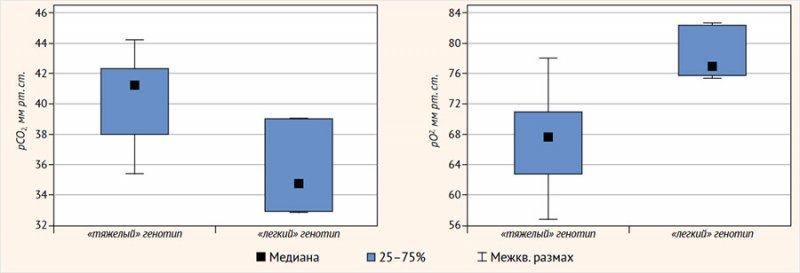
При разделении пациентов на группы у детей с «тяжелыми» мутациями (n = 22) парциальное давление углекислого газа в капиллярной крови (pCO2, мм рт. ст.) было достоверно (р = 0,027) выше (Me = 41,1 [38,0; 42,3] против Me = 34,4 [32,9; 39,1]), чем у пациентов, в генотипе которых была как минимум одна «легкая» мутация (n = 3), а парциальное давление кислорода (pO2, мм рт. ст.) – достоверно (р = 0,010) ниже (Me = 67,6 [63,0; 70,9] против Me = 76,2 [75,5; 82,6]) (рис. 2). Сатурация, измеренная пульсоксиметром, и гемоглобин крови значимых различий не показали, однако показатель DLCO, согласно рекомендациям, был скорректирован по гемоглобину.
Рисунок 2. Парциальное давление углекислого газа и кислорода в капиллярной крови (мм рт. ст.) в зависимости от генотипа пациентов
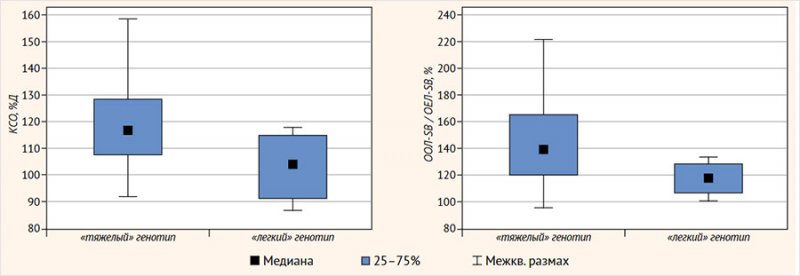
Различия в группах с «тяжелым» и «легким» генотипом у показателей KCO-SB (%Д) (р = 0,095), по данным эталонных значений Y. Kim et al. и А. Thomas et al., а также различия отношения остаточного объема легких (ООЛ) к общей емкости легких (ОЕЛ), измеренных при проведении исследования диффузионной способности легких (ООЛ-SB/ ОЕЛ-SB, %) (р = 0,082), не были статистически значимы, вероятно, на фоне большого разброса показателей в группе детей с «тяжелыми» мутациями и малочисленности группы с «легким» генотипом (рис. 3), однако можно предположить взаимосвязь данных тенденций. Остальные анализируемые показатели (КТ ОГК, БПГ, СПМ, показатели антропометрии, кислотно-щелочного состояния капиллярной крови, DLCO и KCO-BP) в группах также не различались.
Рисунок 3. Показатели теста диффузионной способности легких по монооксиду углерода методом однократного вдоха с задержкой дыхания (KCO-SB (%Д) и ООЛ-SB/ОЕЛ-SB, %) в зависимости от генотипа пациентов
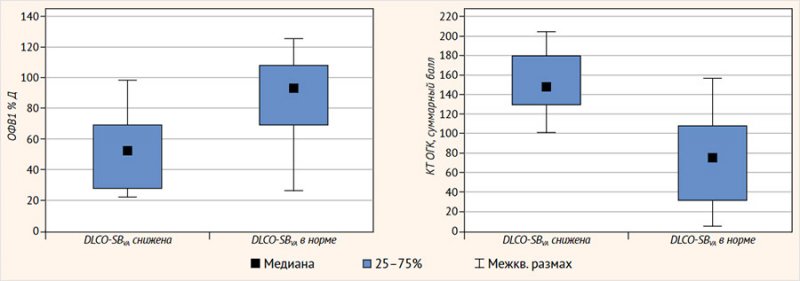
При анализе KCO-SB и DLCO-SB без корректировки на альвеолярный объем последний показатель был ниже 80 %Д лишь у 1 пациента по Y. Kim et al., у 2 детей – по А. Thomas A. et al., у 5 пациентов – по нормам А. Zapletal et al., в то время как скорректированный по альвеолярному объему DLCO-SB (DLCO-SBVA) был понижен у 9 пациентов по Y. Kim et al. и у 6 детей по прогнозируемым значениям А. Thomas A. et al. По нормам Y. Kim и А. Thomas КCO-SB был в норме или повышен у всех обследованных, а KCO-BP был снижен лишь у 1 ребенка, в то время как KCO-SBVA был снижен у 3 и 2 детей по Y. Kim и А. Thomas соответственно.
Мы разделили пациентов на группы по DLCO-SBVA по эталонным значениям Y. Kim et al.: группа 0 – < 80 %Д (n = 9; 8 детей с «тяжелым» генотипом), группа 1 – > 80 %Д (n = 19; 16 пациентов с «тяжелым» генотипом). В этих группах не было выявлено статистической значимости различий по KCO-SB (%Д) и ООЛ-SB/ОЕЛ-SB (%), а также измеренным по БПГ внутригрудному объему газа (ВГО) и ОЕЛ (ОЕЛ-BP). Значимо (р < 0,05) в группе детей с DLCO-SBVA < 80 %Д были ниже показатели KCO-BP (%Д), VA-SB (%Д), VA-BP (%Д), VA-SB/ОЕЛ-SB (%), жизненной емкости легких (ЖЕЛ (%Д)), ОФВ1 (%Д), форсированной ЖЕЛ (ФЖЕЛ (%Д)), ОФВ1/ФЖЕЛ (%Д), пиковой скорости выдоха (ПСВ (%Д)), максимальных объемных скоростей выдоха (МОС (%Д)) при 25, 50 или 75% ФЖЕЛ, а выше следующие показатели: бронхиального сопротивления (БС), pCO2 (мм рт. ст.), ООЛ (%Д), ООЛ/ОЕЛ (%Д), суммарного балла КТ ОГК по шкале Броди, бронхоэктазов, мукоидных пробок, перибронхиальных утолщений, паренхиматозных изменений, в т. ч. зон «матового стекла», кист и булл, кроме того, выявлена тенденция к повышению зон повышенной воздушности, но статистической значимости не обнаружено (р = 0,078) (рис. 4, табл. 1).
Таблица 1. Показатели функциональных тестов и КТ ОГК в группах детей в зависимости от наличия (группа 0) или отсутствия (группа 1) снижения DLCO-SBVA
Возраст, лет | 16,1 [14,5; 16,5] | 14,4 [11,7; 16,3] | 9 | 19 | 0,117 |
КСО-BP, %Д | 96,4 [88,3; 106,1] | 114,9 [102,3; 126,0] | 9 | 19 | 0,010 |
КСО-SB, %Д | 117,2 [110,1; 122,7] | 114,7 [101,0; 128,0] | 9 | 19 | 0,633 |
КСО-SBVA, %Д | 83,3 [81,4; 87,0] | 104,1 [94,9; 112,3] | 9 | 19 | 0,000 |
DLСО-SBVA, %Д | 68,8 [64,5; 75,8] | 101,4 [94,9; 115,7] | 9 | 19 | 0,000 |
DLСО-SB, %Д | 91,7 [86,6; 94,5] | 119,2 [110,7; 130,8] | 9 | 19 | 0,000 |
ООЛ / ОЕЛ (SB), % | 33,1 [30,7; 34,9] | 33,1 [26,8; 39,5] | 9 | 19 | 0,809 |
VA / ОЕЛ (SB), % | 97,1 [96,5; 97,2] | 97,8 [97,5; 98,1] | 9 | 19 | 0,000 |
БС, %Д | 325,2 [187,9; 488,0] | 140,6 [93,0; 194,0] | 9 | 19 | 0,019 |
ОЕЛ-BP, %Д | 89,0 [82,3; 95,8] | 95,5 [88,3; 106,1] | 9 | 19 | 0,263 |
ЖЕЛ-BP, %Д | 65,0 [44,7; 74,9] | 88,0 [75,8; 93,8] | 9 | 19 | 0,009 |
ВГО, %Д | 136,1 [112,7; 153,0] | 100,0 [78,7; 184,0] | 9 | 19 | 0,383 |
ООЛ, %Д | 197,3 [112,4; 251,2] | 97,8 [97,5; 98,1] | 9 | 19 | 0,028 |
ООЛ / ОЕЛ (BP), % | 48,4 [30,6; 60,8] | 24,5 [19,9; 35,5] | 9 | 19 | 0,011 |
ООЛ / ОЕЛ (BP), %Д | 224,8 [141,7; 284,8] | 115,1 [92,2; 163,8] | 9 | 19 | 0,010 |
z-score ИМТ | -1,6 [-3,3; -0,9] | -1,0 [-2,0; -0,4] | 9 | 19 | 0,332 |
Hb | 137,0 [130,0; 145,0] | 130,0 [124,0; 138,0] | 9 | 19 | 0,129 |
Рh | 7,401 [7,386; 7,423] | 7,411 [7,391; 7,427] | 8 | 17 | 0,669 |
pСО2 (мм рт. ст.) | 41,5 [40,5; 43,2] | 39,1 [36,7; 41,6] | 8 | 17 | 0,049 |
pО2 (мм рт. ст.) | 66,9 [64,3; 71,6] | 68,9 [64,2; 75,5] | 8 | 17 | 0,549 |
Лактат | 2,2 [1,8; 2,6] | 2,2 [1,6; 2,6] | 8 | 17 | 0,887 |
Концентрация бикарбоната | 25,4 [24,7; 25,9] | 24,3 [23,1; 25,6] | 8 | 17 | 0,120 |
ФЖЕЛ, %Д | 63,8 [45,3; 79,2] | 90,1 [76,4; 109,3] | 9 | 19 | 0,019 |
ОФВ1, %Д | 51,8 [27,3; 69,0] | 95,2 [67,8; 108,9] | 9 | 19 | 0,006 |
ОФВ1 / ФЖЕЛ, %Д | 71,8 [66,3; 88,6] | 101,5 [93,9; 104,5] | 9 | 19 | 0,001 |
ПСВ, %Д | 62,0 [51,5; 85,1] | 102,0 [73,0; 114,1] | 9 | 19 | 0,028 |
МОС 25, %Д | 37,0 [24,0; 79,7] | 102,0 [73,0; 121,8] | 9 | 19 | 0,006 |
МОС 50, %Д | 29,3 [17,3; 52,0] | 97,0 [57,7; 128,6] | 9 | 19 | 0,003 |
МОС 75, % | 15,6 [13,7; 35,2] | 77,8 [39,1; 122,2] | 9 | 19 | 0,003 |
МОС 25–75, %Д | 15,2 [13,7; 23,6] | 55,3 [43,4; 62,1] | 9 | 19 | 0,013 |
КТ, суммарный балл | 147,5 [128; 180,8] | 77,25 [30,8; 105,5] | 7 | 15 | 0,001 |
Бронхоэктазы, балл | 54,75 [48,3; 60,3] | 23 [5,8; 49,3] | 7 | 15 | 0,002 |
Мукоидные пробки, балл | 27 [23; 3] | 11 [3; 20] | 7 | 15 | 0,001 |
Перибронх. утолщ., балл | 39,5 [35,3; 5] | 21 [17; 21,75] | 7 | 15 | 0,003 |
Паренхима, балл | 13 [12; 16] | 5 [1; 9] | 7 | 15 | 0,003 |
Распр. паренх. утолщ., балл | 5 [5; 7] | 1 [1; 4] | 7 | 15 | 0,006 |
«Матовое стекло», балл | 6 [4; 10] | 2 [0; 3] | 7 | 15 | 0,011 |
Кисты или буллы, балл | 1 [1; 1] | 0 [0; 0] | 7 | 15 | 0,030 |
Зоны пов. воздушн., балл | 11 [10; 20] | 8 [0; 14] | 7 | 15 | 0,078 |
Примечание: красным выделены статистически значимые (p < 0,05) различия.
Рисунок 4. Различия функциональных показателей и структурных изменений у пациентов в зависимости от DLCO-SBVA
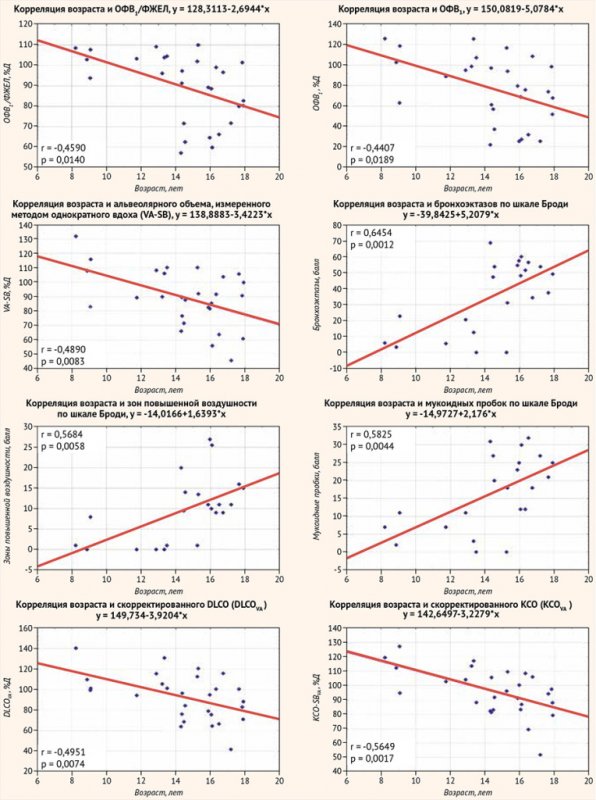
Возраст в вышеуказанных группах не различался (р > 0,05), однако значимо коррелировал с показателями DLCO-SB, VA-SB, DLCO-SBVA, KCO-SBVA, но не с KCO-SB и KCO-BP. Кроме того, возраст значимо коррелировал среди показателей СПМ с ОФВ1, ОФВ1/ФЖЕЛ, МОС 50 и МОС 75, а по КТ ОГК – с суммарным баллом, бронхоэктазами, мукоидными пробками и зонами повышенной воздушности (рис. 5). Среди показателей БПГ слабая незначимая связь (имеющая характер тенденции) с возрастом была обнаружена только для ООЛ (%Д) (r = 0,351; р = 0,067) и ООЛ/ОЕЛ (%Д) (r = 0,333; р = 0,083).
Рисунок 5. Корреляции возраста и показателей легких у пациентов
Показатели КТ ОГК по шкале Броди лучше коррелировали с DLCO-SBVA, KCO-SBVA, чем с DLCO-SB и KCO-BP, а с KCO-SB корреляции выявлено не было. KCO-BP и DLCO-SB в целом хуже отражал состояние легких, чем показатели, скорректированные по альвеолярному объему, однако KCO-BP, но не KCO-SBVA значимо был обратно связан с показателем зон повышенной воздушности по КТ ОГК, что, вероятно, обусловлено увеличением ОЕЛ-BP (и, следовательно, VA-BP) за счет ООЛ-BP (табл. 2). Среди всех обследованных VA-BP (Me = 97,4 (min-max: 64,4–119,1) %Д) был выше VA-SB (Me = 89,8 (min-max: 45,7–132,0) %Д), однако различия не были статистически значимы (p = 0,092). Для пациентов, которым проводилось КТ ОГК, различия альвеолярных объемов были аналогичными: VA-BP (Me = 101,4 (min-max: 65,7–119,1) %Д) и VA-SB (Me = 91,9 (min-max: 45,7–132,0) %Д, p = 0,149. Таким образом, представляется сомнительным определение диффузионной способности в том альвеолярном объеме, который рассчитан методом БПГ.
Таблица 2. Корреляции показателей исследования диффузионной способности легких, возраста и ОФВ1 с показателями КТ ОГК по шкале Броди
Показатели | Статистические данные | ||||||||||
|
|
|
|
|
| ||||||
|
|
|
|
|
|
| |||||
|
|
|
|
|
|
| |||||
|
|
|
|
|
|
| |||||
|
|
|
|
|
|
| |||||
|
|
|
|
|
|
| |||||
|
|
|
|
|
|
| |||||
|
|
|
|
|
|
| |||||
ООЛ-BP |
|
|
|
|
|
| |||||
ООЛ/ОЕЛ (BP) |
|
|
|
|
|
| |||||
Примечание: красным выделены статистически значимые (p < 0,05) n = 22.
По результатам проведенного исследования выявлено, что у большинства пациентов с муковисцидозом показатели диффузионного теста были в пределах нормы, а снижение наблюдалось только у пациентов старше 14 лет параллельно с усугублением бронхоэктазии.
Выводы
Таким образом, полученные предварительные результаты позволяют сделать вывод об информативности исследования диффузионной способности легких в клинической практике при ведении детей с муковисцидозом. Кроме того, для повышения информативности метода целесообразна корректировка полученных результатов с поправкой на альвеолярный объем, т. к. при интерпретации результатов диффузионного теста без этой коррекции снижение диффузионной способности легких у некоторых пациентов может быть пропущено или недооценено.
В связи с вышеизложенным необходимы дальнейшие исследования диффузионной способности легких с корректировкой на альвеолярный объем на большей выборке детей с муковисцидозом, особенно старшего возраста и с тяжелым течением заболевания.
Список литературы / References
- Баранов А.А., Намазова-Баранова Л.С., Куцев С.И., Авдеев С.Н., Полевиченко Е.В., Белевский А.С. и др. Кистозный фиброз (муковисцидоз): клинические рекомендации. М.; 2021. Режим доступа: https://mukoviscidoz.org/doc/КР372.pdf.
- Лукина О.Ф. Особенности исследования функции внешнего дыхания у детей и подростков. Практическая пульмонология. 2017;(4):39-43. Режим доступа: https://cyberleninka.ru/article/n/osobennosti-issledovaniya-funktsii-vneshnego-dyhaniya-u-detey-i-podrostkov.
- Савушкина О.И., Неклюдова Г.В., Черняк А.В. Теоретические, методические и клинические аспекты исследования диффузионной способности легких. Бюллетень физиологии и патологии дыхания. 2016;(59):119-124. Режим доступа: https://cfpd.elpub.ru/jour/article/view/911.
- Айсанов З.Р., Каменева М.Ю., Черняк А.В., Перельман Ю.М., Приходько А.Г., Чушкин М.И. и др. Спирометрия. М.; 2021. 62 с. Режим доступа: https://spulmo.ru/upload/spirometriya_16_12_2021_extEd.pdf?t=1.
- Чучалин А.Г., Айсанов З.Р., Чикина С.Ю., Черняк А.В., Калманова Е.Н. Федеральные клинические рекомендации Российского респираторного общества по использованию метода спирометрии. Пульмонология. 2014;(6):11-24. Режим доступа: https://journal.pulmonology.ru/pulm/article/view/488.
- Vilozni D., Dagan A., Sarouk I., Bar-Aluma B.E., Ashkenazi M., Bezalel Y., Efrati O. Advanced Lung Disease in Patients with Cystic Fibrosis Is Associated with Low Diffusion capacity. Isr Med Assoc J. 2020;22(12):770-774. Available at: https://pubmed.ncbi.nlm.nih.gov/33381950.
- Espiritu J.D., Ruppel G., Shrestha Y., Kleinhenz M.E. The diffusing capacity in adult cystic fibrosis. Respir Med. 2003;97:606-611. https://doi.org/10.1053/rmed.2003.1487.
- Chemery L., Fekete K., Guillot S., Roussey M., Desrues B., Dabadie A. et al. Diffusing capacity for carbon monoxide (T(LCO)) and oxygen saturation during exercise in patients with cystic fibrosis. Arch Pediatr. 2004;11(9):1060-1066. https://doi.org/10.1016/j.arcped.2004.04.019.
- Merkus P.J., Govaere E.S., Hop W.H., Stam H., Tiddens H.A., de Jongste J.C. Preserved diffusion capacity in children with cystic fibrosis. Pediatr Pulmonol. 2004;37(1):56-60. https://doi.org/10.1002/ppul.10357.
- Амелина Е.Л., Марченков Я.В., Черняк А.В., Красовский С.А. Количественная оценка результатов компьютерной томографии высокого разрешения органов грудной клетки у взрослых больных муковисцидозом. Пульмонология. 2009;(1):59-66. https://doi.org/10.18093/0869-0189-2009-0-1-59-66.
- Черняк А.В., Неклюдова Г.В., Красовский С.А., Михайличенко К.Ю., Науменко Ж.К., Поливанов Г.Э. Метод вымывания азота при множественном дыхании и структурные изменения бронхолегочной системы у взрослых больных муковисцидозом. Пульмонология. 2020;(2):193-203. https://doi.org/10.18093/0869-0189-2020-30-2-193-203.
- Keens T.G., Mansell A., Krastins I.R., Levison H., Bryan A.C., Hyland R.H., Zamel N. Evaluation of the single-breath diffusing capacity in asthma and cystic fibrosis. Chest. 1979;76(1):41-44. https://doi.org/10.1378/chest.76.1.41.
- Wheatley C.M., Foxx-Lupo W.T., Cassuto N.A., Wong E.C., Daines C.L., Morgan W.J., Snyder E.M. Impaired lung diffusing capacity for nitric oxide and alveolar-capillary membrane conductance results in oxygen desaturation during exercise in patients with cystic fibrosis. J Cyst Fibros. 2011;10(1):45-53. https://doi.org/10.1016/j.jcf.2010.09.006.
- Dressel H., Filser L., Fischer R., Marten K., Müller-Lisse U., de la Motte D. et al. Lung diffusing capacity for nitric oxide and carbon monoxide in relation to morphological changes as assessed by computed tomography in patients with cystic fibrosis. BMC Pulm Med. 2009;9:30. https://doi.org/10.1186/1471-2466-9-30.
- de Jong P.A., Nakano Y., Lequin M.H., Mayo J.R., Woods R., Paré P.D., Tiddens H.A. Progressive damage on high resolution computed tomography despite stable lung function in cystic fibrosis. Eur Respir J. 2004;23(1):93-97. https://doi.org/10.1183/09031936.03.00006603.
- Cotes J.E., Chinn D.J., Quanjer P.H., Roca J., Yernault J.C. Standardization of the measurement of transfer factor (diffusing capacity). Eur Respir J. 1993;6(16 Suppl.):41-52. https://doi.org/10.1183/09041950.041s1693.
- Harris E.A., Seelye E.R., Whitlock R.M. Revised standards for normal resting dead-space volume and venous admixture in men and women. Clin Sci Mol Med. 1978;55(1):125-128. https://doi.org/10.1042/cs0550125.
- Измерение диффузионной способности легких по монооксиду углерода методом одиночного вдоха: стандарты Американского торакального и Европейского респираторного обществ (часть 2). Пульмонология. 2019;(3):269-291. https://doi.org/10.18093/0869-0189-2019-29-3-269-291.
- Johnson D.C. Importance of adjusting carbon monoxide diffusing capacity (DLCO) and carbon monoxide transfer coefficient (KCO) for alveolar volume. Respir Med. 2000;94(1):28-37. https://doi.org/10.1053/rmed.1999.0740.
- Kim Y.-J., Hall G.L., Christoph K., Tabbey R., Yu Z., Tepper R.S., Eigen H. Pulmonary diffusing capacity in healthy caucasian children. Pediatr Pulmonol. 2011;47(5):469-475. https://doi.org/10.1002/ppul.21564.
- Thomas A., Hanel B., Marott J., Buchvald F., Mortensen J., Nielsen K.G. The single-breath diffusing capacity of CO and NO in healthy children of European descent. PLoS ONE. 2014;9(12):e113177. https://doi.org/10.1371/journal.pone.0113177.
- Дьякова С.Э., Мизерницкий Ю.Л. Новые возможности исследования функции внешнего дыхания у детей. Российский вестник перинатологии и педиатрии. 2018;(4):79-83. Режим доступа: https://www.pedperinatology.ru/jour/article/view/700.
- Zapletal A., Samanek M., Paul T. Lung function in children and adolescents. Methods, Reference Values. 1987;22:114-218.



 1
1 2
2 3
3 4
4


Комментарии (0)