
Журнал "Медицинский совет" №1/2024
DOI: 10.21518/ms2024-002
И.Н. Захарова1, И.В. Бережная1, Е.В. Скоробогатова2
Д.К. Дмитриева1, М.А. Черняева3, Д.М. Курбакова3
1 Российская медицинская академия непрерывного профессионального образования; 125993, Россия, Москва, ул. Баррикадная, д. 2/1, стр. 1
2 Детская городская клиническая больница имени З.А. Башляевой; 25373, Россия, Москва, ул. Героев Панфиловцев, д. 28
3 Северный государственный медицинский университет; 163000, Россия, Архангельск, Троицкий проспект, д. 51
Кишечная микробиота – один из основных компонентов, влияющих на состояние здоровья человека. Становление микрофлоры кишечника начинается уже во внутриутробном периоде, однако наиболее интенсивная колонизация ребенка микроорганизмами матери и окружающей среды происходит в интранатальном и постнатальном периодах. Начало формирования микробиоты закладывает система «мать – плацента – плод». Материнская микробиота начинает изменяться во время беременности для модификации метаболизма, благоприятного для плода, и продолжается в течение всей беременности, оказывая влияние и на зарождение собственной микробиоты плода. На развитие микробиома плода также влияет микробиом матки, околоплодных вод и пуповины, хотя ранее считалось, что эти органы стерильны, как и кишечник плода. В ходе многолетних исследований данные утверждения были опровергнуты и в т. ч. было доказано существование отдельного микробиома мекония, не совпадающего с микробиотой матери. Постнатальные факторы, такие как способ родоразрешения и тип вскармливания, также влияют на становление кишечной микробиоты. Естественные роды подвергают младенцев воздействию влагалищной микробиоты матери. При кесаревом сечении ребенок подвергается воздействию микробиоты окружающей среды, что нарушает естественную микробную колонизацию. Грудное молоко обладает собственным микробиомом, который может меняться и подстраиваться под потребности ребенка. Исключительно грудное вскармливание влияет на уровень колонизации Bifidobacterium и Bacteroides, которые метаболизируют олигосахариды грудного молока, в качестве побочного продукта продуцируя короткоцепочечные жирные кислоты. Для поддержания уровня Bifidobacterium на достаточном уровне с целью формирования здоровой микробиоты может быть использована пробиотическая терапия. В данном обзоре представлены этапы и условия формирования микробиоты кишечника младенца, а также их взаимосвязь в процессе онтогенеза.
Для цитирования: Захарова ИН, Бережная ИВ, Скоробогатова ЕВ, Дмитриева ДК, Черняева МА, Курбакова ДМ. Формирование микробиоты младенца: мать – плацента – плод – ребенок. Медицинский совет. 2024;18(1):269–275. https://doi.org/10.21518/ms2024-002.
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Вклад авторов: авторы внесли равный вклад на всех этапах работы и написания статьи.
Infant microbiota formation: mother – placenta – fetus – baby
Irina N. Zakharova1, Irina V. Berezhnaya1, Ekaterina V. Skorobogatova2
Diana K. Dmitrieva1, Maria A. Chernyaeva3, Daria M. Kurbakova3
1 Russian Medical Academy of Continuing Professional Education; 38, Smolnaya St., Moscow, 125445, Russia
2 Bashlyaeva Children’s City Clinical Hospital; 28, Geroev Panfilovtsev St., Moskow, 125373, Russia
3 Northern State Medical University; 51, Troitsky Ave., Arkhangelsk, 163004, Russia
Gut microbiota is one of the main components that influence human health status. The gut microflora begins to establish as early as the prenatal period, however, the most intensive colonization of the infant by maternal and environment microorganisms occurs during the intranatal and postnatal periods. The mother-placenta-fetus system lays the foundation for early formation of microbiota. The maternal microbiota starts changing during pregnancy in order to modify metabolism to make it more favourable to the fetus, and continues throughout pregnancy, influencing the incubation of the fetus's own microbiota. The development of the fetal microbiome is also affected by the microbiome of the uterus, amniotic fluid and umbilical cord, although these organs were previously thought to be sterile, like the fetal gut. Multi-year research findings refuted these assertions and proved the existence of a separate meconium microbiome, which does not coincide with the maternal microbiota. The postnatal factors, such as mode of delivery and type of infant feeding, also influence the development of the gut microbiota. Vaginal birth exposes infants to maternal vaginal microbiota. During cesarean section, infants are exposed to environmental microbiota, which disrupts natural microbial colonization. Breast milk has its own microbiome, which can change and adapt to the infant needs. Exclusive breastfeeding affects Bifidobacterium and Bacteroides colonization rates, which metabolize breast milk oligosaccharides, producing short-chain fatty acids as a byproduct. Probiotic therapy can be used to maintain sufficient levels of Bifidobacterium to form a healthy microbiota. This review presents the stages and conditions for the formation of the infant’s gut microbiota, as well as the relationship between them in the course of ontogenesis.
For citation: Zakharova IN, Berezhnaya IV, Skorobogatova EV, Dmitrieva DK, Chernyaeva MA, Kurbakova DM. Infant microbiota formation: mother – placenta – fetus – baby. Meditsinskiy Sovet. 2024;18(1):269–275. (In Russ.) https://doi.org/10.21518/ms2024-002.
Conflict of interest: the authors declare no conflict of interest.
Contribution of authors: all authors contributed equally to this work and writing of the article at all stages.
Введение
Микробиом эволюционировал вместе с человеком на протяжении всей истории. Несмотря на достигнутые успехи в изучении микробиома, все еще отсутствуют (или минимальны) данные насчет формирования микробиома некоторых органов, например, несколько затруднительным представляется изучение внутриутробной флоры плода. Наиболее изученным считается микробиом кишечника, активно изучаются оси микробиома: «кишечник – мозг», «кишечник – кожа», «кишечник – почка», «кишечник – кость» и др. Проект «Микробиом человека» сообщает о выделении только из фекалий человека более 3 000 видов бактерий [1]. При этом микробиом остается уникальным для каждого человека. На настоящий момент достоверно известно, что человеческий микробиом выполняет множество важных функций – от участия непосредственно в процессе переваривания пищи до формирования иммунитета. Также микробиота оказывает действие на психологическое здоровье и психические состояния. Нарушения в формировании и созревании микробиоты кишечника могут привести к пожизненным патологическим состояниям, например воспалительным заболеваниям кишечника, бронхиальной астме, сахарному диабету 1-го типа [2]. Микробиота кишечника влияет на энергетический баланс человека, извлекая энергию из неперевариваемых компонентов питания. Соединяясь с мозгом посредством нейронных связей, микробиом производит или способствует производству химических веществ, используемых мозгом для регулирования основных физиологических процессов и психических функций, таких как обучение, память и настроение. Некоторые штаммы Lactobacillus и Bifidobacterium производят гамма-аминомасляную кислоту (ГАМК) [3], которая является доминирующим нейротрансмиттером, ингибирующим нервные импульсы. Другие виды бактерий, такие как Enterococcus и Escherichia, а также некоторые штаммы Candida, способствуют образованию серотонина.
Пренатальное становление кишечной микробиоты
Система «мать – плацента – плод» закладывает начало формирования микробиоты будущего новорожденного. Нормальная вагинальная флора у беременных женщин состоит из Lactobacillus, Gardnerella, Prevotella, Sneathia, Atopobium, Dialister и Mega-sphaera [4]. Во время беременности материнский микробиом меняется. Отмечается увеличение бактериальной нагрузки, со второго триместра значительно изменяется кишечный микробиом: альфа-разнообразие уменьшается, увеличивается численность Actinobacteria и Proteobacteria, а в третьем триместре снижается уровень продуцирующей бутират Faecalibacterium и повышается бета-разнообразие [5]. Перед родами снижаются титры Lactobacillus. Онтогенетический смысл изменений кишечной микробиоты в период беременности приспособительный: модификация направленности метаболизма, благоприятного для внутриутробно растущего плода [6].
Ранее считалось, что матка, а следовательно, и плод, и его кишечник полностью стерильны и собственным микробиомом не обладают. Плацента считалась барьером, предотвращающим контакт плода с материнским микробиомом. Однако в ходе исследований было обнаружено разнообразие микроорганизмов в меконии новорожденного ребенка, наличие собственного микробиома матки, околоплодных вод, пуповины и даже наличие в плаценте микропластика [7, 8]. Нестерильность мекония впервые была продемонстрирована в 2008 г. E. Jiménez на 21 новорожденных детях, преимущественно были выделены роды Enterococcus и Staphylococcus. Более того, авторы продемонстрировали, что при пероральном введении матери специфического штамма Enterococcus faecium он далее обнаруживался в микробном содержимом кишечника новорожденного [9]. Бактериальное разнообразие мекония в т. ч. зависит от срока гестации, и чем меньше гестационный возраст, тем ниже разнообразие и микробная колонизация [10]. Микроорганизмы обнаруживаются и в амниотической жидкости (рис. 1).
Рисунок 1. Микробиота матери влияет на будущий микробиом плода
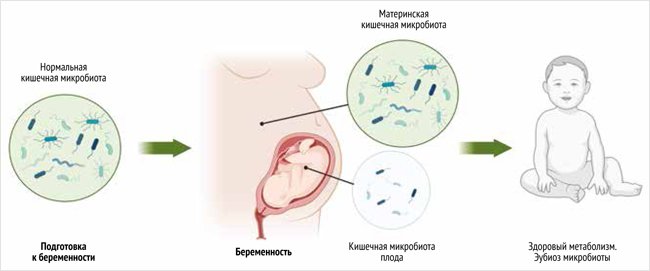
Околоплодные воды в развитии микробиоты желудочно-кишечного тракта
Существование микробиоты околоплодных вод остается спорным вопросом. Традиционно обнаружение микроорганизмов в амниотической жидкости считалось неблагоприятным маркером инфекционного процесса, однако современные исследования как на мышиных, так и на человеческих моделях стойко демонстрируют наличие неинфекционной микробиоты в околоплодных водах. Например, в исследовании M. Collado в 2016 г. были проанализированы образцы фекалий матери, плаценты, околоплодных вод, молозива, мекония и фекалий младенцев у 15 пар «мать – ребенок», рассматривались только доношенные дети, родившиеся путем планового кесарева сечения (для исключения переноса бактерий во время вагинальных родов). Образцы были проанализированы при помощи 16S рРНК-секвенирования. Наиболее распространенным типом микроорганизмов в околоплодных водах оказались протеобактерии с преобладанием Enterobacter, Escherichia и Shigella, вторым типом оказались Propionibacterium, и в менее чем в 1% встречались Streptococcus и Staphylococcus. Lactobacillus присутствовали в околоплодных водах в 1,5% от общего количества бактерий [11]. Таким образом, было продемонстрировано, что околоплодные воды содержат уникальные микробиомные сообщества, хотя само происхождение внутриутробных микроорганизмов все еще доподлинно неизвестно. Неясно, как осуществляется отбор определенных микробов в околоплодных водах; очевидным является взаимодействие между типичными факторами окружающей среды (например, pH, уровнем кислорода, источниками углерода), врожденным и приобретенным иммунитетом [6]. Высказывается предположение, что мекониальный микробиом происходит в т. ч. из проглоченных околоплодных вод [12]. Первое заглатывание околоплодных вод регистрируется уже на сроке 10 нед. гестации, а в последнем триместре плод может заглатывать до литра околоплодных вод в день [6].
Роль плаценты в формировании микробиоты плода
Нормальное функционирование плаценты необходимо для роста и развития плода, а также для защиты плода от микробных патогенов. Установление состава собственного микробиома плаценты является несколько затруднительной задачей, т. к. микробное обсеменение плаценты длительное время считалось четким маркером инфекционного процесса. В настоящее время с помощью новейших методов секвенирования удалось установить, что плацентарный микробиом характеризуется преобладанием протеобактерий по сравнению с другими участками тела и преимущественно состоит из непатогенной комменсальной микробиоты Firmicutes, Tenericutes, Bacteroidetes и Fusobacteria. Кроме того, в других исследованиях было обнаружено, что выделяемые из плаценты таксоны представляют собой виды, характерные скорее для полости рта, чем урогенитального тракта [13]. Например, Fusobacterium nucleatum, прикрепляясь к эпителиальным и эндотелиальным клеткам хозяина с помощью адгезина FadA, оказывает влияние на проницаемость и способен связывать сосудистый эндотелий. Кроме того, Fusobacterium nucleatum, вероятно, служит фактором стимуляции для E. coli – также широко распространенного таксона, выделенного из плаценты, а их совместное взаимодействие усиливало проницаемость эндотелия для E. coli. Это любопытное наблюдение коррелирует с известной связью заболеваний пародонта и риском преждевременных родов [14].
Исследование M. Stout в 2013 г. на 195 пациентах продемонстрировало наличие грамположительных и грамотрицательных бактерий в базальной пластинке. Внутриклеточные бактериальные включения обнаруживались в 26% случаев при самостоятельных родах в срок и в 54% случаев при преждевременных родах (р = 0,02), хориоамнионит встречался только у 17% пациентов. Проведенное исследование демонстрирует источником возможной внутриутробной колонизации базальную пластинку плаценты [15].
Особенности плаценты – анатомические, физиологические и иммунологические – направлены на предотвращение бактериальной колонизации. Однако микроорганизмы и вирусы способны преодолевать многоуровневую защиту, обеспечиваемую этими барьерами. Такими микроорганизмами являются Treponema pallidum, Toxoplasma gondii, Listeria monocytogenes, Plasmodium spp., Brucella spp., энтеровирусы, вирус краснухи, парвовирус [16].
Связь между способом родоразрешения и микробиотой новорожденного
Способ родоразрешения является одним из основополагающих факторов становления микробной флоры младенца [17]. Естественные роды подвергают младенцев воздействию микробов, которые колонизируют родовые пути матери. Это приводит к тому, что микробиота кишечника новорожденных аналогична микробиоте их матери и микрофлоре влагалища матери, где присутствует род Bifidobacterium – B. longum и B. catenulatum spp. Напротив, совпадения микробиоты матерей и детей, рожденных путем кесарева сечения, не наблюдалось. Микробиота была представлена Enterobacter hormaechei, E. cancerogenus; Staphylococcus saprophyticus, S. lugdunensis, S. aureus; Streptococcus australis; Haemophilus parainfluenzae, H. aegyptius, H. influenzae, H. haemolyticus и Veillonella dispar, V. parvula [18]. Основным источником микроорганизмов для детей, рожденных путем кесарева сечения, является окружающая среда (операционный инструментарий, микрофлора родильного зала, палат, медицинского персонала и других новорожденных), что вместе с более длительными сроками пребывания в роддоме повышает риск инфицирования госпитальными штаммами (рис. 2) [19].
Рисунок 2. Формирование кишечной микробиоты [19]
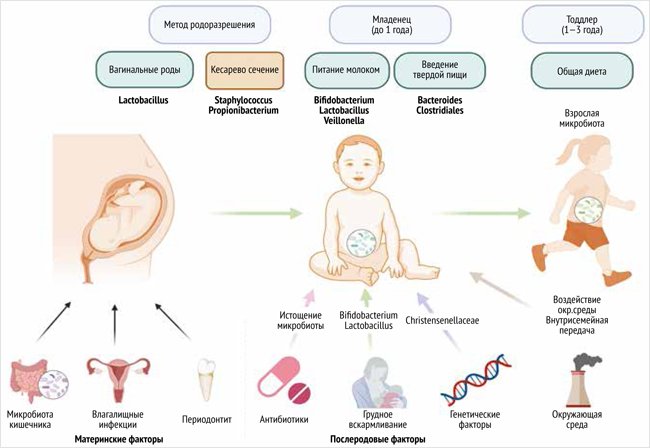
Кесарево сечение нарушает микробную колонизацию, что может привести к долгосрочным метаболическим последствиям. Кроме того, существуют более высокие риски приобрести атопические заболевания в течение первых двух лет после рождения у детей, родившихся после кесарева сечения, по сравнению с детьми, рожденными естественным путем [20].
Микрофлора, характерная для первого дня жизни: Leuconostoc citreum, Streptococcus mitis, Enterobacter spp., Lactococcus lactis, на 2-й день жизни присоединяется Escherichia coli, Enterococcus faecalis, Enterobacter, S. mitis и Streptococcus salivarius. Для 6-го дня жизни характерны Clostridium difficile, Enterobacter sp., Citrobacter, Enterobacter cloacae и E. coli [19]. Микробный состав фекалий младенцев первой недели жизни значительно отличается от состава мекония, а на 3–4-й день жизни микробиота имеет значительное сходство с микробным составом молозива, что подтверждает вклад бактерий, содержащихся в грудном молоке, в становление и развитие кишечной флоры новорожденного [11, 21].
Роль грудного вскармливания
Исключительно грудное вскармливание рекомендуется Всемирной организацией здравоохранения минимум до 6 мес., а сохранение грудного вскармливания – до 2 лет1 [22]. Грудное молоко – богатый источник микроэлементов и макронутриентов, его состав меняется с ростом ребенка, подстраиваясь под новые пищевые потребности. Грудное молоко также обладает собственным изменяемым микробиомом. В нем доминируют стафило- и стрептококки, а также Lactobacilliaceae, Corynebacteriaceae и др. [23]. Исключительно грудное вскармливание снижает распространенность этих бактерий (в пользу Bifidobacteria и Bacteroides) [24]. Еще одним важным элементом состава грудного молока являются олигосахариды: группа гликанов с лактозным основанием, линейными или разветвленными сахарами (глюкозы, галактозы, фукозы, N-ацетилглюкозамина, N-ацетилнейраминовой кислоты или сиаловой кислоты). Вследствие того, что олигосахариды не расщепляются пищеварительными ферментами в кишечном тракте младенца, они могут достигать дистального отдела подвздошной и толстой кишки. Например, гликозилированные или фукозилированные олигосахариды имеют структуру, аналогичную гликозилированным фрагментам, которые присутствуют в кишечном эпителии. До идентификации их структуры считалось, что олигосахариды представляют собой гликопротеины или гликолипиды, секретируемые эпителием молочной железы. Это сходство позволяет им подавлять связывание определенных бактерий с эпителием, таких как Streptococcus pneumoniae и Campylobacter jejuni, препятствуя адгезии бактерий к эпителиальным клеткам [25].
Bifidobacterium и Bacteroides метаболизируют олигосахариды и используют их в качестве источника энергии. Побочным продуктом данного процесса являются короткоцепочечные жирные кислоты (КЦЖК). Таким образом, данный процесс можно рассматривать как способ формирования здорового микробиома, так и доставку КЦЖК в кишечник младенцев, у которых отсутствуют условия для переваривания клетчатки. Вследствие того, что единственным источником олигосахаридов является молоко, младенцы, получающие грудное молоко, в первые несколько недель имеют повышенное содержание облигатных анаэробов, таких как Bacteroides и Bifidobacterium, по сравнению с детьми, вскармливаемыми смесью. Продолжительность грудного вскармливания влияет на количество Bifidobacterium у младенцев [26]. Страны с более высокими показателями продолжительности грудного вскармливания имеют около 80–90% колонизации Bifidobacterium longum subsp. infantis, тогда как у младенцев из стран с низкой средней продолжительностью грудного вскармливания наблюдалось около 0,7–14% Bifidobacterium longum subsp. infantis [25].
Дети, рожденные посредством кесарева сечения, дети на искусственном вскармливании и в некоторых случаях дети на грудном вскармливании особенно нуждаются в достаточном уровне Bifidobacterium. В таких случаях, для того чтобы скорректировать формирование микробиома в сторону эубиоза, на помощь могут прийти пробиотические препараты. Единственное в России сочетание комбинации штаммов Bifidobacterium longum СЕСТ7894 и Pediococcus pentosaceus CECT8330, аналогичной штаммам эубиотической микробиоты, представлено пробиотическим препаратом Бифистим Бэби. Bifidobacterium longum ингибирует условно-патогенные бактерии и эффективно подавляет их рост, не позволяя нарушить равновесие микробиоты. Pediococcus pentosaceus оказывает противовоспалительный эффект за счет индукции противовоспалительных цитокинов (IL10) и проявляет высокоадгезивные качества на клетках кишечного эпителия, защищая от прикрепления нежелательной флоры. Синергетическое действие этих штаммов способствует формированию здоровой микрофлоры кишечника ребенка, облегчает и снижает частоту колик у младенцев, а также оказывает влияние на укрепление иммунитета [27]. Комбинация штаммов Bifidobacterium longum СЕСТ7894 и Pediococcus pentosaceus CECT8330, как продемонстрировали клинические исследования, уменьшает симптомы функциональных нарушений желудочно-кишечного тракта и показывает эффективность при уменьшении выраженности младенческих колик, достоверно уменьшая время вызванного коликами плача на 2-й день терапии. На 7-е сут. приема время плача сокращалось на 70% [28, 29]. Пробиотический препарат Бифистим Бэби выпускается в удобных для приема у новорожденных каплях (6 капель 1 раз в день, курс приема 3–4 нед. или дольше), может применяться у детей с рождения и в т. ч. рекомендован к приему для пробиотического лечения младенческих колик.
Здоровая микробиота играет критически важную роль в развитии, созревании и дифференциации иммунной системы кишечника, что оказывает значительное влияние на физическое и умственное развитие ребенка. Патогенная микрофлора кишечника является потенциально опасным фактором для развития различных заболеваний как в желудочно-кишечном тракте, так и за его пределами.
Заключение
Созревание микробиоты желудочно-кишечного тракта – длительный и сложный процесс, который начинается внутриутробно и продолжается после рождения. Материнская вагинальная микрофлора, окружающая плод, является одним из факторов успешного вынашивания, а также развития врожденной иммунной системы новорожденного. Гастроинтестинальный тракт детей, рожденных естественным путем, частично заселяется микрофлорой матери, что способствует защите организма ребенка от патогенных и условно-патогенных микроорганизмов, снижает риски развития хронических заболеваний. Грудное молоко обладает высокой степенью усвояемости, содержит антитела против бактерий и вирусов, способствует формированию здорового микробиома младенца. Происхождение внутриутробной флоры все еще доподлинно не установлено. Требуются дальнейшие исследования для уточнения механизмов колонизации, а также изучение транспортных путей материнской кишечной флоры в молочную железу и к фетоплацентарному комплексу.
1 Всемирная организация здравоохранения: питание детей грудного и раннего возраста. Режим доступа: https://www.who.int/.
Список литературы / References
- Saeed NK, Al-Beltagi M, Bediwy AS, El-Sawaf Y, Toema O. Gut microbiota in various childhood disorders: Implication and indications. World J Gastroenterol. 2022;28(18):1875–1901. doi: 10.3748/wjg.v28.i18.1875.
- Rutayisire E, Huang K, Liu Y, Tao F. The mode of delivery affects the diversity and colonization pattern of the gut microbiota during the first year of infants’ life: a systematic review. BMC Gastroenterol. 2016;16(1):86. doi: 10.1186/s12876-016-0498-0.
- Barrett E, Ross RP, O’Toole PW, Fitzgerald GF, Stanton C. γ-Aminobutyric acid production by culturable bacteria from the human intestine. J Appl Microbiol. 2012;113(2):411–417. doi: 10.1111/j.1365-2672.2012.05344.x.
- Смирнова НН, Новикова ВП, Куприенко НБ, Прокопьева НЭ, Хавкин АИ. Влияние микробиома репродуктивного тракта женщины на внутриутробное и постнатальное развитие ребенка. Вопросы гинекологии, акушерства и перинатологии. 2022;21(6):107–112. doi: 10.20953/1726-1678-2022-6-107-112. / Smirnova NN, Novikova VP, Kuprienko NB, Prokopyeva NE, Khavkin AI. Influence of female reproductive tract microbiome on prenatal and postnatal child development. Gynecology, Obstetrics and Perinatology. 2022;21(6):107–112. (In Russ.) doi: 10.20953/1726-1678-2022-6-107-112.
- Koren O, Goodrich JK, Cullender TC, Spor A, Laitinen K, Bäckhed HK et al. Host remodeling of the gut microbiome and metabolic changes during pregnancy. Cell. 2012;150(3):470–480. doi: 10.1016/j.cell.2012.07.008.
- Беляева ИА, Бомбардирова ЕП, Митиш МД, Потехина ТВ, Харитонова НА. Онтогенез и дизонтогенез микробиоты кишечника у детей раннего возраста: триггерный механизм нарушений детского здоровья. Вопросы современной педиатрии. 2017;16(1):29–38. doi: 10.15690/vsp.v16i1.1692. / Belyaeva IA, Bombardirova EP, Mitish MD, Potekhina TV, Kharitonova NA. Ontogenesis and Dysontogenesis of the Gut Microbiota in Young Children: a Trigger Mechanism of Child Health Disorders. Current Pediatrics. 2017;16(1):29–38. (In Russ.) doi: 10.15690/vsp.v16i1.1692.
- Ragusa A, Svelato A, Santacroce C, Catalano P, Notarstefano V, Carnevali O et al. Plasticenta: First evidence of microplastics in human placenta. Environ Int. 2021;146:106274. doi: 10.1016/j.envint.2020.106274.
- Nuriel-Ohayon M, Neuman H, Koren O. Microbial Changes during Pregnancy, Birth, and Infancy. Front Microbiol. 2016;7:1031. doi: 10.3389/fmicb.2016.01031.
- Jiménez E, Marín ML, Martín R, Odriozola JM, Olivares M, Xaus J et al. Is meconium from healthy newborns actually sterile? Res Microbiol. 2008;159(3):187–193. doi: 10.1016/j.resmic.2007.12.007.
- Turunen J, Tejesvi MV, Paalanne N, Hekkala J, Lindgren O, Kaakinen M et al. Presence of distinctive microbiome in the first-pass meconium of newborn infants. Sci Rep. 2021;11(1):19449. doi: 10.1038/s41598-021-98951-4.
- Collado MC, Rautava S, Aakko J, Isolauri E, Salminen S. Human gut colonisation may be initiated in utero by distinct microbial communities in the placenta and amniotic fluid. Sci Rep. 2016;6:23129. doi: 10.1038/srep23129.
- Ardissone AN, de la Cruz DM, Davis-Richardson AG, Rechcigl KT, Li N, Drew JC, Murgas-Torrazza R et al. Meconium microbiome analysis identifies bacteria correlated with premature birth. PLoS ONE. 2014;9(3):e90784. doi: 10.1371/journal.pone.0090784.
- Aagaard K, Ma J, Antony KM, Ganu R, Petrosino J, Versalovic J. The placenta harbors a unique microbiome. Sci Transl Med. 2014;6(237):237ra65. doi: 10.1126/scitranslmed.3008599.
- Fardini Y, Wang X, Témoin S, Nithianantham S, Lee D, Shoham M, Han YW. Fusobacterium nucleatum adhesin FadA binds vascular endothelial cadherin and alters endothelial integrity. Mol Microbiol. 2011;82(6):1468–1480. doi: 10.1111/j.1365-2958.2011.07905.x.
- Stout MJ, Conlon B, Landeau M, Lee I, Bower C, Zhao Q et al. Identification of intracellular bacteria in the basal plate of the human placenta in term and preterm gestations. Am J Obstet Gynecol. 2013;208(3):226.e1-7. doi: 10.1016/j.ajog.2013.01.018.
- Шипицына ЕВ. Микробиом плаценты: сдвиг парадигмы или несовершенство методологии. Вестник Российской академии медицинских наук. 2021;76(5):436–448. doi: 10.15690/vramn1489. / Shipitsyna EV. Placental Microbiome: a Paradigm Shift or Flaw in the Methodology? Annals of Russian Academy of Medical Sciences. 2021;76(5):436–448. doi: 10.15690/vramn1489.
- Kim H, Sitarik AR, Woodcroft K, Johnson CC, Zoratti E. Birth Mode, Breastfeeding, Pet Exposure, and Antibiotic Use: Associations With the Gut Microbiome and Sensitization in Children. Curr Allergy Asthma Rep. 2019;19(4):22. doi: 10.1007/s11882-019-0851-9.
- Backhed F, Roswall J, Peng Y, Feng Q, Jia H, Kovatcheva-Datchary P et al. Dynamics and stabilization of the human gut microbiome during the first year of life. Cell Host Microbe. 2015;17(6):852. doi: 10.1016/j.chom.2015.05.012.
- Николаева ИВ. Формирование кишечной микрофлоры ребенка и факторы, влияющие на этот процесс. Детские инфекции. 2011;(3):39–42. Режим доступа: https://cyberleninka.ru/. / Nikolaeva IV. Formation of the intestinal microbiota of children and the factors that influence this process. Children Infections. 2011;(3):39–42. Available at: https://cyberleninka.ru/.
- Dominguez-Bello MG, De Jesus-Laboy KM, Shen N, Cox LM, Amir A, Gonzalez A et al. Partial restoration of the microbiota of cesarean-born infants via vaginal microbial transfer. Nat Med. 2016;22:250–253. doi: 10.1038/nm.4039.
- Rautava S, Luoto R, Salminen S, Isolauri E. Microbial contact during pregnancy, intestinal colonization and human disease. Nat Rev Gastroenterol Hepatol. 2012;9(10):565–576. doi: 10.1038/nrgastro.2012.144.
- Victora CG, Bahl R, Barros AJ, França GV, Horton S, Krasevec J et al. Lancet Breastfeeding Series Group. Breastfeeding in the 21st century: epidemiology, mechanisms, and lifelong effect. Lancet. 2016;387(10017):475–490. doi: 10.1016/S0140-6736(15)01024-7.
- Pannaraj PS, Li F, Cerini C, Bender JM, Yang S, Rollie A et al. Association between breast milk bacterial communities and establishment and development of the infant gut microbiome. JAMA Pediatr. 2017;171:647–654. doi: 10.1001/jamapediatrics.2017.0378.
- Ho NT, Li F, Lee-Sarwar KA, Tun HM, Brown BP, Pannaraj PS et al. Meta-analysis of effects of exclusive breastfeeding on infant gut microbiota across populations. Nat Commun. 2018;9(1):4169. doi: 10.1038/s41467-018-06473-x.
- Gopalakrishna KP, Hand TW. Influence of Maternal Milk on the Neonatal Intestinal Microbiome. Nutrients. 2020;12(3):823. doi: 10.3390/nu12030823.
- Łoniewski I, Skonieczna-Żydecka K, Stachowska L, Fraszczyk-Tousty M, Tousty P, Łoniewska B. Breastfeeding Affects Concentration of Faecal Short Chain Fatty Acids During the First Year of Life: Results of the Systematic Review and Meta-Analysis. Front Nutr. 2022;9:939194. doi: 10.3389/fnut.2022.939194.
- Chen K, Liu C, Li H, Lei Y, Zeng C, Xu S et al. Infantile Colic Treated With Bifidobacterium longum CECT7894 and Pediococcus pentosaceus CECT8330: A Randomized, Double-Blind, Placebo-Controlled Trial. Front Pediatr. 2021;9:635176. doi: 10.3389/fped.2021.635176.
- Astó E, Huedo P, Altadill T, Aguiló García M, Sticco M, Perez M, Espadaler-Mazo J. Probiotic Properties of Bifidobacterium longum KABP042 and Pediococcus pentosaceus KABP041 Show Potential to Counteract Functional Gastrointestinal Disorders in an Observational Pilot Trial in Infants. Front Microbiol. 2022;12:741391. doi: 10.3389/fmicb.2021.741391.
- Navarro-Tapia E, Sticco M, Astó E, Aguilo M, Vallefuoco F, Espadaler J. Patient characteristics influencing infant colic amelioration under probiotic treatment. Ann.Nutr.Metab. 2019;74(Suppl. 1):1–31. doi: 10.1159/000496759.
Фото:
Shutterstoсk/FOTODOM + изображения для статьи созданы с помощью BioRender.com



 1
1 2
2 3
3 4
4


Комментарии (0)