Журнал "Медицинский совет" №7/2024
DOI: 10.21518/ms2024-088
М.В. Свистушкин*, А.А. Бакулина, П.Ю. Бикмулина, А.В. Золотова, Л.В. Селезнева, Е.А. Шевчик, П.А. Кочетков, Н.Б. Сережникова, А.Н. Никифорова, И.А. Тычкина, А.И. Шпичка, В.М. Свистушкин, П.С. Тимашев
Первый Московский государственный медицинский университет имени И.М. Сеченова (Сеченовский Университет); 119048, Россия, Москва, ул. Трубецкая, д. 8, стр. 2
Введение. Одним из наиболее актуальных вопросов современной оториноларингологии является проблема формирования стойких дефектов голосовых связок и барабанной перепонки. Такое положение вещей связано с разнообразием причин, вызывающих развитие данных состояний, а также с тем, что лечение данных процессов, как правило, представляет собой технически сложную задачу и не всегда является эффективным.
Цель. Оценить возможности применения биоинженерных имплантов (БП) на основе мезенхимных стромальных клеток (МСК), полиэтиленгликолевого фибринового геля (ПЭГ-фибринового геля) и коллагеновой матрицы для восстановления дефектов вибрирующих тканей лор-органов – голосовых складок и барабанной перепонки.
Материалы и методы. Для эксперимента по восстановлению голосовой складки были отобраны 6 кроликов, разделенных поровну на 2 группы. После формирования рубца голосовой складки производилось имплантирование биоэквивалента: сфероиды на основе МСК + ПЭГ-фибриновый гель (группа – сфероиды ГС, n = 3) в объеме 0,5 мл, для группы контроля роль биоэквивалента выполнял физиологический раствор (группа – контроль ГС, n = 3). Для эксперимента по восстановлению барабанной перепонки были отобраны 6 шиншилл, разделенных поровну на 2 группы. Первым этапом создавалась стойкая перфорация, на которой либо не проводилось вмешательство (группа – контроль БП, n = 3), либо перфорация закрывалась с использованием биоэквивалента на основе сфероидов МСК, ПЭГ-фибринового геля и коллагеновой матрицы (группа – сфероиды БП, n = 3).
Результаты и обсуждение. При морфологическом исследовании определялось более полное восстановление структуры ткани в группах воздействия по сравнению с контрольными группами.
Выводы. Имплантация разработанных биоэквивалентов в места повреждения голосовых складок и барабанных перепонок приводит к формированию ткани, морфологически приближающейся к строению интактных структур.
Для цитирования: Свистушкин МB, Бакулина АА, Бикмулина ПЮ, Золотова АВ, Селезнева ЛВ, Шевчик ЕА, Кочетков ПА, Сережникова НБ, Никифорова АН, Тычкина ИА, Шпичка АИ, Свистушкин ВМ, Тимашев ПС. Биоинженерные импланты на основе мезенхимных стромальных клеток в восстановлении повреждений голосовых складок и барабанной перепонки (пилотные экспериментальные результаты). Медицинский Совет. 2024;(7):110-121. https://doi.org/10.21518/ms2024-088
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Вклад авторов: авторы внесли равный вклад в написание статьи.
Mesenchymal stromal cells based bioengineered implants in vocal folds and tympanic membrane restoration (рilot experimental results)
Mikhail V. Svistushkin, Alesia A. Bakulina, Polina Y. Bikmulina, Anna V. Zolotova, Liliya V. Selezneva, Elena A. Shevchik, Petr A. Kochetkov, Natalia B. Serejnikova, Anna N. Nikiforova, Irina A. Tychkina, Anastasia I. Shpichka, Valery M. Svistushkin, Peter S. Timashev
Sechenov First Moscow State Medical University (Sechenov University); 8, Bldg. 2, Trubetskaya St., Moscow, 119991, Russia
Introduction. One of the most pressing issues of modern otorhinolaryngology is the problem of the formation of persistent defects of the vocal cords and tympanic membrane. This state of affairs is due to the variety of reasons that cause the development of these conditions, as well as the fact that the treatment of these processes, as a rule, is a technically complex task and is not always effective.
Objective. Experimental evaluation of the possibility of using bioengineered implants based on MSCs, PEG-fibrin gel and collagen matrix to restore defects in vibrating tissues of ENT organs – vocal folds and tympanic membrane.
Materials and methods. For the experiment on vocal fold restoration, 6 rabbits were selected, divided equally into 2 groups. After the formation of the vocal fold scar, a bioequivalent was implanted: spheroids based on MSCs + PEG-fibrin gel (group – VF-spheroids, n = 3) in a volume of 0.5 ml, for the control group, the role of bioequivalent was performed by saline solution (VF-control group, n = 3). For the eardrum repair experiment, 6 chinchillas were selected, divided equally into 2 groups. At the first stage, a persistent chronic perforation was created, on which either no intervention was carried out (ED-control group, n = 3), or the perforation was closed using a bioequivalent based on MSC spheroids, PEG-fibrin gel and collagen matrix (ED-spheroid group, n = 3).
Results and discussion. Endoscopic and morphological examination revealed a more complete restoration of tissue structure in the treatment groups compared to the control groups.
Conclusion. Implantation of the developed bioequivalents in the sites of vocal fold and tympanic membrane injury leads to the formation of tissue morphologically similar to the structure of intact structures.
For citation: Svistushkin MV, Bakulina AA, Bikmulina PY, Zolotova AV, Selezneva LV, Shevchik EA, Kochetkov PA, Serejnikova NB, Nikiforova AN, Tychkina IA, Shpichka AI, Svistushkin VM, Timashev PS. Mesenchymal stromal cells based bioengineered implants in vocal folds and tympanic membrane restoration (рilot experimental results). Meditsinskiy sovet = Medical Council. 2024;(7):110-121. (In Russ.) https://doi.org/10.21518/ms2024-088
Conflict of interest: the authors declare no conflict of interest.
Contribution of authors: the authors made equal contributions to the writing of the article.
Введение
Среди множества нозологий, клинически
проявляющихся стойким нарушением голосовой функции и тугоухостью, наиболее
трудными для лечения являются заболевания, связанные с грубыми анатомическими
изменениями барабанной перепонки (БП) и голосовых складок (ГС). Причины таких
повреждений чрезвычайно многообразны, а в роли ведущего патофизиологического звена
выступает хроническое воспаление или травма, которые приводят к появлению
стойкой перфорации барабанной перепонки, ее фиброзным изменениям или рубцам и
атрофии в случае голосовых складок. В клинической практике под эту категорию
попадают такие заболевания, как хронический гнойный средний отит, рубцовые
стенозы гортани, рубцы голосовых складок, состояния после хордэктомии [1–10].
Для
восстановления нормальной функции звукопроведения и профилактики развития
среднего отита и его осложнений любой дефект барабанной перепонки должен быть
закрыт. Особенностью закрытия перфорации барабанной перепонки является не
только необходимость восстановления ее целостности, но и возможность
восстановления механоакустических свойств, которые играют важную роль в формировании
слуха. Учитывая особенности индивидуальной анатомии и течения патологического
процесса в среднем ухе, отохирургами было предложено множество методик закрытия
перфораций барабанной перепонки – мирингопластики или тимпанопластики с
использованием различных аутотрансплантатов: фасциальный лоскут, перихондрий,
фрагменты хряща, многослойные трансплантаты [3, 4,
11–15]. Эффективность хирургического лечения зависит от
многих факторов, в т. ч. толщины используемого трансплантата, опыта
хирурга, тщательности деэпидермизации краев дефекта. Все это не исключает
неполное приживление или отторжение трансплантата в раннем и позднем
послеоперационном периодах и возникновения реперфорации барабанной перепонки.
Не всегда достигается успешное закрытие перфорации барабанной перепонки с
оптимальными функциональными результатами [3, 4,
11, 12, 16].
В настоящее время лечебная тактика при рубцах
голосовых складок складывается на следующих принципах. Консервативное лечение,
как правило, является первой линией выбора: в профилактике и раннем лечении
рубцов определенную роль играют глюкокортикостероиды, антибиотики,
муколитическая и антирефлюксная терапия [8, 17, 18]. Фонопедия показывает хорошие результаты при небольших рубцах и
применяется как изолированно, так и дополнительно в послеоперационном периоде [10, 19].
Хирургическое лечение рекомендуется проводить
не ранее чем через 6 мес. после формирования рубца [10, 19,
20]. Целью
операций является увеличение объема и медиализация голосовой складки, улучшение
ее эластичности. Для этого применяется обширный ряд хирургических методик,
включающих эндоларингеальные инъекционные и имплантационные медиализации,
медиализационную тиропластику, отсепаровку эпителия от рубца, внутрислизистые
имплантации синтетических препаратов, например, на основе гиалуроновой кислоты и
аутологичных тканей, таких как жир и фасции, а также различные комбинации этих
техник и лазерное воздействие на рубцовую ткань[6, 22–28]. В случаях рубцового стеноза голосового отдела гортани эффективным
является восстановление просвета с помощью пластики лоскутами слизистой
оболочки на ножке, установка эндоларингеальных стентов, расширяющих просвет
гортани и предотвращающих контакт раневых поверхностей, использование CO2-лазера
[5, 6, 29–35].
Несмотря на разнообразие методик, их
результат в реабилитации голосовой функции непредсказуем и существенно
ограничен. Данная проблема связана с тем, что существующие методы уменьшают
потерю воздуха и усталость при фонации, но не восстанавливают структуру
собственной пластинки слизистой оболочки голосовой складки, которая
обеспечивает необходимые для ее вибрации биомеханические свойства, голосовая
складка остается жесткой и неподвижной [8, 36–38].
Клеточные
технологии и биоинженерия, относящиеся к регенеративной медицине, открывают для
клиницистов новые перспективы в разработке методов лечения и профилактики
рубцовых повреждений голосовых складок и перфораций барабанной перепонки, и в
последнее время интерес к ее достижениям в мировой оториноларингологии
значительно возрос. Их идея заключается в восстановлении нормальной структуры и
функции тканей на клеточном и молекулярном уровне за счет целенаправленной
контролируемой активации пролиферации и дифференцировки клеток, нормализации
синтеза компонентов межклеточного матрикса и ограничения интенсивности
воспалительного процесса.
Важной чертой клеточных подходов для
восстановления голосовых складок и барабанной перепонки становится активное
исследование различных скаффолдов, используемых в качестве носителей для
клеток. Их использование может улучшать конечный результат восстановления за счет
изменения свойств клеток, уменьшения их потери при имплантации и увеличения
продолжительности их жизни [38]. В
работах на ГС для этой цели с положительными результатами использовались
скаффолды на основе гиалуроновой кислоты и коллагена [39–42]. Также одним из перспективных клеточных носителей для клеточной терапии
повреждений голосовых складок является фибрин. В in vitro исследовании H. Park et al. показано, что среди гидрогелей, которые могут
использоваться для имплантации клеток в голосовые складки в культурах жировых
мезенхимных стромальных клеток (МСК) с фибрином и с комплексами фибрина с
гиалуроновой кислотой и с коллагеном, было обнаружено в два раза большее
количество общей ДНК, чем в культурах с коллагеном и ГК по отдельности;
экспрессия эластина была значительно выше в клетках, выращенных в гелях на
основе фибрина [43]. В
работе J. Long
et al. двухслойная тканеинженерная конструкция на основе фибрина и жировых МСК
была способна поддерживать вибрации и обладала сходными вязко-упругими
свойствами с тканью голосовых складок [44]. Кроме
того, немаловажными являются и кровоостанавливающие свойства фибрина, в ларингологии
препараты фибрина в качестве гемостатического средства широкого применяются в
клинической практике, но наблюдается большой разброс в величине и эффективности
гемостаза [45].
К настоящему моменту с целью закрытия как
острых, так и хронических перфораций барабанной перепонки также предприняты
попытки использования большого количества каркасов (скаффолдов). Достаточно
часто с этой целью применяются коллагенсодержащие материалы, отличающиеся друг
от друга некоторыми физико-химическими свойствами. Наиболее распространено в
клинической практике использование в качестве каркаса коллагеновой или
желатиновой губки, в т. ч. и в сочетании с различными факторами роста
[46–50]. Коллаген обладает уникальными биологическими свойствами, губки на его
основе продемонстрировали эффективность поглощения тканевого экссудата при
контакте с раной, обеспечивая влажную среду и защиту от инфицирования и
механических повреждений. Следует отметить, что пористость данного материала
позволяет транспортировать клетки и питательные вещества [51].
Цель данной
работы заключалась в экспериментальной оценке возможности применения биоинженерных
имплантов на основе МСК, полиэтиленгликолевого фибринового
геля
(ПЭГ-фибринового
геля) и коллагеновой матрицы для
восстановления дефектов вибрирующих тканей лор-органов – голосовых складок и
барабанной перепонки.
Материалы и методы
Подготовка
биоинженерных имплантов
Биоматериал для выделения клеток был предоставлен
Биобанком Сеченовского университета и получен от пациентов после получения
информированного согласия. В работе использовали первичные культуры
мезенхимальных стромальных клеток (МСК), выделенных из альвеолярной слизистой
оболочки свободной десны человека. Выделение первичных культур проводилось в
соответствии со стандартными протоколами. Клетки культивировали в среде,
содержащей DMEM/F12 (1:1, Gibco, США), гентамицин (50 мкг/мл, Sigma-Aldrich,
Германия), FBS (10%, Thermo Fisher, США), инсулин-трансферрина-селенит (1:100, «БиолоТ»,
Россия) и bFGF (10 нг/мл, ProSpec, Израиль) при стандартных условиях (37 °С и
5% СО2). Эксперименты проводились с использованием клеток на 3–5 пассажах.
Для формирования трехмерных сфероидов суспензию
МСК объемом 140 мкл помещали в агарозные планшеты с 256 лунками. Количество
клеток на один сфероид составляло 2000. Далее агарозные планшеты с МСК
культивировали в течение 3 сут.
Гидрогелевая система состояла из желатина,
фибриногена, ПЭГ-метакрилата и рибофлавина. Для получения гидрогеля бычий
желатин (75 мг/мл, Sigma-Aldrich, Германия) смешивали с бычьим фибриногеном (25
мг/мл, Sigma-Aldrich, Германия) в фосфатно-солевом буфере (PBS). Затем в
раствор добавляли гетеробифункциональный акрилат метилового эфира
поли(этиленгликоля) (ПЭГ-метакрилат, 2,57 мг/мл, Sigma-Aldrich, Германия).
Реакцию конъюгации проводили в течение 2 ч при 37 °С в темноте. После инкубации
в гидрогель добавляли рибофлавин в качестве фотоинициатора (0,02%, Sigma-Aldrich,
Германия). Для
получения биочернил клеточные сфероиды смешивали с гидрогелем для получения
концентрации 1000 сфероидов на мл и помещали в картридж биопринтера со
светозащитой. Картридж охлаждали до температуры 22 оС для застывания
биочернил.
Охарактеризованные коллагеновые мембраны
подготавливали для 3D-биопечати с помощью хирургических ножниц и
дерматологических панчей в стерильных условиях. Полученные матрицы помещали в
раствор стерильного фосфатного буфера на 10 мин и затем переносили в подготовленные
24-луночные планшеты. В работе использовали экструзионный биопринтер BIO X
(CellInk, Швеция). Температуру биочернил внутри печатающей головки (BIO X
temperature-controlled printhead, CellInk, Швеция) и после печати на
столике-платформе также непрерывно поддерживали на уровне 22 °C. Для картриджей
использовали одноразовые сопла (диаметр сопла 25 G, CellInk, Швеция).
Для оценки выживаемости сфероидов (рис. 1)
и трехмерных биоэквивалентов (рис. 2) была использована комбинация
методов определения жизнеспособности и пролиферации клеток. Метаболическую и
пролиферативную активность клеток оценивали с помощью тестов AlamarBlue
(ThermoFisher Scientific, США) и PicoGreen (Quant-iT PicoGreen, ThermoFisher Scientific,
США). Жизнеспособность клеток визуализировали с использованием окрашивания
Live/Dead (Sigma-Aldrich, Германия), а ядра клеток контрастировали с помощью
Hoechst 33258. Образцы исследовали с помощью флуоресцентного микроскопа EVOS
(ThermoFisher Scientific, США). Кроме того, для оценки морфологии клеток и
сфероидов использовали световой микроскоп с фазово-контрастным модулем ZEISS
Axio Scope.A1 (Carl Zeiss, Германия).
Рисунок 1. Жизнеспособность сфероидов из МСК,
культивируемых в агарозных планшетах в течение 3 сут.
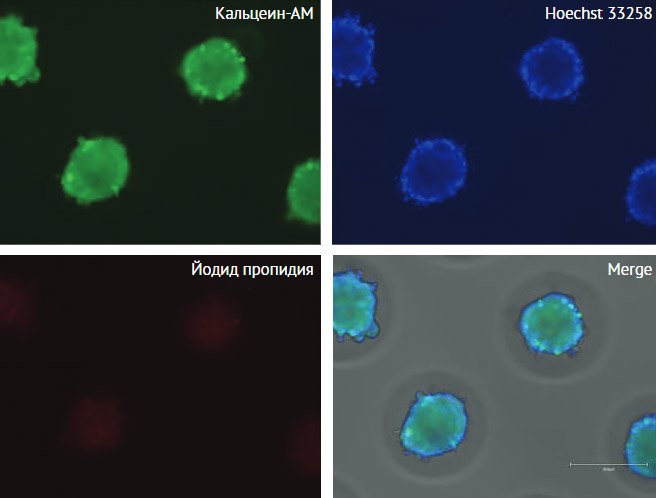
Окрашивание Live/Dead (живые клетки окрашиваются
кальцеином-АМ, мертвые – йодидом пропидия). Ядра контрастированы красителем
Hoecsht 33258. Флуоресцентная и световая фазово-контрастная (на merge)
микроскопия, масштабный отрезок 300 мкм
Рисунок 2. Жизнеспособность
напечатанных конструктов через 3 сут. культивирования
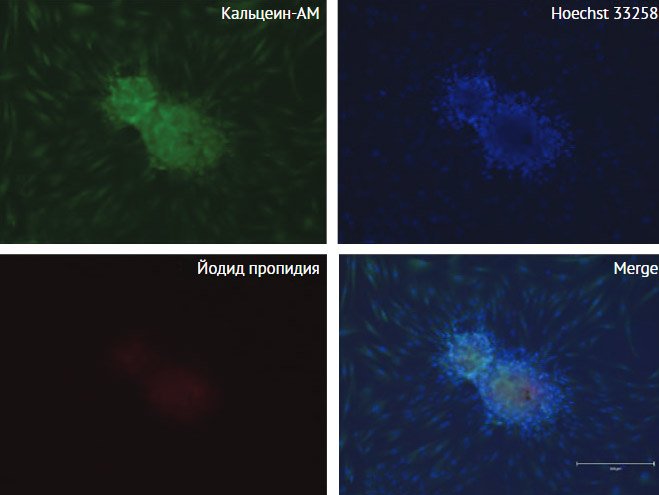
Окрашивание Live/Dead (живые клетки окрашиваются кальцеином-АМ, мертвые –
йодидом пропидия). Ядра контрастированы красителем Hoecsht 33258.
Флуоресцентная микроскопия, масштабный отрезок 300 мкм подрисуночная
Хирургические
методы
Исследования на
животных были одобрены локальным этическим комитетом Сеченовского университета
(протокол №11-23 от 15 июня 2023 г.). В экспериментах на голосовых складках
использовалась модель, состоящая из имплантации клеточного продукта во
вторичную рану голосовой складки кролика после резекции рубца, развившегося на
месте первичного дефекта [52]. При восстановлении барабанной перепонки
использовалась экспериментальная модель стойкой перфорации на шиншиллах [53]. По дизайну данное исследование являлось
контролируемым экспериментом с параллельными группами (рис. 3).
Рисунок 3. Дизайн исследования
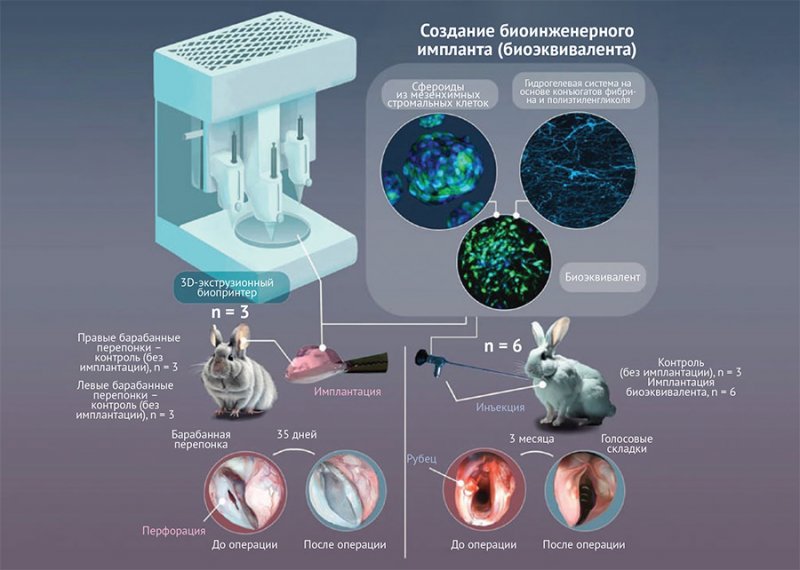
Создание модельного дефекта рубцового повреждения голосовых складок
Для обеспечения
безболезненности манипуляций и миорелаксации использовалась аналго-седация путем
внутримышечного введения тилетамина/золазепама из расчета 10–15 мг/кг и
раствора ксилазина 1–2 мг/кг. Для прямой ларингоскопии гортани использовался
неонатологический клинок для оротрахеальной интубации по С. Miller №1,
визуализация осуществлялась с помощью ригидного эндоскопа KarlStorz – Hopkins
0° 4,0 мм. Во время 1-й операции (n = 6) создавался
односторонний дефект левой голосовой складки – удалялась слизистая оболочка и
собственная пластинка на протяжении 1/3 голосовой складки с отступом 3–4 мм от
передней комиссуры с помощью чашеобразных щипцов длиной 18 см и диаметром
захватывающей поверхности 2 мм. При
необходимости осуществлялась санация кровяных сгустков и гемостаз путем
прижатия ватного тупфера на зонде с навивкой, смоченного раствором адреналина.
Имплантация
клеточных продуктов
Через 3 мес. проводилась вторая операция, в
ходе которой выполнялась идентификация рубца голосовой складки, затем рубец
иссекался с помощью чашеобразных щипцов, границы рубца определялись визуально и
тактильно. Непосредственно после этого выполнялась имплантация продуктов путем
инъекции с помощью иглы для эндоскопической риносинусохирургии. Трем животным
был имплантирован биоэквивалент: сфероиды на основе МСК + ПЭГ-фибриновый гель (группа – сфероиды ГС) в объеме 0,5 мл (1 x
103 сфероидов) – и трем
животным — эквивалентный объем физиологического раствора (группа – контроль
ГС). Подготовка имплантата проводилась
непосредственно в операционной. Два компонента геля: фибриноген, содержащий
сфероиды МСК, и тромбин – смешивались в шприце 1,0 мл в пропорциях 1:1 (по 0,25
мл), и через 60–90 с при визуальных признаках начала полимеризации гель через
иглу имплантировался во вторичную рану голосовой складки. Ведение в
послеоперационном периоде не отличалось от описанного для первой операции. Из
всех оперированных животных ни в одном случае не отмечена гибель животного в
результате развития каких-либо осложнений.
Экспериментальная модель хронической перфорации барабанной
перепонки создавалась 3 шиншиллам с левой и правой стороны. Модель разработана
и описана коллективом авторов Сеченовского университета [53]. Первым этапом в задненижнем квадранте формировалось
миринготомическое отверстие с помощью микроиглы из стандартного отиатрического
микрохирургического набора. После чего тем же инструментом по окружности
перфорации выполняются четыре радиальных надреза на 12, 3, 6 и 9 ч, и
образованные лоскуты треугольной формы подворачиваются внутрь к медиальной
поверхности барабанной перепонки. Далее после подворачивания краев перфорации в
дефект устанавливалась тимпаностомическая трубка на срок 30 дней. Через 30 дней шунт удалялся, в
последующем в течение 21 дня за сформированной перфорацией барабанной перепонки
проводилось динамическое наблюдение с целью контроля отсутствия тенденции к
самостоятельному закрытию.
Вторым этапом у правосторонних
хронических перфораций (n = 3) была выполнена диссекция эпидермального края
(«освежение краев»), закрытие перфорации не проводилось, данные барабанные
перепонки составили группу – контроль
БП. Левосторонние дефекты (n = 3) после
предварительного освежения краев закрыты с помощью биоэквивалента на
основе сфероидов МСК, ПЭГ-фибринового геля и коллагеновой матрицы: группа
– сфероиды БП. Имплант с
помощью микрощипцов и микродиссекционной иглы устанавливался на поверхность барабанной
перепонки в области перфорации таким образом, чтобы края перфорации были
перекрыты на 1 мм (рис. 4). В послеоперационном периоде выполнялось
динамическое наблюдение за животными, медикаментозная терапия не проводилась.
Рисунок 4. Этапы эксперимента
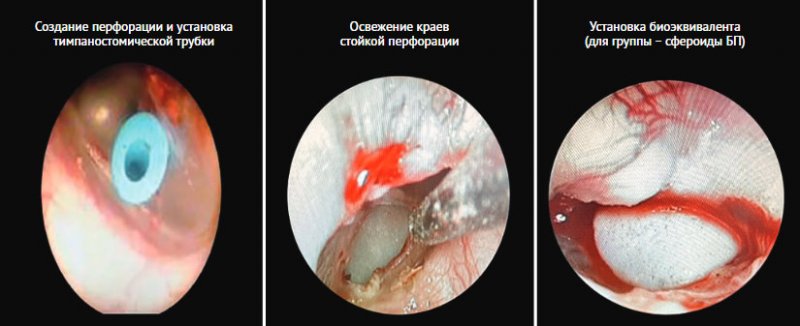
Для оценки
результатов эксперимента проводился эндоскопический контроль in vivo и морфологическое
исследование через 3 мес. после имплантации в голосовые складки и на 35-й день
после установки импланта в область перфорации барабанной перепонки.
Морфологическое
исследование
Голосовые
складки. Животные контрольных и экспериментальных групп
выводились из эксперимента через 3 мес. после 2-й операции путем
внутримышечного введения летальной дозы раствора тилетамина и золазепама.
Гортанно-трахеальный комплекс иссекался, выделялись голосовые складки с
подлежащим щитовидным хрящом. Препараты фиксировались в 10%-ном нейтральном
забуференном формалине и заливались в апарфиновые блоки. Барабанные
перепонки. Животные контрольных и экспериментальных групп выводились из
эксперимента на 35-й день после деэпидермизации края стойкой перфорации путем
внутримышечного введения летальной дозы раствора тилетамина и золазепама. Проводилась
блок-резекция височной кости с находящимися в ней фиброзным кольцом и
барабанной перепонкой, для сохранения целостности барабанная перепонка отправлялась на гистологическое исследование
и оценку вибрационных свойств. Фиксированные в 10%-ном нейтральном забуференном
формалине ткани декальцинировали в течение 1 нед., после чего заливали в
парафиновые блоки.
Срезы
препаратов голосовых складок и барабанных перепонок толщиной 4–5 микрометров
окрашивали гематоксилином и эозином, после чего исследовали с помощью
универсального микроскопа LEICA DM4000 B, оснащенного видеокамерой LEICA
DFC7000 T.
Результаты
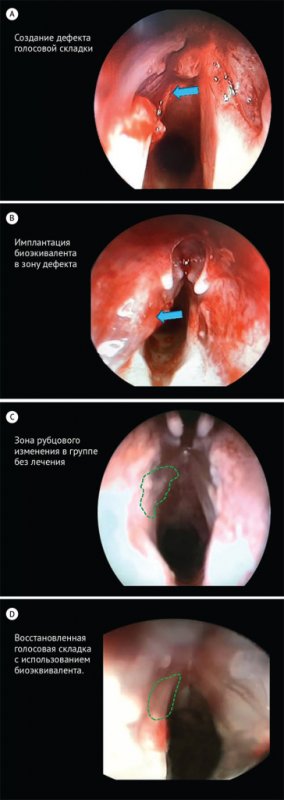
При эндоскопическом исследовании в группе рубцов
голосовых складок без имплантации на месте послеоперационного дефекта визуально
и тактильно определяется плотная рубцовая ткань. В группе имплантации
биоэквивалента визуально ткань на месте дефекта малоотличима от противоположной
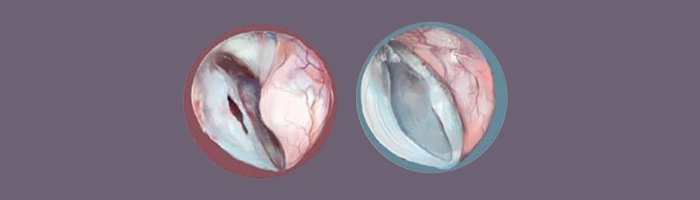
правой интактной голосовой складки. Остатки импланта не определяются (рис. 5).
Рисунок
5. Эндоскопическая картина голосовых складок
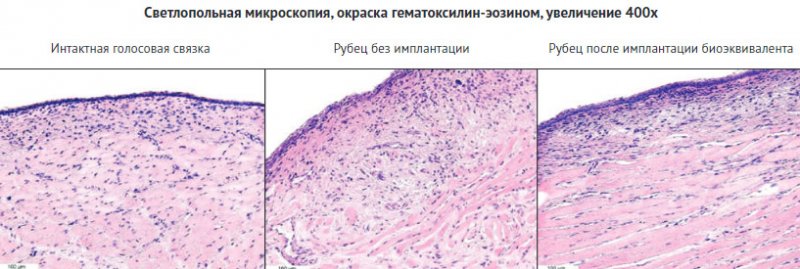
Морфологическое строение интактных
голосовых складок в группе чистого контроля имело типичную структуру для
голосовых складок кролика. В центральной части складка была выстлана
неороговевающим многослойным плоским эпителием, сменяющимся на периферии многорядным
мерцательным. Под эпителием находилась собственная пластинка
слизистой оболочки, образованная рыхлой волокнистой соединительной тканью из
продольно ориентированных пучков коллагеновых волокон и расположенных между
ними фибробластов с незначительным содержанием макрофагов и лимфоцитов.
Капиллярные сосуды были немногочисленны. Глубже располагался мышечный слой, в
котором пучки поперечнополосатых скелетных мышечных волокон были разделены
между собой тонкими соединительнотканными прослойками.
В группе без имплантации площадь
сформированных рубцов в области дефекта была достаточно обширна. Область
дефекта голосовой складки была покрыта многослойным плоским эпителием, но с
участками гипертрофии, атрофии и дистрофии. Под эпителием располагалась
рубцовая ткань, состоящая из плотно и в основном продольно расположенных
коллагеновых волокон, тогда как в более глубоком слое слизистой оболочки
отмечалось их более рыхлое и беспорядочное расположение. Лимфо-макрофагальная
инфильтрация и васкуляризация в этой группе были повышены по сравнению с
нормой. Также выявлялся выраженный фиброз мышечных волокон.
В группе имплантации биоэквивалента
на месте послеоперационного дефекта выявлялись незначительные рубцовые
изменения слизистой оболочки. По сравнению с контрольными группами рубцы были
относительно узкими и занимали не большую площадь, чем интактная слизистая
оболочка. Рубец был покрыт многослойным плоским эпителием с четким
расположением слоев и без признаков дистрофических изменений. Коллагеновые
волокна и фибробласты в основном имеют продольную ориентацию. Васкуляризация и
лимфо-макрофагальная инфильтрация были слабыми и сравнимыми с нормой.
Фиброзирование мышечного слоя не выявлялось (рис. 6).
Рисунок
6. Микроскопическая картина интактной и восстановленных голосовых связок
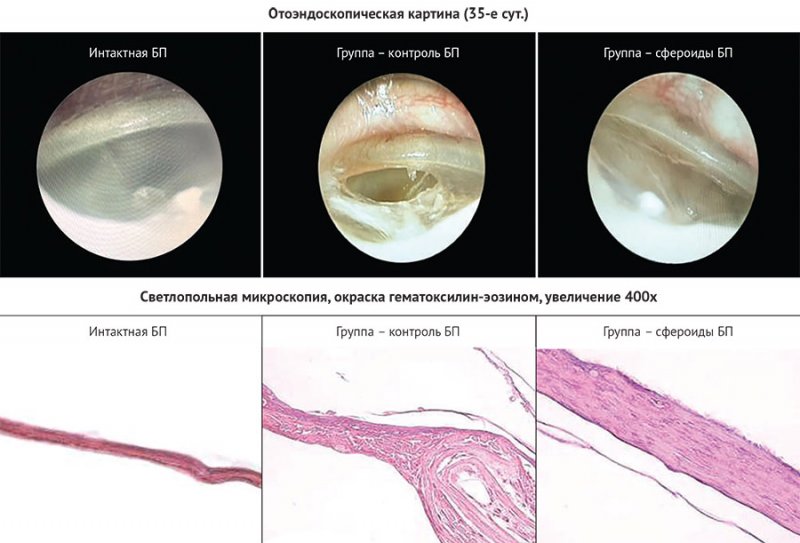
По результатам
эндоскопического исследования закрытие правосторонних перфораций (n = 3) (БП,
контрольная группа) не наблюдалось ни у одного животного, что говорит о том, что
перфорация, созданная по описанному методу, является стойкой. На 35-е сут. у
всех животных (n = 3 правосторонних БП) наблюдалась практически полная
резорбция биоэквивалента, остатки материала удалены с помощью вакуумного
отсоса. При эндоотоскопии визуализировали малозаметный рубец в зоне перфорации
(рис. 7).
Морфология.
Интактная БП
На всем протяжении барабанная перепонка была
очень тонкой и немного утолщалась лишь в краевых участках, в местах
прикрепления к кости. Ткань барабанной перепонки состояла из трех слоев:
поверхностный слой на наружной стороне был представлен многослойным плоским
эпителием, глубже был расположен слой рыхлой волокнистой соединительной ткани и
с внутренней стороны находился однослойный кубический эпителий. В контрольной
группе (стойкая перфорация) барабанная перепонка была резко утолщена по всей
длине, особенно в области дефекта (рис. 4) и состояла из фиброзной ткани
разной степени зрелости. В более зрелых участках фиброзная ткань утончалась,
уплотнялась и состояла из продольно ориентированных и плотно расположенных
коллагеновых волокон и немногочисленных фибробластов, клеток воспаления и
кровеносных сосудов. В рыхлых зонах утолщения часто наблюдалась гиперплазия
многослойного плоского эпителия, отмечалось разволокнение компонентов
барабанной перепонки в виде переплетающихся тяжей и тонких новообразованных коллагеновых
волокон, выявлялись многочисленные сосуды и высокая лимфо-макрофагальная
инфильтрация, что свидетельствовало о тимпаните – воспалении барабанной
перепонки после нанесении перфорации. В экспериментальной группе
(биоэквивалент) барабанная перепонка была незначительно утолщена по всей длине
или в области дефекта. Большая часть барабанной перепонки была представлена
плотными участками из фиброзной ткани, состоящей из плотно и продольно
расположенных коллагеновых волокон и немногочисленных фибробластов между ними.
В фиброзной ткани отсутствовала воспалительная инфильтрация и содержание
сосудов было минимальным. Утолщение барабанной перепонки в области дефекта
снаружи с обеих сторон было выстлано эпителием нормальной структуры, а внутри
заполнено переплетающимися коллагеновыми пучками и фибробластами (рис. 7).
7. Нативная и восстановленные барабанные перепонки: отоэндоскопическая и
микроскопическая картины
Обсуждение
В
настоящее время для восстановления целостности барабанной перепонки
используются различные виды материалов [3, 4,
11–15], однако их применение во многом зависит от опыта
хирурга, не обеспечивает полноценное восстановление функциональных особенностей
ткани, а также сопряжено с риском развития реперфорации.
Аналогичной проблемой являются рубцовые изменения голосовых
складок – существующие методы лечения не позволяют полностью восстановить
анатомическую структуру голосовых складок, что ограничивает их функциональные
возможности и не приводит к желаемым результатам [5, 20, 29–35].
В настоящее время проводятся исследования по разработке
оптимального скаффолда для восстановления микроструктуры как барабанной
перепонки, так и голосовых складок. Многие из них уже доказали свою
эффективность [39–42].
В нашем исследовании в качестве скаффолда был выбран
ПЭГ-фибриновый гидрогель, содержащий МСК, т. к. данная конструкция уже
доказала свою эффективность в ходе экспериментов [44, 45]. С помощью 3D-биопечати
на основе коллагеновой матрицы создавались трехмерные структуры клеток, в дальнейшем
использующиеся в качестве биоэквивалента.
Для закрытия стойкой перфорации барабанной
перепонки также использовались 3D-конструкты на основе коллагеновой матрицы и МСК человека.
Целью данных экспериментов было оценить
возможность и эффективность применение трехмерных биоэквивалентов для
восстановления дефектов вибрирующих тканей лор-органов – голосовых складок и
барабанной перепонки.
3D-клеточные биоэквиваленты показали хорошую
биодеградируемость (через 3 мес. в группе – сфероиды ГС визуально ткань
малоотличима от интактной ГС, на 35-е сут. в группе – сфероиды БП – практически полная
резорбция биоэквивалента).
Также многообещающими являются результаты
гистологического исследования: в группе – сфероиды ГС наблюдается более полное
восстановление структуры ГС по отношению к группе – контроль ГС (рубцы узкие,
коллагеновые волокна и фибробласты имеют продольную ориентацию, наблюдается
восстановление эпителия, по структуре практически не отличающегося от
нативного). В группе – сфероиды БП восстановленная ткань имела структуру, более
приближенную к нативной по сравнению с группой контроля (ткань БП состояла из
плотно и продольно расположенных коллагеновых волокон и фибробластов). Кроме
того, принципиальным отличием было отсутствие воспалительной инфильтрации в
фиброзной ткани в группе – сфероиды БП, в то время как в группе – контроль БП
наблюдалась высокая лимфо-макрофагальная инфильтрация.
Таким образом,
результаты, полученные в ходе данного эксперимента, открывают перспективу для
дальнейших исследований применения клеточных технологий для восстановления
близкой к нативной структуры вибрирующих органов, что обеспечит не только
анатомическое восполнение дефекта, но также позволит восстанавливать
функциональную активность органов, сниженную вследствие патологического
процесса.
Выводы
Имплантация
разработанных биоэквивалентов в места повреждения голосовых складок приводит к
формированию ткани, морфологически приближающейся к структуре интактных
голосовых складок. Уменьшается размер, толщина и плотность рубцов, происходит
восстановление архитектуры и строения коллагеновых волокон. Тканеинженерные
имплантаты также показали высокую эффективность в регенерации дефектов
барабанной перепонки — полное закрытие острых и хронических перфораций в
контрольных точках наблюдения. Следует отметить восстановление фиброзного слоя
барабанной перепонки.
Дальнейшее развитие
данного направления и разработка технологий лечения на основе биоинженерных
имплантов позволят повысить эффективность лечения пациентов с рубцовыми
повреждениями голосового отдела гортани и тугоухостью.
Список литературы / References
Развернуть
- Seonwoo H, Kim SW, Kim J, Chunjie T, Lim KT, Kim YJ et al. Regeneration of chronic tympanic membrane perforation using an EGF-releasing chitosan patch. Tissue Eng Part A. 2013;19(17-18):2097-2107. https://doi.org/10.1089/TEN.TEA.2012.0617.
- Rana AK, Upadhyay D, Yadav A, Prasad S. Correlation of Tympanic Membrane Perforation with Hearing Loss and Its Parameters in Chronic Otitis Media: An Analytical Study. Indian J Otolaryngol Head Neck Surg. 2020;72(2):187-193. https://doi.org/10.1007/s12070-019-01740-9.
- Hussain Z, Pei R. Necessities, opportunities, and challenges for tympanic membrane perforation scaffolding-based bioengineering. Biomed Mater. 2021;16(3). https://doi.org/10.1088/1748-605X/ABCF5D.
- Aleemardani M, Bagher Z, Farhadi M, Chahsetareh H, Najafi R, Eftekhari B et al. Can Tissue Engineering Bring Hope to the Development of Human Tympanic Membrane? Tissue Eng Part B Rev. 2021;27(6):572-589. https://doi.org/10.1089/TEN.TEB.2020.0176.
- Нажмудинов ИИ, Вавин ВВ, Давудов ХШ, Гаращенко ТИ, Давудова БХ, Магомедова КМ, Хоранова МЮ. Варианты хирургического лечения рубцовых стенозов среднего (складкового) отдела гортани. Медицинский совет. 2019;(21):118-125. https://doi.org/10.21518/2079-701X-2019-21-118-125.
- Гаращенко ТИ, Назарочкин ЮВ, Бойкова НЭ, Стройков МА, Аведисян ВЭ. Осложнения интубации трахеи и трахеотомии после длительной искусственной вентиляции легких у детей. Вопросы практической педиатрии. 2015;10(5):68-72. Режим доступа: https://www.phdynasty.ru/katalog/zhurnaly/voprosy-prakticheskoy-pediatrii/2015/tom-10-nomer-5/26761.
- Friedrich G, Dikkers FG, Arens C, Remacle M, Hess M, Giovanni A et al. Vocal fold scars: Current concepts and future directions. Consensus report of the phonosurgery committee of the European laryngological society. Eur Arch Otorhinolaryngol. 2013;270(9):2491-2507. https://doi.org/10.1007/S00405-013-2498-9.
- Hantzakos A, Dikkers FG, Giovanni A, Benninger MS, Remacle M, Sjögren EV, Woo P. Vocal fold scars: a common classification proposal by the American Laryngological Association and European Laryngological Society. Eur Arch Otorhinolaryngol. 2019;276(8):2289-2292. https://doi.org/10.1007/s00405-019-05489-3.
- Hirano S. Current treatment of vocal fold scarring. Curr Opin Otolaryngol Head Neck Surg. 2005;13(3):143-147. https://doi.org/10.1097/01.moo.0000162261.49739.b7.
- Ремакль М, Эккель ХЭ, Янова ЮК (ред.). Хирургия гортани и трахеи. М.: БИНОМ; 2014. 198 с. Режим доступа: https://glavkniga.su/filecont/50071.pdf
- Maharajan N, Cho GW, Jang CH. Application of mesenchymal stem cell for tympanic membrane regeneration by tissue engineering approach. Int J Pediatr Otorhinolaryngol. 2020;133. https://doi.org/10.1016/J.IJPORL.2020.109969.
- Azimi B, Milazzo M, Danti S. Cellulose-Based Fibrous Materials From Bacteria to Repair Tympanic Membrane Perforations. Front Bioeng Biotechnol. 2021;9:669863. https://doi.org/10.3389/fbioe.2021.669863.
- Fisch U, May JS, Linder T. Tympanoplasty, Mastoidectomy, and Stapes Surgery, 2nd edn. Ann R Coll Surg Engl. 2010;92(1):81. Available at: https://www.researchgate.net/publication/317058345_Tympanoplasty_Mastoidectomy_and_Stapes_Surgery_2nd_edn.
- Zahnert T, Bornitz M, Hüttenbrink KB. Acoustic and mechanical properties of tympanic membrane transplants. Laryngorhinootologie. 1997;76(12):717-723. https://doi.org/10.1055/S-2007-997513.
- Heermann H. Tympanoplasty with fascial tissue taken from the temporal muscle after straightening the anterior wall of the auditory meatus. HNO. 1961;9:136-137. Available at: https://pubmed.ncbi.nlm.nih.gov/13712731.
- Villar-Fernandez MA, Lopez-Escamez JA. Outlook for Tissue Engineering of the Tympanic Membrane. Audiol Res. 2015;5(1):117. https://doi.org/10.4081/AUDIORES.2015.117.
- Крюков АИ, Гуров АВ, Кирасирова ЕА, Кулабухов ЕВ. Современные методы профилактики и терапии осложнений при реконструктивной хирургии у пациентов со стенозом гортани и трахеи. Вестник оториноларингологии. 2019;84(6)48-53. https://doi.org/10.17116/otorino20198406148.
- Benninger MS, Alessi D, Archer S, Bastian R, Ford C, Koufman J et al. Vocal fold scarring: current concepts and management. Otolaryngol Head Neck Surg. 1996;115(5):474-482. https://doi.org/10.1177/019459989611500521.
- Remacle M, Lawson G, Hedayat A, Trussart C, Jamart J. Medialization framework surgery for voice improvement after endoscopic cordectomy. Eur Arch Otorhino laryngol. 2001;258(6):267-271. https://doi.org/10.1007/s004050100350.
- Martínez Arias À, Remacle M, Lawson G. Treatment of vocal fold scar by carbon dioxide laser and collagen injection: retrospective study on 12 patients. Eur Arch Otorhinolaryngol. 2010;267(9):1409-1414. https://doi.org/10.1007/s00405-010-1231-1.
- Finck CL, Harmegnies B, Remacle A, Lefebvre P. Implantation of esterified hyaluronic acid in microdissected Reinke’s space after vocal fold microsurgery: shortand long-term results. J Voice. 2010;24(5):626-635. https://doi.org/10.1016/J.JVOICE.2008.12.015.
- Mortensen MM, Woo P, Ivey C, Thompson C, Carroll L, Altman K. The Use of the Pulse Dye Laser in the Treatment of Vocal Fold Scar: A Preliminary Study. Laryngoscope. 2008;118(10):1884-1888. https://doi.org/10.1097/MLG.0b013e31817d7546.
- Neuenschwander MC, Sataloff RT, Abaza MM, Hawkshaw MJ, Reiter D, Spiegel JR. Management of Vocal Fold Scar with Autologous Fat Implantation. J Voice. 2001;15(2):295-304. https://doi.org/10.1016/S0892-1997(01)00031-5.
- Sataloff RT, Spiegel JR, Heuer RJ, Baroody MM, Emerich KA, Hawkshaw MJ, Rosen DC. Laryngeal mini-microflap: a new technique and reassessment of the microflap saga. J Voice. 1995;9(2):198-204. https://doi.org/10.1016/S0892-1997(05)80253-X.
- Schneider B, Denk D, Bigenzahn W. Functional Results After External Vocal Fold Medialization Thyroplasty With the Titanium Vocal Fold Medialization Implant. Laryngoscope. 2003;113(4):628-634. https://doi.org/10.1097/00005537-200304000-00008.
- Sulica L, Rosen CA, Postma GN, Simpson B, Amin M, Courey M, Merati A. Current practice in injection augmentation of the vocal folds: indications, treatment principles, techniques, and complications. Laryngoscope. 2010;120(2):319-325. https://doi.org/10.1002/LARY.20737.
- Tsunoda K, Kondou K, Kaga K, Niimi S, Baer T, Nishiyama K, Hirose H. Autologous Transplantation of Fascia into the Vocal Fold: Long‐Term Result of Type‐1 Transplantation and the Future. Laryngoscope. 2005;115(S108):1-10. https://doi.org/10.1097/01.mlg.0000183966.72921.31.
- Вавин ВВ, Давудов ХШ, Гаращенко ТИ, Юнусов АС, Нажмудинов ИИ, Поляков ДП. Использование СО2-лазера в эндоларингеальной хирургии постинтубационных стенозов гортани у детей. Вопросы практической пе диатрии. 2019;14(5):34-38. https://doi.org/10.20953/1817-7646-2019-5-34-38.
- Вавин ВВ, Нажмудинов ИИ, Давудов ХШ, Гаращенко ТИ, Давудова БХ, Магомедова КМ, Хоранова МЮ. Микрохирургия хронических постинтубационных стенозов гортани с использованием СО2-лазера. Медицинский совет. 2020;(6):132-138. https://doi.org/10.21518/2079-701X-2020-6-132-138.
- Вавин ВВ, Нажмудинов ИИ, Давудов ХШ, Гаращенко ТИ, Давудова БХ, Магомедова КМ, Хоранова МЮ. Особенности применения СО2-лазера при хирургическом лечении хронических рубцовых стенозов гортани. Медицинский совет. 2020;(6):108-113. https://doi.org/10.21518/2079-701X-2020-6-108-113.
- Нажмудинов ИИ, Гусейнов ИГ, Давудов ХШ, Магомедова КМ, Вавин ВВ, Давудова БХ и др. Cпособ лечения рубцового стеноза голосового отдела гортани в области передней комиссуры. Патент RU 2729354 С1, 05.12.2019. Режим доступа: https://i.moscow/patents/ru2729354c1_20200807.
- Захарова МЛ, Павлов ПВ. Cпособ ларинготрахеопластики при сочетанных межголосовых и подголосовых стенозах гортани. Патент RU 2665458 С1, 29.08.2018. Режим доступа: https://patenton.ru/patent/RU2665458C1.pdf.
- Крюков АИ, Кунельская НЛ, Кирасирова ЕА, Пиминиди ОК, Лафуткина НВ, Мамедов РФ. Способ послеоперационного протезирования голосового отдела гортани после ларингопластики и стент для его осуществления. Патент RU 2609777 С, 03.02.2017. Режим доступа: https://i.moscow/patents/ru2609777c1_20170203.
- Цветков ЭА, Павлов ПВ, Попов АВ. Способ лечения мембран гортани и эндопротез для его осуществления. Патент RU 2153300 С2, 27.07.2000. Режим доступа: https://patents.google.com/patent/RU2153300C2/ru.
- Graupp M, Bachna-Rotter S, Gerstenberger C, Friedrich G, Fröhlich-Sorger E, Kiesler K, Gugatschka M. The unsolved chapter of vocal fold scars and how tissue engineering could help us solve the problem. Eur Arch Otorhinolaryngol. 2016;273(9):2279-2284. https://doi.org/10.1007/s00405-015-3668-8.
- Mattei A, Magalon J, Bertrand B, Philandrianos C, Veran J, Giovanni A. Cell therapy and vocal fold scarring. Eur Ann Otorhinolaryngol Head Neck Dis. 2017;134(5):339-345. https://doi.org/10.1016/j.anorl.2017.06.006.
- Свистушкин ВМ, Старостина СВ, Люндуп АВ, Дедова МГ, Будейкина ЛС, Свистушкин МВ и др. Возможности клеточных технологий в лечении рубцовых поражений голосовых складок. Вестник Российской академии медицинских наук. 2016;71(3):190-199. https://doi.org/10.15690/vramn586.
- Li L, Stiadle JM, Lau HK, Zerdoum AB, Jia X, Thibeault SL, Kiick KL.Tissue engineering-based therapeutic strategies for vocal fold repair and regeneration. Biomaterials. 2016;108:91-110. https://doi.org/10.1016/j.biomaterials.2016.08.054.
- Ohno S, Hirano S, Kanemaru S, Kitani Y, Kojima T, Tateya I et al. Implantation of an atelocollagen sponge with autologous bone marrowderived mesenchymal stromal cells for treatment of vocal fold scarring in a canine model. Ann Otol Rhinol Laryngol. 2011;120(6):401-408. https://doi.org/10.1177/000348941112000610.
- Kanemaru S, Nakamura T, Omori K, Kojima H, Magrufov A, Hiratsuka Y et al. Regeneration of the vocal fold using autologous mesenchymal stem cells. Ann Otol Rhinol Laryngol. 2003;112(11):915-920. https://doi.org/10.1177/000348940311201101.
- Lee BJ, Wang SG, Lee JC, Jung JS, Bae YC, Jeong HJ et al. The prevention of vocal fold scarring using autologous adipose tissue-derived stromal cells. Cells Tissues Organs. 2006;184(3-4):198-204. https://doi.org/10.1159/000099627.
- Hiwatashi N, Hirano S, Suzuki R, Kawai Y, Mizuta M, Kishimoto Y et al. Comparison of ASCs and BMSCs combined with atelocollagen for vocal fold scar regeneration. Laryngoscope. 2016;126(5):1143-1150. https://doi.org/10.1002/LARY.25667.
- Park H, Karajanagi S, Wolak K, Aanestad J, Daheron L, Kobler JB et al. Threedimensional hydrogel model using adipose-derived stem cells for vocal fold augmentation. Tissue Eng Part A. 2010;16(2):535-543. https://doi.org/10.1089/TEN.TEA.2009.0029.
- Long JL, Neubauer J, Zhang Z, Zuk P, Berke GS, Chhetri DK. Functional testing of a tissue-engineered vocal fold cover replacement. Otolaryngol Head Neck Surg. 2010;142(3):438-440. https://doi.org/10.1016/J.OTOHNS.2009.11.020.
- Remacle M, Eckel HE (eds.). Surgery of Larynx and Trachea. Springer; 2010. 308 p. https://doi.org/10.1007/978-3-540-79136-2.
- Jang CH, Cho YB, Yeo M, Lee H, Min EJ, Lee BH, Kim GH. Regeneration of chronic tympanic membrane perforation using 3D collagen with topical umbilical cord serum. Int J Biol Macromol. 2013;62:232-240. https://doi.org/10.1016/J.IJBIOMAC.2013.08.049.
- Kanemaru SI, Kanai R, Omori K, Yamamoto N, Okano T, Kishimoto I et al. Multicenter phase III trial of regenerative treatment for chronic tympanic membrane perforation. Auris Nasus Larynx. 2021;48(6):1054-1060. https://doi.org/10.1016/J.ANL.2021.02.007.
- Kim SH, Jeong JY, Park HJ, Moon BM, Park YR, Lee OJ et al. Application of a Collagen Patch Derived from Duck Feet in Acute Tympanic Membrane Perforation. Tissue Eng Regen Med. 2017;14(3):233-241. https://doi.org/10.1007/S13770-017-0039-0.
- Teh BM, Marano RJ, Shen Y, Friedland PL, Dilley RJ, Atlas MD. Tissue engineering of the tympanic membrane. Tissue Eng Part B Rev. 2013;19(2):116-132. https://doi.org/10.1089/TEN.TEB.2012.0389.
- Li X, Zhang H, Zhang Y. Repair of large traumatic tympanic membrane perforation using ofloxacin otic solution and gelatin sponge. Braz J Otorhinolaryngol. 2022;88(1):9-14. https://doi.org/10.1016/J.BJORL.2020.03.007.
- Rezvani Ghomi E, Nourbakhsh N, Akbari Kenari M, Zare M, Ramakrishna S. Collagen-based biomaterials for biomedical applications. J Biomed Mater Res B Appl Biomater. 2021;109(12):1986-1999. https://doi.org/10.1002/JBM.B.34881.
- Svistushkin MV, Kotova S, Shpichka A, Starostina S, Shekhter A, Bikmulina P et al. Stem cell therapy for vocal fold regeneration after scarring: a review of experimental approaches. Stem Cell Res Ther. 2022;13:176. https://doi.org/10.1186/S13287-022-02853-9.
- Mokoyan Z, Svistushkin V, Zolotova A, Svistushkin M. Chronic tympanic membrane perforation: Histopathological evidence of the experimental model. Int J Pediatr Otorhinolaryngol. 2021;151:110964. https://doi.org/10.1016/J.IJPORL.2021.110964.
Фото:
Shutterstoсk/FOTODOM



 1
1 2
2 3
3 4
4


Комментарии (0)