
Журнал "Медицинский совет" №12/2024
DOI: 10.21518/ms2024-289
И.К. Терновых1, С.В. Воробьев1,2, С.Н. Янишевский1, А.М. Танташева1, К.М. Шубина1, М.С. Антушева1, М.Г. Сатиева1
1 Национальный медицинский исследовательский центр имени В.А. Алмазова
2 Санкт-Петербургский государственный педиатрический медицинский университет
Деменция в настоящее время рассматривается в качестве одной из важнейших причин снижения качества бытовой, социальной адаптации пациентов, нарушения их возможностей функционирования в окружающем мире. Она может формироваться при целом спектре заболеваний, основными из которых являются нейродегенеративные процессы, в частности болезнь Альцгеймера. В диагностике когнитивных расстройств, кроме клинического и нейропсихологического, а также лабораторного обследования, существенную роль играют современные методы компьютерной нейровизуализации. Существенное значение при этом придается исследованиям на основе магнитного резонанса, достигшим большого прогресса за последнее время. Изменения, регистрируемые с помощью структурной магнитно-резонансной томографии (МРТ), зачастую «отстают» от регистрируемой клинической симптоматики и определяются на развернутых этапах болезни. Для верификации ранних проявлений нейродегенеративных изменений, наблюдающихся в головном мозге, предложены новые методы МРТ. К ним, в частности, относится магнитно-резонансная (МР)морфометрия. Она позволяет определить абсолютные значения выраженности атрофических изменений, установить их точную топическую локализацию. Ее применение не только улучшает возможности постановки диагноза на додементных стадиях, но также повышает качество дифференциальной диагностики различных патогенетических вариантов наблюдающихся когнитивных нарушений. Кроме того, применение специальных программ постпроцессинговой обработки данных уменьшает вероятность ошибки при интерпретации полученных данных. В настоящее время предложены три варианта оценки результатов МР-морфометрии, основанных на анализе объема отдельных структур головного мозга, толщины серого вещества, а также пространственной формы тех или иных формирований. Комплексное использование этих вариантов способствует наиболее качественному МР-морфометрическому обследованию головного мозга при формировании нейродегенеративного процесса.
Для цитирования: Терновых ИК, Воробьев СВ, Янишевский СН, Танташева АМ, Шубина КМ, Антушева МС, Сатиева МГ. Возможности и перспективы метода магнитно-резонансной морфометрии в диагностике деменций. Медицинский Совет. 2024;(12):22–30. https://doi.org/10.21518/ms2024-289
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Благодарности. Работа выполнена в рамках Государственного задания 124021600050-1.
Possibilities and prospects of the MR morphometry method in the diagnosis of dementia
Ivan К. Ternovykh1, Sergey V. Vorobyev1,2, Stanislav N. Yanishevskiy1, Anna М. Tantasheva1, Kristina M. Shubina1, Maria S. Antusheva1, Marina G. Satieva1
1 Almazov National Medical Research Centre; 2, Akkuratova St., St Petersburg, 197341, Russia
2 St Petersburg State Pediatric Medical University; 2, Litovskaya St., St Petersburg, 194100, Russia
Dementia is one variant severe disorder’s
higher cortical function and is currently considered as one most important
cause a decrease in the quality household, social adaptation patients, and a
violation their ability function in the world around them. It can be formed in
a wide range disease, main which are neurodegenerative processes, in particular
Alzheimer's disease. In the diagnosis cognitive disorders, in addition to
clinical and neuropsychological, as well as laboratory examination, modern
methods computer neuroimaging plays an essential role. Same time, significant
importance is attached research based on magnetic resonance, which has achieved
great progress in recent years. Changes recorded by structural magnetic
resonance imaging (MR tomography) often "lag behind" recorded
clinical symptoms and are determined advanced disease. New MR methods have been
proposed to verify early manifestations of neurodegenerative changes observed
in the brain. These include, in particular, MR morphometry. It allows you to
determine absolute values severity of atrophic changes, to establish their
exact topical localization. Its use not only improves the possibilities of
diagnosis pre-stage stages, but also improves quality of differential diagnosis
various pathogenetic variants observed cognitive disorders. In addition, use
special postprocessing data processing programs reduce the likelihood errors in
interpretation received data. Currently, three options have been proposed for
evaluating the results of MR morphometry, based on the analysis volume
individual brain structures, thickness gray matter, as well as the spatial
shape certain formations. Integrated use these options contributes highest
quality MR morphometric examination of the brain during formation
neurodegenerative process.
For citation: Ternovykh IК, Vorobyev SV, Yanishevskiy SN, Tantasheva AM, Shubina КM, Antusheva MS, Satieva MG. Possibilities and prospects of the MR morphometry method in the diagnosis of dementia. Meditsinskiy sovet = Medical Council. 2024;(12):22–30. (In Russ.) https://doi.org/10.21518/ms2024-289
Conflict of interest: the authors declare no conflict of interest.
Acknowledgments. This work was performed as part of State Assignment 124021600050-1.
Введение
Согласно определению
Всемирной организации здравоохранения (ВОЗ), деменция – это синдром, который
может быть вызван целым рядом заболеваний, которые постепенно нарушают работу
нейронов головного мозга (ГМ) и приводят к приобретенному глобальному снижению
когнитивных функций, таких как память, сложные бытовые и профессиональные
действия, коммуникативные навыки, способность решения задач повседневной
деятельности и др., до уровня, формирующего социальную и бытовую дезадаптацию и
утрату самостоятельности. Хотя деменция не оказывает воздействия на сознание,
нарушение когнитивной функции часто сопровождается, а иногда и предваряется
перепадами настроения, ухудшением контроля над эмоциональным состоянием,
деградацией социального поведения или мотивации. Деменция имеет физические,
психологические, социальные и экономические последствия не только для пациентов,
но и для тех, кто за ними ухаживает, членов семей и общества в целом. Нередко
это сопровождается недостаточной осведомленностью о проблеме деменции и
непониманием ее особенностей, что приводит к социальной стигматизации и
затрудняет проведение диагностики и оказание помощи. Основу подхода к оценке
когнитивного снижения составляет сбор анамнеза и клиническое обследование, в то
время как нейровизуализация и лабораторная диагностика дополняют клиническую
оценку при дифференциации первичных и вторичных причин деменции. В настоящее
время наибольшее развитие получило направление компьютерной нейровизуализации, особенно
на основе МР-томографии, которое позволило расширить возможности анализа
характерных для деменции изменений ГМ. Учитывая результаты имеющихся данных, можно
говорить о том, что именно спектр данных технологий диагностики станет
важнейшим биомаркером при оценке степени деменции и особенностей ее развития.
Современные технологии и нейровизуализации
Исторически
нейровизуализация при деменции использовалась в качестве метода исследования
для диагностики вторичных причин деменции, в частности сосудистых заболеваний
головного мозга, нормотензивной гидроцефалии, объемных образований и
инфекционных процессов. Однако благодаря технологическим достижениям в этой
области, которые сопровождаются лучшим пониманием патогенетических особенностей
течения заболевания и появлением новых методов лечения, в современную эпоху
становится актуальным диагностировать первичные деменции на ранних стадиях. За
последнее десятилетие появилось несколько новых показателей и
последовательностей изображений, которые фактически «раскрывают» мозг с высокой
степенью радиологической и патологической корреляции [1].
Согласно современным
представлениям, нейровизуализация при деменции подразделяется на структурную,
функциональную и молекулярную визуализацию [2]. В структурной
нейровизуализации для анализа изменений в ГМ используются компьютерная
томография (КТ) и магнитно-резонансная томография (МРТ). Однако результаты
визуализации, полученные с помощью традиционных методов структурной
визуализации, обычно отстают от клинической симптоматики. Использование
воксельной морфометрии (ВМ) при анализе серого вещества и диффузионно-тензорной
визуализации (ДТВ) при анализе белого вещества усиливает
клинико-рентгенологическую корреляцию [2]. Функциональная визуализация
базируется на позитронно-эмиссионной томографии (ПЭТ), однофотонной эмиссионной
КТ (ОФЭКТ) и функциональной МРТ (ФМРТ) для анализа функциональной активности
мозга. Значимую роль в диагностике деменций играет ПЭТ. При ПЭТ-визуализации в
качестве индикатора может использоваться 18F-фтордезоксиглюкоза, а при
ОФЭКТ-визуализации для анализа церебральной активности наиболее часто
применяется 99mTc гексаметилпропиленаминооксим [2]. Эти методы позволяют
оценивать мозговую активность посредством косвенных коррелятов – путем анализа
метаболизма глюкозы или измерения церебральной перфузии. ФДГ-ПЭТ широко
применяется в качестве дополнительного метода для раннего установления и
дифференциальной диагностики различных типов деменций. В частности, при болезни
Альцгеймера (БА) обнаруживается гипометаболизм глюкозы в височно-теменных
отделах, коррелирующий с тяжестью деменции, усиливающийся по мере утраты
нейронов и снижения синаптической активности [3]. За последние два десятилетия
были разработаны ПЭТ-критерии, описывающие различные патологические и
физиологические биомаркеры БА, что внесло значительный вклад в диагностику
этого заболевания. Нейровизуализационные маркеры, нацеленные на визуализацию бета-амилоида
и тау-протеина, позволили дифференцировать БА и другие типы деменции, оценивать
эффекты терапии [4]. Также перспективы представляет использование других
лигандов, в частности направленных на измерение синаптической плотности с
помощью ПЭТ-визуализации биомаркера SV2A (синаптического везикулярного
протеина), что открывает новые возможности для исследования нейродегенеративных
заболеваний. Ожидается, что ПЭТ-визуализация SV2A, находящаяся сейчас в стадии
разработки, предоставит дополнительную информацию об изменениях синаптических
белков на протяжении всего периода прогрессирования БА и внесет вклад в раннее
выявление заболевания [4]. ФМРТ использует последовательность, зависящую от
уровня кислорода в крови. Метод основан на том, что повышение мозговой
активности связано с увеличением соотношения оксигемоглобина и
дезоксигемоглобина. В молекулярной визуализации применяются
радиоактивные индикаторы, которые связываются с белковыми отложениями,
считающимися патологическими при конкретном заболевании [2]. Молекулярная
визуализация включает визуализацию амилоида, тау-протеина и транслокационного
белка [5]. Подробное описание и обсуждение технологий функциональной и
молекулярной нейровизуализации не входит в задачи данного обзора.
Структурная нейровизуализация
Структурная визуализация
с использованием КТ или МРТ широко используется в клинической практике и
рекомендуется несколькими диагностическими и исследовательскими руководствами
для контроля течения заболевания у пациентов с деменцией [6], при этом МРТ безусловно
предпочтительнее КТ, если она доступна [1].
Структурная визуализация помогает проводить дифференциальную диагностику и исключить
такие нозологии, как объемные образования, инсульт, нормотензивная гидроцефалия,
а также позволяет провести дифференциальную диагностику деменций на основе
характерных закономерностей атрофии, изменений белого вещества и наличия или
отсутствия цереброваскулярных заболеваний [7]. Выявленные изменения могут быть
обобщены в радиологических отчетах и количественно оценены с использованием
различных методов, включая визуальную оценку с использованием проверенных
оценочных шкал, объемную оценку, или более детальную количественную оценку с
использованием таких методов, как ВМ или оценка толщины коры. Однако важно
отметить, что в этих случаях роль нейровизуализации заключается в подтверждении
клинического диагноза. Например, при БА наблюдается атрофия с преобладанием в
височной доле, особенно в гиппокампе, что имеет особенное значение в ранней
диагностике заболевания. Лобно-височная деменция (ЛВД) проявляется атрофией
переднего височного полюса и лобной атрофией, а подтип семантической деменции
связан с асимметричной височной атрофией. При
деменции с тельцами Леви (ДТЛ) наблюдается относительная сохранность
гиппокампа, в то же время определяется атрофия затылочных и подкорковых
областей, тогда как сосудистые когнитивные нарушения и сосудистая деменция
связаны с кортикальными и подкорковыми изменениями (последние включают
гиперинтенсивность белого вещества, формирование лакун, расширение периваскулярных
пространств и микрокровоизлияния) [8, 9].
Диффузионно-тензорная
визуализация. Методами структурной визуализации, которые
кажутся наиболее многообещающими для диагностики деменции на доклинических
стадиях, являются ДТВ и ВМ. До недавнего времени существовало представление о
том, что основные изменения при БА затрагивают клеточные группы серого вещества
ГМ, а изменения белого вещества считались вторичными. Однако недавние
исследования БА продемонстрировали доказательства микроструктурных изменений в
белом веществе ГМ (демиелинизация и разрушение аксонов), которые предшествуют
другим патологическим изменениям, и, в свою очередь, приводят к изменению
диффузионных свойств воды. Объяснение этому таково: тау-протеин – транспортный
белок, присутствующий преимущественно в аксонах; при его гиперфосфорелировании
происходит нарушение транспортной функции аксонов, что объясняет ранние
изменения белого вещества, связанные с БА. Кроме того, в работах по выполнению
ДТВ носителям аллели APOE4 была показана потеря белого вещества,
непропорциональная атрофии медиальной височной доли, что еще больше
подчеркивает возможность развития ранних изменений белого вещества при БА
задолго до потери серого вещества [10].
В структуру ДТВ входят 4
важных параметра: 1) фракционная анизотропия, представляющая собой долю
тензора, присвоенную определенному направлению диффузии; 2) средняя диффузия,
которая представляет собой среднюю диффузию молекул воды в данном вокселе; 3)
коэффициент осевой диффузии, который является мерой диффузии молекул воды вдоль
длинной оси волокон в области исследования; 4) радиальная диффузия, которая
является мерой диффузии молекул воды в направлении, перпендикулярном длинной
оси волокон в области исследования [11].
Величина этих параметров
варьирует в зависимости от основного патологического процесса. Например,
простая демиелинизация при нормальной целостности аксонов приводит к увеличению
радиальной диффузии без изменений осевой диффузии, тогда как в случае
валлеровской дегенерации будет наблюдаться снижение фракционной анизотропии и
осевой диффузии с увеличением радиальной диффузии и незначительным изменением
средней диффузии [11]. При деменции на фоне БА повышается средняя диффузионная
способность и снижается фракционная анизотропия с преобладанием этих изменений
в задней части мозолистого тела, задней части поясной извилины, лобной и
височной долей. Эти процессы происходят после атрофии коры, что позволяет
предположить, что причиной изменений белого вещества является валлеровская
дегенерация [12]. При других вариантах деменции параметры ДТВ также изменяются.
Так, при ДТЛ наблюдается снижение фракционной анизотропии и увеличение средней
диффузии в теменно-затылочных долях с относительной сохранностью лобных и
височных долей, что контрастирует с особенностями БА, а при лобно-височной
дегенерации отмечают резкое снижение фракционной анизотропии в лобных долях по
сравнению с БА [2].
Воксельная морфометрия. МР-морфометрия
и топическая локализация нейродегенеративных изменений. ВМ
– метод измерения пространственных характеристик исследуемого мозга. С помощью
него описываются как локальные, так и глобальные изменения объема или атрофии
различных структур центральной нервной системы. В отличие от исследований по
измерению объема вручную по анатомическим ориентирам, которые отнимают много
времени и могут привести к систематической ошибке из-за субъективной оценки, ВМ
дает более точные результаты. Кроме того, при визуальном анализе обнаруживаются
только грубые изменения объема и раннюю стадию заболевания можно не заметить.
Это ограничение можно преодолеть с помощью ВМ, которая анализирует каждый
воксель в области интереса. В то же время ВМ не лишена недостатков, таких как
ошибки обработки и получение различных результатов в зависимости от методов,
используемых для обработки [2].
С учетом того, что
атрофия является одним из основных патоморфологических критериев
нейродегенерации, МР-морфометрия находит все более широкое применение в рамках
диагностического процесса у пациентов с когнитивными расстройствами. Так, в
работе M.C. Evans et al. было установлено, что среднее
стандартное отклонение потери объема ГМ при БА составляет 1,5% в год у
пациентов с деменцией по сравнению со значением 1,1% в год у пациентов с УКР и
0,5% в год в контрольной группе [13].
Авторы исследования отметили, что у пациентов с умеренными когнитивными
расстройствами (УКР), перешедшими в деменцию при БА, значимая атрофия ГМ
наблюдалась в два раза чаще, чем у пациентов с УКР без прогрессирования
когнитивной дисфункции. J.L. Whitwell et al. [14] также установили, что при
прогрессировании у пациентов с УКР с последующим развитием в течение 18 мес. от
исходного сканирования тяжелых когнитивных нарушений наблюдаются значимые
атрофические изменения ГМ по сравнению с группой УКР без прогрессирования. G.F. Busatto et al. провели
исследование, в котором использовали полностью автоматизированный метод ВМ для
оценки изменений по всей площади височной доли при разделении пациентов с БА и
здоровых добровольцев из контрольной группы [15]. При этом их результаты
подтвердили данные предыдущих исследований [16–18], в которых у пациентов с БА
обнаружена значительная двусторонняя потеря объема ГМ в области медиальной
височной доли, а также установлено, что основной областью, где инициируются
нейродегенеративные изменения на самых ранних стадиях БА, является
энторинальная кора. В проведенном в это же время исследовании G.B. Karas et al. впервые с помощью ВМ
продемонстрировали значительное уменьшение объема мозжечка, медиального
таламуса и головки хвостатого ядра у пациентов с БА [19]. Эти результаты стали
подтверждением более ранних гистоморфологических работ, выполненных E. Braak et al. [20, 21]. В своем
следующем исследовании G.B. Karas et
al. проанализировали закономерности потери вещества ГМ, чтобы на основе ВМ дать
характеристику УКР и деменции при БА [22]. Помимо этой основной задачи, авторы
хотели выяснить, изменяется ли объем гиппокампа у пациентов, перешедших из УКР
в деменцию. Результаты исследования показали, что в группе пациентов с УКР
наблюдалась потеря объема ГМ в области медиальной височной доли, в то время как
у пациентов с деменцией превалировали изменения в теменной и поясной коре.
Интересное исследование
продемонстрировали F.S.R.B. da Silva et
al.: их данные также свидетельствуют, что при БА основные нейродегенеративные
изменения наблюдаются в области гиппокампа, парагиппокампа, а также
энторинальной коры. При этом обнаружена достоверная корреляционная связь между
распространенностью и степенью выраженности атрофических изменений, с одной
стороны, и результатами обследования по краткой шкале оценки психического
статуса и клинической рейтинговой шкале деменции – с другой [23]. В другой
работе оценивалась степень уменьшения объема серого вещества у пациентов с БА
по сравнению с группой контроля, состоявшей из относительно здоровых лиц
аналогичной возрастной когорты. Оценка производилась в несколько временных
промежутков в интервале от 2 нед. до 24 мес. от начала наблюдения. Было
установлено, что в зонах интереса (гиппокамп, энторинальная кора, амигдала) у
пациентов с БА на начальном этапе объем серого вещества был на 19% меньше, чем
в группе здоровых добровольцев. Данный показатель снизился почти на 82% к окончанию
срока наблюдения. При этом интересным является тот факт, что наибольший уровень
атрофических изменений, выявляемых уже в самые ранние сроки исследования,
наблюдается в области СА2 гиппокампа, имеющей обширные внутри- и
экстрагиппокампальные связи и играющей существенное значение в кодирование
временных и контекстуальных проявлений памяти [24, 25].
Кроме того, установлена определенная закономерность развития
атрофических изменений, затрагивающих отдельные области, которые можно
объединить в рамках функциональных нейрональных сетей, задействованных в
реализации когнитивных функций [26]. Визуальная картина топического
распределения основных нейродегенеративных изменений указана на рис. 1.
Таким образом, метод ВМ
делает возможным установить уровень и топическую локализацию
нейродегенеративных изменений, специфичную для группы с прогрессирующим
характером нарушения высших корковых функций.
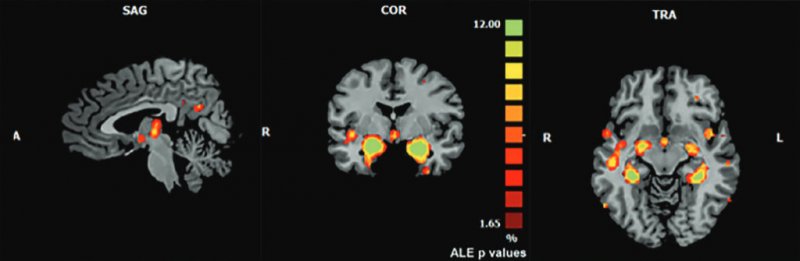
Рисунок
1. Локализация анатомических структур головного мозга,
имеющих наиболее выраженные атрофические изменения у пациентов с БА, по
сравнению с группой здоровых добровольцев, и включающих гиппокамп,
парагиппокамп, нижнюю височную извилину, миндалевидные тела (по J. Manuello et al., 2018).
Данные МРТ-исследований,
основанные на анализе объема
С самых первых
исследований, посвященных измерениям объема гиппокампа у пациентов с БА, стало
очевидно, что уровень его атрофии может представлять собой полезный
диагностический биомаркер. В ряде работ, сравнивающих группы пациентов с БА и
здоровых добровольцев, сообщалось, что объем гиппокампа варьирует от 1600 мм3
[27] до 3000 мм3 [28]. По данным N. Schuff et al., атрофия гиппокампа
ускорялась на 26,5 ± 4,5 мм3/год при деменции вследствие БА и на
12,1 ± 3,2 мм3/год при УКР, что эквивалентно 1,6 ± 0,2%/год и 0,6 ±
0,2%/год, соответственно, по отношению к исходному объему [27]. Одна из первых
работ, в которых МРТ использовалась для выяснения того, могут ли изменения
объема медиальной височной доли способствовать дифференцировке пациентов с БА и
без нее, была проведена в 1997 г. C.R. Jack et al.
[29]. В их исследование вошли 126 добровольцев старшей возрастной группы
(группа контроля) и 94 пациента с вероятной БА. В обеих группах оценивали
объемы гиппокампа, парагиппокампальной извилины и миндалевидного тела. Результаты
показали параллельное снижение объема перечисленных структур с увеличением
возраста в обеих группах, однако уменьшение объема медиальной височной доли у
пациентов с БА было гораздо значительнее по сравнению с субъектами группы
контроля (p < 0,001). Позднее, в 2001 г., G. Galton et al. подтвердили, что атрофия гиппокампа
является полезным диагностическим биомаркером, и показали, что у пациентов с БА
она достигает 50% [30]. В 2007 г. исследователи под руководством M. Chupin использовали объем гиппокампа, чтобы
дифференцировать группу контроля от пациентов с УКР и деменцией при БА [31]. В дальнейшем
эта техника была полностью автоматизирована O. Colliot et al., при этом гиппокамп и миндалевидное
тело оценивались одновременно [32]. Результаты этой работы выявили значительное
уменьшение объема гиппокампа во всех группах пациентов. В частности,
наблюдалось снижение объема на 32% между контрольной группой и пациентами с
деменцией, на 19% между контрольной группой и больными с УКР и, наконец, на 15%
между группами с УКР и деменцией. Кроме того, более поздними исследованиями
было установлено, что уже на доклинической (бессимптомной) стадии БА отмечается
значимое уменьшение объема субикулума и областей СА1-СА3 гиппокампа [33].
Помимо гиппокампа, для
оценки прогрессирования БА используются и другие структуры, такие как
энторинальная кора. В 1999 г. К. Juottonen et al. выполнили исследование с
использованием волюметрической МРТ у пациентов с БА и здоровых добровольцев [34].
Оказалось, что у пациентов с БА отмечается существенное уменьшение объема энторинальной
коры с обеих сторон. Обнаружено, что он был на 38% меньше справа и на 40%
меньше слева по сравнению с субъектами группы контроля. Аналогичная картина
наблюдалась и при оценке объема гиппокампа: его значение было на 33% меньше
справа и на 35% меньше слева по сравнению с нормой. Кроме того, результаты,
полученные в работе С. Pennanen
et al., показали, что атрофия
энторинальной коры была более выраженной по сравнению с объемом гиппокампа у
пациентов с УКР, тогда как у пациентов с БА превалировала именно атрофия
гиппокампа [35].
Данные МРТ-исследований, основанные на анализе толщины
Впервые
автоматизированные структурные измерения толщины энторинальной коры и
надкраевой извилины были выполнены в 2009 г. R.S. Desikan et al., чтобы дифференцировать пациентов с
БА от нормы [36]. Они использовали объемные сканирования из двух независимых
когорт, изображения которых были получены из исследования OASIS [37] и базы данных ADNI [2].
Объем гиппокампа, энторинальная кора и толщина надкраевой извилины показали
среднюю площадь под кривой (area
under curve –
AUC)
0,91 в обследуемой когорте и 0,95 – в контрольной группе. Следует отметить, что
их результаты были сопоставимы и даже превосходили другие методы нейровизуализации,
такие как ПЭТ с фтордезоксиглюкозой [38, 39], или ПЭТ с лигандами связывания
амилоида [40, 41]. Кроме того, точность распознавания пациентов с УКР в этом
исследовании была сопоставима с предыдущим исследованием ПЭТ с использованием
индикатора связывания бета-амилоида и тау-протеина [41] и двумя структурными МРТ-обследованиями
[42, 43]. Другое исследование продемонстрировало, что на стадии УКР наиболее
характерным является изменение толщины молекулярного слоя зубчатой извилины, а
также субикулума и СА1 области гиппокампа [44]. В работе по глобальному измерению
толщины коры всего мозга J.P. Lerch
et al. было установлено, что данный
показатель уменьшился во многих областях ГМ, однако наиболее пострадавшими
областями были парагиппокампальная извилина и медиальные височные доли [45]. При
этом по мере прогрессирования заболевания уменьшение толщины коры наблюдается
во все большем количестве областей, захватывая не только гиппокампальную
формацию, но и поясную кору, различные регионы височной, теменной коры, а также
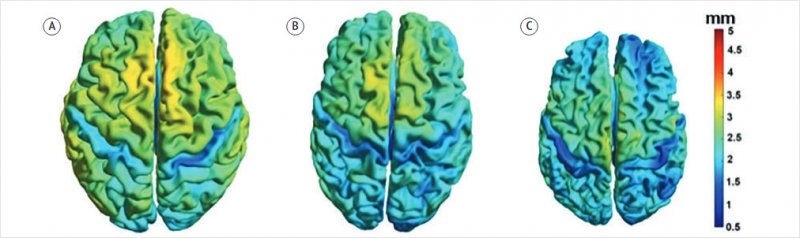
лобные доли [46]. На рис. 2 отражена
динамика уменьшения толщины корковых структур на разных стадиях заболевания.
При этом в ходе
исследований [34, 35] было обнаружено, что доминантное полушарие мозга страдает
сильнее. Таким образом, установлено, что корковая атрофия на ранних стадиях БА
затрагивает не только медиальную височную долю, но и части лимбической системы,
латеральные височные доли и кору других отделов головного мозга.
2. Цветовое картирование, отражающее изменение толщины
коры различных отделов головного мозга при прогрессировании БА. А – группа
контроля, Б – УКР, В – деменция (по Z. Wu et al., 2021)
Данные МРТ-исследований, основанные на исследованиее формы и комплексном анализе
В работе Е. Gerardin et
al. анализировались особенности формы гиппокампа вместо оценки объема, и было
установлено, что анализ формы может обнаружить локальную атрофию гиппокампа до
того, как он начнет терять объем [47]. Следовательно, этот метод может быть
более чувствительным, особенно на этапе УКР. Анализ формы можно использовать
для выявления атрофии в локальных областях гиппокампа, и, по мнению авторов,
точность дифференцировки между пациентами с БА и субъектами группы контроля
превосходила исследования, в которых использовался объемный анализ, где
точность отличий варьировалась от 80 до 90%. Однако эти результаты были
получены в исследованиях, в которых использовалась ручная, а не
автоматизированная обработка данных. Автоматизированную процедуру для получения
3D-морфологии и формы гиппокампа впервые использовали S.G. Costafreda et al. [48]. В их модель
прогнозирования был включен только гиппокамп, при этом была достигнута
прогностическая эффективность, сравнимая или превосходящая другие исследования
[49–51]. Также авторами ряда исследований было сделано предположение о том, что
атрофия головки гиппокампа может быть ранним признаком риска прогрессирования
когнитивной дисфункции и может использоваться для прогнозирования развития УКР в
деменцию при БА [52–54]. Таким образом, церебральная атрофия, зафиксированная с
помощью методик структурной МРТ, является многообещающим биомаркером в оценке
ранней стадии БА. Многие исследования [35, 42, 55, 56] доказали, что медиальная
височная доля представляет собой область, которая подвергается изменениям даже
на доклинической стадии заболевания. Хотя гиппокамп является наиболее часто исследуемой
структурой для оценки БА, более раннее вовлечение в атрофический процесс энторинальной
коры было установлено во многих работах, и ее оценка может оказаться весьма
перспективной [14, 30, 34, 57–60]. Необходимость количественной обработки и
визуализации МРТ-изображений с помощью программ постпроцессинговой обработки
данных обусловлена тем фактом, что человеческий глаз не может воспринимать
тонкие анатомические изменения, затрагивающие структуры мозга, поэтому он
обнаруживает атрофию после того, как мозг уже подвергся достаточно существенным
структурным изменениям. Все вышеупомянутые исследования свидетельствуют о том,
что машинный (программный) анализ МР-изображений имеет важное значение для
оценки БА и может использоваться для дифференциальной диагностики либо для
прогнозирования перехода УКР в деменцию при БА. Необходимо, однако, отметить,
что очень мало исследований [61, 62] отличаются комплексным подходом –
одновременной оценкой объема, толщины, формы регионов-мишеней ГМ, что, в свою
очередь, может снижать точность дифференциальной диагностики и прогнозирования
их течения и исходов.
В настоящее время очень
большое внимание уделяется возможностям оценки клинического развития различных
вариантов деменций. Очень важно идентифицировать конкретные диагностические морфометрические
маркеры развития нарушений высших корковых функций, чтобы предсказать, каков
риск прогрессирования пациентов с УКР в деменцию при различных патогенетических
вариантах нарушений высших корковых функций. Возможно, выполнение серийных
МРТ-сканирований с ежегодными или более длительными интервалами для изучения
прогрессирования заболевания даст представление о прогнозировании рисков для
пациента. Интересно, что при прогрессировании заболевания данные анализа
морфометрических измерений, полученных с помощью ВМ, могут дать результаты,
сопоставимые с клеточными или метаболическими маркерами, полученными при
использовании других методов нейровизуализации, таких как ПЭТ с лигандами к амилоиду
Aβ и фтордезоксиглюкозой. Тем не менее ряд других исследований [35, 43, 57]
показали, что до появления клинических симптомов предпочтительнее использовать
МР-морфометрию, в большинстве случаев она
может быть более точной и информативной, чем метаболические маркеры [63–65].
Заключение
На современном этапе развития и практического
применения технологий нейровизуализации исследования по диагностике и поиску
МР-маркеров БА в основном включают объемные 3D T1-взвешенные
последовательности. Однако существуют и другие стратегии МРТ, такие как МРТ с
диффузионно-взвешенной визуализацией (DWI) и ДТВ [66], возможности которых в
плоскости рассматриваемых нами вопросов еще предстоит изучить в крупных
когортных исследованиях. Кроме того, обучение искусственного интеллекта и
развитие медицинских нейросетей – это новая тенденция в анализе МР-изображений,
которая становится методологией выбора во многих исследованиях, в т. ч.
посвященных БА и другим деменциям [67]. Количественная МРТ может оказать
большое влияние на своевременную диагностику и лечение таких заболеваний,
особенно если подходы, описанные в этом обзоре, вскоре перейдут от
экспериментальной стадии к клинической.
[1] Overview | Dementia:
assessment, management and support for people living with dementia and their
carers | Guidance | NICE. Available at: https://www.nice.org.uk/guidance/ng97.
2023.
[2] The Alzheimer’s Disease Neuroimaging
Initiative (ADNI). 2017. Available at: http://adni.loni.usc.edu.
Список литературы / References
Развернуть
- Martin-Macintosh EL, Broski SM, Johnson GB, Hunt CH, Cullen EL, Peller PJ. Multimodality Imaging of Neurodegenerative Processes: Part 1, The Basics and Common Dementias. AJR Am J Roentgenol. 2016;207(4):871-882. https://doi.org/10.2214/AJR.14.12842.
- Ranganathan LN, Guhan R, Arun Shivaraman MM, Sankar PL, Srinivasan AV, Suriyakumar G, Periakaruppan AL. Changing Landscapes in the Neuroimaging of Dementia. Ann Indian Acad Neurol. 2018;21(2):98-106. https://doi.org/10.4103/aian.AIAN_48_18.
- Прокопенко СВ, Баранкин БВ, Марьина НМ, Можейко ЕЮ, Зубрицкая ЕМ, Чанчикова НГ и др. Диагностика болезни Альцгеймера с использованием ПЭТ/КТ: клиническое наблюдение. Сибирское медицинское обозрение. 2018;(6):67-73. https://doi.org/10.20333/2500136-2018-6-67-73.
- Bao W, Xie F, Zuo C, Guan Y, Huang YH. PET Neuroimaging of Alzheimer’s Disease: Radiotracers and Their Utility in Clinical Research. Front Aging Neurosci. 2021;13:624330. https://doi.org/10.3389/fnagi.2021.624330.
- Rayment D, Biju M, Zheng R, Kuruvilla T. Neuroimaging in dementia: An update for the general clinician. Prog Neurol Psychiatry. 2016;20:16-20. https://doi.org/10.1002/pnp.420.
- Jack CR, Bennett DA, Blennow K, Carrillo MC, Feldman HH, Frisoni GB et al. A/T/N: an unbiased descriptive classification scheme for Alzheimer disease biomarkers. Neurology. 2016;87(5):539-547. https://doi.org/10.1212/WNL.0000000000002923.
- Harper L, Barkhof F, Scheltens P, Schott JM, Fox NC. An algorithmic approach to structural imaging in dementia. J Neurol Neurosurg Psychiatry. 2014;85(6):692-698. https://doi.org/10.1136/jnnp-2013-306285.
- Harper L, Barkhof F, Fox NC, Schott JM. Using visual rating to diagnose dementia: a critical evaluation of MRI atrophy scales. J Neurol Neurosurg Psychiatry. 2015;86(11):1225-1233. https://doi.org/10.1136/jnnp-2014-310090.
- Wardlaw JM, Smith EE, Biessels GJ, Cordonnier C, Fazekas F, Frayne R et al. Neuroimaging standards for research into small vessel disease and its contribution to ageing and neurodegeneration. Lancet Neurol. 2013;12(8):822-838. https://doi.org/10.1016/S1474-4422(13)70124-8.
- Sachdev PS, Zhuang L, Braidy N, Wen W. Is Alzheimer’s a disease of the white matter? Curr Opin Psychiatry. 2013;26(3):244-251. https://doi.org/10.1097/YCO.0b013e32835ed6e8.
- Madden DJ, Bennett IJ, Burzynska A, Potter GG, Chen NK, Song AW. Diffusion tensor imaging of cerebral white matter integrity in cognitive aging. Biochim Biophys Acta. 2012;1822(3):386-400. https://doi.org/10.1016/j.bbadis.2011.08.003.
- Medina DA, Gaviria M. Diffusion tensor imaging investigations in Alzheimer’s disease: the resurgence of white matter compromise in the cortical dysfunction of the aging brain. Neuropsychiatr Dis Treat. 2008;4(4):737-742. https://doi.org/10.2147/ndt.s3381.
- Evans MC, Barnes J, Nielsen C, Kim LG, Clegg SL, Blair M et al. Volume changes in Alzheimer’s disease and mild cognitive impairment: cognitive associations. Eur Radiol. 2010;20(3):674-682. https://doi.org/10.1007/s00330-009-1581-5.
- Whitwell JL, Shiung MM, Przybelski SA, Weigand SD, Knopman DS, Boeve BF et al. MRI patterns of atrophy associated with progression to AD in amnestic mild cognitive impairment. Neurology. 2008;70(7):512-520. https://doi.org/10.1212/01.wnl.0000280575.77437.a2.
- Busatto GF, Garrido GE, Almeida OP, Castro CC, Camargo CH, Cid CG et al. A voxel-based morphometry study of temporal lobe gray matter reductions in Alzheimer’s disease. Neurobiol Aging. 2003;24(2):221-231. https://doi.org/10.1016/s0197-4580(02)00084-2.
- Dickerson BC, Goncharova I, Sullivan MP, Forchetti C, Wilson RS, Bennett DA et al. MRI-derived entorhinal and hippocampal atrophy in incipient and very mild Alzheimer’s disease. Neurobiol Aging. 2001;22(5):747-754. https://doi.org/10.1016/s0197-4580(01)00271-8.
- Juottonen K, Laakso MP, Insausti R, Lehtovirta M, Pitkänen A, Partanen K, Soininen H. Volumes of the entorhinal and perirhinal cortices in Alzheimer’s disease. Neurobiol Aging. 1998;19(1):15-22. https://doi.org/10.1016/s0197-4580(98)00007-4.
- Killiany RJ, Moss MB, Albert MS, Sandor T, Tieman J, Jolesz F. Temporal lobe regions on magnetic resonance imaging identify patients with early Alzheimer’s disease. Arch Neurol. 1993;50(9):949-954. https://doi.org/10.1001/archneur.1993.00540090052010.
- Karas GB, Burton EJ, Rombouts SA, van Schijndel RA, O’Brien JT, Scheltens Ph et al. A comprehensive study of gray matter loss in patients with Alzheimer’s disease using optimized voxel-based morphometry. Neuroimage. 2003;18(4):895-907. https://doi.org/10.1016/s1053-8119(03)00041-7.
- Braak H, Braak E.Neuropathological stageing of Alzheimer-related changes. Acta Neuropathol. 1991;82(4):239-259. https://doi.org/10.1007/BF00308809.
- Braak E, Griffing K, Arai K, Bohl J, Bratzke H, Braak H. Neuropathology of Alzheimer’s disease: what is new since A. Alzheimer? Eur Arch Psychiatry Clin Neurosci. 1999;249(3):14-22. https://doi.org/10.1007/pl00014168.
- Karas GB, Scheltens P, Rombouts SA, Visser PJ, van Schijndel RA, Fox NC, Barkhof F. Global and local gray matter loss in mild cognitive impairment and Alzheimer’s disease. Neuroimage. 2004;23(2):708-716. https://doi.org/10.1016/j.neuroimage.2004.07.006.
- Bernardes da Silva FRS, Barbosa OJH, Rondinoni C, Dos Santos AC, Garrido Salmon CE, da Costa Lima NK et al. Neuro-degeneration profile of Alzheimer’s patients: A brain morphometry study. Neuroimage Clin. 2017;15:15-24. https://doi.org/10.1016/j.nicl.2017.04.001.
- Blair JC, Lasiecka ZM, Patrie J, Barrett MJ, Druzgal TJ. Cytoarchitectonic Mapping of MRI Detects Rapid Changes in Alzheimer’s Disease. Front Neurol. 2020;11:241. https://doi.org/10.3389/fneur.2020.00241.
- Robert V, Cassim S, Chevaleyre V, Piskorowski RA. Hippocampal area CA2: properties and contribution to hippocampal function. Cell Tissue Res. 2018;373(3):525-540. https://doi.org/10.1007/s00441-017-2769-7.
- Manuello J, Nani A, Premi E, Borroni B, Costa T, Tatu K et al. The Pathoconnectivity Profile of Alzheimer’s Disease: A Morphometric Coalteration Network Analysis. Front Neurol. 2018;8:739. https://doi.org/10.3389/fneur.2017.00739.
- Schuff N, Woerner N, Boreta L, Kornfield T, Shaw LM, Trojanowski JQ et al. MRI of hippocampal volume loss in early Alzheimer’s disease in relation to ApoE genotype and biomarkers. Brain. 2009;132(4):1067-1077. https://doi.org/10.1093/brain/awp007.
- Morra JH, Tu Z, Apostolova LG, Green AE, Avedissian C, Madsen SK et al. Validation of a fully automated 3D hippocampal segmentation method using subjects with Alzheimer’s disease mild cognitive impairment, and elderly controls. Neuroimage. 2008;43(1):59-68. https://doi.org/10.1016/j.neuroimage.2008.07.003.
- Jack CRJr, Petersen RC, Xu YC, Waring SC, O’Brien PC, Tangalos EG et al. Medial temporal atrophy on MRI in normal aging and very mild Alzheimer’s disease. Neurology. 1997;49(3):786-794. https://doi.org/10.1212/wnl.49.3.786.
- Galton CJ, Gomez-Anson B, Antoun N, Scheltens P, Patterson K, Graves M et al. Temporal lobe rating scale: application to Alzheimer’s disease and frontotemporal dementia. J Neurol Neurosurg Psychiatry. 2001;70(2):165-173. https://doi.org/10.1136/jnnp.70.2.165.
- Chupin M, Mukuna-Bantumbakulu AR, Hasboun D, Bardinet E, Baillet S, Kinkingnéhun S et al. Anatomically constrained region deformation for the automated segmentation of the hippocampus and the amygdala: Method and validation on controls and patients with Alzheimer’s disease. Neuroimage. 2007;34(3):996-1019. https://doi.org/10.1016/j.neuroimage.2006.10.035.
- Colliot O, Chételat G, Chupin M, Desgranges B, Magnin B, Benali H et al. Discrimination between Alzheimer disease, mild cognitive impairment, and normal aging by using automated segmentation of the hippocampus. Radiology. 2008;248(1):194-201. https://doi.org/10.1148/radiol.2481070876.
- Wu J, Shahid SS, Lin Q, Hone-Blanchet A, Smith JL, Risk BB et al. Multimodal magnetic resonance imaging reveals distinct sensitivity of hippocampal subfields in asymptomatic stage of Alzheimer’s disease. Front Aging Neurosci. 2022;14:901140. https://doi.org/10.3389/fnagi.2022.901140.
- Juottonen K, Laakso MP, Partanen K, Soininen H. Comparative MR analysis of the entorhinal cortex and hippocampus in diagnosing Alzheimer disease. AJNR Am J Neuroradiol. 1999;20(1):139-144. Available at: https://pubmed.ncbi.nlm.nih.gov/9974069.
- Pennanen C, Kivipelto M, Tuomainen S, Hartikainen P, Hänninen T, Laakso MP et al. Hippocampus and entorhinal cortex in mild cognitive impairment and early AD. Neurobiol Aging. 2004;25(3):303-310. https://doi.org/10.1016/S0197-4580(03)00084-8.
- Desikan RS, Cabral HJ, Hess CP, Dillon WP, Glastonbury CM, Weiner MW et al. Automated MRI measures identify individuals with mild cognitive impairment and Alzheimer’s disease. Brain. 2009;132(8):2048-2057. https://doi.org/10.1093/brain/awp123.
- Marcus DS, Fotenos AF, Csernansky JG, Morris JC, Buckner RL. Open access series of imaging studies: longitudinal MRI data in nondemented and demented older adults. J Cogn Neurosci. 2010;22(12):2677-2684. https://doi.org/10.1162/jocn.2009.21407.
- Mosconi L, Tsui WH, Herholz K, Pupi A, Drzezga A, Lucignani G et al. Multicenter standardized 18F-FDG PET diagnosis of mild cognitive impairment, Alzheimer’s disease, and other dementias. J Nucl Med. 2008;49(3):390-398. https://doi.org/10.2967/jnumed.107.045385.
- Jack CRJr, Lowe VJ, Senjem ML, Weigand SD, Kemp BJ, Shiung MM et al. 11C PiB and structural MRI provide complementary information in imaging of Alzheimer’s disease and amnestic mild cognitive impairment. Brain. 2008;131(3):665-680. https://doi.org/10.1093/brain/awm336.
- Li Y, Rinne JO, Mosconi L, Pirraglia E, Rusinek H, DeSanti S et al. Regional analysis of FDG and PIB-PET images in normal aging, mild cognitive impairment, and Alzheimer’s disease. Eur J Nucl Med Mol Imaging. 2008;35(12):2169-2181. https://doi.org/10.1007/s00259-008-0833-y.
- Small GW, Kepe V, Ercoli LM, Siddarth P, Bookheimer SY, Miller KJ et al. PET of brain amyloid and tau in mild cognitive impairment. N Engl J Med. 2006;355(25):2652-2663. https://doi.org/10.1056/NEJMoa054625.
- Killiany RJ, Gomez-Isla T, Moss M, Kikinis R, Sandor T, Jolesz F et al. Use of structural magnetic resonance imaging to predict who will get Alzheimer’s disease. Ann Neurol. 2000;47(4):430-439. Available at: https://pubmed.ncbi.nlm.nih.gov/10762153.
- Davatzikos C, Fan Y, Wu X, Shen D, Resnick SM. Detection of prodromal Alzheimer’s disease via pattern classification of magnetic resonance imaging. Neurobiol Aging. 2008;29(4):514-523. https://doi.org/10.1016/j.neurobiolaging.2006.11.010.
- Kwak K, Niethammer M, Giovanello KS, Styner M, Dayan E.Differential Role for Hippocampal Subfields in Alzheimer’s Disease Progression Revealed with Deep Learning. Cereb Cortex. 2022;32(3):467-478. https://doi.org/10.1093/cercor/bhab223.
- Lerch JP, Pruessner J, Zijdenbos AP, Collins DL, Teipel SJ, Hampel H, Evans AC. Automated cortical thickness measurements from MRI can accurately separate Alzheimer’s patients from normal elderly controls. Neurobiol Aging. 2008;29(1):23-30. https://doi.org/10.1016/j.neurobiolaging.2006.09.013.
- Wu Z, Peng Y, Hong M, Zhang Y. Gray Matter Deterioration Pattern During Alzheimer’s Disease Progression: A Regions-of-Interest Based Surface Morphometry Study. Front Aging Neurosci. 2021;13:593898. https://doi.org/10.3389/fnagi.2021.593898.
- Gerardin E, Chételat G, Chupin M, Cuingnet R, Desgranges B, Kim HS et al. Multidimensional classification of hippocampal shape features discriminates Alzheimer’s disease and mild cognitive impairment from normal aging. Neuroimage. 2009;47(4):1476-1486. https://doi.org/10.1016/j.neuroimage.2009.05.036.
- Costafreda SG, Dinov ID, Tu Z, Shi Y, Liu CY, Kloszewska I et al. Automated hippocampal shape analysis predicts the onset of dementia in mild cognitive impairment. Neuroimage. 2011;56(1):212-219. https://doi.org/10.1016/j.neuroimage.2011.01.050.
- Plant C, Teipel SJ, Oswald A, Böhm C, Meindl T, Mourao-Miranda J et al. Automated detection of brain atrophy patterns based on MRI for the prediction of Alzheimer’s disease. Neuroimage. 2010;50(1):162-174. https://doi.org/10.1016/j.neuroimage.2009.11.046.
- Misra C, Fan Y, Davatzikos C. Baseline and longitudinal patterns of brain atrophy in MCI patients, and their use in prediction of short-term conversion to AD: results from ADNI. Neuroimage. 2009;44(4):1415-1422. https://doi.org/10.1016/j.neuroimage.2008.10.031.
- Duchesne S, Bocti C, De Sousa K, Frisoni GB, Chertkow H, Collins DL. Amnestic MCI future clinical status prediction using baseline MRI features. Neurobiol Aging. 2010;31(9):1606-1617. https://doi.org/10.1016/j.neurobiolaging.2008.09.003.
- Csernansky JG, Wang L, Swank J, Miller JP, Gado M, McKeel D et al. Preclinical detection of Alzheimer’s disease: hippocampal shape and volume predict dementia onset in the elderly. Neuroimage. 2005;25(3):783-792. https://doi.org/10.1016/j.neuroimage.2004.12.036.
- Apostolova LG, Dutton RA, Dinov ID, Hayashi KM, Toga AW, Cummings JL, Thompson PM. Conversion of mild cognitive impairment to Alzheimer disease predicted by hippocampal atrophy maps. Arch Neurol. 2006;63(5):693-699. https://doi.org/10.1001/archneur.63.5.693.
- Morra JH, Tu Z, Apostolova LG, Green AE, Avedissian C, Madsen SK et al. Automated mapping of hippocampal atrophy in 1-year repeat MRI data from 490 subjects with Alzheimer’s disease, mild cognitive impairment, and elderly controls. Neuroimage. 2009;45(1):3-15. https://doi.org/10.1016/j.neuroimage.2008.10.043.
- Dickerson BC, Goncharova I, Sullivan MP, Forchetti C, Wilson RS, Bennett DA et al. MRI-derived entorhinal and hippocampal atrophy in incipient and very mild Alzheimer’s disease. Neurobiol Aging. 2001;22(5):747-754. https://doi.org/10.1016/s0197-4580(01)00271-8.
- Jack CRJr, Petersen RC, Xu YC, O’Brien PC, Smith GE, Ivnik RJ et al. Prediction of AD with MRI-based hippocampal volume in mild cognitive impairment. Neurology. 1999;52(7):1397-1403. https://doi.org/10.1212/wnl.52.7.1397.
- Killiany RJ, Hyman BT, Gomez-Isla T, Moss MB, Kikinis R, Jolesz F et al. MRI measures of entorhinal cortex vs hippocampus in preclinical AD. Neurology. 2002;58(8):1188-1196. https://doi.org/10.1212/wnl.58.8.1188.
- deToledo-Morrell L, Stoub TR, Bulgakova M, Wilson RS, Bennett DA, Leurgans S et al. MRI-derived entorhinal volume is a good predictor of conversion from MCI to AD. Neurobiol Aging. 2004;25(9):1197-1203. https://doi.org/10.1016/j.neurobiolaging.2003.12.007.
- Tapiola T, Pennanen C, Tapiola M, Tervo S, Kivipelto M, Hänninen T et al. MRI of hippocampus and entorhinal cortex in mild cognitive impairment: a follow-up study. Neurobiol Aging. 2008;29(1):31-38. https://doi.org/10.1016/j.neurobiolaging.2006.09.007.
- Gómez-Isla T, Hollister R, West H, Mui S, Growdon JH, Petersen RC et al. Neuronal loss correlates with but exceeds neurofibrillary tangles in Alzheimer’s disease. Ann Neurol. 1997;41(1):17-24. https://doi.org/10.1002/ana.410410106.
- Cuingnet R, Gerardin E, Tessieras J, Auzias G, Lehéricy S, Habert MO et al. Automatic classification of patients with Alzheimer’s disease from structural MRI: a comparison of ten methods using the ADNI database. Neuroimage. 2011;56(2):766-781. https://doi.org/10.1016/j.neuroimage.2010.06.013.
- Wolz R, Julkunen V, Koikkalainen J, Niskanen E, Zhang DP, Rueckert D et al. Multimethod analysis of MRI images in early diagnostics of Alzheimer’s disease. PLoS ONE. 2011;6(10):e25446. https://doi.org/10.1371/journal.pone.0025446.
- Desikan RS, Cabral HJ, Settecase F, Hess CP, Dillon WP, Glastonbury CM et al. Automated MRI measures predict progression to Alzheimer’s disease. Neurobiol Aging. 2010;31(8):1364-1374. https://doi.org/10.1016/j.neurobiolaging.2010.04.023.
- Vemuri P, Wiste HJ, Weigand SD, Shaw LM, Trojanowski JQ, Weiner MW et al. MRI and CSF biomarkers in normal, MCI, and AD subjects: predicting future clinical change. Neurology. 2009;73(4):294-301. https://doi.org/10.1212/WNL.0b013e3181af79fb.
- Frisoni GB, Fox NC, Jack CRJr, Scheltens P, Thompson PM. The clinical use of structural MRI in Alzheimer disease. Nat Rev Neurol. 2010;6(2):67-77. https://doi.org/10.1038/nrneurol.2009.215.
- Bracoud L, Bouguen E, Bonneville F, Schaerer J, Kiyasova V, Roche F et al. DWI and DTI results on normal controls MCI and Alzheimer’s disease subjects from the rosas study. J Alzheimers Assoc. 2015;11(7):801-802. https://doi.org/10.1016/j.jalz.2015.06.129.
- LeCun Y, Bengio Y, Hinton G.Deep learning. Nature. 2015;521(7553):436-444. https://doi.org/10.1038/nature14539.
Фото:
Shutterstoсk/FOTODOM



 1
1 2
2 3
3 4
4


Комментарии (0)