Фото: H_Ko/FOTODOM/Shutterstoсk
Журнал "Медицинский совет" №18/2025
DOI: 10.21518/ms2025-369
А.Б. Киселев1, ORCID: 0000-0002-0319-8222
Р.Ш. Юнусов2, ORCID: 0000-0003-2634-1818
В.А. Чаукина1, ORCID: 0000-0001-8944-8546
О.В. Андамова1, ORCID: 0000-0002-4810-4760
А.С. Автушко1, ORCID: 0000-0002-9855-4276
1 Новосибирский государственный медицинский университет; 630091, Россия, Новосибирск, Красный проспект, д. 52
2 Медицинский центр «Сибирский Доктор»; 634034, Россия, Томск, ул. Елизаровых, д. 17/3
Введение. Повышение эффективности консервативного лечения экссудативного среднего отита (ЭСО) у детей остается актуальной проблемой ввиду полиэтиологичности данного заболевания, а также частого использования хирургической тактики разрешения секреторного отита. Статья объединяет кафедральный опыт наблюдения за течением ЭСО после ОРИ верхних дыхательных путей при различных видах терапии, направленной на разные звенья патогенеза заболевания.
Цель. Оценить клиническую эффективность лечения ЭСО у детей, перенесших ОРИ, интраназальным введением азоксимера бромида в сравнении с комплексной терапией мукорегулятором, топическими антибактериальными средствами и деконгестантом.
Материалы и методы. Проведено клиническое рандомизированное простое открытое проспективное сравнительное исследование с участием 49 детей в возрасте 4–7 лет с ЭСО после ОРИ. Группа наблюдения – 23 пациента, которые получали монотерапию азоксимера бромида (раствор) интраназально по 3 капли в каждый носовой ход 3 раза в день в течение 2 нед. Группа контроля – 26 пациентов, которые получали комплексную терапию (интраназально комбинированный спрей неомицина и полимиксина, дексаметазона метабензоата и фенилэфрина по одному впрыскиванию в каждую ноздрю 3 раза в день в течение 10 дней) и пероральный прием карбоцистеина в дозе, соответствующей возрасту, в течение 2 нед.
Результаты. На фоне терапии азоксимера бромидом динамика восстановления интратимпанального давления не уступала таковой при стандартном лечении, при этом число рецидивов ЭСО в последующие 3 и 6 мес. было меньше.
Выводы. Возрастные особенности местного иммунитета, характерные для детей 4–7 лет могут быть предрасполагающим фактором вялотекущего катарального воспаления слизистой оболочки слуховой трубы и барабанной полости после ОРИ. Интраназальная иммунокоррекция азоксимера бромидом купирует катаральный воспалительный процесс барабанной полости и слуховой трубы при развитии ЭСО после ОРВИ.
Для цитирования: Киселев АБ, Юнусов РШ, Чаукина ВА, Андамова ОВ, Автушко АС. Интраназальная иммунотропная терапия поствирусного экссудативного среднего отита у детей дошкольного возраста. Медицинский совет. 2025;19(18):22–28. https://doi.org/10.21518/ms2025-369.
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Intranasal immunotropic therapy for post-viral exudative otitis media in preschool children
Alexey B. Kiselev1, ORCID: 0000-0002-0319-8222
Ramil Sh. Yunusov2, ORCID: 0000-0003-2634-1818
Viktoriya A. Chaukina1, ORCID: 0000-0001-8944-8546
Olga V. Andamova1, ORCID: 0000-0002-4810-4760
Alexander S. Avtushko1, ORCID: 0000-0002-9855-4276
1 Novosibirsk State Medical University; 52, Krasny Ave., Novosibirsk, 630091, Russia
2 The Siberian Doctor Medical Center; 17/3, Elizarovy St., Tomsk, 634034, Russia
Introduction. Improving the effectiveness of conservative treatment of secretory otitis media (SOM) in children remains an urgent problem because of the multifactorial etiology of the disease and the continued reliance on surgical intervention. The article presents the collective experience of monitoring the course of SOM after ARI with therapy aimed at various links in the pathogenesis of the disease.
Aim. To evaluate the clinical efficacy of intranasal azoximer bromide (Polyoxidonium®, Petrovax, Russia) versus combination therapy with a mucoregulator, topical antibacterial agents, and a decongestant for the treatment of secretory otitis media in children after acute respiratory viral infection.
Materials and methods. A randomized, open-label, prospective, comparative clinical study was conducted in 49 children aged 4–7 years with SOM after ARI. The study group included 23 patients who received intranasal azoximer bromide, 3 drops in each nostril three times daily for two weeks. The control group comprised 26 patients who received combination therapy: an intranasal spray containing neomycin, polymyxin, dexamethasone metabenzoate, and phenylephrine (one administration per nostril three times daily for 10 days) plus oral carbocysteine at an age-appropriate dose for two weeks.
Results. During azoximer bromide treatment, the dynamics of intratympanic pressure recovery were not inferior to those with standard therapy, and SOM relapses were less frequent at 3 and 6 months.
Conclusions. Age-related characteristics of local immunity in children aged 4-7 years may underlie chronic catarrhal inflammation of the mucous membrane of the auditory tube and tympanic cavity after acute respiratory viral infection. Intranasal immunocorrection with azoximer bromide resolves catarrhal inflammation of the tympanic cavity and auditory tube during SOM developing after acute respiratory viral infection.
For citation: Kiselev АВ, Yunusov RSh, Chaukina VA, Andamova OV, Avtushko AS. Intranasal immunotropic therapy for post-viral exudative otitis media in preschool children. Meditsinskiy Sovet. 2025;19(18):22–28. (In Russ.) https://doi.org/10.21518/ms2025-369.
Conflict of interest: the authors declare no conflict of interest.
Введение
Экссудативный средний отит (ЭСО) – негнойное воспаление среднего уха. Заболевание широко встречается в детском возрасте и носит полиэтиологичный характер. Эпидемиологические исследования ЭСО у детей в возрастной динамике указывают на широкую распространенность заболевания среди детей в возрасте от 3 до 7 лет с частотой встречаемости до 20–30% [1], с тенденцией к росту заболеваемости [2]. В качестве предрасполагающих факторов развития ЭСО, а нередко и ведущего звена его патогенеза, рассматривают инфекционные воспалительные и аллергические заболевания носоглотки [3, 4], аденоидов, тубарную дисфункцию [5–9]. Однако существует достаточно большое количество публикаций, в которых указывают на связь ЭСО с другими патологическими состояниями, в том числе – COVID-19 [10], пассивным курением [11], генетическими заболеваниями [12], искривлением носовой перегородки или текущим риносинуситом [13], опухолями головы и шеи [14], железодефицитной анемией [15] и влиянием окружающей среды [16]. Также отмечается возможность развития ЭСО без признаков тубарной дисфункции, при отсутствии аллергического и гнойного воспаления в носоглотке [17]. Полиэтиологичность заболевания сопровождается разноречивой оценкой клинической эффективности фармакотерапии ЭСО. Наиболее распространено мнение о том, что в краткосрочной перспективе препараты интраназальных кортикостероидов, антигистаминные средства и антибиотики демонстрируют отсутствие клинически значимого влияния на динамику ЭСО [18, 19]. По другим данным, более длительная терапия ЭСО интраназальными кортикостероидами в течение более 1 мес. демонстрирует хорошую клиническую эффективность [20, 21]. Показана высокая эффективность терапии ЭСО дексаметазоном и амброксолом [22]. Опубликованы данные о рациональности использования АСИТ-терапии для лечения ЭСО [23]. Опираясь на данные, полученные в доклиническом эксперименте, предложено дополнять терапию ЭСО приемом пробиотиков [24]. Низкая эффективность терапии ЭСО отражена в консенсусе Конгресса Международной федерации оториноларингологических обществ 2017 г., в связи с чем была поддержана активная хирургическая тактика лечения ЭСО [25]. С целью повышения эффективности терапии ЭСО, согласно рекомендациям по клинической практике в Японии, следует лечить не только состояния, связанные с самим ЭСО, такие как выпот в среднем ухе и патологические изменения барабанной перепонки, но и патологические изменения в окружающих органах, связанные с инфекционными или воспалительными заболеваниями [26].
Неэффективность консервативной терапии ЭСО при наличии кондуктивной тугоухости приводит к необходимости хирургического лечения. Однако хирургическая тактика также может сопровождаться рецидивами ЭСО [17, 27, 28]. Поскольку рецидивирующие и хронические формы ЭСО встречаются достаточно часто, поиск новых методов лечения и оценка клинических факторов, предрасполагающих к развитию заболевания и поддерживающих его прогрессию, сохраняют актуальность.
Основное клиническое проявление ЭСО включает в себя скопление негнойного выпота за неизмененной барабанной перепонкой. Морфологически процесс соответствует вялотекущему катаральному воспалению, который может поддерживаться разными факторами: тубарной дисфункцией, аденоидитом или аллергическим ринитом [29–31]. Повышение секреторной активности слизистой оболочки барабанной полости может быть связано с персистенцией респираторных вирусов или наличием в среднем ухе бактериальных биопленок [32]. Описаны случаи выделения из тимпанального секрета вирусов гриппа, парагриппа, вируса Эпштейн-Барр, риновирусов и аденовирусов [33]. Анамнез детей с ЭСО может указывать на развитие ЭСО после острой респираторной инфекции (ОРИ) или острого среднего отита [34]. Связь ЭСО с предшествующей ОРИ верхних дыхательных путей (ВДП) и доказанные случаи персистенции в тимпанальном секрете патогенных вирусов, в частности – риновирусов, наводят на мысль о несостоятельности местного иммунитета ВДП как причины неполной санации слизистых оболочек от патогенных вирусов. В основе иммунного механизма развития ЭСО у детей может лежать незрелость детского иммунитета слизистых оболочек, поскольку возрастной особенностью иммунной системы детей 3–7 лет является низкий уровень IgA слизистых оболочек и сыворотки крови (ниже, чем у взрослых) при высоком уровне IgE (соответствует уровню взрослых) [35]. В условиях высокой инфекционной обсемененности недостаток IgA облегчает патогенным микроорганизмам проникновение в слизистые оболочки и дальнейшую персистенцию в них, что приводит к накоплению инфекционных антигенов в поверхностной слизи и слизистой оболочке. В этих условиях высокое содержание молекул IgE обеспечивает повышенную дегрануляцию тучных клеток и базофилов, поскольку связанные с мембраной клеток молекулы IgE, соединяясь с антигеном, «включают» последовательные события, ведущие к выбросу медиаторов воспаления. В результате каскада иммунных реакций происходит повышение проницаемости сосудов, секреторной активности слизистой оболочки, изменение реологических свойств слизи и работы мукоцилиарного транспорта [36–38]. Предполагаемый иммунный механизм развития ЭСО у детей после ОРИ лежит в основе интереса к изучению эффективности иммуноактивной терапии данного заболевания.
Цель – оценить клиническую эффективность лечения ЭСО у детей, перенесших ОРВИ, интраназальным введением азоксимера бромида.
Материалы и методы
Проведено рандомизированное открытое простое сравнительное исследование. Объектом исследования являлись дети в возрасте 4–7 лет, у которых развитие ЭСО отмечено после перенесенной ОРИ ВДП. Критерии включения в исследование: наличие ЭСО, подтвержденного тимпанометрией типа В; отсутствие на момент включения признаков острой вирусной или бактериальной инфекции ВДП; свободное глоточное устье слуховых труб; правильное развитие и сформированность лор-органов и челюстно-лицевой области; соматический статус без хронической патологии; отсутствие диспансерного наблюдения узких специалистов; отсутствие установленного аллергического ринита и случаев успешного лечения заболеваний носа и носоглотки препаратами мометазона и флутиказона.
Критериями исключения служили возраст детей до 4 и старше 7 лет; гипертрофия аденоидов 3-й степени; хронический назофарингит (аденоидит) в стадии обострения; отказ родителей от участия детей в исследовании, невозможность наблюдения за ребенком в течение 6 мес.
За период с марта 2023 г. по март 2025 г. проведено амбулаторное обследование и лечение 49 детей (28 мальчиков и 21 девочка) в возрасте от 4 до 7 лет. Длительность заболевания составляла от 1 до 18 мес.
1-я группа – 23 ребенка (13 мальчиков, 10 девочек); средний возраст 5,2 ± 0,63 года. В группе проведено лечение азоксимера бромидом (Полиоксидоний, 6 мг/мл) интраназально по 3 капли в каждый носовой ход 3 раза в день в течение 14 дней. Повторный курс проведен через 3 мес.
2-я группа – 26 детей (15 мальчиков, 11 девочек), средний возраст 5,4 ± 0,37 года. В группе проведено лечение пероральным приемом карбоцистеина в течение 2 нед. в сочетании с интраназальным использованием комплексного спрея, содержащего полимиксин, неомицин, дексаметазон и фенилэфрин по 1 впрыскиванию в каждый носовой ход 3 раза в день в течение 10 дней.
Согласно данным литературы, иммуномодулятор азоксимера бромид (Полиоксидоний) обладает комплексным действием: иммуномодулирующим, детоксицирующим, противовоспалительным, а также оказывает нормализующее действие на факторы мукозальной защиты – секреторный IgA и лизоцим. Характерной особенностью азоксимера бромида при интраназальном применении является способность активировать факторы ранней защиты организма от инфекции. Препарат стимулирует бактерицидные свойства нейтрофилов, макрофагов, усиливает их способность поглощать бактерии, повышает бактерицидные свойства секрета слизистой оболочки ВДП. Азоксимера бромид при местном применении (интраназально, сублингвально) позволяет увеличить экспрессию генов антимикробных пептидов – β-дефензинов. Данные эффекты позволяют обеспечить улучшение клинической картины у пациентов, в том числе за счет купирования симптомов и снижения количества обострений хронических инфекционных процессов [39].
Для оценки выраженности субъективных проявлений ЭСО проводилось анкетирование родителей по анкете, разработанной авторами, состоящей из 10 вопросов. Первые 5 вопросов верифицировали симптомы патологии носа и носоглотки как триггерных факторов развития отита у детей. Второй раздел анкеты направлен на выявление симптомов снижения слуха и нарушения речи у ребенка. Каждый пункт анкеты содержал 5 градаций ответа от 1 до 5, отражающих возрастающую степень выраженности симптома. Предварительно была проведена конвергентная валидация анкеты.
Для оценки объективных проявлений ЭСО выполняли тимпанометрию на анализаторе среднего уха Zodiac 901.4 (GN Otometrics Madsen, Дания). С целью оценки регуляции иммунного ответа слизистых оболочек определяли концентрацию провоспалительных цитокинов IL-8 и IL-18 в назальном смыве со стороны больного уха методом ИФА. Макрофагально-моноцитарные цитокины IL-8, IL-18 способствуют формированию эффективного противоинфекционного иммунного ответа. Структура цитокинового профиля назального секрета здоровых детей характеризуется достаточно высоким удельным весом IL-8 в назальном секрете [3], поэтому клиническое значение может иметь как резкое повышение указанных интерлейкинов, которое связывают с активной бактериальной инфекцией [38], так и низкий уровень, отражающий недостаточную санацию инфекционного процесса. Для получения назального смыва собирали мазок вдоль верхней поверхности нижней носовой раковины на всем ее протяжении стерильным ватным тупфером (ТУ 9398-012-44881728-2014), увлажненным физиологическим раствором. Затем тупфер помещали в пробирку с 2,0 мл физиологического раствора на 30 мин, после чего его отжимали и центрифугировали полученную суспензию в течение 10 мин при 3000 об/мин. Надосадочную жидкость собирали и исследовали. Концентрацию цитокинов нормировали по содержанию общего белка в назальном секрете.
Клинические оценки проводили при включении пациента в исследование, через 1, 3 и 6 мес. Содержание провоспалительных цитокинов назального секрета исследовали при включении в исследование, через 1 и 3 мес. Ежемесячно регистрировали случаи возникновения острой респираторной инфекции с вовлечением ВДП. Критериями клинического выздоровления у всех пациентов считали нормализацию тимпанограммы, восприятие шепотной речи с 6 м в свободном звуковом поле, отсутствие дискомфорта в ухе / ушах и ушных шумов, нормализацию контура опознавательных пунктов барабанных перепонок, отсутствие рецидивов в течение полугода.
Статистическую обработку данных выполняли с использованием программы Microsoft Excel. При вариационном анализе рассчитывали медиану (Me) и межквартильный размах (Q25–Q75). Для сравнения независимых выборок до и после лечения применяли критерий χ². Результаты считали достоверными при уровне значимости р < 0,05.
Результаты
Среди наблюдаемых пациентов преобладали дети с двусторонним ЭСО: в 1-й группе – 18 детей (78,3% от группы), во 2-й группе – 21 ребенок (88,5%). В случаях одностороннего экссудативного процесса асимметрия тимпанограмм правого и левого ушей обозначалась как A/B или B/A.
Выраженность симптомов со стороны носоглотки исходно была на низком уровне, что объяснимо критериями отбора пациентов. В процессе исследования наблюдалась общая тенденция к снижению суммарных баллов анкет по отосимптомам относительно исходного состояния (табл. 1). Согласно данным анкетирования, в 1-й группе за период 1–6 мес. наблюдалось достоверное снижение выраженности отосимптомов относительно исходного уровня. При χ2 крит = 3,841, df = 1, α = 0,05 отличие баллов по отосимптомам между суммой через 1 мес. соответствовало χ2 = 6,765, через 3 мес. – χ2 = 4,418, через 6 мес. – χ2 = 5,068. За счет явного сокращения выраженности отосимптомов наблюдалось достоверное снижение суммарного балла анкет у пациентов 1-й группы. Во 2-й группе наблюдалась тенденция к снижению выраженности отосимптомов, без достижения уровня достоверности.
Таблица 1. Сумма баллов анкетирования, Me (Q25 – Q75)
| Симптомы патологии носоглотки | 7 (6–7,75) | 6 (5–6) | 6 (5–6) | 6 (5–6) | 7 (6–7,75) | 6 (6–7) | 7 (6–8) | 9 (8–9) |
| Отосимптомы | 15 (14–17 ) | 7 (6–8)* | 6 (5–6)* | 5 (5–6)* | 13,5 (11–16) | 8 (7,25–9) | 8 (7–8) | 9,5 (8–11,75) |
| Общий суммарный балл, анкета | 22 (21–23,75) | 13* (12–14,75) | 11* (11–11) | 11* (11–11) | 21,5 (18,25–23) | 14 (13–15) | 15 (14–16) | 19 (16–20) |
Примечание. * p < 0,05 по сравнению с исходным уровнем в группе.
По данным акустической импедансометрии в динамике наблюдения с 1-го по 6-й мес. доля тимпанограмм типа C и B во 2-й группе регистрировалась чаще (табл. 2) и на этапе обследования через 6 мес. достигла достоверного отличия относительно 1-й группы (χ2 = 5,121 при χ2 крит = 3,841, df = 1, α = 0,05). В табл. 2 и представлена доля нормальных тимпанограмм на каждом этапе исследования.
Таблица 2. Доля тимпанограмм типа А у наблюдаемых пациентов, абс (%)
| 1-я, n = 23, тимпанограмм 46 | 5 (21,7) | 19 (86,2) | 21 (91,3) | 20 (86,9)* |
| 2-я, n = 26, тимпанограмм 52 | 5 (19,2) | 16 (61,5) | 18 (69,2) | 15 (57,7) |
Примечание. n – количество пациентов в группе, * р < 0,05 относительно 2-й группы.
Заболеваемость ОРИ среди детей за 6-месячный период наблюдения существенно различалась между группами. В 1-й группе за период наблюдения до 3 мес. ОРИ перенес 1 пациент (4,4% от пациентов 1-й группы), тогда как во 2-й группе – 8 пациентов (30,8% от пациентов 2-й группы), при этом 3 пациента (11,5% от пациентов 2-й группы) перенесли ОРИ в течение первого месяца наблюдения. За период 6 мес. дети из 1-й группы болели ОРИ достоверно реже, чем дети 2-й группы. Всего за полгода наблюдения в 1-й группе перенесли ОРИ 4 ребенка, а во 2-й группе – 17 детей (χ2 = 11,478 при χ2крит = 3,841, df = 1, α = 0,05) (рисунок).
Рисунок. Заболеваемость ОРИ среди детей в период наблюдения (%)
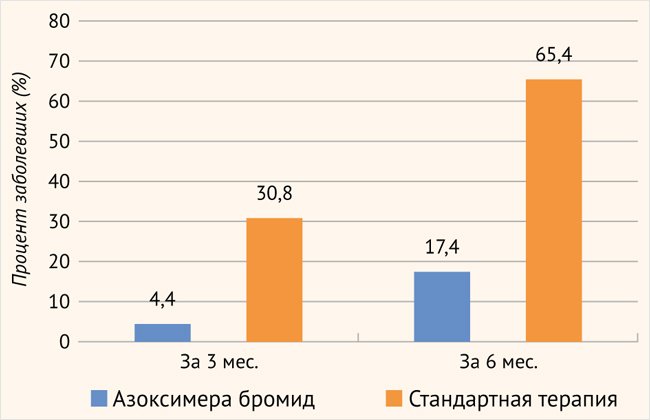
Примечание. χ² = 11,478 (p < 0,05) – достоверное различие между группами за 6 мес.
Снижение заболеваемости ОРИ в 1-й группе сопровождалось повышением в назальном секрете IL-8, IL-18 до достижения уровня показателя у здоровых детей (табл. 3).
Таблица 3. Содержание провоспалительных цитокинов в назальном смыве, пг/л, Ме (Q25 – Q75)
| 1-я | 188 (107–289) | 269 (238–437) | 39 (219–522) | 55 (29–78) | 45 (37–64) | 98 (39–131) |
| 2-я | 269 (194–362) | 192 (147–251) | 246 (188–380) | 74 (53–100) | 48 (38–79) | 72 (48–115) |
| Здоровые дети | 423 (400–498) | 96 (85–223) |
Обсуждение
Несостоятельность макрофагально-моноцитарного звена иммунитета не всегда может быть компенсирована различными противовоспалительными механизмами, что обусловливает неполноценную защиту и санацию слизистых оболочек ВДП от антигенов окружающей среды. Это, в свою очередь, способствует их персистенции в слизистой оболочке, в том числе – среднего уха. Защитная реакция организма на постоянное присутствие возбудителя в условиях неполноценности иммунных реакций реализуется в виде развития хронического воспаления, что и определяет специфическую клиническую картину.
Ввиду малой эффективности консервативной терапии, детям с ЭСО часто проводят хирургическое лечение в виде удаления аденоидных вегетаций как предрасполагающего фактора дисфункции слуховых труб и очага хронического воспаления. Следует отметить, что при таком лечебном подходе происходит лишь устранение клинической картины гипертрофии глоточной миндалины и хронического аденоидита. Устранения респираторной инфекции у части детей не происходит, что связано с сохранением местных иммунных нарушений, лежащих в основе патогенеза заболевания, а также склонности воспалительного процесса к рецидивам или персистирующему течению ЭСО. При изучении ЭСО у детей без аллергического ринита и гипертрофии глоточной миндалины III степени мы отметили преобладание двустороннего вовлечения ушей в патологический процесс и отсутствие выраженной клиники аденоидита. Выявленные особенности могут являться клиническим проявлением локального нарушения иммунных санационных механизмов. Иммунотерапия, направленная на усиление бактерицидных свойств слизистых оболочек носоглотки и уха (в том числе за счет лизоцима и секреторного IgA), способна за 3–6 мес. устранить вялотекущий ЭСО. Сочетание иммуномодулирующих средств с краткосрочной традиционной терапией острых инфекционных процессов полости носа и носоглотки может стать наиболее перспективным подходом в лечении ЭСО у детей дошкольного возраста.
Выводы
Двусторонний вялотекущий экссудативный средний отит, развившийся после перенесенной острой респираторной инфекции у ребенка-дошкольника без жалоб на назальную обструкцию, может быть результатом неполноценной санации слизистых оболочек уха и носоглотки ввиду местных иммунных нарушений. Возрастные особенности местного иммунитета, характерные для детей 4–7 лет, могут предрасполагать к развитию иммунных отклонений в виде длительно текущего катарального воспаления. Интраназальная иммунокоррекция азоксимера бромидом эффективно купирует катаральный воспалительный процесс барабанной полости и слуховой трубы при развитии ЭСО после ОРВИ.
Список литературы / References
Развернуть
- Крюков АИ, Ивойлов АЮ, Пакина ВР, Яновский ВВ. Патогенетический подход к лечению экссудативного среднего отита в детском возрасте. РМЖ. 2013;(11):545. Режим доступа: https://www.rmj.ru/. / Kryukov AI, Ivoilov AI, Pakina BP, Yanovsky BB. A pathogenetic approach to the treatment of exudative otitis media in childhood. RMJ. 2013;(11):545. (In Russ.) Available at: https://www.rmj.ru/.
- Полунин ММ, Чернова ОВ. Лечение экссудативного среднего отита у детей раннего возраста с учетом анатомических особенностей слуховой трубы. Вестник оториноларингологии. 2020;85(1):10–13. doi: 10.17116/otorino20208501110. / Polunin MM, Chernova OV. Treatment of exudative (secretory) otitis media in young children taking into account the anatomical features of the auditory tube. Vestnik Oto-Rino-Laringologii. 2020;85(1):10–13. (In Russ.) doi: 10.17116/otorino20208501110.
- Yang B, Brook CD. The Role of Allergy in Otologic Disease. Otolaryngol Clin North Am. 2017;50(6):1091–1101. doi: 10.1016/j.otc.2017.08.005.
- Орлова ЮЕ, Свистушкин ВМ, Никифорова ГН, Шевчик ЕА. Принципы лечения детей с патологией глоточной миндалины на фоне аллергического ринита (обзор литературы). Consilium Medicum. 2022;24(3):193–198. doi: 10.26442/20751753.2022.3.201516. / Orlova YE, Svistushkin VM, Nikiforova GN, Shevchik EA. Treatment principles of children with pharyngeal tonsil pathology in the background of allergic rhinitis (literature review): a review. Consilium Medicum. 2022;24(3):193–198. (In Russ.) doi: 10.26442/20751753.2022.3.201516.
- Савенко ИВ, Бобошко МЮ. Экссудативный средний отит. СПб.: Диалог; 2020. 168 с. Режим доступа: https://litres.uz/.
- Skovbjerg S, Roos K, Andersson M, Rabe H, Nilsson S, Lindh M, Wold AE. Inflammatory Mediator Profiles in Secretory Otitis Media in Relationship to Viable Bacterial Pathogens and Bacterial and Viral Nucleic Acids. J Interferon Cytokine Res. 2020;40(12):555–569. doi: 10.1089/jir.2020.0075.
- De Corso E, Cantone E, Galli J, Seccia V, Lucidi D, Di Cesare T et al. Otitis media in children: Which phenotypes are most linked to allergy? A systematic review. Pediatr Allergy Immunol. 2021;32(3):524–534. doi: 10.1111/pai.13431.
- Золотова ТВ, Князева ОА, Давыдова АП, Манченкова ИИ. Рецидивирование экссудативного среднего отита как следствие неустранённой патологии полости носа и носоглотки. Folia Otorhinolaryngologiae et Pathologiae Respiratoriae. 2023;29(2):77–84. Режим доступа: https://www.elibrary.ru/. / Zolotova TV, Knyazeva OA, Davydova AP, Manchenkova II. Reccurence of exudative otitis media as a consequence of untreated pathology of the nasal cavity and nasopharynx. Folia Otorhinolaryngologiae et Pathologiae Respiratoriae. 2023;29(2):77–84. (In Russ.) Available at: https://www.elibrary.ru/.
- Liu W, Shi L, Feng Y. Advance in the pathogenesis of otitis media with effusion induced by platelet-activating factor. Sci Prog. 2024;107(4):368504241265171. doi: 10.1177/00368504241265171.
- Zhang Y, Liu J, Yang F, He Y, Yan S, Bai Y et al. COVID-19-related secretory otitis media in the omicron era: a case series. Eur Arch Otorhinolaryngol. 2023;280(10):4697–4700. doi: 10.1007/s00405-023-08075-w.
- Li DP, He M, Chai W, Huang H. The relationship between incidence of secretory otitis media and passive smoking in children. Lin Chuang Er Bi Yan Hou Tou Jing Wai Ke Za Zhi. 2017;31(15):1211–1213. doi: 10.13201/j.issn.1001-1781.2017.15.018.
- Chen J, Li W, Wen LT, Yang C, Sun CH, Qiu JH, Zha DJ. Crouzon syndrome with secretory otitis media: a case report and literature review. Lin Chuang Er Bi Yan Hou Tou Jing Wai Ke Za Zhi. 2019;33(9):845–847. doi: 10.13201/j.issn.1001-1781.2019.09.011.
- Guo C, Pan L, Chen L, Xie J, Liang Z, Huang Y, He L. Investigating the epidemiological relevance of secretory otitis media and neighboring organ diseases through an Internet search. Peer J. 2024;12:e16981. doi: 10.7717/peerj.16981.
- Covelli E, Margani V, Trasimeni G, Filippi C, Bandiera G, Monini S, Barbara M. A case of cavernous hemangioma of the infratemporal fossa causing recurrent secretory otitis media. Braz J Otorhinolaryngol. 2022;88(6):999–1002. doi: 10.1016/j.bjorl.2021.03.001.
- Akcan FA, Dündar Y, Bayram Akcan H, Cebeci D, Sungur MA, Ünlü İ. The Association between Iron Deficiency and Otitis Media with Effusion. J Int Adv Otol. 2019;15(1):18–21. doi: 10.5152/iao.2018.5394.
- Padia R, Alt JA, Curtin K, Muntz HR, Orlandi RR, Berger J, Meier JD. Environmental contributions to otitis media requiring tympanostomy tubes. Int J Pediatr Otorhinolaryngol. 2017;101:97–101. doi: 10.1016/j.ijporl.2017.07.035.
- Свистушкин ВМ, Никифорова ГН, Шевчик ЕА, Золотова АВ. Экссудативный средний отит – современные возможности консервативного лечения. Российская оториноларингология. 2014;(2):153–161. Режим доступа: https://cyberleninka.ru/. / Svistushkin VM, Nikiforova GN, Shewchik EA, Zolotova AV. Otitis media with effusion – modern capabilities of conservative treatment. Rossiiskaya Otorinolaringologiya. 2014;(2):153–161. Available at: https://cyberleninka.ru/.
- Principi N, Marchisio P, Esposito S. Otitis media with effusion: benefits and harms of strategies in use for treatment and prevention. Expert Rev Anti Infect Ther. 2016;14(4):415–423. doi: 10.1586/14787210.2016.1150781.
- Rasheed AM. Is Topical Nasal Steroid Useful for Treatment of Otitis Media with Effusion in Children? Int Tinnitus J. 2023;27(1):62–67. doi: 10.5935/0946-5448.20230011.
- Гавриленко ЮВ. Эффективность применения топического кортикостероидного препарата «Фликс» при лечении секреторного среднего отита у детей. Современная педиатрия. 2018;(2):91–96. doi: 10.15574/SP.2018.90.91. / Gavrylenko YuV. Topical GCS drug “FLIX” efficacy in the treatment of secretory otitis media in children. Sovremennaya Pediatriya. 2018;(2):91–96. (In Russ.) doi: 10.15574/SP.2018.90.91.
- Ikeda R, Hidaka H, Ito M, Kamide Y, Kuroki H, Nakano A et al. Pharmacotherapy focusing on for the management of otitis media with effusion in children: Systematic review and meta-analysis. Auris Nasus Larynx. 2022;49(5):748–754. doi: 10.1016/j.anl.2022.03.017.
- Xiaorong D, Li M, Xuefeng L, Jian H. Effects of dexamethasone combined with ambroxol hydrochloride on T-Cell subsets and hearing in patients with secretory otitis media. Pak J Pharm Sci. 2019;32:1437–1440. Available at: https://pubmed.ncbi.nlm.nih.gov/.
- La Mantia I, Varricchio A, Ciprandi G. Allergen immunotherapy in children with otitis media with effusion: a preliminary experience. Eur Ann Allergy Clin Immunol. 2021;53(6):288–290. doi: 10.23822/EurAnnACI.1764-1489.181.
- Kaytez SK, Ocal R, Yumusak N, Celik H, Arslan N, Ibas M. Effect of probiotics in experimental otitis media with effusion. Int J Pediatr Otorhinolaryngol. 2020;132:109922. doi: 10.1016/j.ijporl.2020.109922.
- Simon F, Haggard M, Rosenfeld RM, Jia H, Peer S, Calmels MN, Couloigner V, Teissier N. International consensus (ICON) on management of otitis media with effusion in children. Eur Ann Otorhinolaryngol Head Neck Dis. 2018;135(1S):33–39. doi: 10.1016/j.anorl.2017.11.009.
- Hidaka H, Ito M, Ikeda R, Kamide Y, Kuroki H, Nakano A et al. Clinical practice guidelines for the diagnosis and management of otitis media with effusion (OME) in children in Japan – 2022 update. Auris Nasus Larynx. 2023;50(5):655–699. doi: 10.1016/j.anl.2022.12.004.
- Милешина НА, Володькина ВВ, Курбатова ЕВ, Осипенков СС, Полунин ММ, Чернова ОВ. Основы оказания медицинской помощи при экссудативном среднем отите. Вестник оториноларингологии. 2021;86(6):31–34. doi: 10.17116/otorino20218606131. / Mileshina NA, Volodkina VV, Kurbatova EV, Osipenkov SS, Polunin MM, Chernova OV. The main steps in treatment of the children with otitis media with effusion. Vestnik Oto-Rino-Laringologii. 2021;86(6):31–34. (In Russ.) doi: 10.17116/otorino20218606131.
- El Feghaly RE, Jackson MA. Predicting Recurrent Acute Otitis Media and the Need for Tympanostomy: A Powerful Tool. Pediatrics. 2023;151(2):e2022060110. doi: 10.1542/peds.2022-060110.
- Zernotti ME, Pawankar R, Ansotegui I, Badellino H, Croce JS, Hossny E et al. Otitis media with effusion and atopy: is there a causal relationship? World Allergy Organ J. 2017;10(1):37. doi: 10.1186/s40413-017-0168-x.
- Sogebi OA, Oyewole EA, Ogunbanwo O. Asymptomatic Otitis Media With Effusion in Children With Adenoid Enlargement. J Natl Med Assoc. 2021;113(2):158–164. doi: 10.1016/j.jnma.2020.08.005.
- Galić MZ, Klančnik M. Adenoid size in children with otitis media with effusion. Acta Clin Croat. 2022;60(3):532–539. doi: 10.20471/acc.2021.60.03.25.
- Elzayat S, El-Deeb ME, El-Shirbeny HA, El-Shirbiny H, Abdel-Maboud M, Nasr K. The Prevalence and Association of Biofilms With Otitis Media With Effusion: A Systematic Review and Meta-Analysis. Ann Otol Rhinol Laryngol. 2024;133(2):229–238. doi: 10.1177/00034894231188855.
- Kulikova E, Golovko N, Chumakova A, Panchenko T. Treatment of secretory otitis media in children, depending on the stage of the process and on the background of the pathological conditions. Georgian Med News. 2019;(296):49–54. Available at: https://pubmed.ncbi.nlm.nih.gov/.
- Paing A, Elliff-O’Shea L, Day J, Joshi D, Arnold S, Holland Brown T, Kennedy V. Modifiable risk factors for developing otitis media with effusion in children under 12 years in high-income countries: a systematic review. Arch Dis Child. 2024;110(1):45–51. doi: 10.1136/archdischild-2024-327454.
- Щеплягина ЛА, Круглова ИВ. Возрастные особенности иммунитета у детей. РМЖ. 2009;(23):1564. Режим доступа: https://www.rmj.ru/. / Shcheplyagina LA, Kruglova IV. Vozrastnye osobennosti immuniteta u detej. RMJ. 2009;(23):1564. (In Russ.) Available at: https://www.rmj.ru/.
- Вавилова ВП, Перевощикова НК, Ризо АА, Павленко СА, Филиппова ТВ и др. Применение отечественного иммуномодулятора Полиоксидония в практике лечения детей с патологией лимфоглоточного кольца. Аллергология и иммунология в педиатрии. 2005;4:47–53. / Vavilova VP, Perevoshchikova NK, Rizo AA, Pavlenko SA, Filippova TV et al. Domestic immunomodulator Polyoxidonium in paediatric practice of treating pharyngeal lymphoid tissue ring pathology. Allergology and Immunology in Pediatrics. 2005;4:47–53. (In Russ.)
- Просекова ЕВ, Нетесова СЮ, Забелина НР, Сабыныч ВА, Сотниченко СА. Структура цитокинового профиля назального секрета при аллергическом рините у детей. Тихоокеанский медицинский журнал. 2014;(1):38–41. Режим доступа: https://www.tmj-vgmu.ru/. / Prosekova EV, Netesova SYu, Zabelina NR, Sabynych VA, Sotnichenko SA. The cytokine profile structure of nasal secretion in children’s allergic rhinitis. Pacific Medical Journal. 2014;1:38–41. (In Russ.) Available at: https://www.tmj-vgmu.ru/.
- Татаурщикова НС, Сидорович ИГ. Цитокиновый статус как критерий эффективности интраназальной аэрозольтерапии раствором циклоферона в лечении аллергического риносинусита. Вестник оториноларингологии. 2012;77(3):79–82. Режим доступа: https://www.mediasphera.ru/. / Tataurshchikova NS, Sidorovich IG. The cytokine status as a criterion for the efficacy of intranasal aerosol therapy with the use of a cycloferon solution in the patients presenting with allergic rhinosinusitis. Vestnik Oto-Rino-Laringologii. 2012;77(3):79–82. (In Russ.) Available at: https://www.mediasphera.ru/.
- Вавилова ВП, Тарасова НИ, Чернюк ОС, Караульнова ТА. Новые пути влияния на местные факторы защиты у детей с патологией лимфоглоточного кольца. Лечащий врач. 2011;(6):99–102. Режим доступа: https://www.lvrach.ru/. / Vavilova VP, Chernyuk OS, Karaul’nova TA, Tarasova NI. New ways to influence local protective factors in children with pharyngeal lymphoid tissue ring pathology. Lechaschi Vrach. 2011;(6):99–102. (In Russ.) Available at: https://www.lvrach.ru/.
Фото:
H_Ko/FOTODOM/Shutterstoсk



 1
1 2
2 3
3 4
4


Комментарии (0)