Журнал "Медицинский совет" № 5/2024
DOI: 10.21518/ms2024-140
И.Г. Красивина1, https://orcid.org/0009-0005-7143-2307
Л.Н. Долгова1,2, https://orcid.org/0000-0003-0244-9699
Н.В. Долгов1,2, https://orcid.org/0000-0003-2181-9325
1 Ярославский государственный медицинский университет; 150000, Россия, Ярославль, ул. Революционная, д. 5
2 Клиническая больница «РЖД-Медицина» города Ярославль; 150031, Россия, Ярославль, Суздальское шоссе, д. 21
Введение. Эффективность лечения подагры обеспечивается достижением сывороточного целевого уровня мочевой кислоты, который в настоящее время в большинстве национальных клинических рекомендаций и консенсусов указан менее 360 мкмоль/л. Достижение поставленных целей терапии обеспечивается модификацией образа жизни пациентов и адекватным назначением уратснижающей терапии и часто сопряжено с рядом трудностей.
Цель. Проанализировать частоту назначения и успешность уратснижающей терапии у пациентов с подагрой за период пятилетнего наблюдения в условиях реальной клинической практики.
Материал и методы. Проведена ретроспективная оценка ведения 104 пациентов (72 мужчины и 32 женщины) с впервые установленным в 2018 г. диагнозом «подагра», наблюдавшихся по 2023 г. включительно. Анализировали адекватность назначения уратснижающей терапии, частоту обострений артрита, наличие сопутствующих заболеваний в подгруппах достигавших или не достигавших целевого уровня мочевой кислоты менее 360 мкмоль/л.
Результаты. Достигали целевого уровня мочевой кислоты 26 чел. при сравнимом соотношении мужчин и женщин в подгруппах достигавших или не достигавших. Факт достижения целевого уровня мочевой кислоты регистрировался в течение первого года наблюдения и сохранялся в последующем. Назначение уратснижающей терапии зарегистрировано у 42% пациентов группы, но лишь у 41% из них оно было адекватным. Даже при адекватном назначении аллопуринола у 1/3 пациентов не был достигнут целевой уровень мочевой кислоты. Назначение альтернативного урикостатика фебуксостата отмечено лишь у 9% пациентов.
Заключение. Достижение целевого уровня мочевой кислоты при подагре в условиях реальной клинической практики отмечено у 25% пациентов, а назначение уратснижающей терапии – у 42%. Назначение целевого уровня мочевой кислоты было адекватным менее чем у 1/2 пациентов. Альтернативный аллопуринолу урикостатик фебуксостат назначался меньше чем 1/10 пациентов. Возможность достижения цели уратснижающей терапии определялась в течение первого года от постановки диагноза подагры. При недостижении целевого уровня мочевой кислоты в данный промежуток времени необходимо анализировать причины неудачи и назначать или интенсифицировать уратснижающую терапию.
Для цитирования: Красивина ИГ, Долгова ЛН, Долгов НВ. Уратснижающая терапия при подагре: трудности в достижении цели и пути их преодоления. Медицинский совет. 2024;18(5):– https://doi.org/10.21518/ms2024-140.
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Urate-lowering therapy for gout: Difficulties in goal achieving the and ways to overcome
Irina G. Krasivina1, https://orcid.org/0009-0005-7143-2307, Lidiya N. Dolgova1,2, https://orcid.org/0000-0003-0244-9699, Nikolay V. Dolgov1,2, https://orcid.org/0000-0003-2181-9325
1 Yaroslavl State Medical University; 5, Revolutsionnaya St., Yaroslavl, 150000, Russia
2 Clinical Hospital “RZD-Medicine” in the city of Yaroslavl; 21, Suzdalskoe Shosse, Yaroslavl, 150031, Russia
Introduction. The effectiveness of gout treatment is assured by achieving a serum uric acid target level, which is currently accepted by most national clinical guidelines and consensus as < 360 µmol/L. Achievement of therapy goals is ensured by modification of patients' lifestyle and adequate prescription of urate-reducing therapy and often involves a number of difficulties
Aim. To analyze the frequency of prescription and success of urate-reducing therapy in patients with gout over a five-year observation period in real clinical practice.
Material and methods. Retrospective evaluation of the management of 104 patients (72 men and 32 women) with gout diagnosed for the first time in 2018, followed up to and including 2023. We analyzed the adequacy of urate-reducing therapy prescription, frequency of arthritis exacerbations, and presence of comorbidities in subgroups achieving or not achieving uric acid target level < 360 μmol/L.
Results. 26 people achieved uric acid target level, with a comparable ratio of men and female in subgroups of achieving or not achieving. The fact of achieving uric acid target level was recorded during the first year of observation and was maintained subsequently. Prescription of urate-reducing therapy was registered in 42% of the group, but in only 41% of them it was adequate. Even with adequate prescription of allopurinol, 1/3 of the patients did not achieve uric acid target level. The prescription of an alternative uricostatic agent, febuxostat, was noted in only 9% of patients.
Conclusions. Achieving total control in gout in real clinical practice noted in 25%, and urate-reducing therapy was prescribed in 42% of patients. Adequate purpose of uric acid target level was less than 1/2 of the patients. Alternative uricostatic to allopurinol febuxostat was prescribed in less than 1/10 of patients. Opportunity achievement of the urate-reducing therapy goal was determined within the first year from diagnosis gout. If the uric acid target level is not reached within a given period of time, it is necessary analyze the reasons for failure and prescribe or intensify urate-reducing therapy.
For citation: Krasivina IG, Dolgova LN, Dolgov NV. Urate-lowering therapy for gout: Difficulties in goal achieving the and ways to overcome. Meditsinskiy Sovet. 2024;18(5):– (In Russ.) https://doi.org/10.21518/ms2024-140.
Conflict of interest: the authors declare no conflict of interest.
Введение
Подагра
– известное со времен Древней Греции и Гиппократа заболевание, сохранившее свое
историческое название (от греческого ποδάγρα – «ловушка для ног», с последующим
переходом в латинский термин роdаgrа), продолжает оставаться коварным процессом
с длительным латентным периодом бессимптомной гиперурикемии и последующим
развитием атак острого, зачастую острейшего артрита, серьезно нарушающего
качество жизни пациента [1].
Распространенность
подагры в зависимости от исследуемой популяции и метода варьирует от 0,67–0,9% в
Италии, 1,6% – в Австралии, 2,49% – в Великобритании до 6,24% – на Тайване и 10%
взрослых мужчин-маори в Новой Зеландии. В среднем по миру данный показатель
оценивается в 1–4%. Отмечается наиболее высокая распространенность заболевания
у ряда этнических меньшинств, а также имеются половые различия: от 3 до 10 раз
чаще подагра встречается у мужчин, чем у женщин. Заболеваемость подагрой
увеличивается с возрастом: от 0,1–0,3% в среднем популяционном уровне до 0,4% –
у людей старше 80 лет, а ее распространенность в данной возрастной когорте
поднимается до 11–13% [2–4]. Эпидемиологическое исследование,
проведенное в 12 субъектах Российской Федерации, оценило общую заболеваемость
подагрой в России как 300 случаев на 100 000 населения или 330 000
взрослого населения [5].
Современное
определение, этиология, патогенез, диагностика подагры хорошо известны
практическим врачам, а вот лечение данного заболевания до сих пор сопряжено с
большим количеством трудностей [6–9]. В соответствии с клиническими
рекомендациями Минздрава России от 2018 г. [10], цели консервативной терапии
подагры подразделяются на тактические, заключающиеся в купировании острого или
обострения хронического подагрического артрита, и стратегические, направленные
на профилактику развития острых подагрических атак с предотвращением образования
новых и растворением имеющихся депозитов моноурата натрия. Купирование острой
подагрической атаки хорошо разработано и включает применение активной
противовоспалительной терапии – колхицина, нестероидных противовоспалительных
препаратов (НПВП), глюкокортикоидов (ГКС), канакинумаба [10–12].
Стратегическая
цель достигается путем назначения уратснижающей терапии (УСТ). Именно это
направление обеспечивает эффективность лечения больного подагрой, но оно же и вызывает
у практических врачей трудности, связанные с выбором, дозировкой и временем назначения
уратснижающих препаратов. Однозначно всем больным подагрой рекомендуется поддерживать
целевой уровень мочевой кислоты (ЦУМК) менее 360 мкмоль/л, а при тяжелой
тофусной форме – менее 300 мкмоль/л, но при этом не рекомендуется снижение
сывороточной урикемии менее 180 мкмоль/л. Для достижения указанных уровней
обсуждаются немедикаментозные методы: гипопуриновая диета, снижение массы тела,
коррекция терапии сопутствующих заболеваний, а показанием к назначению
медикаментозной УСТ являются стойкая гиперурикемия, более одного эпизода
острого артрита за год или хронический артрит, рентгенологические признаки
повреждения суставов, связанные с подагрой, тофусы. Назначение УСТ сразу после
купирования первого артрита рекомендовано у людей моложе 40 лет, а также при
наличии патологии почек и коморбидных по метаболическому синдрому заболеваний.
Препаратом первой линии в клинических рекомендациях Минздрава России является
урикостатический препарат аллопуринол, назначение которого рекомендовано начинать
с низких доз (50–100 мг) под контролем сывороточной урикемии через 14 дней
после первого назначения и с плавной титрацией дозы до необходимой для
достижения ЦУМК. В качестве препарата второй линии в случае недостижения ЦУМК
или развития нежелательных явлений при терапии аллопуринолом, а также при
нарушении функции почек рекомендовано назначение альтернативного
урикостатического препарата – селективного ингибитора ксантиноксидазы фебуксостата
без обсуждения дозировок. Сопоставление с зарубежными клиническими
рекомендациями [11, 13–15] показывает, что в отношении ЦУМК
отмечается абсолютное мировое единство, несмотря на разницу в подходах ко
времени инициации и продолжительности УСТ. Возникает вопрос: насколько успешно
выполняются клинические рекомендации по УСТ в условиях современной российской
действительности?
Цель –
анализ частоты назначения и успешности УСТ у пациентов с подагрой за период
пятилетнего наблюдения в условиях реальной амбулаторной практики.
Материалы
и методы
Проведена
ретроспективная оценка пятилетнего ведения 104 пациентов (72 мужчины и 32
женщины) с впервые установленным в 2018 г. диагнозом «подагра» (М10 по
Международной классификации болезней 10-го пересмотра), наблюдавшихся в Клинической
больнице «РЖД-Медицина» города Ярославль до 2023 г. включительно. Диагноз основывался на классификационных критериях
диагностики подагры (ACR/EULAR 2015) [16]. Средний возраст группы в начале
наблюдения – 58,6 ± 13,0 года (29–79 лет), средний индекс массы тела (ИМТ) –
33,0 ± 5,4 кг/м2 (22,6–49,1 кг/м2). У
большинства пациентов имелась сопутствующая патология: у 84% – артериальная
гипертензия, 37% – атеросклероз различных локализаций, 36,5% – заболевания
почек, 35% – сахарный диабет 2-го типа (СД2), 29% – ишемическая болезнь сердца,
27,5% – гастроэнтерологические заболевания, в том числе у 17% – неалкогольная
жировая болезнь печени (НАЖБП), 12% – остеоартриты, 10% – онкологические
заболевания, 6% – первичные воспалительные артропатии, 6% – бронхообструктивные
заболевания. Анализировали достижение целевого уровня МК менее 360 мкмоль/л,
частоту обострений артрита, адекватность назначения УСТ, под которой понимали
назначение урикостатиков в соответствии с отечественными клиническими
рекомендациями только после купирования острого артрита с минимальных стартовых
доз и последующей плавной титрацией дозировки до необходимой для достижения
ЦУМК. Исследование было одобрено этическим комитетом Ярославского
государственного медицинского университета (протокол №59 от 27 декабря 2022 г.).
Статистическая
обработка результатов исследования проводилась при помощи статистической
программы Statistica 13.3 (StatSoft). Вычислялись средние значения, стандартные
отклонения и их различия по t-критерию Стьюдента при нормальном распределении
количественных признаков. Использовали критерий χ2 при анализе сопряженности
параметров в четырехпольных таблицах Фишера, коэффициент корреляции Спирмена.
За уровень статистической значимости принималось значение p < 0,05.
Результаты
В среднем ежегодно с 2018 по 2023 г. регистрировалось
по 1800 обращений за медицинской помощью к ревматологам Клинической больницы «РЖД-Медицина»
города Ярославль пациентов с установленным диагнозом «подагра». Количество пациентов
с вновь установленным диагнозом в этот
временной промежуток регистрировалось от 60 до 360 в год, что составляло в среднем
5,4 на 1000 прикрепленного населения. Ежегодные визиты в поликлинику за
выбранный период с прохождением лабораторного контроля зарегистрированы у 104
человек, которым диагноз подагры был установлен в 2018 г.
Уровень сывороточных уратов соответствовал целевому
в 2023 г. у 26 (25%) пациентов, из них – 18 мужчин и 8 женщин. Среди 78 пациентов, не достигших ЦУМК,
было 54 мужчины и 24 женщины. Статистически значимой разницы по соотношению
полов не обнаружено (2,3 : 1). Проведено сравнение в смешанных подгруппах основных клинических и лабораторных
характеристик в зависимости от достижения (подгруппа Д) или недостижения (подгруппа
Н) ЦУМК. Достижение ЦУМК в 2023 г. отмечалось у 25% группы. Результаты представлены
в табл. 1.
Таблица 1. Основные
исходные характеристики группы в зависимости от достижения целевого уровня
мочевой кислоты в 2023 г.
Показатель | Не достигшие ЦУМК (Н) | Достигшие ЦУМК (Д) |
Количество (мужчины/женщины) | 78 (54/24) | 26 (18/8) |
Возраст исходно в 2018 г., лет | 56,6 ± 13,9 | 64,5 ± 6,6* |
ИМТ в 2018 г., кг/м2 | 33,4 ± 5,5 | 31,8 ± 4,5 |
Назначение УСТ, n/% | 32/41,0 | 12/46,2 |
Адекватное назначение УСТ, n/% пациентов в случае назначения | 6/18,8 | 12/100* |
МК исходно в 2018 г., мкмоль/л | 498,9 ± 71,7 | 504,6 ± 112,1 |
МК в 2023 г., мкмоль/л | 500,6 ± 95,6 | 303,4 ± 51,9* |
Креатинин, мкмоль/л | 108,5 ± 27,7 | 117,2 ± 80,0 |
Аланинаминотрансфераза, Е/л | 34,6 ± 28,9 | 27,5 ± 16,6 |
Аспартатаминотрасфераза, Е/л | 33,3 ± 27,8 | 24,9 ± 18,9 |
Глюкоза, ммоль/л | 6,6 ± 1,8 | 6,5 ± 1,5 |
С-реактивный белок, мг/л | 19,7 ± 35,4 | 4,9 ± 3,1 |
Холестерин, ммоль/л | 5,6 ± 1,6 | 4,6 ± 1,3* |
ЛПВП, ммоль/л | 1,1 ± 0,2 | 1,1 ± 0,3 |
ЛПНП, ммоль/л | 3,3 ± 1,3 | 2,9 ± 1,2 |
Триглицериды, ммоль/л | 2,4 ± 1,4 | 2,1 ± 1,1 |
Сумма сопутствующих нозологий | 3,1 ± 1,5 | 2,9 ± 1,5 |
Примечание. ЦУМК – целевой уровень мочевой кислоты; ИМТ – индекс
массы тела; УСТ – уратснижающая терапия; МК – мочевая кислота; ЛПВП – липопротеиды высокой плотности; ЛПНП –
липопротеиды низкой плотности.
* Различия статистически значимы, р < 0,05.
Пациенты,
достигшие в 2023 г. сывороточного уровня уратов менее 360 мкмоль/л, были на 14%
старше не достигших цели УСТ. Исходно, в 2018 г., ИМТ, уровень МК, большинство
стандартных лабораторных параметров между подгруппами значимо не различались. Коморбидная
отягощенность в обеих подгруппах также была сопоставима: в среднем пациенты
имели по 3 сопутствующих заболевания, ведущим из которых была артериальная гипертензия
(более 80%). Информация по распространенности сопутствующих заболеваний
представлена на рис. 1. Различия выявлены по частоте сопутствующего остеоартрита
любых локализаций, который в 3,2 раза чаще встречался в подгруппе Д, и НАЖБП,
которая, наоборот, в 3,2 раза чаще встречалась в подгруппе Н.
Рисунок
1. Распространенность сопутствующих
заболеваний в подгруппах достигших и не достигших целевого уровня мочевой
кислоты в 2023 г., %
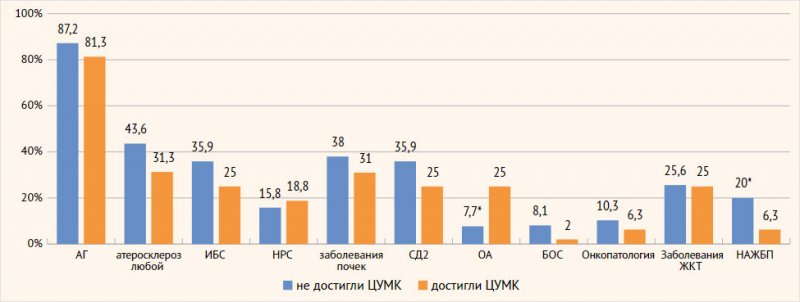
ЦУМК – целевой уровень мочевой кислоты; АГ – артериальная гипертензия; НРС – нарушение сердечного ритма; ОА – остеоартроз; ПсА – псориатическая артропатия; РА – ревматоидный артрит; СпА – спондилоартроз; ЖКТ – желудочно-кишечный тракт; ИБС – ишемическая болезнь сердца; СД2 – сахарный диабет 2-го типа; БОС – бронхообструктивный синдром; НАЖБП – неалкогольная жировая болезнь печени.
* Различия статистически значимы, р < 0,05
В подгруппе Н имелась тенденция к увеличению распространенности атеросклероза
любых локализаций, ишемическая болезнь сердца, СД2, заболеваний почек, а в подгруппе
Д – ревматоидного артрита и спондилоартритов, псориаза и псориатической
артропатии, но без статистической значимости различий.
Проанализирована
динамика уровня сывороточных уратов в подгруппах Д и Н по годам наблюдения,
результаты представлены на рис. 2. Обращает
на себя внимание факт достижения ЦУМК в течение первого года и сохранения
достигнутых результатов у большинства пациентов из подгруппы Д, а в подгруппе Н
– отсутствие динамики уровня МК.
Рисунок 2. Средние значения
уровня мочевой кислоты в подгруппах достигших и не достигших целевого уровня мочевой
кислоты по годам наблюдения, мкмоль/л
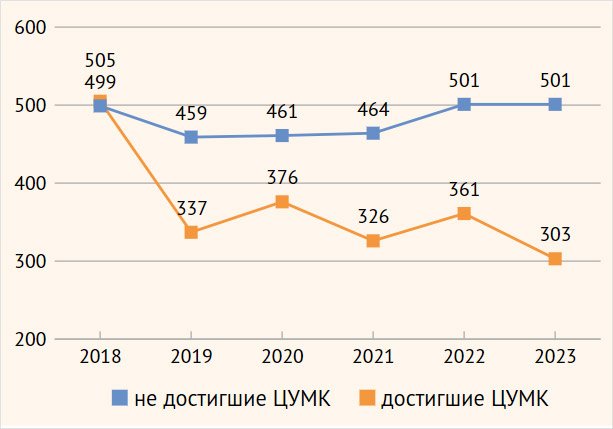
ЦУМК – целевой уровень мочевой кислоты
Следующий
этап анализа был посвящен оценке частоты назначения УСТ, ее адекватности в
случае назначения и взаимосвязи УСТ с достижением ЦУМК и развитием обострений
артрита. Результаты представлены в табл. 2.
Назначение УСТ имело место у 44 (42,3%) пациентов (в 2018–2019 гг. все получали
аллопуринол, который с 2020 по 2023 г. у 4 пациентов был заменен на фебуксостат).
Взаимосвязи назначения УСТ и достижения ЦУМК не отмечено: цели достигали 27,3%
пациентов, которым назначались урикостатики и 23,3% пациентов, у которых
удавалось достичь этого интервенцией в образ жизни.
Таблица 2. Достижение целевого
уровня мочевой кислоты и обострения артрита при адекватной и неадекватной уратснижающей
терапии
Показатель | Адекватная УСТ | Неадекватная УСТ |
Количество, n | 18 | 26 |
Достигли ЦУМК, n (%) | 12 (66,7) | 0 (0) |
Не достигли ЦУМК, n (%) | 6 (33,3) | 26 (100) |
Обострения артрита, n (%): – не было; – реже 1 раз в год; – ежегодно; – чаще 1 раза в год | 12 (66,7) 4 (22,2) 2 (11,1) 2 (11,1) | 14 (53,8) 6 (23,1) 4 (15,4) 2 (7,7) |
Примечание. УСТ –
уратснижающая терапия; ЦУМК – целевой уровень мочевой кислоты.
При
неадекватном назначении УСТ достижения ЦУМК не было ни в одном случае, а при
адекватном 2/3 пациентов достигали цели терапии (ꭓ2 = 23,8; р = 0,000).
Неадекватное назначение УСТ наиболее часто заключалось в однократном назначении
100 мг аллопуринола и отсутствии последующей эскалации дозы, несмотря на
проведенный лабораторный контроль. Частота обострений артрита была сопоставима
в подгруппах адекватной и неадекватной УСТ.
При
корреляционном анализе Спирмена более частые обострения артрита были взаимосвязаны
с мужским полом (0,27; р < 0,05), молодым возрастом (0,45; р < 0,05),
исходным уровнем МК (0,41; р < 0,05), наличием НАЖБП (0,30; р < 0,05) и
отсутствием патологии почек (0,31; р < 0,05) и СД2 (0,38; р < 0,05).
Сравнение
анализируемых параметров в зависимости от наличия СД2 (n =
36) и его отсутствия (n
=
68) выявило, что УСТ пациентам с сочетанием подагры и СД2 назначалась в 2,5
раза реже (p
<
0,005), но и частота обострений у них была реже в 2,6 раза (ꭓ2=
7,77; р = 0,0053). Анализ в зависимости от наличия или отсутствия НАЖБП продемонстрировал
при практически равном назначении УСТ (40 и 41% соответственно) в 2,4 раза
более частые обострения при сочетании подагры с НАЖБП (ꭓ2 = 7,57; р =
0,006).
Обсуждение
Эффективность
лечения пациентов с подагрой определяется прежде всего стратегическим
достижением ЦУМК в крови, что должно закономерно обеспечить стабилизацию
состояния в виде отсутствия или значительного уменьшения частоты атак острого
артрита. К сожалению, мировая практика демонстрирует неудовлетворительные
результаты как в неотложной терапии обострений артрита [17], так и в назначении УСТ и
достижении ЦУМК. Так, наблюдательное пятилетнее исследование ведения больных
подагрой в национальной австралийской популяции общей практики, опубликованное
в 2015 г. и включившее в анализ почти 1,5 млн электронных записей, обнаружило,
что назначение аллопуринола имело место у 57% пациентов с подагрой в течение 5
лет исследования, но при этом лишь у 55% из них осуществлялся контроль
сывороточной урикемии, а ЦУМК менее 360 мкмоль/л в любое время в течение пятилетнего
периода наблюдения регистрировался всего у 22,4% пациентов [18].
В
проспективном многоцентровом общенациональном исследовании, проведенном во
Франции, назначение аллопуринола в дозе 100 мг/сут больным подагрой через 3–6 мес.
наблюдения привело к достижению ЦУМК менее 360 мкмоль/л у 28,0% пациентов,
наблюдаемых врачами первичной медико-санитарной помощи, и у 29,3% – ревматологами
[19].
Более
длительное, с 2004 по 2020 г., наблюдение за 129 972 больными подагрой в
Великобритании продемонстрировало, что УСТ в течение первого года от момента
установления диагноза назначалась в среднем в 28,9% случаев (от 26,8% у тех, у
кого диагноз был поставлен в 2004 г., до 34,7% – в 2020 г.). Достижение ЦУМК
360 мкмоль/л и менее в 2020 г. отмечено у 36,0%, причем у 17,1% был достигнут уровень
300 мкмоль/л и менее, что соответствовало современным рекомендациям EULAR для пациентов с высоким
кардиоваскулярным риском и хронической болезнью почек [20].
Полученные
в нашем исследовании результаты реальной амбулаторной практики
продемонстрировали назначение УСТ у 42%, а достижение ЦУМК – у 25% пациентов за
пять лет наблюдения.
Нужно
отметить, что доля достигающих ЦУМК существенно отличается при проведении клинических
исследований за счет сужения критериев включения и более интенсивного мониторинга
состояния пациентов-участников. В 12-недельном исследовании, проведенном в
Научно-исследовательском институте ревматологии имени В.А. Насоновой, при
инициации УСТ использовали аллопуринол в стартовой дозе 100 мг/сут с
последующим повышением на 100 мг/сут каждые 2–3 нед. до достижения целевого
уровня, при его неэффективности и (или) нежелательных реакциях назначали
фебуксостат 80 мг/сут, при необходимости – с повышением до 120 мг/сут. Достижение
дифференцированного ЦУМК было зарегистрировано в 79% случаев, а использование
унифицированной цели сывороточных уратов менее 360 мкмоль/л демонстрировало
эффективность 92% [21].
В 72-недельном
рандомизированном исследовании относительной эффективности и безопасности
аллопуринола и фебуксостата участвовали 940 больных подагрой. Титрование доз
аллопуринола от 100 до 800 мг или фебуксостата от 40 до 120 мг проводили на
протяжении 24 нед. с проведением противовоспалительной профилактической
терапии, в последующем осуществляли поддержание достигнутого результата с 25-й
по 48-ю неделю и наблюдение до 72-й недели. Достижение ЦУМК было 80% вне
зависимости от лечения. Одна вспышка или более подагрической атаки зарегистрирована
у 36,5% участников, получавших аллопуринол, и у 43,5% – фебуксостат (p <
0,001). Профиль безопасности препаратов оказался сопоставим в том числе и по заболеваниям
сердечно-сосудистой системы и почек [22].
Как видно из приведенных
результатов разных клинических исследований, эффективное назначение УСТ
возможно при выполнении условия титрации дозы урикостатика до достижения цели,
но именно отсутствие данного этапа, а также неизбежный на этом пути риск
увеличения частоты обострений является наиболее распространенной проблемой, приводящей
к неэффективности, а зачастую и дискредитации УСТ в глазах как врачей, так и
пациентов. Вопреки тому что подагра является одним из немногих ревматических
заболеваний, которое доступно эффективному контролю при соблюдении рекомендаций
врачами и пациентами, в 19 клинических исследованиях сообщается, что менее 1/2 пациентов
с данным диагнозом получают УСТ. Более того, даже при назначении УСТ
отсутствует титрация урикостатика до достижения ЦУМК, что неизбежно ведет к продолжению
депонирования кристаллов моноурата натрия, а пациент при этом подвергается еще
и дополнительному риску развития нежелательных побочных эффектов от приема
лекарства. В подавляющем большинстве стран ревматологи оказывают помощь тяжелым
или сложным пациентам, а основная часть помощи пациентам с подагрой зависит от врачей
первичного звена. К сожалению, неудовлетворительное ведение наблюдается в обоих
случаях. Дополнительную трудность представляет недостаточная комплаентность
пациентов в условиях высокой степени мультиморбидности и полипрагмазии. Повышение
эффективности лечения больных подагрой однозначно связано с более настоятельным
и тщательным исполнением национальных рекомендаций и консенсусов на всех
уровнях оказания медицинской помощи, вплоть до привлечения персонала среднего
звена для обучения пациентов и контроля исполнения назначений [23–28].
В полученных нами данных
при УСТ 42% больных подагрой это назначение было адекватным лишь у 18 из 44 чел.,
однако даже при соблюдении клинических рекомендаций достижение ЦУМК имело место
лишь у 12 из 18 пациентов. Анализ амбулаторных карт 6 пациентов из подгруппы Н,
которым изначально УСТ назначалась адекватно, показал недостаточную
эффективность аллопуринола. В их ситуации возможно назначение альтернативного
урикостатика, которым на сегодняшний день является селективный ингибитор
ксантиноксидазы фебуксостат [29]. Его особенностью является
значительно более выраженное уратснижающее действие, что закономерно может повышать
риск частоты обострений в начальном периоде терапии. Преодоление этой трудности
возможно несколькими путями, часть которых отражена в проспективном
многоцентровом рандомизированном открытом сравнительном исследование FORTUNE-1
(Япония), в котором оценивали частоту возникновения обострений подагры у 255 пациентов,
распределенных на 3 группы. В группе А проводилось ступенчатое увеличение дозы
фебуксостата с 10 до 40 мг/день, в группе B назначалась
фиксированная доза фебуксостата 40 мг/день + колхицин 0,5 мг/день, в группе С –
фиксированная доза фебуксостата 40 мг/день. Наблюдение проводили в течение 12
нед. Завершил исследование 241 пациент, при этом обострения подагры наблюдались
у 20,8% в группе А, у 18,9% – в группе В и у 36,0% – в группе С. Полученные
данные показали, что ступенчатое повышение дозы фебуксостата может быть
эффективной альтернативой профилактическому назначению низких доз колхицина во
время инициации УСТ [30].
Анализ использования фебуксостата
в реальных условиях у 114 пациентов с тяжелой подагрой, ассоциированной с хронической
болезнью почек, СД2, артериальной гипертензией, был проведен в многоцентровом
ретроспективном когортном исследовании путем изучения электронных медицинских
записей в 3 больницах Китая с января 2014 по февраль 2022 г. Стартовые дозы,
рекомендованные при инициации УСТ, были 20 или 40 мг, при необходимости
увеличивались до 80 мг. Через 12 нед. лечения ЦУМК менее 300 мкмоль/л был
достигнут у 55% пациентов [31].
Анализ публикаций по применению фебуксостата как в клинических
исследованиях, так и в реальной практике демонстрирует успешность, а
соответственно, и необходимость использования более низких стартовых доз
препарата, чем имеющиеся в аптечной сети России, где доступны формы выпуска по
80 или 120 мг. Для обеспечения инициации терапии фебуксостатом хотя бы с дозы
40 мг практикующие врачи отдают предпочтение делимым таблеткам. Таким вариантом
препарата является Аденурик®, опыт использования которого представлен в следующем
клиническом примере из анализируемой когорты пациентов.
Клинический пример
Мужчина, 1973 года рождения, рост 170 см, масса тела 86 кг, ИМТ 29,8
кг/м2, окружность талии 100 см. Начало суставного синдрома – в 2016 г.,
когда впервые появилась боль и ограничение подвижности в левом локтевом
суставе. Был госпитализирован в ревматологическое отделение, где получал
лечение НПВП, локальное введение бетаметазона. Выписан с диагнозом «латеральный
эпикондилит левого локтевого сустава». Уровень МК в крови не определялся.
Выписан с улучшением, однако боли в локтевом суставе приступообразно
рецидивировали более 2 раз в год, самостоятельно купировал их приемом НПВП в течение
3–5 дней.
Первая атака классического артрита первого плюснефалангового сустава (ПФС)
левой стопы развилась в мае 2018 г. Пациент обратился к хирургу, был
перенаправлен к ревматологу с предварительным выполнением анализов крови (МК 663
мкмоль/л, С-реактивный белок (СРБ) 12,4 мг/л). Был выставлен диагноз «подагра,
острый подагрический артрит первого ПФС левой стопы, функциональная
недостаточность суставов 2-й степени (ФНС2)». Пациент был госпитализирован в
ревматологическое отделение, получал лечение НПВП внутримышечно и 2 раза за
период госпитализации бетаметазон локально в область первого ПФС левой стопы. При
выписке уровень МК 446 мкмоль/л, СРБ 7,6 мг/л. Рекомендована гипопуриновая диета
без УСТ. Через полтора месяца после выписки из стационара амбулаторно был выполнен
анализ крови на МК (437 мкмоль/л) и СРБ (3,9 мг/л).
В августе 2018 г. пациент был вновь госпитализирован в ревматологическое отделение с
острым подагрическим артритом первого ПФС правой стопы. Сывороточная урикемия 556
мкмоль/л, СРБ 34,3 мг/л, в анализе мочи микропротеинурия 0,16 г/л, лейкоцитурия
1–2 в поле зрения, эритроцитурия 12–15 в поле зрения. Прошел курс стационарного
лечения (НПВП и локальное введение ГКС). При выписке рекомендована гипопуриновая
диета и аллопуринол 100 мг утром, контроль уровня МК, диспансерное наблюдение
терапевта, ревматолога.
В октябре 2018 г. выявлена мочекаменная болезнь, камни в обеих почках, НАЖБП
– стеатогепатит минимальной
активности, по поводу которой пролечивался в гастроэнтерологическом отделении.
Колебания уровня МК за период октября 2018 – апреля 2019 г. – от 440 до 605
мкмоль/л, короткие обострения в виде припухлости и болей в левом локтевом или
одном из первых ПФС порядка 3–4 раз, чаще купировал их самостоятельно приемом
НПВП. В апреле 2019 г. лечился по поводу язвенной болезни двенадцатиперстной
кишки. В июне 2019 г. успешно проведена дистанционная литотрипсия камней почек.
В период с июля 2019 по июнь 2022 г. пациент неоднократно осматривался
терапевтом, хирургом, гастроэнтерологом, урологом. Контроль сывороточной
урикемии проводился (439–770 мкмоль/л), но рекомендации по эскалации дозы
аллопуринола или смене уратснижающего препарата в медицинской документации
отсутствуют.
В июне 2022 г. отметил выраженные боли и припухлость правого коленного
сустава, был госпитализирован в ревматологическое отделение с диагнозом «подагра,
хроническое течение, рецидивирующий подагрический артрит, олигоартрит,
активность 1-й степени; мочекаменная болезнь». При поступлении урикемия 712
мкмоль/л, СРБ 15,1 мг/л. Получал лечение НПВП, колхицином, локальное введение
ГКС. При выписке рекомендован фебуксостат 40 мг/сут. Приверженность пациента к
приему лекарственных препаратов была низкой, периодически возникающие боли в суставах
купировал приемом НПВП. Различий в частоте обострения суставных болей на фоне
приема 100 мг аллопуринола или 40 мг фебуксостата не отмечал.
В марте 2023 г. резко усилились боли в суставах стоп, обоих коленных
суставах, правом плечевом суставе. Госпитализирован в ревматологическое отделение.
При осмотре: дефигурация, ограничение подвижности в коленных суставах, суставах
стоп, резкое ограничение подвижности в правом плечевом суставе. Сывороточная
урикемия 693 мкмоль/л, СРБ 112 мг/л. На рентгенограмме стоп в прямой проекции
рентгеновские суставные щели первых ПФС обеих стоп сужены с субхондральным
остеосклерозом, краевыми остеофитами до 1 мм. Единичная эрозия проксимальной
фаланги первого пальца правой стопы в области суставной поверхности межфалангового
сустава с относительно четкими контурами.
Из протокола ультразвукового исследования коленных суставов: утолщение внутренней
боковой связки со сливающимися точечными гиперэхогенными включениями с обеих
сторон, больше слева; в верхнем завороте слой жидкости справа толщиной до 8 мм,
слева – до 6 мм, синовиальная оболочка неравномерно утолщена, жидкость содержит
большое количество мелкодисперсной взвеси; синовиальная оболочка сустава вне
верхнего заворота утолщена с обеих сторон, количество внутрисуставной жидкости
вне верхнего заворота увеличено с обеих сторон, сухожилие подколенной мышцы
утолщено, со сливающимися точечными гиперэхогенными включениями с обеих сторон,
в подколенной ямке слева киста Бейкера размерами до 13 × 13 × 31 мм, стенки
кисты не утолщены, содержимое однородно. Заключение: выявлены ультразвуковые
признаки начального двустороннего гонартроза на фоне подагры; дегенеративные
изменения медиальных менисков 2–3-й степени; двусторонний хронический синовит;
подагрический тендинит подколенного сухожилия с обеих сторон, подагрический
лигаментит большеберцовой коллатеральной связки с обеих сторон; киста Бейкера
слева. При ультразвуковом исследовании правого плечевого сустава выявлены сонографические
признаки подагрического остеоартрита ключично-акромиального сочленения:
суставные поверхности неровные, четкие, с микроэрозивными изменениями, капсула
сустава утолщена, пониженной эхогенности, полость сустава расширена за счет
синовиальной гиперплазии с микрокристаллическими включениями, кровоток усилен.
Получал терапию НПВП, колхицином, локальное введение ГКС в коленные
суставы. Выписан с диагнозом: основной – подагра, хронический подагрический
артрит с поражением правого плечевого сустава, суставов стоп 2-й степени,
коленных суставов 1-й степени, подагрический тендинит подколенного сухожилия с
обеих сторон, подагрический лигаментит большеберцовой коллатеральной связки с
обеих сторон, ФНС2; фоновый – двусторонний гонартроз 1-й степени,
дегенеративные изменения медиальных менисков 2–3-й степени, киста Бейкера
слева, артроз суставов стоп 2-й степени, ФНС2.
Рекомендовано: модификация образа жизни, гипопуриновая диета,
фебуксостат 80 мг и колхицин 0,5 мг в сутки ежедневно. Динамика уровня МК
573–487–388 мкмоль/л к сентябрю 2023 г. Подагрический артрит за данный период
не рецидивировал, колхицин отменен. С октября 2023 по январь 2024 г. пациент
продолжал прием фебуксостата в
дозе 80 мг/сут, лечение переносит удовлетворительно. Уровень МК в январе 2024 г.
– 370 мкмоль/л. В связи с наличием в анамнезе мочекаменной болезни и недостижением
ЦУМК планируется повышение дозы фебуксостата до 120 мг/сут.
Данный клинический пример, к сожалению, демонстрирует достаточно
типичный путь больного подагрой от дебюта в молодом возрасте (43 года), когда в
силу, возможно, не вполне классического начала с вовлечением локтевого сустава
не проводилось исследование сывороточной урикемии. Классические подагрические
атаки начались через 2 года, правильный диагноз был установлен, аллопуринол
назначен после второй атаки артрита, но титрация дозы до достижения ЦУМК не проводилась.
Приверженность к изменению образа жизни у пациента низкая. В результате мы
видим развитие хронического полиартикулярного поражения с вовлечением крупных
суставов, в том числе плечевого, а также формирование конкрементов в почках,
потребовавших литотрипсии. ЦУМК в данном клиническом примере следует определить ниже 300
мкмоль/л, в связи с чем пациенту был рекомендован фебуксостат.
Заключение
Ретроспективный
анализ ведения 104 больных подагрой на протяжении 5 лет от момента установления
диагноза в условиях реальной практики показал, что достигали снижения
сывороточной урикемии до целевого уровня менее 360 мкмоль/л 26 чел. (25%) при
сравнимом соотношении мужчин и женщин среди достигших и не достигших ЦУМК. При
высокой степени полиморбидности среди пациентов, достигших целевой урикемии,
преобладали пожилые пациентов с сопутствующим остеоартритом любых локализаций,
а среди не достигавших ЦУМК более частой сопутствующей нозологией
регистрировалась НАЖБП. Влияние сопутствующих заболеваний на возможность
достижения цели УСТ у больных подагрой требует дополнительного изучения.
Возможность
достижения цели УСТ конкретным пациентом определялась в течение первого года
наблюдения. При недостижении ЦУМК в течение первого года от постановки диагноза
подагры необходимо анализировать причины неудачи и активно назначать или
интенсифицировать УСТ. Назначение УСТ было зарегистрировано у 42% наблюдаемой
группы. Среди тех 44 пациентов, которым была назначена УСТ, лишь у 18 (41%)
можно считать ее адекватной (назначение с минимальных доз урикостатического
препарата после купирования острого артрита, наличие периода титрации дозы до
достижения ЦУМК, противовоспалительная профилактика обострений артрита в период
титрации). Даже при адекватном назначении аллопуринола у 1/3 пациентов не была
достигнута цель УСТ. Альтернативным урикостатическим препаратом, позволяющим
преодолеть данную трудность, является фебуксостат.
Развернуть
- Прожерина Ю, Широкова И. Подагра: новое в
клинических рекомендациях. Ремедиум.
2021;(2):58–61. Режим доступа: https://remedium-journal.ru/journal/article/view/858. - Prozherina Yu, Shirokova I.
Gout: what’s new in the clinical guidelines. Remedium. 2021;(2):58–61. (In Russ.) Available at: https://remedium-journal.ru/journal/article/view/858. - Dehlin
M, Jacobsson L, Roddy E. Global epidemiology of gout: prevalence, incidence,
treatment patterns and risk factors. Nat
Rev Rheumatol. 2020;16(7):380–390. https://doi.org/10.1038/s41584-020-0441-1. - Kuo
CF, Grainge MJ, Zhang W, Doherty M. Global epidemiology of gout: prevalence,
incidence and risk factors. Nat
Rev Rheumatol. 2015;11(11):649–662. https://doi.org/10.1038/nrrheum.2015.91. - Singh
JA, Gaffo A. Gout epidemiology and comorbidities. Semin Arthritis Rheum. 2020;50(3S):S11–S16. https://doi.org/10.1016/j.semarthrit.2020.04.008. - Галушко ЕА, Насонов ЕЛ. Распространенность
ревматических заболеваний в России. Альманах
клинической медицины. 2018;46(1):32–39. https://doi.org/10.18786/2072-0505-2018-46-1-32-39. - Galushko
EA,
Nasonov
EL.
Prevalence of rheumatic
diseases in Russia. Almanac of Clinical
Medicine. 2018;46(1):32–39. (In Russ.) https://doi.org/10.18786/2072-0505-2018-46-1-32-39. - Елисеев МС. Подагра. М.: ГЭОТАР-Медиа; 2019. 240 с.
- Панина ЕВ, Елисеев МС. Перспективы
применения уратснижающей терапии у пациентов с бессимптомной гиперурикемией и
подагрой. Медицинский совет.
2023;(21):128–134. https://doi.org/10.21518/ms2023-404. - Panina EV, Eliseev MS. Prospects for prescription of urate-lowering therapy
in patients with asymptomatic hyperuricemia and gout. Meditsinskiy Sovet. 2023;(21):128–134. (In Russ.) https://doi.org/10.21518/ms2023-404. - Цурко ВВ, Громова МА. Оптимальная
уратснижающая терапия у пациентов с подагрой – современная трактовка проблемы. РМЖ. 2021;(7):50–54. Режим доступа:
https://www.rmj.ru/articles/revmatologiya/Optimalynaya_uratsnighayuschaya_terapiya_upacientov_spodagroy__sovremennaya_traktovka_problemy/. - Tsurko VV, Gromova MA. Optimal
urate-lowering therapy in patients with gout – modern version of the problem. RMJ. 2021;(7):50–54. (In Russ.)
Available at: https://www.rmj.ru/articles/revmatologiya/Optimalynaya_uratsnighayuschaya_terapiya_upacientov_spodagroy__sovremennaya_traktovka_problemy/. - Светлова МС. Клинические проявления,
диагностика и лечение подагры в практике врача первичного звена. Медицинский
совет. 2020;(4):136–142.
https://doi.org/10.21518/2079-701X-2020-4-136-142. - Svetlova MS. Clinical manifestations, diagnosis and treatment of gout in the
practice of a primary care physician. Meditsinskiy
Sovet. 2020;(4):136–142. (In Russ.) https://doi.org/10.21518/2079-701X-2020-4-136-142. - Владимиров СА, Елисеев МС, Ильиных ЕВ,
Марусенко ИМ, Чичасова НВ, Якупова СП. Подагра:
клинические рекомендации. М.; 2018. Режим доступа: https://legalacts.ru/doc/klinicheskie-rekomendatsii-podagra-utv-minzdravom-rossii/. - FitzGerald
JD, Dalbeth N, Mikuls T, Brignardello-Petersen R, Guyatt G, Abeles AM et al.
2020 American College of Rheumatology Guideline for the Management of Gout. Arthritis Care Res (Hoboken).
2020;72(6):744–760. https://doi.org/10.1002/acr.24180. - Latourte
A, Pascart T, Flipo RM, Chalès G, Coblentz-Baumann L, Cohen-Solal A et al. 2020
Recommendations from the French Society of Rheumatology for the management of
gout: Management of acute flares. Joint
Bone Spine. 2020;87(5):387–393. https://doi.org/10.1016/j.jbspin.2020.05.001. - Lee
JJ, Lee JS, Chung MK, Ahn JK, Choi HJ, Hong SJ et al. Korean guidelines for the
management of gout. J Rheum Dis.
2023;30(3):141–150. https://doi.org/10.4078/jrd.2023.0029. - Елисеев МС. Комментарии к обновленным
рекомендациям Американской коллегии ревматологов по лечению подагры.
Уратснижающие препараты (часть 1). Современная
ревматология. 2020;14(3):117–124. https://doi.org/10.14412/1996-7012-2020-3-117-124. - Eliseev
MS.
Commentaries on the updated
American College of Rheumatology guidelines for the management of gout. Urate-lowering
drugs (Part 1). Modern Rheumatology
Journal. 2020;14(3):117–124. https://doi.org/10.14412/1996-7012-2020-3-117-124. - Елисеев МС. Рекомендации Американской
коллегии ревматологов (2020 г.) по ведению больных подагрой: что нового и что
спорно. Научно-практическая ревматология. 2021;59(2):129–133. https://doi.org/10.47360/1995-4484-2021-129-133. - Eliseev MS. ACR management guidelines for the treatment of gout: What’s new and
what’s controversial. Rheumatology
Science and Practice. 2021;59(2):129–133. (In Russ.) https://doi.org/10.47360/1995-4484-2021-129-133. - Neogi
T, Jansen TL, Dalbeth N, Fransen J, Schumacher HR, Berendsen D et al. 2015 Gout
classification criteria: an American College of Rheumatology/European League
Against Rheumatism collaborative initiative. Ann Rheum Dis. 2015;74(10):1789–1798. https://doi.org/10.1136/annrheumdis-2015-208237. - Towiwat
P, Phungoen P, Tantrawiwat K, Laohakul P, Aiewruengsurat D, Thanadetsuntorn C
et al. Quality of gout care in the emergency departments: a multicentre study. BMC Emerg Med. 2020;20(1):27. https://doi.org/10.1186/s12873-020-00319-w. - Robinson
PC, Taylor WJ, Dalbeth N. An Observational Study of Gout Prevalence and Quality
of Care in a National Australian General Practice Population. J Rheumatol. 2015;42(9):1702–1707. https://doi.org/10.3899/jrheum.150310. - Goossens
J, Lancrenon S, Lanz S, Ea HK, Lambert C, Guggenbuhl P et al. GOSPEL 3:
Management of gout by primary-care physicians and office-based rheumatologists
in France in the early 21st century – comparison with 2006 EULAR
Recommendations. Joint Bone Spine.
2017;84(4):447–453. https://doi.org/10.1016/j.jbspin.2017.04.002. - Russell
MD, Rutherford AI, Ellis B, Norton S, Douiri A, Gulliford MC et al. Management
of gout following 2016/2017 European (EULAR) and British (BSR) guidelines: An
interrupted time-series analysis in the United Kingdom. Lancet Reg Health Eur. 2022;18:100416. https://doi.org/10.1016/j.lanepe.2022.100416. - Чикина МН, Елисеев МС, Желябина ОВ. Практическое
применение национальных клинических рекомендаций по лечению подагры
(предварительные данные). Современная
ревматология. 2020;14(2):97–103. https://doi.org/10.14412/1996-7012-2020-2-97-103. - Chikina
MN,
Eliseev
MS,
Zhelyabina
OV.
Practical application of
national clinical guidelines for the management of gout (preliminary data). Modern Rheumatology Journal.
2020;14(2):97–103. https://doi.org/10/14412/1996-7012-2020-2-97-103. - O’Dell
JR, Brophy MT, Pillinger MH, Neogi T, Palevsky PM, Wu H et al. Comparative
Effectiveness of Allopurinol and Febuxostat in Gout Management. NEJM Evid. 2022;1(3):10.1056/evidoa2100028.
https://doi.org/10.1056/evidoa2100028. - Sivera
F, Andres M, Dalbeth N. A glance into the future of gout. Ther Adv Musculoskelet Dis. 2022;14:1759720X221114098. https://doi.org/10.1177/1759720X221114098. - Rogenmoser
S, Arnold MH. Chronic gout: Barriers to effective management. Aust J Gen Pract. 2018;47(6):351–356. https://doi.org/10.31128/AJGP-11-17-4384. - Doherty
M, Jenkins W, Richardson H, Sarmanova A, Abhishek A, Ashton D et al. Efficacy
and cost-effectiveness of nurse-led care involving education and engagement of
patients and a treat-to-target urate-lowering strategy versus usual care for
gout: a randomised controlled trial. Lancet.
2018;392(10156):1403–1412. https://doi.org/10.1016/S0140-6736(18)32158-5. - Roman
YM. Moving the Needle in Gout Management: The Role of Culture, Diet, Genetics,
and Personalized Patient Care Practices. Nutrients.
2022;14(17):3590. https://doi.org/10.3390/nu14173590. - Красивина ИГ, Долгова ЛН, Долгов НВ,
Бахвалова ДЮ. Реалии современной уратснижающей терапии при подагре. Медицинский совет. 2023;(10):116–126. https://doi.org/10.21518/ms2023-181. - Krasivina
IG,
Dolgova
LN,
Dolgov NV, Bakhvalova DYu. Realities of modern urate-reducing therapy for gout. Meditsinskiy Sovet. 2023;(10):116–126.
(In Russ.) https://doi.org/10.21518/ms2023-181. - Петрова МС, Мусийчук ММ, Мазуров ВИ.
Актуальная стратегия лечения подагрического артрита. Современная ревматология. 2018;12(3):70–75. https://doi.org/10.14412/1996-7012-2018-3-70-75. - Petrova
MS,
Musiychuk
MM,
Mazurov
VI.
The current treatment strategy
for gouty arthritis. Modern Rheumatology
Journal. 2018;12(3):70–75. (In Russ.) https://doi.org/10.14412/1996-7012-2018-3-70-75. - Мазуров ВИ, Беляева ИБ, Петрова МС,
Башкинов РА. Современная парадигма лечения гиперурикемии и подагры у
коморбидных пациентов с развитием кардиоваскулярной патологии. Медицинский совет. 2020;(19):78–88. https://doi.org/10.21518/2079-701X-2020-19-78-88. - Mazurov
VI,
Belyaeva
IB,
Petrova
MS,
Bashkinov
RA.
Modern paradigm of treatment
of hyperuricemia and gout in comorbid patients with the development of
cardio-vascular pathology. Meditsinskiy Sovet.
2020;(19):78–88. (In Russ.) https://doi.org/10.21518/2079-701X-2020-19-78-88. - Yamanaka
H, Tamaki S, Ide Y, Kim H, Inoue K, Sugimoto M et al. Stepwise dose increase of
febuxostat is comparable with colchicine prophylaxis for the prevention of gout
flares during the initial phase of urate-lowering therapy: results from
FORTUNE-1, a prospective, multicentre randomised study. Ann Rheum Dis. 2018;77(2):270–276. https://doi.org/10.1136/annrheumdis-2017-211574. - Si
X, Huang L, Ding Q, Zhang W, Zhao R, Ai C et al. Comparison of clinical and
economic evaluation between selected generic and original febuxostat tablets in
Chinese gout patients with hyperuricemia: A real-world multicenter
retrospective study. Medicine
(Baltimore). 2024;103(4):e37081. https://doi.org/10.1097/MD.0000000000037081.



 1
1 2
2 3
3 4
4


Комментарии (0)