
Журнал "Медицинский совет" №8/2025
DOI: 10.21518/ms2025-231
Ю.А. Кучерявый1, ORCID: 0000-0001-7760-2091
Д.Н. Андреев2, ORCID: 0000-0002-4007-7112
Н.В. Новожилов1, ORCID: 0009-0000-8162-7961
1 Ильинская больница; 143421, Россия, Московская обл., Красногорск, д. Глухово, ул. Рублевское Предместье, д. 2, корп. 2
2 Российский университет медицины (РосУниМед); 127006, Россия, Москва, ул. Долгоруковская, д. 4
Введение. Синдром избыточного бактериального роста (СИБР) при низком уровне фекальной эластазы-1 (ФЭ-1) нередко маскируется под симптомы внешнесекреторной недостаточности поджелудочной железы (ВНПЖ). При этом заместительная ферментная терапия препаратами панкреатина оказывается низкоэффективной.
Цель. Изучить терапевтическую эффективность рифаксимина-альфа у пациентов с низкими уровнями ФЭ-1 без визуализационных признаков поражения поджелудочной железы.
Материалы и методы. В исследование были включены 35 амбулаторных пациентов с низкими уровнями ФЭ-1 (менее 200 мкг/г), рефрактерными клиническими проявлениями, характерными для заболеваний нижних отделов желудочно-кишечного тракта, и без признаков поражения поджелудочной железы по данным визуализационных методов исследования. Общая длительность лечения составила 15 нед., в ходе которых пациенты получали 6 чередующихся циклов терапии по 14 дней: рифаксимином-альфа и пробиотиком. Рифаксимин-альфа назначался в дозе 1 200 мг в сутки на 3 приема по 400 мг в течение 14 дней. Пробиотическая терапия на 14 дней включала штамм Lacticaseibacillus paracasei DG (L. paracasei DG) в связи с тем, что у пациентов отмечались как диарея, так и запоры. L. paracasei DG без пребиотика назначался при доминировании диареи. Прием L. paracasei DG с пребиотиком рекомендовался при доминировании запора по 1 капсуле/саше сроком на 3 нед.
Результаты. Отмечен статистически значимый регресс (p < 0,05) всех первичных жалоб. Медианный уровень ФЭ-1 значимо повысился с 76,0 (95% ДИ: 48,9–113,0) до 290 (95% ДИ: 260,0–332,3) мкг/г (p < 0,0001). Нормализация уровня ФЭ-1 была отмечена у 32 пациентов (91,4%) (p < 0,0001).
Заключение. Одной из доминирующих причин низкой ФЭ-1 у пациентов с кишечной симптоматикой и отсутствием объективных признаков поражения поджелудочной железы может являться СИБР. Цикличная терапия рифаксимином-альфа и пробиотиком на основе штамма L. paracasei DG позволила добиться регресса клинических проявлений, улучшения качества жизни и нормализации уровня ФЭ-1 спустя 15 нед. лечения у большинства пациентов.
Для цитирования: Кучерявый ЮА, Андреев ДН, Новожилов НВ. Влияние антибактериальной и пробиотической терапии на восстановление сниженного уровня фекальной эластазы у пациентов без визуализационных признаков поражения поджелудочной железы. Медицинский совет. 2025;19(8):187–192. https://doi.org/10.21518/ms2025-231.
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Effect of antibacterial and probiotic therapy on the restoration of low fecal elastase levels in patients without imaging findings of pancreatic injuries
Yury A. Kucheryavyy1, ORCID: 0000-0001-7760-2091
Dmitriy N. Andreev2, ORCID: 0000-0002-4007-7112
Nikita V. Novozhilov1, ORCID: 0009-0000-8162-7961
1 Ilyinskaya Hospital; 2, Bldg. 2, Rublevskoe Predmestie St., Glukhovo village, Krasnogorsk, Moscow Region, 143421, Russia
2 Russian University of Medicine (ROSUNIMED); 4, Dolgorukovskaya St., Moscow, 127006, Russia
Introduction. The small intestinal bacterial overgrowth (SIBO) with low levels of fecal elastase-1 (FE-1) often mimics the symptoms of of exocrine pancreatic insufficiency (EPI). In this case, enzyme replacement therapy with pancreatin preparations proves ineffective.
Aim. To study the therapeutic efficacy of rifaximin alfa in patients with low FE-1 levels without imaging findings of pancreatic injury.
Materials and methods. The study included 35 outpatients with low FE-1 levels (less than 200 μg/g), refractory clinical manifestations specific to lower gastrointestinal tract diseases, and no signs of pancreatic injuries seen on cross sectional imaging. The total duration of treatment was 15 weeks, during which patients received 6 alternating cycles each lasting 14 days: rifaximin alfa and a probiotic. Rifaximin alfa was administered at a dose of 1,200 mg per day split in 3 doses of 400 mg each for 14 days. Probiotic therapy for 14 days included Lacticaseibacillus paracasei DG (L. paracasei DG) due to the fact that patients had both diarrhea and constipation. L. paracasei DG without prebiotic was prescribed to patients with diarrheapredominant irritable bowel syndrome. L. paracasei DG with a prebiotic was recommended to patients with constipationpredominant irritable bowel syndrome at a dose of 1 capsule/sachet once a day for 3 weeks.
Results. A statistically significant regression (p < 0.05) of all primary complaints was observed. The median FE-1 levels significantly increased from 76.0 (95% CI: 48.9–113.0) to 290 (95% CI: 260.0–332.3) μg/g (p < 0.0001). Normalization of FE-1 levels was observed in 32 patients (91.4%) (p < 0.0001).
Conclusion. SIBO can be one of the dominant causes of low FE-1 levels in patients with intestinal symptoms and no objective signs of pancreatic injuries. Cyclic therapy with rifaximin-alpha and probiotic based on the strain L. paracasei DG allowed to achieve regression of clinical manifestations, improve the quality of life and normalize FE-1 levels after 15-week therapy in most patients.
For citation: Kucheryavyy YuA, Andreev DN, Novozhilov NV. Effect of antibacterial and probiotic therapy on the restoration of low fecal elastase levels in patients without imaging findings of pancreatic injuries. Meditsinskiy Sovet. 2025;19(8):187–192. (In Russ.) https://doi.org/10.21518/ms2025-231.
Conflict of interest: the authors declare no conflict of interest.
Введение
Сегодня определение уровня фекальной эластазы-1 (ФЭ-1) является широко рекомендуемым рутинным тестом для диагностики внешнесекреторной недостаточности поджелудочной железы (ВНПЖ) [1–3]. Преимуществами данного теста являются неинвазивность, высокая воспроизводимость, низкая стоимость и широкая доступность во многих клиниках мира [1, 4]. В норме уровень фекальной эластазы в кале составляет 200–500 мкг/г и более, тогда как при ВНПЖ легкой и средней степени характеризуется снижением до 100–200 мкг/г, а при тяжелой степени – менее 100 мкг/г [2–4].
Последний метаанализ продемонстрировал, что диагностика ФЭ-1 обладает достаточно высокой чувствительностью (96%, 95% ДИ: 0,79–0,99) и специфичностью (88%, 95% ДИ: 0,59–0,97) при верификации ВНПЖ в сравнении с количественной оценкой фекального жира [5]. Вместе с тем диагностическая точность данного теста при легкой ВНПЖ может существенно снижаться [6], а частота ложноположительных результатов повышаться [5]. Низкий уровень фекальной эластазы может быть обусловлен неоформленным стулом у пациента (разбавление каловых масс искажает результат), неправильным сбором образца кала (контаминация водой, мочой или нарушения условий хранения), возрастными изменениями (у пожилых людей отмечается гипофункция органов пищеварения) [7, 8]. Помимо этого, существует целый ряд заболеваний и патологических состояний, при которых может определяться снижение уровня фекальной эластазы ниже референтных значений, включая сахарный диабет, целиакию, воспалительные заболевания кишечника, синдром раздраженного кишечника (СРК), кишечные инфекционные заболевания, а также синдром избыточного бактериального роста (СИБР) в тонкой кишке [7–9]. Для большинства из вышеперечисленных заболеваний характерны клинические проявления, во многом схожие с ВНПЖ (вздутие живота, флатуленция, тошнота, абдоминальная боль, а также диарея), хотя тактика диагностики и лечения абсолютно другая [8]. Классическим примером является СИБР, характеризующийся значительным увеличением количества бактерий в тонкой кишке и обладающий способностью вызывать симптомы, сходные с клиническими проявлениями ВНПЖ. При этом заместительная ферментная терапия препаратами панкреатина здесь оказывается низкоэффективной [10]. Известно, что до трети пациентов с хроническим панкреатитом (ХП) страдают СИБР [8], однако достоверно неизвестно, имеется ли значимая связь СИБР у пациентов с низким уровнем ФЭ и при этом отсутствием инструментальных признаков поражения поджелудочной железы.
Цель исследования – изучение терапевтической эффективности рифаксимина-альфа у пациентов с низкими уровнями ФЭ-1 без визуализационных признаков поражения поджелудочной железы.
Материалы и методы
Дизайн исследования
Было проведено ретроспективное несравнительное исследование на базе отделения гастроэнтерологии АО «Ильинская больница». Включению подлежали амбулаторные пациенты с низкими уровнями ФЭ-1 (менее 200 мкг/г), рефрактерными клиническими проявлениями, характерными для заболеваний нижних отделов желудочно-кишечного тракта (ЖКТ), а также без признаков поражения поджелудочной железы по данным визуализационных методов исследования.
Критерии включения:
- мужчины и женщины в возрасте от 18 до 80 лет;
- снижение ФЭ-1 менее 200 мкг/г по данным двух последовательных исследований в образцах стула типа 3–4 по Бристольской шкале;
- клинические проявления, характерные для заболеваний нижних отделов ЖКТ (вздутие живота, флатуленция, тошнота, абдоминальная боль, диарея или запор) длительностью не менее 6 мес.;
- отсутствие клинического эффекта от применения спазмолитиков, прокинетиков, прои пребиотиков, ингибиторов протонной помпы, ферментных препаратов панкреатина в дозах до 50 000 ЕД липазы на прием пищи.
Пациент не включался в исследование, если соответствовал хотя бы одному из нижеприведенных критериев невключения/исключения:
- наличие патологических изменений в поджелудочной железе или желчном пузыре по данным визуализационных методов исследования (магнитно-резонансной холангиопанкреатографии (МРХПГ), мультиспиральной компьютерной томографии (МСКТ) или магнитно-резонансной томографии (МРТ), эндоскопического ультразвукового исследования);
- наличие атрофических и/или эрозивно-язвенных изменений по данным эзофагогастродуоденоскопии;
- наличие органической патологии по данным видеоколоноскопии;
- верифицированная целиакия, воспалительные заболевания кишечника и кишечные инфекции;
- операции на поджелудочной железе в анамнезе;
- наличие сахарного диабета;
- наличие на момент включения в исследование онкологических заболеваний;
- наличие аутоиммунных заболеваний в анамнезе или в настоящий момент;
- назначение антибактериальных препаратов, пробиотиков в течение 30 дней до момента начала терапии;
- назначение иммуносупрессоров, нестероидных противовоспалительных средств и цитостатиков;
- хроническая печеночная и/или почечная недостаточность;
- беременность;
- участие в других клинических интервенционных исследованиях в настоящий момент и в течение 30 дней до момента начала терапии;
- злоупотребление алкоголем или психотропными средствами и другими лекарственными препаратами в настоящее время или в течение последнего года;
- несоблюдение участником правил участия в исследовании (пропуск приема препаратов, отказ от сотрудничества, недисциплинированность и т. д.);
- возникновение в ходе исследования иных причин, препятствующих проведению исследования.
Первичный мониторинг основных анамнестических и клинических показателей включал оценку симптомов, характерных для заболеваний нижних отделов ЖКТ, характера стула, особенностей усиления симптоматики.
Общая длительность лечения составила 15 нед., в ходе которых пациенты получали последовательно 6 циклов терапии рифаксимином-альфа и пробиотиком с их чередованием (рисунок).
Рисунок. Фармакотерапия. Всего 6 циклов, включая циклично 14-дневный курс рифаксимином-альфа (циклы 1, 3, 5), далее – 3 нед. пробиотиком (циклы 2, 4, 6)
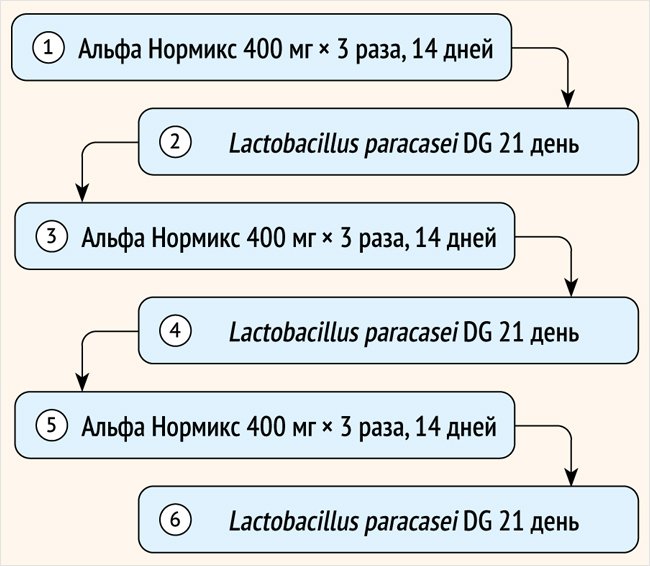
Всем пациентам, включенным в исследование, назначался Альфа Нормикс (рифаксимин-альфа) в дозе 1 200 мг в сутки на 3 приема по 400 мг в течение 14 дней. Пробиотическая терапия выбрана не случайно на базе линейки продуктов Энтеролактис, содержащей штамм Lacticaseibacillus paracasei DG (L. paracasei DG) в связи с тем, что у пациентов отмечались как диарея, так и запоры. Так, L. paracasei DG без пребиотика (Энтеролактис Плюс) назначался в случае доминирования диареи, прием L. paracasei DG с пребиотиком (Энтеролактис Дуо) рекомендовался в случае доминирования запора по 1 капсуле/саше сроком на 3 нед.
Разрешенная дополнительная терапия включала индивидуально подобранный уровень лактазы у пациентов с клиническими или лабораторными признаками лактазной недостаточности, микрокапсулированный панкреатин до 50 000 ЕД липазы на прием пищи, миотропные спазмолитики.
Последующая оценка клинических показателей, депрескрайбинг разрешенной сопроводительной терапии и уровня ФЭ-1 проводились спустя 15–20 нед. от момента начала терапии.
Этика
Исследование было подготовлено и проведено в соответствии с законодательными, нормативными, отраслевыми стандартами и применимыми этическими требованиями.
Статистический анализ
Статистическая обработка данных осуществлялась с помощью специального программного обеспечения MedCalc 23.1.1 (Бельгия) в среде Microsoft Windows 11 (США). Анализировались качественные (факт купирования отдельных симптомов) и количественные (динамика уровня ФЭ-1) конечные точки. Проверка статистических гипотез будет осуществлена с помощью непараметрического U-критерия Манна – Уитни, критерия Уилкоксона и параметрического критерия Фишера. Различия между группами могут считаться достоверными при р < 0,05.
Результаты
Популяция пациентов
Отбор пациентов проводился с июня 2023 г. по декабрь 2024 г. Было отобрано 35 больных, соответствующих критериям включения/невключения в исследование. Средний возраст обследованных лиц составил 41,6 ± 7,6 года, в гендерной структуре преобладали женщины (n = 22, 62,8%).
У абсолютного или доминирующего числа пациентов отмечалось вздутие живота (100%), усиление симптоматики при употреблении глютеносодержащих и молочных продуктов, а также фруктов и овощей (100%), нарастание симптоматики в течение дня (94,3%), постпрандиальное усиление симптоматики (88,6%), а также кишечные колики на высоте вздутия (74,3%). Диарея регистрировалась у 60,0% больных, тогда как запор – лишь у 14,3%. Примерно треть пациентов (34,3%) отмечали похудание и/или невозможность набрать массу тела за период до включения в исследование.
По данным лабораторного обследования первичная лактазная недостаточность (полиморфизм гена MCM6: -13910 T>C, генотип С/С) выявлена у 9 (25,7%) пациентов, что имело абсолютную корреляцию с эскалацией клинических проявлений при употреблении молочных продуктов во всех случаях. Данным больным в процессе лечения была дополнительно введена коррекция недостаточности с применением препаратов лактазы в индивидуально подобранной дозе (в среднем 8 600 ЕД лактазы на прием пищи). Уровень ФЭ-1 менее 100 мкг/г был выявлен у 22 (62,3%) пациентов настоящей выборки.
В соответствии с дизайном исследования анализ эффективности проводился спустя 15–20 нед. от начала проводимой терапии. В общем пуле пациентов отмечен статистически значимый регресс (p < 0,05) всех жалоб, выявленных на момент первичного скрининга (таблица). Медианный уровень ФЭ-1 значимо повысился с 76,0 (95% ДИ: 48,9–113,0) до 290 (95% ДИ: 260,0–332,3) мкг/г (p < 0,0001). Нормализация уровня ФЭ-1 была отмечена у 32 пациентов (91,4%) (p < 0,0001). Помимо этого, на фоне терапии у превалирующего числа пациентов удалось добиться постепенной отмены терапии спазмолитиками и препаратами панкреатина.
Таблица. Основные данные клинического обследования пациентов до и после терапии
| Вздутие живота | 35 (100%) | 6 (17,1%)* |
| Абдоминальный дискомфорт или боли | 19 (54,3%) | 5 (14,2%)* |
| Кишечные колики на высоте вздутия | 26 (74,3%) | 2 (5,7%)* |
| Постпрандиальное усиление симптоматики | 31 (88,6%) | 7 (20%)* |
| Нарастание симптоматики в течение дня | 33 (94,3%) | 5 (14,2%)* |
| Ночная симптоматика | 5 (14,3%) | 0 (0%)* |
| Диарея | 21 (60,0%) | 1 (2,8%)* |
| Запор | 5 (14,3%) | 0 (0%)* |
| Неустойчивый стул | 3 (8,6%) | 2 (5,7%) |
| Похудание и/или невозможность набрать массу тела | 12 (34,3%) | 0 (0%)* |
| Усиление симптоматики при употреблении глютеносодержащих и молочных продуктов, а также фруктов и овощей | 35 (100%) | 2 (5,7%)* |
| Лактазная недостаточность, генотип С/С | 9 (25,7%) | неприменимо |
| ФЭ-1 менее 200 мкг/г | 35 (100%) | 3 (8,6%)* |
| ФЭ-1 менее 100 мкг/г | 22 (62,3%) | 0 (0%)* |
| Спазмолитики | 21 (60,0%) | 0 (0%)* |
| Препараты панкреатина | 26 (74,3%) | 0 (0%)* |
Примечание. * – p < 0,05.
Обсуждение
ФЭ-1 – это протеолитический фермент, секретируемый экзокринной частью поджелудочной железы и составляющий около 6% от общего пула продуцируемых ферментов этого органа [11]. ФЭ-1 связывается с солями желчных кислот и минимально разрушается при прохождении через ЖКТ, что делает ее пригодной для диагностики ВНПЖ [12]. Именно вышеперечисленное, включая высокую доступность и дешевизну, определяет данный тест как наиболее частый рутинный инструмент диагностики ВНПЖ в клинической практике [1, 2].
Целью настоящего исследования явилась оценка терапевтической эффективности рифаксимина-альфа у пациентов с низкими уровнями ФЭ-1 без визуализационных признаков поражения поджелудочной железы. В первичный скрининг включено 35 пациентов с низкими уровнями ФЭ-1 (менее 200 мкг/г), клиническими проявлениями, характерными для заболеваний нижних отделов ЖКТ, а также без признаков поражения поджелудочной железы по данным визуализационных методов исследования (МРХПГ, МСКТ или МРТ). После курса терапии (6 циклов терапии рифаксимином-альфа и пробиотиком с их чередованием) отмечен статистически значимый регресс всех жалоб, выявленных на момент первичного скрининга (p < 0,05). Помимо этого, у превалирующего количества пациентов (91,4%) отмечена нормализация уровня ФЭ-1 после лечения. В целом наше исследование показывает, что одной из доминирующих причин низкой ФЭ-1 у пациентов с кишечной симптоматикой и отсутствием объективных признаков поражения поджелудочной железы по данным МРХПГ и МСКТ может являться СИБР. Мы не проводили дыхательные водородные тесты (ДВТ) нашим пациентам, однако эмпирическое назначение рифаксимина-альфа продемонстрировало существенный регресс симптоматики, что говорит о корректности нашей изначальной концепции. В пользу данной концепции о релевантности СИБР говорят и полученные данные о сопутствующей терапии пациентов, когда удалось добиться депрескрайбинга спазмолитиков и препаратов панкреатина во всех случаях (100%).
Стоит отметить, что истинная распространенность СИБР в популяции неизвестна, однако у лиц с гастроэнтерологическими жалобами она может превышать 30% [13, 14], достигая 36,7% при СРК, 69% при функциональной диарее, 78% при функциональных запорах и 85% при тонкокишечной дисфункции с пониженной абсорбционной способностью и повышенной проницаемостью в тонкой кишке [14]. В данной популяции высок риск вторичных ассоциированных с СИБР заболеваний и патологических состояний, включая снижение ФЭ-1, мимикрирующее под первичную ВНПЖ. Так, при СИБР в тонкой кишке активно размножаются условно-патогенные бактерии, часть из которых продуцируют собственные протеазы, способные разрушать ФЭ-1 [15]. Помимо этого, ряд микроорганизмов могут продуцировать органические кислоты, изменяя рН в просвете кишечника, тогда как в кислой среде многие ферменты поджелудочной железы теряют свою стабильность и быстрее деградируют [8, 16]. Отдельно стоит отметить, что СИБР часто сопровождается диареей, что искажает результат теста на ФЭ-1 из-за разбавления каловых масс [7, 8].
В целом же связь СИБР с низкими уровнями ФЭ-1 многофакторная и в первую очередь определяется изменением микробиоты кишечника. В исследовании F. Frost et al. [17], включавшем 1 795 добровольцев без заболеваний поджелудочной железы, с изучением микробиоты методом секвенирования гена 16S рРНК было показано, что частота снижения ФЭ-1 у лиц без заболеваний ЖКТ достигла 9,5%. Авторы показали, что колебания уровней ФЭ-1 были достоверно связаны (р < 0,0001) с изменениями разнообразия микробиоты больше, чем с возрастом, полом, индексом массы тела, курением, потреблением алкоголя или диетическими факторами. Значительные изменения выявлены в 30 таксонах у лиц со сниженной ФЭ-1. Снижение секреции по данным s-МРХПГ (проводилась 435 больным) также ассоциировано с изменениями микробного разнообразия (р < 0,0002), но в меньшей степени, чем с изменениями ФЭ-1 (в 2,5 раза). Увеличение +121% Prevotella (q < 0,0001) и уменьшение Bacteroides -38% (q < 0,0001) у лиц со сниженной ФЭ-1 указывали на переход от энтеротипа 1 к энтеротипу 2 [17]. Таким образом, функция ацинарных клеток поджелудочной железы в настоящее время является единственным наиболее значимым фактором макроорганизма, связанным с изменениями состава микробиоты кишечника. Низкая ФЭ-1 была ассоциирована с уменьшением «филогенетического разнообразия» / индекса альфа-разнообразия, чрезмерным ростом бактерий, что может снизить устойчивость макроорганизма к желудочно-кишечным инфекциям и быть сопричиной персистирующего СИБР. В более чем 65% случаев ВНПЖ ассоциирована со снижением ФЭ-1 без уменьшения экзокринной секреции поджелудочной железы, т. е. данные случаи стоит рассматривать как ВНПЖ вторичного генеза. А раз так, то данный вид ВНПЖ является не просто корректируемым, а высоковероятно излечимым, поскольку его основной причиной является скомпрометированный тонкокишечный микробиом. Стоит отметить, что бактерии рода Prevotella, увеличение которых выявлено у лиц с низкой ФЭ-1 в этом исследовании, характеризуются провоспалительной активностью [18], доказана способность некоторых видов Prevotella продуцировать сероводород, а значит, обладать выраженной протеолитической активностью с возможной деградацией и ФЭ-1 в том числе [19]. Уровень ФЭ-1 не коррелирует с условно-патогенной микрофлорой при ХП [20], а значит, снижение ФЭ-1 может объясняться только изменением качественного и количественного состава нормобиоты, что и происходит при СИБР.
Таким образом, у пациентов с клиническими признаками, характерными для ВНПЖ, а также низкой ФЭ-1 и отсутствием или низкой эффективностью заместительной ферментной терапии с применением панкреатина целесообразно проведение ДВТ с использованием глюкозы или лактулозы для диагностики СИБР. Верификация данного патологического состояния требует назначения рифаксимина-альфа для его эрадикации.
Заключение
Таким образом, настоящее ретроспективное исследование продемонстрировало, что одной из доминирующих причин низкой ФЭ-1 у пациентов с кишечной симптоматикой и отсутствием объективных признаков поражения поджелудочной железы по данным МРХПГ и МСКТ может являться СИБР. Цикличная терапия рифаксимином-альфа и пробиотиками на основе L. paracasei DG позволила добиться регресса клинических проявлений у пациентов, улучшения качества их жизни, а также нормализации уровня ФЭ-1 спустя 15 нед. лечения у превалирующего числа больных.
Список литературы / References
Развернуть
- Vujasinovic M, Iglesia D, Dominguez-Muñoz JE, Löhr JM. Recommendations from the European guidelines for the diagnosis and therapy of pancreatic exocrine insufficiency. Pancreatology. 2025;25(3):293–300. doi: 10.1016/j.pan.2025.02.015.
- Domínguez-Muñoz JE, D Hardt P, Lerch MM, Löhr MJ. Potential for Screening for Pancreatic Exocrine Insufficiency Using the Fecal Elastase-1 Test. Dig Dis Sci. 2017;62(5):1119–1130. doi: 10.1007/s10620-017-4524-z.
- Хатьков ИЕ, Маев ИВ, Абдулхаков СР, Алексеенко СА, Алиханов РБ, Бакулин ИГ и др. Профессиональное медицинское сообщество «Панкреатологический клуб». Российский консенсус по экзо- и эндокринной недостаточности поджелудочной железы после хирургического лечения. Терапевтический архив. 2018;90(8):13–26. doi: 10.26442/terarkh201890813-26. / Khatkov IE, Maev IV, Abdulkhakov SR, Alekseenko SA, Alikhanov RB, Bakulin IG et al. Russian consensus on exo- and endocrine pancreatic insufficiency after surgical treatment. Terapevticheskii Arkhiv. 2018;90(8):13–26. (In Russ.) doi: 10.26442/terarkh201890813-26.
- Дубцова ЕА, Винокурова ЛВ, Кузьмина ТН, Малых МВ, Кирюкова МА, Никольская КА, Бордин ДС. Диагностика и коррекция внешнесекреторной недостаточности при заболеваниях поджелудочной железы: методические рекомендации. М.: ГБУЗ МКНЦ им. А.С. Логинова ДЗМ; 2022. 36 с. Режим доступа: https://niioz.ru/.
- Vanga RR, Tansel A, Sidiq S, El-Serag HB, Othman MO. Diagnostic Performance of Measurement of Fecal Elastase-1 in Detection of Exocrine Pancreatic Insufficiency: Systematic Review and Meta-analysis. Clin Gastroenterol Hepatol. 2018;16(8):1220–1228.e4. doi: 10.1016/j.cgh.2018.01.027.
- Tod J, Fine D. Fecal elastase: a useful test for pancreatic insufficiency? Dig Dis Sci. 2010;55(10):2709–2711. doi: 10.1007/s10620-010-1409-9.
- Lam KW, Leeds J. How to manage: patient with a low faecal elastase. Frontline Gastroenterol. 2019;12(1):67–73. doi: 10.1136/flgastro-2018-101171.
- Kunovský L, Dítě P, Jabandžiev P, Eid M, Poredská K, Vaculová J et al. Causes of Exocrine Pancreatic Insufficiency Other Than Chronic Pancreatitis. J Clin Med. 2021;10(24):5779. doi: 10.3390/jcm10245779.
- Smith K, Barnett K, Begley J, Crouch E, Weaver S. PTU-174 Low Faecal Elastase is not always Due to Pancreatic Insufficiency. Gut. 2013;62(Suppl. 1):A119–A120. doi: 10.1136/gutjnl-2013-304907.264.
- Маев ИВ, Кучерявый ЮА, Андреев ДН, Ивашкина НЮ. Синдром избыточного бактериального роста в тонкой кишке: клиническое значение, критерии диагностики и терапевтическая тактика. Инфекционные болезни: новости, мнения, обучение. 2016;(3):118–125. Режим доступа: https://www.elibrary.ru/. / Maev IV, Kucheryavyy YuA, Andreev DN, Ivashkina NYu. Small bowel bacterial overgrowth syndrome: clinical relevance, criteria of diagnostics and therapeutic management. Infectious Diseases: News, Opinions, Training. 2016;(3):118–125. (In Russ.) Available at: https://www.elibrary.ru/.
- Stein J, Jung M, Sziegoleit A, Zeuzem S, Caspary WF, Lembcke B. Immunoreactive elastase I: clinical evaluation of a new noninvasive test of pancreatic function. Clin Chem. 1996;42(2):222–226. Available at: https://pubmed.ncbi.nlm.nih.gov/.
- Chowdhury RS, Forsmark CE. Review article: pancreatic function testing. Aliment Pharmacol Ther. 2003;17(6):733–750. doi: 10.1046/j.1365-2036.2003.01495.x.
- Liu Chen Kiow J, Bellila R, Therrien A, Sidani S, Bouin M. Predictors of Small Intestinal Bacterial Overgrowth in Symptomatic Patients Referred for Breath Testing. J Clin Med Res. 2020;12(10):655–661. doi: 10.14740/jocmr4320.
- Efremova I, Maslennikov R, Poluektova E, Vasilieva E, Zharikov Y, Suslov A et al. Epidemiology of small intestinal bacterial overgrowth. World J Gastroenterol. 2023;29(22):3400–3421. doi: 10.3748/wjg.v29.i22.3400.
- Hou JJ, Wang X, Li Y, Su S, Wang YM, Wang BM. The relationship between gut microbiota and proteolytic activity in irritable bowel syndrome. Microb Pathog. 2021;157:104995. doi: 10.1016/j.micpath.2021.104995.
- Keller J, Layer P. Human pancreatic exocrine response to nutrients in health and disease. Gut. 2005;54(Suppl. 6):vi1–vi28. doi: 10.1136/gut.2005.065946.
- Frost F, Kacprowski T, Rühlemann M, Bülow R, Kühn JP, Franke A et al. Impaired exocrine pancreatic function associates with changes in intestinal microbiota composition and diversity. Gastroenterology. 2019;156(4):1010–1015. doi: 10.1053/j.gastro.2018.10.047.
- Larsen JM. The immune response to Prevotella bacteria in chronic inflammatory disease. Immunology. 2017;151(4):363–374. doi: 10.1111/imm.12760.
- Washio J, Sato T, Koseki T, Takahashi N. Hydrogen sulfide-producing bacteria in tongue biofilm and their relationship with oral malodour. J Med Microbiol. 2005;54(Pt 9):889–895. doi: 10.1099/jmm.0.46118-0.
- Frost F, Weiss FU, Sendler M, Kacprowski T, Rühlemann M, Bang C et al. The Gut Microbiome in Patients With Chronic Pancreatitis Is Characterized by Significant Dysbiosis and Overgrowth by Opportunistic Pathogens. Clin Transl Gastroenterol. 2020;11(9):e00232. doi: 10.14309/ctg.0000000000000232.
Фото:
Shutterstoсk/FOTODOM



 1
1 2
2 3
3 4
4


Комментарии (0)