Журнал "Медицинский совет" №12/2020
DOI: 10.21518/2079-701X-2020-12-36-45
Т.А. Белоусова
М.В. Каиль
Первый Московский государственный медицинский университет им. И.М. Сеченова (Сеченовский Университет); 119991, Россия, Москва, ул. Трубецкая, д. 8, стр. 2
За последнее десятилетие в дерматологической практике отмечается увеличение числа больных, страдающих заболеваниями кожи и подкожной клетчатки. Ежегодно регистрируется 6,4–6,9 млн новых случаев заболеваний этой группы, что побуждает к постоянному поиску новых лекарственных средств и постоянному совершенствованию методик и схем применения апробированных лекарственных препаратов. Топические глюкокортикостероиды, несмотря на более чем 65-летнюю историю применения в терапии больных стероидчувствительными дерматозами, не потеряли своего актуального значения. На сегодняшний момент им не существует терапевтической альтернативы по скорости наступления и активности противовоспалительного действия, поэтому они незаменимы в лечении многих кожных патологий. Одной из тенденций современной фармакологии является не столько получение новых активных молекул ТКГС или их модификаций, сколько создание новых фармакологических форм известных молекул – микронизованных, нанонизованных, которые придают лекарственному веществу важнейшее свойство – повышение биодоступности. Эта передовая технология активно используется в производстве отечественных топических препаратов линии Акридерм, которые вносят большой вклад в программу импортозамещения и доступности лекарственных средств для населения. Оптимальное сочетание ингредиентов основы этих препаратов дополняет и потенцирует лечебное действие стероида. Более 30 лет в клинической практике используется комбинация, содержащая 0,05% бетаметазона дипропионата, 0,1% гентамицина сульфата и 1% клотримазола (Тридерм, Акридерм ГК). Многолетний положительный клинический опыт использования дерматологами этой фиксированной комбинации доказывает обоснованность использования ее во многих клинических ситуациях при присоединении бактериально-грибковой инфекции. Проведенное отечественными дерматологами открытое рандомизированное сравнительное исследование по изучению эффективности и безопасности препарата Акридерм ГК (крем) и препарата Тридерм (крем) в комплексной терапии экземы показало схожие профили высокой клинической эффективности и безопасности обоих препаратов.
Для цитирования: Белоусова Т.А., Каиль М.В. Терапевтические возможности наружных глюкокортикостероидов в современной клинической практике. Медицинский совет. 2020;(12):36–45. doi: 10.21518/2079-701X-2020-12-36-45.
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Therapeutic possibilities of topical corticosteroids in modern clinical practice
Tatyana A. Belousova
Mariya V. Kail
Sechenov First Moscow State Medical University (Sechenov University); 8, Bldg. 2, Trubetskaya St., Moscow, 119991, Russia
Over the past decade, dermatological practice has seen an increase in the number of patients suffering from skin and subcutaneous tissue diseases. Annually, 6.4–6.9 million new cases of this group of diseases are registered, which encourages the constant search for new drugs and the continuous improvement of methods and schemes of application of proven drugs. Topical corticosteroids, despite more than 65 years of history of use in the treatment of patients with steroid-sensitive dermatoses, have not lost their relevance. At present, they have no therapeutic alternative in terms of speed of onset and anti-inflammatory activity, so they are essential in the treatment of many skin pathologies. One of the trends in modern pharmacology is not so much the production of new active molecules of TCS or their modifications, as the creation of new pharmacological forms of known molecules – micronized, nanonized, which give the drug the most important property – increased bioavailability. This advanced technology is actively used in the production of domestic topical drugs of Akriderm lines, which make a major contribution to the program of import substitution and drug availability for the population. The optimal combination of ingredients of the foundation of these drugs complements and potentiates the therapeutic effect of steroid. For more than 30 years in clinical practice, a combination of 0.05% betamethasone dipropionate, 0.1% gentamicin sulfate and 1% clotrimazole (Triderm, Akriderm GK) is used. Many years of positive clinical experience of dermatologists using this fixed combination proves the validity of its use in many clinical situations when bacterial and fungal infection is involved. An open randomized comparative study conducted by Russian dermatologists on the efficacy and safety of Akriderm GK (cream) and Triderm (cream) in the complex treatment of eczema showed similar profiles of high clinical efficacy and safety of both drugs.
For citation: Belousova T.A., Kail M.V. Therapeutic possibilities of topical corticosteroids in modern clinical practice. Meditsinskiy sovet = Medical Council. 2020;(12):36–45. (In Russ.) doi: 10.21518/2079-701X-2020-12-36-45.
Conflict of interest: the authors declare no conflict of interest.
ВВЕДЕНИЕ
Кожные нарушения, благодаря возможности визуального контроля кожного покрова, являются одной из самых частых причин обращаемости к врачу. Кожа тесно взаимодействует путем нейроиммуногуморальных связей с внутренними органами и системами организма и является своего рода проекционным экраном к распознаванию системных патологий и генетических нарушений. За последнее десятилетие в дерматологической практике отмечается увеличение числа больных, страдающих заболеваниями кожи и подкожной клетчатки. Ежегодно регистрируется 6,4–6,9 млн новых случаев заболеваний этой группы. Общая заболеваемость за 2000–2010 гг. увеличилась на 11,6% на 100 000 населения, в 2014 г. она составила 6,107,4 на 100 000 населения. По данным статистики, большая часть новых больных приходится на атопический дерматит и псориаз. Данная тенденция ставит перед практической дерматологией непростые проблемы постоянного поиска новых и модификацию применяемых лекарственных средств, постоянного совершенствования методик и схем применения апробированных лекарственных препаратов [1].
Уникальность кожи как органа состоит в том, что она доступна к непосредственному нанесению лекарственных средств. Наружная терапия позволяет получить достаточно быстрый и выраженный терапевтический эффект у подавляющего числа пациентов. Поэтому местное лечение играет важную, а порой и приоритетную роль в купировании клинических симптомов кожных заболеваний. Базовые принципы рациональной местной терапии включают в себя адекватный выбор лекарственного препарата, его концентрации, лекарственной формы (мазь, крем, лосьон), способа нанесения, кратности дозирования, длительность применения для получения терапевтического эффекта и минимизации побочных действий. Терапевтическая эффективность местного препарата зависит не только от степени его активности, но и способности проникать через кожу. Пенетрация лекарств варьирует от состояния рогового слоя, который имеет разную толщину в разных топографических зонах кожи. Кожа лица, особенно век, складок, половых органов, имеет минимальную толщину рогового слоя, поэтому пенетрация лекарственного вещества в этих зонах самая большая. В то же время кожа ладоней и подошв имеет наименьшую проницаемость для наружных медикаментов. Важно учитывать изменение барьерных свойств кожи при патологических состояниях. Экскориированная или экзематизированная кожа имеет ослабленные барьерные функции, что приводит к более активной пенетрации местных препаратов. Волосистые участки кожного покрова более проницаемы для лекарственных веществ по сравнению с участками без волос, т. к. лекарственные вещества активно проникают в кожу через волосяные фолликулы. Возрастные факторы также влияют на скорость проникновения лекарств в кожу. У пожилых пациентов кожа, несмотря на более тонкий роговой слой, слабо гидратирована, имеет меньше волосяных фолликулов и, следовательно, проникновение лекарственных препаратов может быть замедленным [2].
В последнее время использование многокомпонентных составов в лечении дерматологических больных, приготовленных в рецептурных отделах аптек, значительно уменьшилось. Это стало возможным благодаря появлению большого спектра галеновых (готовых) препаратов, которые по своей эффективности значительно превосходят классические дерматологические прописи, приготовленные в аптечных условиях. Кроме того, традиционно используемые в местном лечении дерматозов классические лекарственные формы и средства имеют целый ряд недостатков. Большинство классических растворов, паст, мазей имеют резкий и неприятный запах, пачкают и окрашивают белье и одежду, что ограничивает их применение в амбулаторной практике. Действие примочек, паст, мазей развивается относительно медленно, требует госпитализации больных и проведения длительного поэтапного лечения. В современной клинической практике значительно возросли требования пациентов к лекарственным препаратам. Препарат должен обладать активным противовоспалительным действием, хорошо переноситься, иметь высокий профиль безопасности, обладать пролонгированным действием, не требующим многократного применения, быть эстетически привлекательным и не ограничивать привычный образ жизни. Во многом эти задачи были решены благодаря введению в клиническую практику наружных кортикостероидных препаратов [3].
ТОПИЧЕСКИЕ ГЛЮКОКОРТИКОСТЕРОИДЫ В НАРУЖНОЙ ТЕРАПИИ ДЕРМАТОЗОВ
Внедрение топических глюкокортикостероидов (ТГКС) в начале 1950-х гг. прошлого века стало большим шагом вперед в лечении дерматологических больных, которые и до настоящего времени активно используются в клинической практике. На сегодняшней момент им не существует терапевтической альтернативы по скорости наступления и активности противовоспалительного действия. Благодаря высокой эффективности они незаменимы в лечении многих кожных патологий – от банальных дерматитов до угрожающих жизни буллезных дерматозов. Активное клиническое использование топических ГКС объясняется их высокой противовоспалительной, противоаллергической, иммуносупрессивной активностью, а также сосудосуживающим и антимикотическим эффектом, и они по-прежнему остаются основной патогенетической терапией для множества иммунозависимых дерматозов [4].
История создания ТГКС начинается с 1952 г., когда M. Sultzberger и V. Witten впервые применили гидрокортизон в дерматологии. Интенсивные исследования в течение последующих десятилетий в области сверхтонкой органической химии по индукции двойных связей, присоединению эфиров и остатков высших кислот, галогенизации и циклизации ТГКС привели к созданию и идентификации различных стероидов со свойствами, намного превосходящими первое поколение ТГКС. В 1960 г. появились ТГКС второго поколения – триамцинолона ацетонид, флуметазона пивалат, фторадренолон. В 1962 г. появились ТГКС третьего поколения: бетаметазона валерат и флуоцинолон. Следует отметить, что для галогенизированных ТГКС ранних поколений была присуща одна негативная особенность: их высокая эффективность сочеталась с высокой частотой побочных эффектов, как местных, так и системных. В конце 60-х были созданы сильные негалогенизированные ТГКС, в частности гидрокортизона 17-бутират. Эти препараты характеризовались улучшенным профилем безопасности. В 70–80 гг. ХХ в. был начат поиск новых ТГКС, которые могли бы обеспечить быстрое и эффективное лечение резистентных дерматозов (псориаз, атопический дерматит, нейродермит) и которые обладали бы при этом адекватным профилем переносимости и безопасности. Так появилось пятое поколение ТГКС, среди которых бетаметазон дипропионат, клобетазол пропионат – представители класса очень сильных ТГКС. Однако к этому времени накопилось достаточно большое количество сведений о побочных эффектах этих препаратов, что явилось основанием к ограниченному и осторожному их использованию среди врачей и развитию «стероидной фобии» у пациентов. Это побудило фармацевтические компании к созданию топических стероидов с улучшенным профилем безопасности при сохранении высокой эффективности за счет оптимизации фармакокинетических свойств, биотрансформации (например, принцип пролекарства), совершенствования основ лекарственных форм, что и было воплощено в препаратах последнего, шестого поколения. Конец 80–90 гг. ознаменовался появлением ТГКС последнего, шестого поколения (мометазона фуроат, метилпреднизолона ацепонат, предникарбаты, карбоксилаты и карботиоаты). Эти средства характеризуются наилучшим соотношением эффективности и безопасности, высоким терапевтическим индексом (соотношение желаемых и побочных эффектов) и возможностью успешного применения как у взрослых, так и у детей [5, 6].
По мере развития наукоемких технологий производство наружных лекарственных препаратов постоянно совершенствуется. Одной из тенденций современной фармакологии является не столько получение новых активных молекул ТГКС или их модификаций, сколько создание новых фармакологических форм известных молекул – микронизованных, нанонизованных, в виде МЧ, НЧ или «троянских» частиц, которые придают лекарственному веществу важнейшее свойство – повышение биодоступности.
Создание новых лекарственных форм стало возможным благодаря развитию фармацевтической порошковой технологии, которая связана с исследованиями в области химии и строения поверхности частиц. В рамках этой технологии разрабатываются и совершенствуются процессы создания частиц с заданными свойствами, таких как форма, размер, адгезивность, морфология, шероховатость, смачиваемость, плотность, пластичность, твердость, хрупкость и гигроскопичность. Уменьшение размеров частиц активного ингредиента увеличивает соотношение между площадью поверхности и объемом, при этом лекарственное средство лучше растворяется в носителе. Этим объясняется повышенная абсорбция микронизированных препаратов. Микронизация ГКС, введение ГКС в «троянские» микрочастицы значительно меняют биологическую и терапевтическую активность ТГКС, повышают эффективность, снижают формирование побочных эффектов, пролонгируют действие ТГКС. Микронизованные и нанонизированные ТГКС являются новым поколением топических иммуносупрессорных препаратов. Эта передовая технология активно используется в производстве отечественных топических препаратов линий Акридерм и Комфодерм, которые вносят большой вклад в программу импортозамещения и доступности лекарственных средств для населения [7, 8].
ВЛИЯНИЕ ОСНОВЫ ТОПИЧЕСКИХ ГЛЮКОКОРТИКОСТЕРОИДОВ НА ЭФФЕКТИВНОСТЬ НАРУЖНОЙ ТЕРАПИИ
Хорошо известно, что рационально подобранная основа наружного препарата способствует увеличению его терапевтической эффективности. Она сама способна оказывать воздействие на течение воспалительного процесса, способствует доставке активного лекарственного вещества к месту его непосредственного действия и отвечает за стабильность препарата в процессе хранения. Величина чрескожной абсорбции разных форм одного и того же ТГКС может различаться в десятки раз, и на этом основании лекарственные формы одного и того же стероида могут находиться в разных классах по фармакологической активности.
Создание новых молекул ТГКС и придание им заданных свойств сочеталось с постоянным усовершенствованием основ этих препаратов с оптимальным составом компонентов, улучшающих их механизм действия. Изготовление лекарств в условиях современных фармацевтических производств позволило пополнить состав форм многими новыми компонентами. Современные основы кремов и мазей ТГКС, помимо традиционных жировых и жироподобных веществ (ланолин, вазелин, воск, растительные и минеральные масла), включают в себя и синтетические компоненты. К ним в первую очередь относятся полиэтиленгликоли, производные целлюлозы, фосфолипиды и др. Это позволило оптимизировать физико-химическое действие препаратов, улучшить пенетрацию действующего вещества с возможностью его проникновения в более глубокие слои кожи, а также увеличить сроки хранения препаратов. Помимо этого, при производстве ТГКС особое внимание уделялось выбору минимального количества активных ингредиентов основы для предотвращения возможной сенсибилизации. Синтетические основы хорошо переносятся кожей, легко наносятся на ее поверхность, быстро впитываются, хорошо эмульгируются, препятствуют испарению влаги. Улучшение органолептических и косметологических свойств основ ТГКС сделало их более удобными в применении по сравнению с классическими прописями, что оказало существенное влияние на приверженность пациента к назначаемому лечению [9].
Топические ГКС производятся в различных лекарственных формах: крем, мазь, лосьон, гель, аэрозоль. Набольшую востребованность в клинической практике имеют две «классические» лекарственные формы: крем и мазь. Мазь является формой выбора при хронических дерматозах, сопровождающихся выраженной сухостью, шелушением, инфильтрацией, лихенификацией, гиперкератозом. Их основы составляют в основном жиры и жироподобные вещества, препятствующие испарению воды, оказывающие окклюзионный эффект и способствующие глубокому проникновению действующих веществ в глубь кожи. Крем имеет эмульсионную структуру по типу «масло в воде» или «вода в масле», состоящую из жировых компонентов, смешанных с водой в соотношении 2:1 и менее. Вода, испаряясь с поверхности кожи, вызывает сужение кровеносных сосудов, обуславливая противовоспалительный, охлаждающий и подсушивающий эффект. Это лекарственная форма по физико-химическим свойствам более всего напоминает естественную гидролипидную мантию поверхности кожи, хорошо впитывается, не оставляя жирного блеска, не пачкает одежду, что оправдывает ее частое назначение в клинической практике. Крем показан при острых, а том числе экссудативных и мокнущих процессах. Основа современных ТГКС-кремов включают большое разнообразие компонентов, и они могут значительно варьировать в зависимости от фирмы производителя. Для усиления проникновения молекулы ТГКС в глубь кожи используются различные веществапроводники: пропиленгликоль, кератолитики. Салициловая кислота входит в состав препаратов Акридерм СК, мочевина – в Комфодерм М2. В большинстве существующих на рынке препаратов эту роль выполняет пропиленгликоль. По химической структуре он представляет собой двухатомный спирт, нетоксичен. Используется как гигроскопическое вещество (увлажнитель), растворитель, стабилизатор и консерватор. Кроме того, весьма полезными являются его бактерицидные свойства, что позволяет минимизировать количественный состав ингредиентов основы. В последнее время особое внимание уделяется основам, состав которых поддерживает кислотность поверхности кожи. Снижение защитных свойств кожи, активация бактериальной и грибковой флоры ограничивает длительное применение ТГКС. Включение в рецептуру основ буферных систем является одним из способов поддержать кислотность средства и обеспечить слабокислый pH кожи. Кислая среда также необходима для более активного высвобождения стероида и его активного проникновения в кожу [10]. В качестве примера можно привести рационально подобранный состав основы кремов Акридерм. Она содержит твердые и жидкие минеральные жировые ингредиенты: вазелин, парафин, вазелиновое масло, воск, нипагин (метиловый эфир параоксибензойной кислоты) с антимикробным и антисептическим эффектом и пропиленгликоль, потенцирующий действие ТГКС и усиливающий антимикробный эффект нипагина, натрия сульфита гептагидрата в качестве буферной системы для поддержания кислотности среды, и динатрия эдетат (трилон Б) для смягчения входящей в крем воды и улучшения впитываемости крема, а также и для увеличения срока годности препарата вследствие его консервирующих свойств. Оптимальное сочетание состава ингредиентов основы дополняет и потенцирует лечебное действие ТГКС.
ПРОБЛЕМА ВЫБОРА ТОПИЧЕСКИХ ГЛЮКОКОРТИКОСТЕРОИДОВ
Широкий спектр ТГКС, используемый в современной дерматологической практике, существенно облегчает работу врача и позволяет обеспечить более высокое качество жизни нашим пациентам. Обладая высокой терапевтической активностью, они быстро купируют островоспалительные явления и зуд, облегчая состояние пациента, что послужило основанием называть их средствами «скорой помощи». Перед врачом всегда стоит проблема выбора конкретного топического стероида и оптимальной лекарственной формы при лечении того или иного пациента. Назначая тот или иной глюкокортикоид, врач одновременно учитывает множество факторов: характер заболевания, локализацию кожного процесса, возраст пациента, предполагаемую длительность терапии, возможность сочетания с другими методами терапии и, что немаловажно, курсовую стоимость лечения. Дерматолог должен быть хорошо осведомлен о химической структуре назначаемого ТГКС, его потенциальной активности и фармакокинетике, наличии лекарственных форм, режиме применения, возможных побочных эффектах, т.е. безопасности [11].
Решению этой проблемы во многом может способствовать рациональная классификация ТГКС. Во всех классификациях ТГКС принято разделять на несколько групп в зависимости от силы местного противовоспалительного действия. Стандартным тестом на выраженность противовоспалительной активности является сосудосуживающий эффект.
Согласно классификации Всемирной организации здравоохранения топические кортикостероиды подразделяются на 7 классов: I класс включает самые сильные стероиды, VII класс – самые слабые (табл.).
Таблица. Классификация топических ГКС
| Класс I (очень сильные) | Клобетазола пропионат 0,05% мазь, крем Бетаметазона дипропионат 0,05% мазь, крем |
| Класс II (cильные) | Мометазона фуроат 0,1% мазь Триамцинолона ацетонид 0,5% мазь |
| Класс III (сильные) | Бетаметазона валерат 0,01% мазь Флутиказона пропионат 0,005% мазь |
| Класс IV (средней силы) | Флуоцинолона ацетонид 0,025% мазь Мометазона фуроат 0,1% крем, лосьон Триамцинолона ацетонид 0,1% мазь Метилпреднизолона ацепонат 0,1% крем, мазь, эмульсия |
| Класс V (средней силы) | Гидрокортизона 17-бутират 0,1% крем, мазь Бетаметазона валерат 0,01% крем Флуоцинолона ацетонид 0,025% крем, гель |
| Класс VI (средней силы) | Флутиказона пропионат 0,005% крем Алклометазона дипропионат 0,05% крем, мазь |
| Класс VII (слабые) | Гидрокортизон 0,5%, 1%, 2,5% мазь Флуметазона пивалат 0,02% крем, мазь |
Более 30 лет в клинической практике активно используется комбинированная кортикостероидная терапия, когда в составе одного и того же лекарственного препарата, наряду со стероидом, содержатся другие активные вещества с иным механизмом действия. Наиболее востребованной является комбинация, содержащая 0,05% бетаметазона дипропионата – топического кортикостероида, относящегося к классу сильных ТГКС, 0,1% гентамицина сульфата – антибиотика, обладающего широким спектром антимикробного действия в отношении грамположительных и грамотрицательных бактерий, и 1% клотримазола – антимикотика, эффективного в отношении дерматофитов, кандид и Malassezia spp. (например, Акридерм ГК). Многолетний положительный клинический опыт использования дерматологами фиксированных комбинаций топических препаратов доказывает обоснованность их использования во многих клинических ситуаций [12–14].
В реальной клинической практике больной с аллергодерматозами обращается к врачу в среднем на 5–7-й день заболевания, т. е. в период уже начавшихся бактериальных осложнений. В связи с этим оптимальным терапевтическим решением является назначение комбинированных топических средств. Применение наружных комбинированных ГКС, воздействующих на широкий спектр патогенных микроорганизмов, позволяет быстро подавить инфекционный процесс и преодолеть резистентность к ГКС, обусловленную суперантигенами S. aureus и других патогенов. Было показано, что в настоящее время не менее 46% кожных стафилококков (в основном S. aureus), высеянных у дерматологических больных, чувствительно к гентамицину, а устойчиво к нему менее трети от выделенных штаммов. При этом возрастает приверженность пациентов к терапии из-за упрощенной схемы применения (меньшее количество используемых одновременно препаратов), уменьшаются финансовые затраты на лечение [15, 16].
В условиях дерматологического приема врачи часто используют эту комбинацию для эмпирической терапии, пробного или стартового лечения, в том случае когда возникают сложности с дифференциальной диагностикой воспалительных и инфицированных дерматозов и проводить исследования по выявлению этиологии инфекции в большинстве случаев не представляется возможным. Значительную часть показаний к назначению комбинированных кортикостероидов составляют дерматозы сочетанной этиологии, составляющие 56% среди хронических дерматозов [17, 18].
В начале комбинированные стероиды поставлялись к нам из-за рубежа, однако в последнее 15 лет отечественная фарминдустрия выпустила ряд удачных воспроизведенных комбинаций: Акридерм СК, Акридерм Гента, Акридерм ГК в форме крема и мази. Перед практическим врачом всегда встает дилемма: какой препарат назначить – оригинальный или генерический. Для решения этой задачи дерматолог прежде всего опирается на собственный клинический опыт, на мнение коллег, а также экспертов, отраженных в клинических рекомендациях и научных публикациях. Клинической оценке эффективности и безопасности отечественных комбинированных стероидов линии Акридерм посвящено большое количество публикаций. На большом клиническом материале в различных дерматологических учреждениях у больных со стероидчувствительными дерматозами, осложненными вторичной бактериальной и/или грибковой инфекциями, была показана их высокая терапевтическая эффективность, достигающая 98% при практическом отсутствии побочных эффектов [19–24].
В 2019 г. впервые было проведено открытое рандомизированное сравнительное исследование по изучению эффективности и безопасности препарата Акридерм ГК (крем) и препарата Тридерм (крем) в комплексной терапии экземы на трех клинических базах Московского научно-практического центра дерматологии и косметологии Департамента здравоохранения г. Москвы. Сравнительная оценка эффективности и безопасности терапии препаратом Акридерм ГК (крем), по сравнению с препаратом Тридерм (крем) для наружного применения, выполнялась согласно критериям GMP на достаточной выборке двух репрезентативных групп пациентов с использованием наиболее значимых дерматологических шкал и индексов (IGA, EASI и POEM) и современных методов статистического анализа. Анализ полученных данных показал схожие профили высокой клинической эффективности и безопасности обоих препаратов [25].
В клинике кожных болезней ПМГМУ им И.М. Сеченова в рамках программы импортозамещения на протяжения последних лет препараты линии Акридерм активно используются в терапии стероидчувсвительных дерматозов, оказывая реальную помощь пациентам с острыми и хроническими дерматозами, в т. ч. и сочетанными с бактериально-грибковой инфекцией. Эти лекарственные средства хорошо сочетаются со всеми видами системной фармакотерапии, применяемой в клинике, а также с методами физиотерапевтического лечения: фототерапией, лазеротерапией, электротерапией, озонотерапией. При распространенных и тяжелых случаях дерматозов топические стероиды в виде адъювантного терапевтического воздействия активно дополняют системные и физиотерапевтические методы лечения.
В качестве иллюстрации приводим собственные клинические наблюдения применения крема Акридерм ГК у больных экземой.
КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ №1
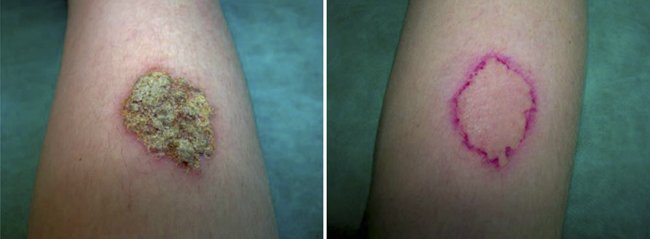
Пациент 25 лет, по профессии строитель. Болен 3 нед. Заболевание началось после производственной травмы предплечья. Больной самостоятельно обрабатывал рану перекисью водорода, смазывал мазью «Спасатель». Раневой дефект не заживал, стал гноиться. Кожа вокруг раны покраснела, появился зуд. Больной был консультирован хирургом, который рекомендовал Фукорцин и мазь Левомеколь. После применения рекомендованных препаратов гнойные выделения несколько уменьшились, однако резко усилился зуд, покраснение, появилась отечность кожи и мелкие пузырьки сначала с прозрачным, а затем с гнойным содержимым по периферии очага. Больной был направлен на консультацию в клинику кожных болезней ПМГМУ им. И.М. Сеченова. При осмотре: на правом предплечье очаг округлых очертаний, с резкими границами размером 4 × 5 см. Центральная часть его была представлена наслоением массивных толстых гнойных корок, при дотрагивании до которых выделялся гной, а периферическая зона – каемкой гиперемированной отечной кожи. Субъективно умеренный зуд (рис. 1). По поводу острой микробной экземы пациенту было рекомендовано применение крема Акридерм ГК 2 раза в день в виде монотерапии. После назначения препарата на 3-й день терапии прекратился зуд, стала регрессировать гиперемия и отечность по периферии очага, прекратилось гноетечение и образование корок. На 5-й день лечения стали отпадать корки. На 10-е сут. применения препарата регрессировала гиперемия, очаг полностью очис тился от гнойных корок (рис. 2).
Рисунок 1. Микробная экзема до лечения
Рисунок 2. Микробная экзема после 10 дней лечения кремом Акридерм ГК
КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ №2
Больной 56 лет, художник, страдает экземой кистей в течение 2 лет. Периодически отмечал небольшое покраснение и зуд кожи кистей, преимущественно правой, после контакта с красками и лаками. В течение года лечился самостоятельно различными косметическими кремами для рук с временным эффектом. Консультирован дерматологом в частной клинике, где был выставлен диагноз «экзема кистей». Было рекомендовано избегать контактов с раздражающими веществами, при обострении использовать крем Адвантан. Последнее обострение возникло 5 дней назад после контакта с растворителем. На тыле правой кисти, на резко гиперемированной отечной коже проявлялись пузырьки, сопровождающиеся сильным зудом. Вследствие расчесов пузырьки вскрывались и покрывались буровато-желтыми влажными корками, при нажатии на них отмечалась болезненность и выделялся гной. Пациент самостоятельно смазывал очаги мазью Левомеколь, которую в прошлом неоднократно применял при травмах и порезах, однако эффекта от лечения не отмечалось. В связи с этим обратился на консультацию в клинику кожных болезней ПМГМУ им. И.М. Сеченова.
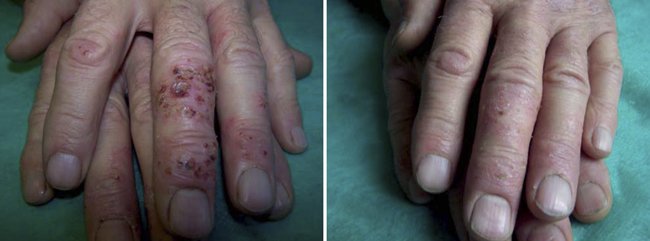
При осмотре: на тыльной поверхности кистей, преимущественно правой, отмечалась слабая эритема, выраженная сухость кожи, местами шелушение. В области тыльной поверхности фаланг 2, 3 и 4 пальцев правой кисти на фоне гиперемированной кожи наблюдалось обильное наслоение гнойно-кровянистых корок, при дотрагивании на них возникала резкая болезненность (рис. 3). Пациенту по поводу обострения хронической экземы, осложненной бактериальной инфекцией, было рекомендовано применение крема Акридерм ГК 2 раза в день в сочетании с Тавегилом по 1 мг 2 раза в день. Эффект от применения крема был заметен уже на 2-е сут.: значительно уменьшилась гиперемия, прекратилось выделение гноя. На 4-й день стали разрыхляться и частично отпадать корки, исчезла болезненность. На 8-е сут. у больного окончательно регрессировали явления гнойного воспаления кожи, очаги полностью очистились от гнойных корок, прекратился зуд (рис. 4).
Рисунок 3. Обострение хронической экземы, осложненной бактериальной инфекцией
Рисунок 4. Обострение хронической экземы, осложненной бактериальной инфекцией, на 8-й день лечения кремом Акридерм ГК
КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ №3
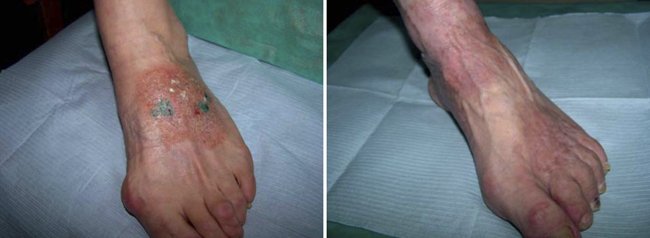
Больной 67 лет, пенсионер. В течение многих лет страдает микозом стоп. Лечился в ряде медицинских учреждений г. Москвы и в частных клиниках, где ему назначались различные мази, аппаратные чистки ногтей и кожи стоп, курсы системных антимикотиков, однако лечился не регулярно. Месяц назад стал отмечать периодическое покраснение кожи правой стопы с переходом на голень, сопровождающееся зудом. Использование противогрибковой мази Фунготербин и мытье вызывало усиление зуда и покраснение кожи. Обратился на консультацию в клинику кожных болезней ПМГМУ им. И.М. Сеченова. При осмотре: на коже правой стопы имеется очаг округлых очертаний с четкими границами размером 7,5 х 6 см, в пределах которого кожа ярко гиперемирована и отечна. На этом фоне видны микровезикулы, местами вскрывшиеся и превратившиеся в эрозии, покрытые серовато-желтыми и геморрогическими корочками. Ногтевые пластинки 1, 3, 4, 5 пальцев утолщены, грязно-желтого цвета, деформированы. Субъективно сильный зуд (рис. 5). Больному был выставлен диагноз «острая микробная экзема» и назначен Эриус 5 мг утром и супрастин 0,25 мг на ночь. Местно Акридерм ГК 2 раза в день. Через 3 дня значительно уменьшились гиперемия и отечность кожи, прекратилось появление новых микровезикул, уменьшился зуд. Через 10 дней очаг полностью очистился от корок, исчезла отечность и почти полностью прекратился зуд (рис. 6). Было рекомендовано продолжить местную терапию Акридермом ГК в связи с остаточной эритемой и зудом еще в течение 7 дней.
Рисунок 5. Микотическая экзема до лечения
Рисунок 6. Микотическая экзема на 10-й день лечения кремом Акридерм ГК
ЗАКЛЮЧЕНИЕ
Топические глюкокортикостероиды, несмотря на длительную, более чем 65-летнюю историю использования в терапии больных стероидчувствительными дерматозами, не потеряли своего актуального значения, прежде всего как препараты «скорой помощи» в купировании обострений многих дерматозов. Одной из тенденций современной фармакологии является не столько получение новых активных молекул ТГКС или их модификаций, сколько создание новых фармакологических форм известных молекул – микронизованных, нанонизованных, в виде МЧ, НЧ или «троянских» частиц, которые придают лекарственному веществу важнейшее свойство, – повышение биодоступности. Эта передовая технология активно используется в производстве отечественных топических препаратов линий Акридерм и Комфодерм, которые вносят большой вклад в программу импортозамещения и доступности лекарственных средств для населения. На большом клиническом материале в различных дерматологических учреждениях у больных со стероидчувствительными дерматозами, осложненными вторичной бактериальной и/или грибковой инфекциями, была показана высокая клиническая эффективность препарата Акридерм ГК. Выраженный клинический эффект был достигнут благодаря повышению биодоступности стероида и удачным сочетанием ингредиентов в его основе, потенцирующих действие стероида.
Более 30 лет в клинической практике активно используется комбинированная кортикостероидная терапия, когда в составе одного и того же лекарственного препарата, наряду со стероидом, содержатся другие активные вещества с иным механизмом действия. Наиболее востребованной является комбинация, содержащая 0,05% бетаметазона дипропионата, 0,1% гентамицина сульфата и 1% клотримазола (Тридерм, Акридерм ГК). Открытое рандомизированное сравнительное исследование по изучению эффективности и безопасности препарата Акридерм ГК (крем) и препарата Тридерм (крем) в комплексной терапии экземы показало схожие профили высокой клинической эффективности и безопасности обоих препаратов.
Многолетний положительный клинический опыт использования дерматологами фиксированных комбинаций топических препаратов доказывает обоснованность их использования во многих клинических ситуациях. Недавно проведенные исследования патогенеза иммунозависимых дерматозов показали, что Staphylococcus aureus, Candida albicans и Malassezia spp. не только вызывают инфекции кожи, но и принимают непосредственное участие в возникновении, развитии и поддержании иммунного воспаления у больных атопическим дерматитом и экземой. Сокращение популяции патогенных микроорганизмов на коже приводит к подавлению ведущего воспалительного триггера хронических дерматозов, что благоприятно сказывается на течении заболевания, уменьшая количество рецидивов и удлиняя период ремиссий.
Список литературы / References
- Померанцев О.Н., Потекаев Н.Н. Заболеваемость болезнями кожи и подкожной клетчатки как медико-социальная проблема. Клиническая дерматололгия и венерология. 2013;(6):4–6. Режим доступа: https://www.mediasphera.ru/. / Pomerantsev O.N., Potekaev N.N. The incidence of skin and subcutaneous fat diseases as a sociomedical problem. Klinicheskaya dermatologiya i venerologiya = Russian Journal of Clinical Dermatology and Venerology. 2013;(6):4–
6. (In Russ.) Available at: https://www.mediasphera.ru/. - Вольф К., Голдсмит Л.А., Кац С.А., Джилкрест Б.А., Паллер Э.С., Леффель Д.Дж. и др. Дерматология Фицпатрика в клинической практике. М.: БИНОМ; 2013. Т. 3, с. 2279–2285. / Wolff K., Goldsmith L.A., Katz S.I., Gilchrest B.A., Paller A.S., Leffell D.J. et al. Fitzpatrick’s Dermatology in General Medicine. 7th ed. New York: McGraw-Hill; 2008.
- Аковбян В.А. Композиционные препараты для наружного лечения: преимущества очевидны. Клиническая дерматология и венерология. 2003;1(4):50–53. / Akovbyan VA. Compositional preparations for external treat-ment: the advantages are obvious. Klinicheskaya dermatologiya i venerologiya = Russian Journal of Clinical Dermatology and Venerology. 2003;1(4):50–53. (In Russ.)
- Schäfer-Korting M., Kleuser B., Ahmed M., Höltje H.D., Korting H.C. Glucocorticoids for human skin: new aspects of mechanism of acfction. Skin Parmacol Physiol. 2005;18:103–114. doi: 10.1159/000084907.
- Клейменова И.А., Есенин С.А. История создания и совершенствования топических стероидов. Дерматология. Приложение к журналу Concilium Medicum. 2011;(3):14–16. Режим доступа: https://www.elibrary.ru/. / Kleymenova I.A., Esenin S.A. History of creation and improvement of topical steroids. Dermatologiya. Prilozhenie k zhurnalu Concilium Medicum = Dermatology. Appendix to the Journal Concilium Medicum. 2011;(3):14–16. (In Russ.) Available at: https://www.elibrary.ru/.
- Tadicherla S., Ross K., Shenefelt P.D., Fenske N.A. Topical corticosteroids in dermatology. J Drugs Dermatol. 2009;8(12):1093–1105. Available at: https://pubmed.ncbi.nlm.nih.gov/.
- Матушевская Е.В., Свирщевская Е.В. Технологии микронизации лекарственных препаратов: новые возможности топических глюкокортикостероидов в дерматологии. Клиническая дерматология и венерология. 2017;(1):43–48. doi: 10.17116/klinderma201716143-48. / Matushevskaya E.V., Svirshchevskaya E.V. Drug micronization technique: new possibilities of topical corticosteroids in dermatology. Klinicheskaya dermatologiya i venerologiya = Russian Journal of Clinical Dermatology and Venerology. 2017;1:43–48. (In Russ.) doi: 10.17116/klinderma201716143-48.
- Устинов М.В., Чаплыгин А.В Микронизация и другие способы повышения эффективности и безопасности топических препаратов в дерматологии. Клиническая дерматология и венерология. 2019;18(4):418–426. doi: 10.17116/klinderma201918041418. / Ustinov M.V., Chaplygin A.V. Micronization and other ways to improve the efficiency and safety of topical drugs in dermatology. Klinicheskaya dermatologiya i venerologiya = Russian Journal of Clinical Dermatology and Venerology. 2019;18(4):418–426. (In Russ.) doi: 10.17116/klinderma201918041418.
- Кочергин Н.Г., Петрунин Д.Д. Современный взгляд на проблему выбора лекарственной формы средств наружной терапии. Клиническая дерматология и венерология. 2011;9(6):84–92. Режим доступа: https://www.elibrary.ru/. / Kochergin N.G., Petrunin D.D. The current view on the problem of the choice of medications for external therapy. Klinicheskaya dermatologiya i
venerologiya = Russian Journal of Clinical Dermatology and Venerology. 2011;9(6):84–92. (In Russ.) Available at: https://www.elibrary.ru/. - Аравийская Е.Р., Соколовский Е.В., Бахтина С.М., Пчелинцев М.В. Роль основы в глюкокортикоидных препаратах: оптимальный состав и механизм действия. Вестник дерматологии и венерологии. 2010;(2):64–70. Режим доступа: https://www.elibrary.ru/. / Aravijskaya E.R., Sokolovsky E.V., Bakhtina S.M., Pchelintsev M.V. Role of vehicle in topical steroids: optimal composition and mode of action. Vestnik dermatologii i venerologii = Herald of Dermatology and Venereology. 2010;(2):64–70. Available at: https://www.elibrary.ru/.
- Brazzini B., Pimpinelli N. New and established corticosteroids in dermatology:clinical pharmacology and therapeutic use. Am J Clin Dermatol. 2002;3(1):47–58. doi: 10.2165/00128071-200203010-00005.
- Williams R.E. The Antibacterial-Corticosteroid Combination. What is its role in atopic dermatitis? Am J Clin Dermatol. 2000;1(4):211–215. doi: 10.2165/00128071-200001040-00002.
- Львов А.Н. Пропедевтические основы комбинированной наружной терапии при дерматозах сочетанной этиологии. Клиническая дерматология и венерология. 2016;(1):78–84. doi: 10.17116/klinderma201615178-84. / Lvov A.N. Propaedeutic principles of the use of a combination topical therapy in dermatoses caused by a combination of factors. Klinicheskaya dermatologiya i venerologiya = Russian Journal of Clinical Dermatology and Venerology. 2016;(1):78–84. (In Russ.) doi: 10.17116/klinderma201615178-84.
- Олисова О.Ю., Белоусова Т.А., Каиль-Горячкина М.В. Стратегия и тактика лечения больных с инфекционно-воспалительными заболеваниями кожи. Consilium Medicum (приложение «Дерматология»). 2017;(1):42–47. Режим доступа: https://www.elibrary.ru/. / Olisova O.Yu., Belousova T.A., Kail-Goriachkina M.V. The strategy and tactics of treatment of patients with infectious-inflammatory diseases of the skin. Dermatologiya. Prilozhenie k zhurnalu Concilium Medicum =
Dermatology. Appendix to the Journal Concilium Medicum. 2017;(1):42–47. (In Russ.) Available at: https://www.elibrary.ru/. - Бурцева Г.Н., Сергеев В.Ю., Сергеев А.Ю. Клинико-микробиологические параллели в современной диагностике и терапии акне. Иммунопатология, аллергология, инфектология. 2014;(1):63–70. Режим
доступа: https://elibrary.ru/. / Burtseva G.N., Sergeev V.Y., Sergeev A.Y. Linking the microbiological and clinicall variation in modern acne therapy. Immunopatologiya, allergologiya, infektologiya = International Journal of Immunopathology, Allergology, Infectology. 2014;(1):63–70. (In Russ.) Available at: https://elibrary.ru/. - Ненашева Н.М. Особенности местной (наружной) терапии осложненного инфекцией атопическиого дерматита. РМЖ. 2015;(12):1–7. Режим доступа: https://www.rmj.ru/. / Nenasheva N.M. Features of topical therapy for atopic dermatitis complicated
by infection. RMZH = RMJ. 2015;(12):1–7. (In Russ.) Available at:
https://www.rmj.ru/. - Устинов М.В. Эмпирическая терапия воспалительных поражений кожи крупных складок. РМЖ. 2016;(14):945–948. Режим доступа: https://www.rmj.ru/. / Ustinov M.V. Empirical therapy of inflammatory skin lesions of large folds. RMZH = RMJ. 2016;(14):945–948. (In Russ.) Available at: https://www.rmj.ru/.
- Котрехова Л.П. Диагностика и рациональная терапия дерматозов сочетанной этиологии. Consilium Medicum (приложение «Дерматология»). 2010;(4):6–11. Режим доступа: https://elibrary.ru/. / Kotrekhova L.P. Diagnostics and rational therapy of dermatoses of combined etiology. Dermatologiya. Prilozhenie k zhurnalu Concilium Medicum = Dermatology. Appendix to the Journal Concilium Medicum. 2010;(4):6–11. (In Russ.) Available at: https://elibrary.ru/.
- Матушевская Е.В.,. Шакуров И.Г, Хисматулина З.Р. Эффективность и переносимость препаратов «линии» Акридерм® в практике дерматовенеролога. Клиническая дерматология и венерология. 2008;6(2):1–4. Режим доступа: https://elibrary.ru/. / Matushevskaya E.V., Shakurov I.G., Khismatulina Z.R. Effectiveness and tolerance of Akriderm preparations in der-matovenereologic practice. Klinicheskaya dermatologiya i venerologiya = Russian Journal of Clinical Dermatology and Venerology. 2008;6(2):1–4. (In Russ.) Available at: https://elibrary.ru/.
- Касихина И.И., Глазко М.Д., Рябчикова Е.И. Проблемы микст-инфекции: пути решения и особенности патогенеза. Клиническая дерматология и венерология. 2014;12(4):56–60. Режим доступа: https://www.mediasphera.ru/. / Kasikhina E.I., Glazko I.I., Riabchikova M.D. PROBLEMS RELated to mixed infections: solutions and features of pathogenesis. Klinicheskaya dermatologiya i venerologiya = Russian Journal of Clinical Dermatology and Venerology. 2014;12(4):56–60. (In Russ.) Available at: https://www.mediasphera.ru/.
- Торшина И.Е. Топическая терапия инфицированных стероидочувствительных дерматозов. Вестник дерматологии и венерологии. 2015;(5):102–108. Режим доступа: https://www.vestnikdv.ru/. / Torshina I.E. Topical therapy of infected corticosteroid-sensitive dermatoses. Vestnik dermatologii i venerologii Herald of Dermatology and Venereology. 2015;(5):102–108. (In Russ.) Available at: https://www.vestnikdv.ru/.
- Свирщевская Е.В., Матушевская Е.В., Чудаков Д.Б., Матушевская Ю.И. Роль инфекции в патогенезе аллергодерматозов. Клиническая дерматология и венерология. 2015;(2):4–10. doi: 10.17116/klinderma20151424-10. / Svirshchevskaya E.V., Matushevskaya E.V., Chudakov D.B., Matushevskaya Yu.I. The role of infection in the pathogenesis of allergodermatoses. Klinicheskaya dermatologiya i venerologiya = Russian Journal of Clinical Dermatology and Venerology. 2015;(2):4–10. (In Russ.) doi: 10.17116/klinderma20151424-10.
- Филимонкова Н.Н., Бахлыкова Е.А. Комбинированная топическая терапия хронических дерматозов. Вестник дерматологии и венерологии. 2015;(3):147–152. doi: 10.25208/0042-4609-2015-91-3-147-152. / Filimonkova N.N., Bakhlykova Y.A. A combined topical therapy of chronic dermatoses. Vestnik dermatologii i venerologii = Herald of Dermatology and Venereology. 2015;(3):147–152. (In Russ.) doi: 10.25208/0042-4609-2015-91-3-147-152.
- Хардикова С.А. Эффективность и переносимость различных форм Акридерм ГК в ежедневной практике дерматовенеролога. Клиническая дерматология и венерология. 2016;(5):55–61. doi: 10.17116/klinderma201615555-61. / Khardikova S.A. Efficacy and tolerability of various forms of akriderm gk in routine dermatological practice. Klinicheskaya dermatologiya i venerologiya = Russian Journal of Clinical Dermatology and Venerology. 2016;(5):55–61. (In Russ.) doi: 10.17116/klinderma201615555-61.
- Халдин А.А., Жукова О.В Открытое рандомизированное сравнительное исследование по изучению эффективности и безопасности поликомпонентных препаратов для наружного применения отечественного и зарубежного производства в комплексной терапии экземы. Клиническая дерматололгия и венерология. 2019;18(3):1–11. doi: 10.17116/klinderma2019180311. / Khaldin A.A., Zhukova O.V. Open randomized controlled trial to study the effectiveness and safety of domestic (Russian) versus foreign multicomponent topical preparations for the treatment of eczema. Klinicheskaya dermatologiya i venerologiya = Russian Journal of Clinical Dermatology and Venerology. 2019;18,(3):1–11. (In Russ.) doi: 10.17116/klinderma2019180311.




 1
1 2
2 3
3 4
4


Комментарии (0)