
Журнал "Медицинский совет" №1/2023
DOI: 10.21518/ms2022-020
С.С. Никитин1,2, https://orcid.org/0000-0002-4920-1722
Н.Б. Гусева3,4,5, https://orcid.org/0000-0002-1583-1769
В.С. Никитин1, https://orcid.org/0000-0003-2236-0296
1 Петрозаводский государственный университет; 185002, Россия, Петрозаводск, проспект Ленина, д. 33
2 Детская республиканская больница имени И.Н. Григовича; 185002, Россия, Петрозаводск, ул. Парковая, д. 58
3 Детская городская клиническая больница No9 имени Г.Н. Сперанского; 123317, Россия, Москва, Шмитовский проезд, д. 29
4 Научно- исследовательский клинический институт педиатрии и детской хирургии имени академика Ю.Е. Вельтищева Российского национального исследовательского медицинского университета имени Н.И. Пирогова; 125412, Россия, Москва, ул. Талдомская, д. 2
5 Российская медицинская академия непрерывного профессионального образования; 125373, Россия, Москва, ул. Героев Панфиловцев, д. 28
Введение. По сведениям из разных литературных источников, Escherichia coli является наиболее распространенным (80–90%) возбудителем инфекции мочевых путей у детей и она значительно превосходит по частоте встречаемости остальные бактерии, хотя имеется тенденция к постепенному уменьшению ее удельного веса, особенно на фоне других возбудителей кишечной группы.
Цель. Определить удельный вес E. coli как возбудителя инфекции мочевых путей в зависимости от возраста на фоне других патогенов.
Материалы и методы. В исследовании участвовало 133 ребенка от 1 года до 17 лет с инфекцией мочевых путей: девочки – 107, мальчики – 26 человек. Бактериологическим методом определен возбудитель, его чувствительность к стандартным антибиотикам и возможность продуцировать бета-лактамазы расширенного спектра. Статистическая обработка проведена в программе Microsoft Excel. При статистическом изучении сопряженности признаков «возраст» и «инфекция» использован критерий Краскела – Уоллиса. Пациенты сгруппированы по следующим возрастным категориям: 1–3, 4–7, 8–11, 12–14 и 15–17 лет.
Результаты. Авторы статьи представили сведения, что E. coli хотя и является лидером, но ее удельный вес не так велик, как принято считать, и составляет только 26–29%, при этом из общего числа 18% являются продуцентами бета-лактамазы расширенного спектра. В статье показано распределение возбудителей инфекции мочевых путей по возрастным группам детей и рассчитана эмпирическая вероятность выявления различных возбудителей в разном возрасте. Доказано, что возрастная группа 8–11 лет наиболее подвержена микст-инфекции. По структуре микст-инфекций это сочетания возбудителей кишечной группы: E. coli c E. faecalis или E. faecium или c Klebsiella pneumoniae.
Выводы. Авторами поднят вопрос о необходимости в ближайшей перспективе коррекции схем эмпирической антибактериальной терапии в связи с превышением обоснованной 10–20%-й резистентности E. coli к цефалоспоринам 3-го поколения из-за увеличения частоты продукции бета-лактамазы расширенного спектра.
Для цитирования: Никитин С.С., Гусева Н.Б., Никитин В.С. Сохранит ли E. coli свои лидирующие позиции как возбудитель инфекции мочевых путей у детей? Медицинский Совет. 2023;(1):110-117. https://doi.org/10.21518/ms2022-020
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Will E. coli retain its leading position as a causative agent of urinary tract infection in children?
Sergey S. Nikitin1,2, https://orcid.org/0000-0002-4920-1722
Natalia B. Guseva3,4,5, https://orcid.org/0000-0002-1583-1769
Vadim S. Nikitin1, https://orcid.org/0000-0003-2236-0296
1 Petrozavodsk State University; 33, Lenin Ave., Petrozavodsk, 185002, Russia
2 Children’s Republican Hospital named after I.N. Grigovich; 58, Parkovaya St., Petrozavodsk, 185002, Russia
3 Children’s City Clinical Hospital No. 9 named after G.N. Speransky; 29, Shmitovsky Proezd, Moscow, 123317, Russia
4 Research Clinical Institute of Pediatrics and Pediatric Surgery named after Academician Yu.E. Veltishchev, Pirogov Russian National Research Medical University; 2, Taldomskaya St., Moscow, 125412, Russia
5 Russian Medical Academy of Continuous Professional Education; 28, Geroev Panfilovtsev St., Moscow, 125373, Russia https://doi.org/10.21518/ms2022-020
Introduction. According to information from various literature sources, Escherichia coli is the most common (80–90%) causative agent of urinary tract infection (UTI) in children, it also significantly exceeds the frequency of occurrence of other bacteria, although there is a tendency to gradually decrease its specific gravity, especially against the background of other pathogens of the intestinal group.
Aim. To determine the specific gravity of E. coli as the causative agent of UTI, depending on age against the background of other pathogens.
Materials and methods. The study involved 133 children aged 1–17 years with UTI, girls – 107, boys – 26. The bacteriological method determined the pathogen, its sensitivity to standard antibiotics and the ability to produce extended-spectrum beta-lactamases (ESBL). Statistical processing was carried out in the Excel program. In the statistical study of the conjugacy of the signs age and infection, the Kruskal – Wallis criterion was used. Patients are grouped into the following age categories: 1–3, 4–7, 8–11, 12–14 and 15–17 years.
Results. The authors of the article provided information that E. coli, although it is the leader, but its share is not as large as is commonly believed and is only 26–29%, while 18% of the total are producers of ESBL. The article shows the distribution of UTI pathogens by age groups of children and calculates the empirical probability of detecting various pathogens at different ages. It is shown that the age group of 8–11 years is most susceptible to mixed infection. According to the structure of mixed infections, these are combinations of pathogens of the intestinal group: E. coli with E. faecalis or E. faecium or with Klebsiella pneumoniae.
Conclusions. The authors raised the question of the need in the near future to correct the schemes of empirical antibacterial therapy in connection with the excess of the justified 10–20% resistance of E. coli to cephalosporins of the 3rd generation due to an increase in the frequency of ESBL production.
For citation: Nikitin S.S., Guseva N.B., Nikitin V.S. Will E. coli retain its leading position as a causative agent of urinary tract infection in children? Meditsinskiy sovet = Medical Council. 2023;(1):110-117. (In Russ.) https://doi.org/10.21518/ms2022-020
Conflict of interest: the authors declare no conflict of interest.
Введение
Инфекции мочевыделительных путей (ИМП) – общее понятие, включающее инфекционные поражения как верхних, так и нижних мочевых путей (пиелонефрит, цистит, уретрит) и применяющееся в клинической практике, когда локализация инфекционного процесса еще не установлена. В структуре заболеваний органов мочевыделительной системы доля воспалительных процессов составляет 80% [1]. Соответственно, ИМП – это один из самых частых поводов для обращения к детскому урологу и нефрологу, а также педиатру. Такая распространенность ИМП определяет актуальность проблемы, которая в современной научной литературе представлена очень широко. По диагностике и лечению ИМП ведущими экспертами сформулированы и опубликованы рекомендации российских и международных сообществ, по частным вопросам имеется множество научных статей [2–6].
Неспецифичность симптомов ИМП, особенно у детей раннего возраста, значительно осложняет диагностику заболевания и определяет большое число поздних госпитализаций – на 2–4-й неделе заболевания. У детей младшей возрастной группы проявлением ИМП может быть лихорадка, бледность кожных покровов, цианоз суборбитальных областей, отказ от еды, срыгивания, дисфункция кишечника. В большинстве случаев такие симптомы ИМП, как дизурия, боль в поясничной или надлобковой области, дети начинают формулировать по достижении ими 3–5-летнего возраста. Несмотря на возможную невыраженность симптомов, ИМП очень вариабельны. Течение и прогноз ИМП зависят от наличия нарушений уродинамики на фоне обструктивных уропатий, пузырно-мочеточникового рефлюкса и нейрогенных дисфункций мочевого пузыря и опасны развитием осложнений, самыми грозными из которых являются уросепсис и хроническая болезнь почек. Также стоит отметить высокую склонность ИМП к рецидивам. Все эти факторы определяют необходимость быстрого начала лечения манифестных форм ИМП.
Ввиду того что результат посева мочи становится известен только через несколько дней после сбора, лечение обычно начинается с эмпирического назначения антибактериальной терапии. Большинство экспертов – детских урологов и нефрологов считают наиболее распространенным возбудителем ИМП Escherichia соli с оговоркой, что на первом году жизни могут преобладать Klebsiella pneumoniae, энтерококки и энтеробактер. При этом структура возбудителей бактериальной инфекции и уровень их антибиотикорезистентности могут значительно меняться в зависимости от региона, поэтому врачу важно знать эти показатели для той области, в которой он ведет свою практику и подбирать терапию, основываясь на них [7–13].
Так, по результатам второй ступени крупного отечественного многоцентрового исследования «ДАРМИС», проведенной в 2017–2018 гг., среди возбудителей ИМП у детей до 79,7% приходилось на E. coli, при этом общая доля энтеробактерий в структуре возбудителей среди детей и взрослых составила 90,6%. В 23,5% случаев у детей кишечная палочка продуцировала бета-лактамазы расширенного спектра (БЛРС), которые во многом ответственны за ее резистентность к некоторым антибиотикам, в том числе первой линии [14].
Приведем несколько примеров по статистике позиции Е. сoli как основного возбудителя ИМП у детей из разных регионов. В исследовании, проведенном в 2017–2018 гг. в Рязани С.С. Кантутис и др. (n = 100 детей в возрасте от 2 мес. до 17 лет; 68% девочек и 32% и мальчиков соответственно), доля кишечной палочки в структуре возбудителей ИМП составила 71% (из них в 14% E. coli синтезировала БЛРС), а доля остальных представителей семейства Enterobacteriaceae – 19% (K. pneumoniae – 13%, Proteus mirabilis – 6%). Также 6% пришлось на долю Enterococcus faecalis [15].
В другом исследовании, проведенном в Чебоксарах в 2017–2018 гг. В.П. Акимовой и др. (n = 1000 детей в возрасте от 1 мес. до 2 лет с лихорадкой, из них положительная культура мочи у 150 детей), E. coli выявлена в 86,66% случаев, другие представители энтеробактерий – в 13,32% (Morganella morganii – 6,66%, Klebsiella spp. – 6,66%) [12].
В исследовании А.Н. Ни и др. (2020), представляющих Дальний Восток, E. coli выявлена в 37 положительных посевов мочи из 82 у пациентов младшего возраста с ИМП [13].
По данным О.А. Ждановой и др., в 2013 г. частота выделения E. coli составила 39,3%. При этом авторы указывают на различия в структуре возбудителей ИМП у детей разных возрастов. Так, у детей до 3 лет Е. соli выявлена в 34,3% наблюдений, а старше 3 лет – в 40,6%. В раннем возрасте часто встречались K. pneumoniae (25,8%) и Proteus (9,7%). В возрасте старше 3 лет получен достаточно высокий процент высевов Enterococcus spp. – 18,4% [16].
Некоторые различия в результатах, вероятно, вызваны разницей в микробиологическом фоне в регионах, небольшими размерами выборок и, возможно, различной возрастной структурой пациентов.
По данным А.Ю. Кузьменкова и др., а также обзора по лечению ИМП у детей, опубликованного И.Н. Захаровой и др., E. coli остается ведущим возбудителем ИМП, но происходит постепенное увеличение значимости иных представителей семейства Enterobacteriaceae [17, 18].
Несмотря на то что в большинстве случаев ИМП вызваны бактериями, многие авторы в своих работах указывают на возможность развития заболевания в результате заражения грибками рода Candida и цитомегаловирусом. Отмечается, что вирусная природа характерна для часто рецидивирующих ИМП, а грибковое поражение для катетер-ассоциированных инфекций и для детей с пороками развития мочеполовой системы [10, 11, 13, 19, 20].
Ежегодные отчеты бактериологической лаборатории ГБУЗ «Детская республиканская больница имени И.Н. Григовича» (Петрозаводск) по выявленным микроорганизмам в посевах мочи хотя и показывают лидирующее значение E. coli, но также ее меньший удельный вес среди всех выявленных возбудителей (26–29% за 2017–2021 гг.) по сравнению с представленными выше опубликованными данными.
Поэтому авторами статьи поставлена цель – определить удельный вес E. coli как возбудителя ИМС у детей в зависимости от возраста на фоне других патогенов.
Материалы и методы
Исследование проведено на базах Детской республиканской больницы имени И.Н. Григовича (Петрозаводск) и Детской городской клинической больницы №9 имени Г.Н. Сперанского (Москва). В него включены 133 человека c положительным результатом посева мочи на флору (девочки – 107 человек (80,5%), мальчики – 26 человек (19,5%)). Возраст детей от 1 года до 17 лет. Все пациенты с ИМС. Метод сбора анализа мочи – стандартный: утром после туалета наружных половых органов осуществлялся сбор средней струи мочи непосредственно в стерильный контейнер. В течение 30 мин моча доставлялась в лабораторию. Бактериологическим методом определен возбудитель, его чувствительность к стандартным антибиотикам и возможность возбудителя продуцировать БЛРС.
Статистическая обработка проведена в программе Microsoft Excel. При статистическом изучении сопряженности признаков «возраст» и «инфекция» использован критерий Краскела – Уоллиса.
Пациенты сгруппированы по следующим возрастным категориям: 1–3 года, 4–7 лет, 8–11 лет, 12–14 лет, 15–17 лет. Определены характерные возбудители ИМП для каждой возрастной категории, и рассчитана эмпирическая вероятность выявления различных возбудителей ИМП в моче у пациентов в зависимости от возраста.
Результаты
При изучении распределения возбудителей ИМП по возрастам получены следующие результаты (таблица).
Таблица. Распределение возбудителей по возрастам
Инфекция | Возраст, лет | ||||
1–3 | 4–7 | 8–11 | 12–14 | 15–17 | |
E. faecalis | – | 6 | 10 | 2 | – |
E. faecium | – | 2 | 4 | – | – |
K. pneumoniae | 4 | 5 | 8 | 2 | 1 |
E. coli | 10 | 11 | 17 | 4 | – |
S. aureus | 2 | 3 | 1 | 2 | 2 |
Acinetobacter | 1 | 3 | 5 | 5 | 2 |
Enterococcus spp. | – | 3 | 5 | 2 | – |
P. mirabilis | 1 | 3 | 3 | – | – |
Eikenella corrodens | 1 | – | 3 | – | – |
Результаты тестирования таблицы сопряженности: χ2 = 10,456, df = 8, Pr > χ2 = 0,234.
Изучение признаков «возраст» и «инфекция» позволило выделить возрастную группу 8–11 лет как наиболее подверженную микст-инфекции. По структуре микст-инфекций это сочетания возбудителей кишечной группы: Е. соli c E. faecalis или Enterococcus faecium или c K. pneumoniae. В группах 1–3 года и 15–17 лет отмечается наличие инфекции одного возбудителя и меньше частота рецидивов ИМП.
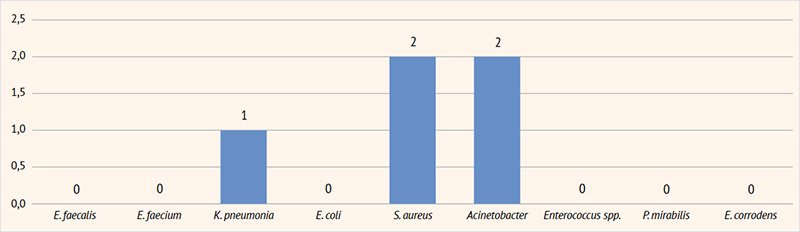
Наиболее часто выявлялась Е. соli в изолированном виде или в виде микст-инфекции, но указанное преобладание не является статистически значимым. Распределение частоты выявляемости различных возбудителей в посевах мочи представлено на рис. 1–5.
Рисунок 1. Результаты посевов мочи на флору у пациентов с инфекцией мочевыделительных путей в возрасте 1–3 года
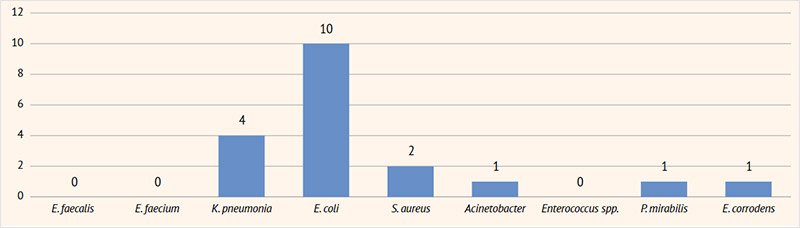
Рисунок 2. Результаты посевов мочи на флору у пациентов с инфекцией мочевыделительных путей в возрасте 4–7 года
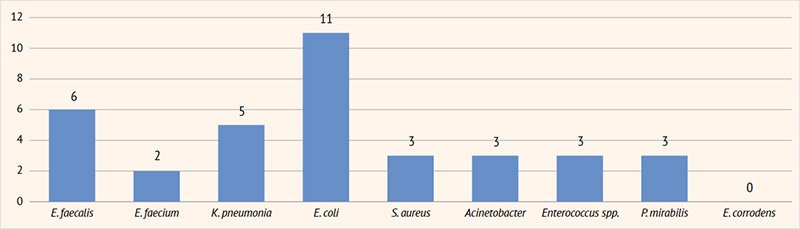
Рисунок 3. Результаты посевов мочи на флору у пациентов с инфекцией мочевыделительных путей в возрасте 8–11 лет
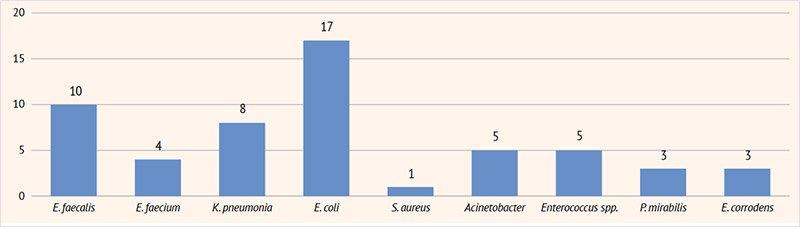
Рисунок 4. Результаты посевов мочи на флору у пациентов с инфекцией мочевыделительных путей в возрасте 12–14 лет
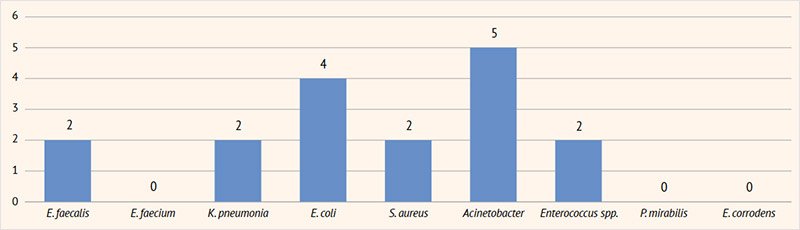
Рисунок 5. Результаты посевов мочи на флору у пациентов с инфекцией мочевыделительных путей в возрасте 15–17 лет
Эмпирическая вероятность наблюдения возбудителей ИМП в различных возрастных диапазонах представлена на рис. 6.
Рисунок 6. Эмпирическая вероятность выявления различных возбудителей инфекции мочевыделительн
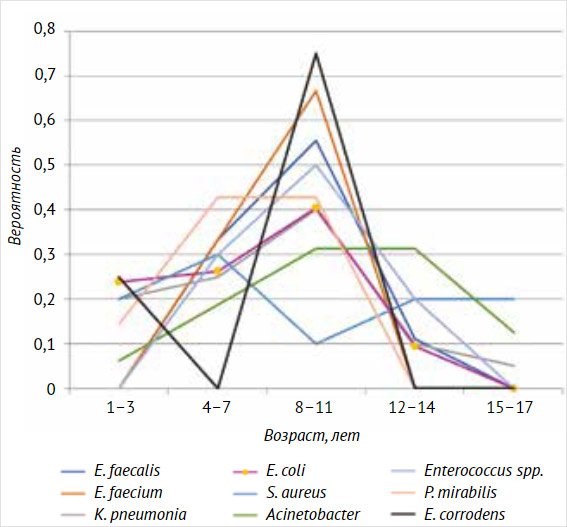
По данным рис. 6 видно, что частота выявления наиболее распространенного возбудителя – Е. соli – начинает снижаться с 12 лет.
При изучении чувствительности к антибиотикам Е. соli в 18% проб показала резистентность к цефалоспоринам 3-го поколения (пример такого анализа приведен на рис. 7). При этом достаточно высокая чувствительность показана к аминогликозидам (гентамицину, амикацину), к цефоперазону + сульбактаму, фосфомицину, амоксициллину + клавуланату, ципрофлоксацину, нитрофуранам, а максимальная чувствительность – к меропенему.
Рисунок 7. Пример результата посева мочи, в котором выделена Е. соli, продуцирующая бета-лактамазы расширенного спектра и резистентная к цефалоспоринам 3-го поколения

Результаты и обсуждение
Меньшая частота встречаемости микст-инфекции в возрасте 1 года – 3 лет и у детей старше 15 лет позволяет предположить более тщательное выполнение рекомендаций по лечению в первом случае со стороны родителей, а у старших детей самостоятельно. Здесь речь идет в первую очередь о режиме питья и объеме принимаемой жидкости, режиме мочеиспусканий – исключении возможности искусственной задержки мочеиспускания. С учетом преимущественно восходящего пути инфицирования такое же предположение можно сделать и по поводу ухода за детьми и гигиены. В средних возрастных группах родительский контроль в данных вопросах уже ослабевает, а навыки самообслуживания еще не полностью сформированы, как и не проявляется характерная для более старших возрастов потребность в гигиене. Наличие в основном восходящего пути заражения объясняет и состав микст-инфекций, который представлен возбудителями кишечной группы: Е. соli, E. faecalis, E. faecium и K. pneumoniae.
Снижение частоты встречаемости ИМП, вызванных возбудителями кишечной группы, у группы пациентов в возрасте 15–17 лет объясняется следующим. ИМП у данной категории детей носили характер осложнения после перенесенных заболеваний – новой коронавирусной инфекции и других острых респираторных вирусных инфекций. Здесь представлены пациенты с острыми пиелонефритами и циститами, ранее не имевшие урологического анамнеза. При этом если в данную возрастную группу попали бы пациенты с хроническим пиелонефритом и (или) хроническим циститом, вполне вероятно, что в посеве мочи была бы выявлена кишечная группа возбудителей.
Заключение
E. coli и другие микроорганизмы кишечной группы составляют подавляющее большинство возбудителей ИМП как по представленным выше литературным данным, так и по данным нашей лаборатории. При этом имеется определенная тенденция к уменьшению доли E. coli по отношению к другим представителям Enterobacteriaceae. Основная проблема, с которой сталкиваются клиницисты и вызывающая беспокойство, заключается в возможной продукции возбудителем БЛРС, которые разрушают как аминопенициллины, так и ингибиторозащищенные пенициллины и цефалоспорины. В этих случаях выявляется неэффективность стартовой терапии цефалоспоринами 3-го поколения [14, 21, 22].
Учитывая рост продукции БЛРС и формирование резистентности цефалоспоринами 3-го поколения, через какой-то, вероятно, небольшой промежуток времени мы столкнемся с вопросом необходимости коррекции схем эмпирической антибактериальной терапии. В настоящее время известно, что резистентность микроорганизма к определенному препарату на 10–20% является основанием для его ограничения в качестве препарата первой линии для эмпирической терапии [22, 23]. Данный уровень антибиотикорезистентности в настоящее время уже достигнут, а по данным некоторых источников даже превышен [14].
Список литературы / References
- Захарова И.Н., Мумладзе Э.Б., Кучерова В.В., Гавеля Н.В., Ручкина Е.В. Значение прокальцитонинового теста в диагностике микробно-воспалительных заболеваний почек и мочевых путей у детей. Вестник Бурятского государственного университета. Медицина и фармация. 2012;(12):98-101. Режим доступа: http://journals.bsu.ru/content/pages/157/medicina._farmaciya._2012_12.pdf.
- Баранов А.А., Козлов Р.С., Намазова-Баранова Л.С., Андреева И.В., Вишнева Е.А., Зокиров Н.З. и др. Инфекция мочевыводящих путей у детей: клинические рекомендации. М.; 2021. 51 с. Режим доступа: https://cr.minzdrav.gov.ru/schema/281_2.
- Захарова И.Н., Горяйнова А.Н., Мумладзе Э.Б., Кучерова В.В., Дмитриева Ю.А. Новые подходы к диагностике и лечению инфекции мочевой системы у детей. Педиатрия. Consilium Medicum. 2012;(1):59-62. Режим доступа: https://omnidoctor.ru/library/izdaniya-dlya-vrachey/pediatriya-consilium-medicum/ped2012/ped2012_1/novye-podkhody-k-diagnostike-i-lecheniyu-infektsii-mochevoy-sistemy-u-detey-i-n-zakharova-a-n-goryay.
- Захарова И.Н., Мачнева Е.Б., Мумладзе Э.Б., Ивахненко Ю.И. Диагностика и лечение инфекций мочевых путей у детей: что нового? Медицинский совет. 2017;(1):180-185. https://doi.org/10.21518/2079-701X-2017-1-180-185.
- Stein R., Dogan H.S., Hoebeke P., Kočvara R., Nijman R.J., Radmayr C., Tekgül S Urinary tract infections in children: EAU/ESPU guidelines. Eur Urol. 2015;67(3):546-558. https://doi.org/10.1016/j.eururo.2014.11.007.
- Robinson J.L., Finlay J.C., Lang M.E., Bortolussi R. Urinary tract infections in infants and children: Diagnosis and management. Paediatr Child Health. 2014;19(6):315-325. https://doi.org/10.1093/pch/19.6.315.
- Захарова И.Н., Османов И.М., Мумладзе Э.Б., Свинцицкая В.И., Бекмурзаева Г.Б. Инфекция мочевых путей у детей: что нужно знать педиатру и нефрологу. Медицинский совет. 2015;(14):114-118. Режим доступа: https://www.med-sovet.pro/jour/article/view/371.
- Zorc J.J., Levine D.A., Platt S.L., Dayan P.S., Macias C.G., Krief W. et al. Clinical and demographic factors associated with urinary tract infection in young febrile infants. Pediatrics. 2005;116(3):644-648. https://doi.org/10.1542/peds.2004-1825.
- Kanellopoulos T.A., Salakos C., Spiliopoulou I., Ellina A., Nikolakopoulou N.M., Papanastasiou D.A. First urinary tract infection in neonates, infants and young children: a comparative study. Pediatr Nephrol. 2006;21(8):1131-1137. https://doi.org/10.1007/s00467-006-0158-7.
- Ушакова Р.А., Бочкарева С.П., Панкратова И.Б. Современные аспекты диагностики инфекции мочевыводящих путей у детей первых двух лет жизни: ретроспективный анализ серии случаев. Доктор.Ру. 2021;20(10):54-60. https://doi.org/10.31550/1727-2378-2021-20-10-54-60.
- Зайцев А.В., Ширяев А.А., Ким Ю.А., Сазонова Н.А., Прилепская Е.А., Васильев А.О., Пушкарь Д.Ю. Инфекции мочевыводящих путей. Современная тактика врача-уролога. РМЖ. 2019;(11):21-26. Режим доступа: http://www.rmj.ru/articles/urologiya/Infekcii_mochevyvodyaschih_putey_Sovremennaya_taktika_vracha-urologa.
- Акимова В.П., Краснов М.В., Андреева Л.В. Распространенность инфекции мочевыводящих путей у детей с лихорадкой в возрасте до двух лет. В: Актуальные проблемы детской уронефрологии: материалы Межрегиональной научно-практической конференции, посвященной 230-летию со дня рождения основателя нефрологии Ричарда Брайта, Чебоксары, 14 мая 2019 г. Чебоксары: Чувашский государственный университет имени И.Н. Ульянова; 2019. С. 110-114. Режим доступа: https://elibrary.ru/item.asp?id=37530738.
- Ни А.Н., Шуматова Т.А., Сергеева Е.В., Шишацкая С.Н., Быкова О.Г. Региональные особенности возбудителей впервые выявленных внебольничных инфекций мочевыводящих путей у детей грудного и раннего возраста. Доктор.Ру. 2020;19(3):24-28. https://doi.org/10.31550/1727-2378-2020-19-3-24-28.
- Козлов Р.С., Палагин И.С., Голуб А.В. Пероральные цефалоспорины III поколения при внебольничных инфекциях мочевых путей: современные аспекты применения. Клиническая микробиология и антимикробная химиотерапия. 2019;21(3):225-228. https://doi.org/10.36488/cmac.2019.3.225-228.
- Кантутис С.С., Садомская Н.А., Аникеева Н.А., Лашко А.Ю., Несина А.В. Некоторые аспекты антибиотикорезистентности возбудителей, выделенных из мочи у детей с инфекциями мочевых путей. Клиническая микробиология и антимикробная химиотерапия. 2019;21(S1):32-33. Режим доступа: https://elibrary.ru/item.asp?id=41334893.
- Жданова О.А., Гурович О.В., Ахматова С.Н., Куликова Ю.П. Микрофлора мочи при инфекции мочевых путей у детей разного возраста. Прикладные информационные аспекты медицины. 2017;20(3):89-93. Режим доступа: https://www.elibrary.ru/item.asp?id=29823215.
- Кузьменков А.Ю., Трушин И.В., Авраменко А.А., Эйдельштейн М.В., Дехнич А.В., Козлов Р.С. AMRmap: интернет-платформа мониторинга антибиотикорезистентности. Клиническая микробиология и антимикробная химиотерапия. 2017;19(2):84-90. Режим доступа: https://cmac-journal.ru/publication/2017/2/cmac-2017-t19-n2-p084.
- Захарова И.Н., Османов И.М., Касьянова А.Н. Лечение инфекции мочевых путей у детей: что мы имеем на сегодняшний день? Обзор мировых и российских рекомендаций. Педиатрия. Consilium Medicum. 2019;(2):20-25. Режим доступа: https://omnidoctor.ru/library/izdaniya-dlya-vrachey/pediatriya-consilium-medicum/ped2019/ped2019_2/lechenie-infektsii-mochevykh-putey-u-detey-chto-my-imeem-na-segodnyashniy-den-obzor-mirovykh-i-rossi.
- Жданова О.А., Настаушева Т.Л., Гребенникова И.В., Батищева Г.А., Балалаева И.Ю. Изменение микрофлоры мочи у детей с внебольничной инфекцией мочевыводящих путей, госпитализированных в период с 1990 по 2015 г.: ретроспективное сплошное исследование серии случаев. Вопросы современной педиатрии. 2018;17(3):216-222. https://doi.org/10.15690/vsp.v17i3.1890.
- Захарова И.Н., Мумладзе Э.Б., Мачнева Е.Б., Касьянова А.Н. Механизмы развития инфекции мочевых путей и бессимптомной бактериурии. Педиатрия. Consilium Medicum. 2018;(1):106-110. Режим доступа: https://omnidoctor.ru/library/izdaniya-dlya-vrachey/pediatriya-consilium-medicum/ped2018/ped2018_1/mekhanizmy-razvitiya-infektsii-mochevykh-putey-i-bessimptomnoy-bakteriurii.
- Перепанова Т.С., Козлов Р.С., Руднов В.А., Синякова Л.А. Антимикробная терапия и профилактика инфекций почек, мочевыводящих путей и мужских половых органов. Федеральные клинические рекомендации. М.: Прима-принт; 2017. 72 с. Режим доступа: https://elibrary.ru/item.asp?id=32843544.
- Козлов Р.С., Голуб А.В. Стратегия использования антимикробных препаратов как попытка ренессанса антибиотиков. Клиническая микробиология и антимикробная химиотерапия. 2011;13(4):322-334. Режим доступа: https://cmac-journal.ru/publication/2011/4/cmac-2011-t13-n4-p322.
- Warren J.W., Abrutyn E., Hebel J.R., Johnson J.R., Schaeffer A.J., Stamm W.E. Guidelines for antimicrobial treatment of uncomplicated acute bacterial cystitis and acute pyelonephritis in women. Infectious Diseases Society of America (IDSA). Clin Infect Dis. 1999;29(4):745-758. https://doi.org/10.1086/520427.



 1
1 2
2 3
3 4
4


Комментарии (0)