Журнал "Атеротромбоз" №1/2021
DOI: 10.21518/2307-1109-2021-1-128-143
Ю. А. Омаров1, Т.Н. Веселова1, Р.М. Шахнович1 , Т.С. Сухинина1, Н.С. Жукова1, И.Н. Меркулова1, Н.А. Барышева1, Д.В. Певзнер1, В.Н. Шитов1, Л.С. Атабаева1, Р.О. Хангоев1, Г.К. Арутюнян1, В.М. Миронов1, Е.В. Меркулов1, И.И. Староверов1, С.К. Терновой1,2
1
Национальный медицинКомпьютерная томографическаяский исследовательский центр кардиологии; 121552, Россия, Москва, 3-я Черепковская ул., д. 15а
2
Первый Московский государственный медицинский университет имени И.М. Сеченова (Сеченовский Университет); 119991, Россия, Москва, ул. Б. Пироговская, д. 6, стр. 1
Введение. Компьютерная томографическая ангиография (КТА) широко используется для выявления атеросклеротических изменений в коронарных артериях (КА). Однако метод ограничен невозможностью проведения функциональной оценки выявленных стенозов. С этой целью может использоваться перфузионная компьютерная томография миокарда (ПКТ).
Цель исследования. Оценить диагностическую точность методов ПКТ миокарда с чреспищеводной электрокардиостимуляцией (ЧПЭС) и стресс-эхокардиографии (стресс-ЭхоКГ) с велоэргометрией (ВЭМ) в выявлении преходящей ишемии у больных с исходным диагнозом «острый коронарный синдром» (ОКС) с пограничными стенозами (50–75%) в КА по отношению к измерениям фракционного резерва кровотока (ФРК).
Материалы и методы. В исследование были включены 30 больных с исходным диагнозом ОКС с пограничными (50–75%) стенозами в КА по данным КТА или коронарной ангиографии (КАГ). Впоследствии им были выполнены ПКТ миокарда на томографе с 320-рядным детектором с ЧПЭС, а также стресс-ЭхоКГ с ВЭМ. В качестве референтного метода использовалось инвазивное измерение ФРК. Значение показателя ФРК < 0,8 указывало на гемодинамическую значимость стеноза. Перфузия миокарда оценивалась визуально. При проведении стресс-ЭхоКГ оценивалась региональная сократимость миокарда левого желудочка.
Результаты. Все больные обследованы согласно заявленному протоколу. ПКТ с ЧПЭС выявила ФРК-значимые стенозы с чувствительностью, специфичностью, прогностической ценностью положительного результата и прогностической ценностью отрицательного результата 56, 93, 90, 65% соответственно, стресс-ЭхоКГ с ВЭМ 62, 93, 91, 68% соответственно.
Выводы. ПКТ миокарда с ЧПЭС позволяет выявить дефекты перфузии, ассоциированные с преходящей ишемией, а диагностическая точность метода при сравнении с ФРК сопоставима с уже хорошо зарекомендовавшей себя стресс-ЭхоКГ. Использование ПКТ с ЧПЭС в комбинации с КТА можно рассматривать как перспективный диагностический инструмент у больных без известной коронарной анатомии и с подозрением на ОКС.
Для цитирования: Омаров Ю.А., Веселова Т.Н., Шахнович Р.М., Сухинина Т.С., Жукова Н.С., Меркулова И.Н., Барышева Н.А., Певзнер Д.В., Шитов В.Н., Атабаева Л.С., Хангоев Р.О., Арутюнян Г.К., Миронов В.М., Меркулов Е.В., Староверов И.И., Терновой С.К. Диагностическая эффективность перфузионной компьютерной томографии миокарда с чреспищеводной электрокардиостимуляцией у больных с исходным диагнозом «острый коронарный синдром». Атеротромбоз. 2021;(1):128-143. https://doi.org/10.21518/2307-1109-2021-11-1-128-143
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Diagnostic efficiency of myocardial perfusion computed tomography with transesophageal pacing in patients with an initial diagnosis of acute coronary syndrome
Yusup A. Omarov1*, Tatiana N. Veselova1, Roman M. Shakhnovich1, Tatyana S. Sukhinina1, Natalia S. Zhukova1, Irina N. Merkulova1, Natalya A. Barysheva1, Dmitry V. Pevzner1, Victor N. Shitov1, Lina S. Atabaeva1, Ruslan O. Khangoev1, Goar K. Arutyunyan1, Vsevolod M. Mironov1, Evgeny V. Merkulov1, Igor I. Staroverov1, Sergey K. Ternovoy1,2
1 National Medical Research Center of Cardiology; 15a, 3rd Cherepkovskaya St., Moscow, 121552, Russia
2 Sechenov First Moscow State Medical University (Sechenov University); 6, Bldg. 1, B. Pirogovskaya St., Moscow, 119991, Russia
Introduction. Computed tomography angiography (CTA) is widely used to detect atherosclerotic changes in coronary arteries (CA). However, the method is limited by the impossibility to perform functional assessment of detected stenoses. Perfusion computed tomography of the myocardium (PCT) can be used for this purpose.
Aim of the study. To assess diagnostic accuracy of PCT of the myocardium with transesophageal electrocardiostimulation (TEES) and stress-echocardiography (stress-echoCG) with veloergometry (VEM) in detection of transient ischemia in patients with initial diagnosis of “acute coronary syndrome” (ACS) with borderline stenoses (50–75%) in CA in relation to measurements of fractional flow reserve (FFR).
Materials and Methods. The study included 30 patients with the initial diagnosis of ACS with borderline (50–75%) stenoses in CA according to CTA or coronary angiography (CAG). Subsequently, they underwent myocardial PCT with 320-row detector with TEES, as well as stress-echoCG with VEM. Invasive FFR measurement was used as a reference method. FFR value < 0.8 indicated hemodynamic significance of stenosis. Myocardial perfusion was assessed visually. Regional myocardial contractility of the left ventricle was assessed by stress-echoCG.
Results. All patients were examined according to the stated protocol. PCT with TEES revealed FFR-significant stenoses with sensitivity, specificity, prognostic value of positive result and prognostic value of negative result 56, 93, 90, 65% respectively, stress-echoCG with VEM 62, 93, 91, 68% respectively. Conclusion. Myocardial PCT with TEES enables to detect perfusion defects associated with transient ischemia, and the diagnostic accuracy of the method in comparison with FFR is comparable with the already well-proven stress-echoCG. The use of PCT with TEES in combination with CTA can be considered as a promising diagnostic tool in patients without known coronary anatomy and with suspected ACS.
For citation: Omarov Yu.A., Veselova T.N., Shakhnovich R.M., Sukhinina T.S., Zhukova N.S., Merkulova I.N., Barysheva N.A., Pevzner D.V., Shitov V.N., Atabaeva L.S., Khangoev R.O., Arutyunyan G.K., Mironov V.M., Merkulov E.V., Staroverov I.I., Ternovoy S.K. Diagnostic efficiency of myocardial perfusion computed tomography with transesophageal pacing in patients with an initial diagnosis of acute coronary syndrome. Aterotromboz = Atherothrombosis. 2021;(1):128-143. (In Russ.) https://doi.org/10.21518/2307-1109-2021-11-1-128-143
Conflict of interest: the authors declare no conflict of interest.
Введение
Компьютерная томография (КТ) является основной визуализирующей методикой, использующейся для обследования больных с подозрением на острый коронарный синдром (ОКС) с низкой или средней предтестовой вероятностью: нетипичной клинической картиной, отсутствием признаков острой ишемии на электрокардиограмме (ЭКГ), нормальным уровнем сердечного тропонина [1, 2]. В многочисленных клинических исследованиях продемонстрировано, что отсутствие стенотических изменений в коронарных артериях (КА) по данным компьютерной томографической ангиографии (КТА) в абсолютном большинстве случаев исключает наличие ишемической болезни сердца (ИБС) [3, 4]. При выявлении стенозов в КА методом КТА важно определить их функциональную значимость, особенно когда стенозы характеризуются как пограничные – 50–75%.
С этой целью может использоваться перфузионная компьютерная томография миокарда (ПКТ) [5, 6]. Растущее число клинических исследований показывает, что комбинация методов ПКТ миокарда и КТА позволяет одномоментно проводить морфологическую и функциональную оценки коронарного атеросклероза с высокой точностью. При проведении ПКТ в качестве стресс-агентов, как правило, используются фармакологическое препараты [7]. В ранее опубликованной работе мы продемонстрировали возможность применения чреспищеводной электрокардиостимуляции (ЧПЭС), являющейся безопасным и эффективным методом стресс-теста [8]. Представляет интерес сравнение данной методики с уже хорошо зарекомендовавшими себя визуализирующими методами, в частности стресс-эхокардиографией (стресс-ЭхоКГ) в сочетании с велоэргометрией (ВЭМ). В силу доступности и высокой информативности данный метод широко используется в клинической практике, его применение имеет высокий класс (I) и уровень доказательности (B) в рекомендациях Европейского общества кардиологов по лечению ОКС без подъема сегмента ST (ОКСбпST) от 2020 г. [2].
В исследование включены больные с подозрением на ОКС, а также пациенты с подтвержденным острым инфарктом миокарда (ОИМ), у которых в ходе проведения коронарной ангиографии (КАГ) были выявлены пограничные стенозы в инфаркт-несвязанных артериях. В качестве референтной методики использовалось инвазивное измерение фракционного резерва кровотока (ФРК), являющееся на сегодняшний день золотым стандартом определения гемодинамической значимости стеноза [9].
Согласно данным многочисленных исследований, ФРК-ориентированный подход к реваскуляризации ассоциируется со снижением риска развития сердечно-сосудистых осложнений, включающих ОИМ и смерть [10], а пороговым значением измерения считается 0,8 [8].
Цель исследования – оценить диагностическую точность методов ПКТ миокарда с ЧПЭС и стресс-ЭхоКГ с ВЭМ в выявлении преходящей ишемии у больных с исходным диагнозом ОКС и пограничными стенозами (50–75%) в КА в сравнении c инвазивным измерением ФРК.
Материалы и методы
В период с февраля 2019 по декабрь 2020 г. в исследование были включены 30 человек, поступившие в блок реанимации и интенсивной терапии, из которых 22 пациента с подозрением на ОКС и выявленным пограничным (50–75%) стенозом в КА по данным КТА и 8 пациентов с ОИМ, у которых выявлялся пограничный стеноз в инфаркт-несвязанных артериях при проведении КАГ. Всем исследуемым проведены ПКТ на томографе с 320‑рядным детектором в сочетании со стресс-тестом ЧПЭС, стресс-ЭхоКГ с ВЭМ и инвазивное измерение ФРК.
В группу с подозрением на ОКС включены пациенты без значимого повышения уровня сердечного тропонина в крови и отсутствием ишемических изменений на ЭКГ. Вместе с тем клиническая картина позволяла заподозрить наличие ОКС. Диагноз ОИМ устанавливался согласно критериям четвертого универсального определения инфаркта миокарда (ИМ) от 2018 г. [11]: выявление повышения и/или последующего снижения уровня маркеров повреждения миокарда (предпочтительнее тропонина) более 99‑го перцентиля верхней границы нормы и хотя бы один из следующих признаков ишемии: клинические симптомы, электрокардиографические признаки (динамика сегмента ST или полная блокада левой ножки пучка Гиса), появление патологического зубца Q, уменьшение массы жизнеспособного миокарда по данным визуализирующих методов или появление новых зон нарушений локальной сократимости.
Критерии исключения из исследования: наличие более одного стеноза в артерии > 50%, свежего очагового поражения или постинфарктного рубца в бассейне исследуемой артерии, почечная недостаточность (скорость клубочковой фильтрации < 50 мл/мин/1,73 м2), аллергические реакции на йодсодержащие препараты в анамнезе, беременность и период кормления грудью, тяжелые сопутствующие заболевания, самостоятельно влияющие на прогноз, наличие противопоказаний к проведению ЧПЭС, стресс-ЭхоКГ с ВЭМ, клаустрофобия.
Больных, которым невозможно было выполнить нагрузочную пробу на ВЭМ при проведении стресс-ЭхоКГ (заболевания опорно-двигательного аппарата, ишемия нижних конечностей), произвести оценку КА при КТА (выраженный кальциноз, наличие артефактов), не включали в исследование.
Прием антиангинальных препаратов, включая бета-адреноблокаторы, был прекращен за 48 ч до проведения стресс-тестов. Пациентам с подозрением на ОКС КТ проводили в течение первых суток поступления в стационар.
Больным с ОИМ исследования проводили на 7–10‑е сутки заболевания.
Клиническая характеристика пациентов, включенных в исследование, представлена в табл. 1.
Таблица 1. Клиническая характеристика пациентов с подозрением на острый коронарный синдром (n = 22) и острый инфаркт миокарда (n = 8)
Общее число пациентов | 30 | 100 |
Средний возраст, годы | 64 ± 7,9 | |
Пол, м/ж | 22/8 | 73/27м |
Постинфарктный кардиосклероз | 12 | 40 |
Стентирование в анамнезе | 10 | 33 |
Артериальная гипертония | 24 | 80 |
Гиперхолестеринемия | 20 | 67 |
Сахарный диабет | 8 | 27 |
Курение | 15 | 50 |
ОНМК в анамнезе | 1 | 3 |
Отягощенная наследственность | 13 | 43 |
Примечание. ОКС – острый коронарный синдром, ОИМ – острый инфаркт миокарда, ОНМК – острое нарушение мозгового кровообращения, м – мужчины, ж – женщины.
Компьютерная томографическая ангиография коронарных артерий. КТА проводили на томографе с 320‑рядным детектором (Canon AQUILION ONE GENESIS 640, Япония). За один оборот рентгеновской трубки продолжительностью 0,275 с одновременно выполнялось 640 томографических срезов толщиной 0,5 мм с внутривенным введением 50–60 мг (в зависимости от массы тела больного) контрастного препарата с концентрацией йода 350–370 мг/мл.
Напряжение на рентгеновской трубке составляло 100 кВ при индексе массы тела (ИМТ) < 25 кг/м2 (120 кВ при ИМТ ≥ 25 кг/м2). После выполнения топограммы грудной клетки проводили разметку зоны интереса от уровня на 1 см выше корня аорты и до уровня диафрагмы. Контрастный препарат вводили внутривенно со скоростью 5 мл/с автоматическим шприцем. Артериальная фаза исследования начиналась автоматически при достижении пиковой концентрации контрастного препарата в просвете корня аорты. Использовалась проспективная ЭКГ-синхронизация в диапазоне интервала R –R от 75 до 95%. При частоте сердечных сокращений (ЧСС) > 65 уд/мин применяли пероральный или внутривенный бета-адреноблокатор.
Протокол проведения перфузионной компьютерной томографии миокарда. Протокол включал две фазы исследования КТА: выполненную на фоне стресс-теста ЧПЭС (фаза стресса) и в покое с одинаковыми параметрами томографии и дозами контрастного вещества. У пациентов, включенных в исследование на основании данных КТА КА, при проведении ПКТ выполняли только исследование фазы стресса, а оценку перфузии миокарда в покое проводили на основании изображений, полученных при первичной КТ.Стресс-тест с ЧПЭС выполняли с помощью чреспищеводного электрокардиостимулятора «Эзотест ДМС».
Исследование проводили натощак, исключая прием пищи за 3–4 ч.
Фаза стресса. В начале исследования выполняли топограмму в боковой и прямой проекциях, по которой устанавливали границы зоны исследования: от бифуркации трахеи и до нижней границы сердца. После этого начинали стресс-тест: во время нахождения пациента на столе компьютерного томографа под контролем параметров 12‑канальной ЭКГ, артериального давления (АД) инициировали ЧПЭС, начиная с частоты на 20 имп/мин меньше субмаксимальной ЧСС, рассчитанной по формуле: 0,75 x (220 – возраст пациента). В дальнейшем каждую минуту, не прекращая стимуляции, дискретно увеличивали частоту ритма на 10 имп/мин в течение 3 мин до достижения субмаксимальной ЧСС – по минуте на каждой ступени. При возникновении атриовентрикулярной блокады II степени с периодами Самойлова – Венкебаха внутривенно вводили 1 мг атропина сульфата. Последнюю ступень стимуляции выполняли при максимальной ЧСС в течение 3 мин. Суммарное время стимуляции составляло 6 мин. В конце 6‑й минуты стимуляции через периферический венозный катетер начиналось автоматическое введение контрастного вещества, и при достижении его пиковой концентрации в проекции корня аорты одномоментно прекращалась стимуляция и проводилась КТА. Средняя ЧСС после прекращения стимуляции составила 64 уд/мин.
Фаза покоя. Исследование в покое проводили через 20 мин после фазы стресса. При ЧСС > 65 уд/мин применяли бета-адреноблокатор перорально или внутривенно.
Средняя доза лучевой нагрузки на пациента составила 11,8 ± 4,4 мЗв.
Протокол проведения исследования схематично изображен на рис. 1.
Рисунок 1. Протокол проведения перфузионной компьютерной томографии
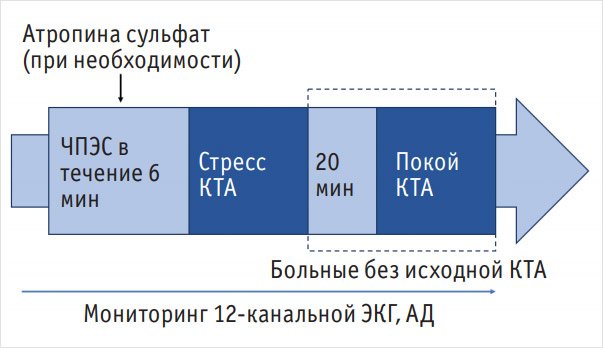
Примечание. ЧПЭС – чреспищеводная электрокардиостимуляция, КТА – компьютерная томографическая ангиография, ЭКГ – электрокардиограмма, АД – артериальное давление.
Анализ состояния коронарных артерий по данным компьютерной томографической ангиографии в покое. Изображения КТА были проанализированы опытным специалистом.
Визуально оценивалась степень стеноза каждого коронарного сегмента. При наличии одного стеноза 50–75% и без других стенозов в артерии ≥ 50% больного включали в исследование.
Анализ перфузии миокарда. C помощью реконструкций полученных изображений выбирали фазу с наименьшим количеством артефактов. Изображения оценивали два специалиста в соответствии с 17‑сегментной моделью Американской кардиологической ассоциации [12], исключая верхушку левого желудочка (ЛЖ). Каждый из 16 сегментов миокарда оценивали по отсутствию или наличию дефекта контрастирования миокарда (дефекта перфузии) при визуальной оценке. Дефектом контрастирования считали более темный участок пониженной рентгеновской плотности миокарда по отношению к остальным сегментам ЛЖ. Специалисты, оценивающие дефекты перфузии миокарда, не знали о локализации стенозов в КА.
Протокол проведения стресс-эхокардиографии с велоэргометрией. Для проведения стресс-ЭхоКГ использовались ультразвуковой прибор экспертного класса Philips ie 33 (Германия), полугоризонтальный велоэргометр, автоматизированный комплекс «Астрокард – КардиоЭфи» (АО «Медитек», Россия).
Исходно проводилась запись эхокардиографических изображений из стандартных позиций: парастернальный доступ – по короткой и длинной осям ЛЖ; апикальный доступ – четырехкамерная, двухкамерная и трехкамерная позиции. Далее выполнялась нагрузочная проба по стандартному протоколу велоэргометрии с начальной нагрузкой 25 Вт и ступенчатым приростом нагрузки на 25 Вт каждые 2 мин до достижения критериев прекращения пробы. В течение всего исследования проводились непрерывная запись ЭКГ, измерение АД на каждой ступени, контроль клинического состояния пациента. На максимуме нагрузки повторно проводилась запись изображений из стандартных позиций, как показано выше.
Критериями прекращения пробы являются:
достижение субмаксимальной ЧСС (75–80% от рассчитанной по возрасту и полу максимальной ЧСС);
появление новых нарушений локальной сократимости или усугубление исходных;
мышечная усталость;
появление пресинкопальных состояний, тяжелого ангинального приступа;
высокая артериальная гипертензия (более 220/120 мм рт. ст.) или симптомная гипотония;
возникновение значимых нарушений ритма сердца: желудочковой тахикардии (ЖТ), частых одиночных или парных желудочковых экстрасистол (ЖЭС), симптомной фибрилляции предсердий (ФП).
Для определения выраженности и распространенности ишемии миокарда использовались 17‑сегментарная модель ЛЖ и качественная четырехбалльная шкала оценки сократимости анализируемых сегментов, где 1 – нормальная сократимость, 2 – гипокинезия, 3 – акинезия, 4 – дискинезия.
Коронарная ангиография и фракционный резерв кровотока. КАГ выполняли на аппарате Philips Allura Xper FD10 (Германия) с применением катетера диметром 6F, который устанавливается в устье КА лучевым доступом.
Для контрастирования КА использовали неионные йодсодержащие контрастные препараты. Количественный анализ ангиограмм проводили визуально и автоматически с помощью системы Xcelera.
Для измерения ФРК с целью достижения дилатации эпикардиальных артерий интракоронарно вводили 250 мкг нитроглицерина. Затем интракоронарный датчик для измерения давления подводили к кончику направляющего катетера для измерения давления в проксимальной части коронарного русла. После нормализации кривых давления интракоронарный датчик проводили дистальнее стеноза в КА. Максимальная гиперемия достигалась путем введения в артерию папаверина (для левой коронарной артерии 20 мг, для правой – 12 мг). После этого измеряли ФРК с последующей мануальной обратной тракцией датчика по направлению к устью артерии для определения гемодинамической значимости атеросклеротической бляшки на различных уровнях КА. При ФРК ≥ 0,80 констатировали гемодинамически незначимое, при ФРК < 0,80 – гемодинамически значимое поражение артерии.
Статистический анализ. Математическую обработку полученных данных осуществляли с помощью программы MedCalc 19.2.0. Чувствительность, специфичность, прогностическую ценность положительного результата (ПЦПР)и прогностическуюценностьотрицательного результата (ПЦОР) рассчитывали для прогнозирования способности ПКТ и стресс-ЭхоКГ подтвердить или исключить ишемию в зоне кровоснабжения исследуемой артерии при сравнении с результатами измерений ФРК.
Результаты
В исследование были включены 22 пациента с подозрением на ОКС и 8 пациентов с ОИМ с пограничными стенозами в КА по результатам КТА или КАГ. Из 30 больных у 16 (54%) пограничный стеноз был локализован в передней нисходящей артерии, у 6 (20%) – в правой КА, у 4 (13%) – в огибающей артерии, у 3 (10%) – в артерии тупого края и у одного пациента (3%) – в диагональной артерии. У 5 пациентов степень стеноза составляла 50–59%, у 9 пациентов – 60–69%, у 16 пациентов – 70–75%.
Все больные (n = 30) обследованы согласно заявленному протоколу. Осложнений при выполнении исследований не отмечено. При проведении ПКТ миокарда с ЧПЭС продолжительность навязывания искусственного ритма составила 6 мин. Введение атропина сульфата во время проведения фазы стресса с ЧПЭС потребовалось 4 пациентам.У двух больных на последней ступени стимуляции отмечался дискомфорт в грудной клетке без ишемической динамики на ЭКГ. Болевой синдром купировался самостоятельно в течение 1 мин после прекращения стимуляции.
По данным ПКТ отмечено 9 (30%) положительных и 21 (70%) отрицательный результат. В 6 случаях с положительным результатом степень исследуемого стеноза составила 70–75%, в 3 случаях – 60–69%. Согласованность заключений специалистов составила 93%.
При проведении стресс-ЭхоКГ во всех случаях пробы доведены до диагностических критериев. Ишемическая динамика на ЭКГ отмечалась у двух пациентов (7%), боли в грудной клетке – у трех (10%). По результатам стресс-ЭхоКГ получено 10 (33%) положительных и 20 (67%) отрицательных результатов.
В 7 случаях с положительным результатом степень исследуемого стеноза составляла 70–75%, в 3 случаях – 60–69%. Толерантность к физическим нагрузкам оказалась высокой у 20 (67%), средней – у 8 (27%), низкой – у 2 (6%) пациентов.
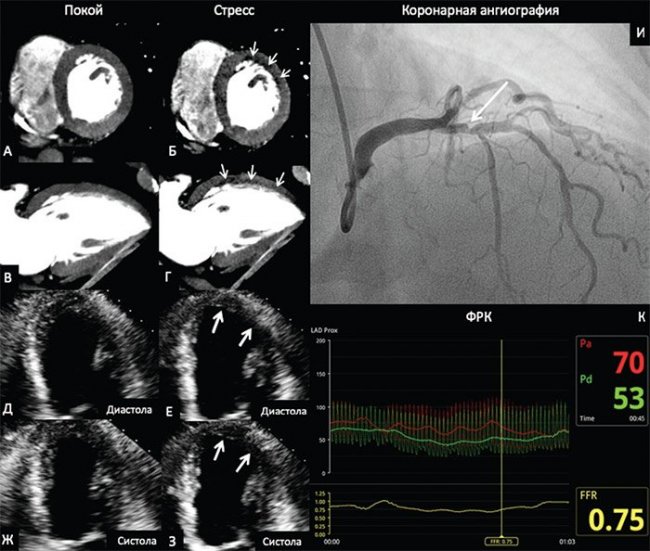
В качестве примера на рис. 2 приведены данные ПКТ с ЧПЭС, стресс-ЭхоКГ с ВЭМ и КАГ с ФРК больного 69 лет с ОКС. По данным ПКТ был выявлен преходящий дефект перфузии, а при проведении стресс-ЭхоКГ – гипокинез средних сегментов, верхушечных передней и переднебоковой локализации. При КАГ выявлен стеноз 70% проксимального сегмента передней нисходящей артерии, значение ФРК составило 0,75.
Рисунок 2. Перфузионная компьютерная томография миокарда, стресс-эхокардиография и коронарная ангиография с измерением фракционного резерва кровотока
На изображениях ПКТ в покое (рис. 2А, 2В) определяется равномерное контрастирование миокарда ЛЖ. На эхокардиограмме в апикальной четырехкамерной позиции (рис. 2Д, 2Ж) отсутствуют зоны нарушения локальной сократимости ЛЖ в покое. На фоне проведения стресс-теста на изображениях ПКТ (рис. 2Б, 2Г) определяется зона пониженного контрастирования (зона дефекта перфузии – стрелки) переднебоковой локализации ЛЖ. На эхокардиограммах в фазе стресса (рис. 2Е, 2З) определяется зона гипокинеза переднебоковой локализации ЛЖ (рис. 2, стрелки). На коронарограмме (рис. 2И) визуализируется 70%-й стеноз проксимального сегмента передней нисходящей артерии (рис. 2И, стрелка). ФРК составил 0,75, что свидетельствует о гемодинамической значимости стеноза.
У всех пациентов с подозрением на ОКС (n = 22) выявленные по данным КТА пограничные стенозы впоследствии подтвердились при проведении КАГ.
Всем 30 больным было проведено измерение ФРК исследуемых стенозов. У 16 (53%) пациентов показатели ФРК указывали на гемодинамическую значимость стеноза. Среднее значение ФРК составило 0,76 ± 0,12. В случае 50–59% стенозов показатель значения ФРК < 0,8 был у 2 пациентов (13%), 60–69% – у 4 (25%) и 70–75% – у 10 (62%) пациентов.
ПКТ с ЧПЭС выявила ФРК-значимые стенозы с чувствительностью, специфичностью, ПЦПР и ПЦПОР 56, 93, 90 и 65% соответственно (табл. 2). Дефекты перфузии по данным ПКТ у 9 из 16 пациентов были истинно положительными, у 13 из 14 пациентов – истинно отрицательными (табл. 3).
Таблица 2. Диагностическая точность перфузионной компьютерной томографии и стрессэхокардиографии в сравнении с измерениями фракционного резерва кровотока, %
| ПКТ | 56 | 93 | 90 | 65 |
| Стресс-ЭхоКГ | 62 | 93 | 91 | 68 |
Таблица 3. Сопоставимость наличие дефекта перфузии по данным перфузионной компьютерной томографии со значениями фракционного резерва кровотока
| ПКТ | ФРК < 0,8 | ФРК ≥ 0,8 |
| Дефект перфузии есть | 9 (ИП) | 1 (ЛП) |
| Дефекта перфузии нет | 7 (ЛО) | 13 (ИО) |
Примечание. ПКТ – перфузионная компьютерная томография, ФРК – фракционный резерв кровотока, ИП – истинно положительный, ЛП – ложноположительный, ЛО – ложноотрицательный, ИО – истинно отрицательный.
Схожие показатели продемонстрировала стресс-ЭхоКГ: чувствительность специфичность, ПЦПР и ПЦОР составили 62, 93, 91, 68% соответственно (табл. 2), у 10 из 16 пациентов проба была истинно положительная, у 13 из 14 – истинно отрицательная (табл. 4).
Таблица 4. Сопоставимость наличия признаков ишемии миокарда левого желудочка по данным стресс-эхокардиографии со значениями фракционного резерва кровотока
| Стресс-ЭхоКГ | ФРК < 0,8 | ФРК ≥ 0,8 |
| Нарушение локальной сократимость есть | 10 (ИП) | 1 (ЛП) |
| Нарушения локальной сократимости нет | 6 (ЛО) | 13 (ИО) |
Обсуждение
Инвазивное измерение ФРК считается эталонным методом оценки гемодинамической значимости стенозов коронарных артерий и определения показаний к реваскуляризации миокарда [8]. В реальной клинической практике с этой целью чаще используются неинвазивные тесты, прежде всего – стресс-ЭхоКГ.Это обусловлено доступностью данной методики, достаточно низкой стоимостью, возможностью избежать проведения инвазивного исследования и в ряде случаев лучевой нагрузки [13]. При этом недостатками метода являются технические ограничения, связанные с артефактами и плохим окном визуализации грудной клетки, а также большая зависимость метода от опыта оператора [14]. Согласно рекомендациям Европейского общества кардиологов по хроническому коронарному синдрому от 2019 г., стресс-ЭхоКГ в первую очередь следует использовать у больных с высокой клинической вероятностью наличия ИБС. Для пациентов с низкой или средней предтестовой вероятностью ОКС, ИБС наиболее предпочтительным методом диагностики является КТА [1]. В случае выявления пограничных стенозов при проведении КТА сочетание этого метода с ПКТ позволяет оценить наличие и локализацию преходящей ишемии.
Комбинация КТА и ПКТ с применением фармакологических проб в качестве стресс-теста показала высокую диагностическую точность в выявлении ИБС в ряде клинических исследований [15, 16]. В нашей работе ПКТ с ЧПЭС в сравнении с золотым стандартом ФРК у больных с пограничными стенозами в КА продемонстрировала достаточно высокую специфичность и ПЦПР: 93 и 90% соответственно. Однако чувствительность и ПЦОР оказались относительно невысокими: 56 и 65% соответственно. СтрессЭхоКГ продемонстрировала схожие показатели: чувствительность, специфичность, ПЦПР и ПЦОР составили 62, 93, 91, 68% соответственно. Таким образом, диагностическая точность исследуемой нами методики оказалась сопоставима с эффективностью стресс-ЭхоКГ, наиболее часто используемой в реальной клинической практике.
В рекомендациях Американского общества эхокардиографии по стресс-ЭхоКГ говорится о высокой точности метода для выявления ИБС по сравнению с КАГ в качестве золотого стандарта [17]. По данным многочисленных исследований средняя чувствительность составляет 88%, средняя специфичность – 83%. При анализе отдельных работ, взятых для расчета этих показателей, становится очевидным, что значения чувствительности существенно варьируются (45–96%) в зависимости от степени стенозирования КА, используемого стрессового агента, количества включенных пациентов. Наиболее высокая чувствительность (96%) наблюдалась в исследованиях с использованием миокардиальной контрастной стресс-ЭхоКГ [18]. В случае применения стандартной стресс-ЭхоКГ эти показатели значительно ниже [19, 20]. При проведении анализа подгрупп пациентов с различной степенью стенозирования в КА чувствительность стресс-ЭхоКГ для выявления стенозов более 70% оказалась существенно выше, чем для стенозов 50–69% [21]. В наше исследование включены больные с пограничными изменениями в коронарных артериях – 50–75%, что объясняет относительно невысокую чувствительность методов. В исследованиях, анализирующих диагностическую точность стресс-ЭхоКГ по отношению к измерениям ФРК, продемонстрированы сопоставимые результаты. Так, в исследовании COMPRESS проводилась оценка функциональной значимости пограничных коронарных стенозов.
Чувствительность и специфичность стресс-ЭхоКГ при сравнении с показателями измерений ФРК составили 67 и 77% соответственно [22].
Использование контрастного усиления при проведении стресс-ЭхоКГпозволяет оценить перфузию миокарда и увеличивает чувствительность метода [23].Литературные данные говорят о том, что чувствительность контрастной ЭхоКГ в выявлении стрессовых нарушений перфузии миокарда и ишемии миокарда может быть выше чувствительности ФРК.Это связывают с возможностью измерения скорости и объема капиллярной крови, стрессовые нарушения которых могут появляться раньше прогностически значимого снижения ФРК [24, 25]. В свою очередь, ПКТ, оценивающая перфузию миокарда, также могла бы продемонстрировать более высокую чувствительность, чем стандартная стресс-ЭхоКГ. Этого не было показано в нашем исследовании, что, возможно, связано с использованием подхода статической ПКТ. Применение динамической ПКТ дает возможность провести более точную количественную оценку перфузионных нарушений миокарда. Такая оценка основана на измерениях миокардиального кровотока, его отношении к объему с помощью математических моделей, применимых к кривым затухания во времени [26]. Сканирование начинается за 4–6 с до появления контрастного вещества в грудном отделе аорты и продолжается в течение 30 с. Анализируются изображения, полученные в систоле ЛЖ. К минусам метода можно отнести более высокую лучевую нагрузку в сравнении со статической ПКТ [27].
Также к ограничению можно отнести необходимость продолжительной задержки дыхания, что затруднительно для пациентов с патологиейорганов дыхания.
Многочисленные исследования показали, что отсутствие преходящей ишемии по данным стресс-ЭхоКГ ассоциируется с благоприятным прогнозом. Сведений о прогностическом значении наличия пограничных стенозов в КА немного [15]. Так, в исследовании T. Giesler et al. в течение 22 мес. проводилось наблюдение за 47 пациентами с пограничными стенозами в коронарных артериях [28]. Частота сердечно-сосудистых событий (смерть и ИМ) у больных в группе с отрицательным результатом стресс-ЭхоКГ,продолживших консервативное лечение, и в группе пациентов с положительным результатом теста, которым впоследствии было проведено стентирование, равнялась нулю. В 2018 г. были опубликованы результаты метаанализа по изучению прогностического влияния неинвазивных диагностических тестов, использованных для выявления коронарного атеросклероза [29]. В работу включены пациенты с подозрением на ОКС с низким риском сердечно-сосудистых событий (18 рандомизированных исследований) или стабильную ИБС (11 исследований). У больных ОКС низкого риска начальная диагностическая стратегия с использованием стресс-ЭхоКГ и магнитно-резонансной томографии приводила к меньшему количеству направлений на КАГ и процедуры реваскуляризации, чем КТА без видимого влияния на будущий риск ИМ. При подозрении на стабильную ИБС не было четкой разницы между диагностическими стратегиями в отношении последующей необходимости КАГ, наблюдалась тенденция к снижению риска развития ИМ в группе больных с первичным использованием КТА. ПКТ не использовалась в анализируемых исследованиях, хотя ранее было продемонстрировано, что использование ПКТ в сочетании с КТА существенно улучшает специфичность последней [30]. Комбинированный анализ КТА и ПКТ представляется перспективным методом диагностики для вышеописанных групп больных. Недоступность большинства вазодилатирующих стрессовых агентов в нашей стране может способствовать применению ЧПЭС в качестве стресс-теста при проведении ПКТ.
Очевидным преимуществом визуализации методом КТА/ПКТ является возможность количественно оценить стенозы в коронарных артериях и определить их функциональную значимость, что могло бы потенциально сделать его универсальным методом диагностики у пациентов с подозрением на ОКС, ИБС. На сегодняшний день у данной методики имеются ограничения. Так, при многососудистом поражении коронарного русла из‑за диффузного снижения сократимости возможна недооценка гипоперфузии, а при высокой ЧСС – наличие артефактов [5].У ЧПЭС также имеются свои ограничения.
Иногда тест невозможно провести из‑за плохой переносимости пациентом, повышенного рвотного рефлекса. Противопоказаниями являются заболевания пищевода: опухоль, дивертикулез, стриктуры, ахалазия. По данным представленного исследования, несмотря на умеренные значения чувствительности ПКТ, точность метода сопоставима с уже хорошо зарекомендовавшей себя стресс-ЭхоКГ. Для дальнейшего изучения диагностических возможностей метода нужны более крупные исследования с включением различных групп пациентов, проведением комбинированного анализа КТА и ПКТ с оценкой прогностического значения выявленных изменений.
Выводы
Диагностическая точность визуализации перфузионных нарушений по данным ПКТ сопоставима с оценкой преходящей ишемии по данным стресс-ЭхоКГ. Комбинированная оценка перфузии миокарда и состояния КА при проведении ПКТ потенциально делает данную методику универсальной для обследования больных с пограничными стенозами КА. Для внедрения ПКТ в клиническую практику необходимо проведение дальнейших исследований, включающих большее количество пациентов с ИБС.
Список литературы / References
Knuuti J., Wijns W., Saraste A., Capodanno D., Barbato E., Funck-Brentano C. et al. 2019 ESC Guidelines for the Diagnosis and Management of Chronic Coronary Syndromes. Eur Heart J. 2020;41(3):407-477. https://doi.org/10.1093/eurheartj/ehz425.- Collet J.P., Thiele H., Barbato E., Barthélémy O., Bauersachs J., Bhatt D.L. et al. 2020 ESC Guidelines for the Management of Acute Coronary Syndromes in Patients Presenting without Persistent ST-Segment Elevation. Eur Heart J. 2021;42(14):1289-1367. https://doi.org/10.1093/eurheartj/ehaa575. 3. Douglas P.S., Hoffmann U., Patel M.R., Mark D.B., Al-Khalidi H.R., Cavanaugh B. Outcomes of Anatomical versus Functional Testing for Coronary Artery Disease. N Engl J Med. 2015;372(14):1291-300. https://doi.org/10.1056/NEJMoa1415516.
- Newby D.E., Adamson P.D., Berry C., Boon N.A., Dweck M.R., Flather M. et al. Coronary CT Angiography and 5-Year Risk of Myocardial Infarction. N Engl J Med. 2018;379(10):924-933. https://doi.org/10.1056/NEJMoa1805971.
- Seitun S., Castiglione Morelli M., Budaj I., Boccalini S., Galletto Pregliasco A., Valbusa A. et al. Stress Computed Tomography Myocardial Perfusion Imaging: A New Topic in Cardiology. Rev Esp Cardiol (Engl Ed). 2016;69(2):188-200. https://doi.org/10.1016/j.rec.2015.10.018.
- Веселова Т.Н., Омаров Ю.А., Шахнович Р.М., Миронов В.М., Арутюнян Г.К., Терновой С.К. и др. Диагностическая эффективность перфузионной компьютерной томографии миокарда и неинвазивного измерения фракционного резерва кровотока по данным компьютерной томографической ангиографии. Russian Electronic Journal of Radiology. 2020;10(3):150-155. https://doi.org/10.21569/2222-7415-2020-10-3-150-155.
- De Cecco C.N., Varga-Szemes A., Meinel F.G., Renker M., Schoepf U.J. Beyond Stenosis Detection: Computed Tomography Approaches for Determining the Functional Relevance of Coronary Artery Disease. Radiol Clin North Am. 2015;53(2):317-334. https://doi.org/10.1016/j.rcl.2014.11.009.
- Омаров Ю.А., Веселова Т.Н., Шахнович Р.М., Сухинина Т.С., Жукова Н.С., Меркулова И.Н. и др. Перфузионная компьютерная томография миокарда с чреспищеводной электрокардиостимуляцией в качестве стресс-теста у больных с пограничными стенозами в коронарных артериях: сравнение с измерениями фракционного резерва кровотока. Кардиология. 2021;61(1):4-11. https://doi.org/10.18087/cardio.2021.1.n1343.
- Neumann F.J., Sousa-Uva M., Ahlsson A., Alfonso F., Banning A.P., Benedetto U. et al. 2018 ESC/EACTS Guidelines on Myocardial Revascularization. Eur Heart J. 2019;40(2):87-165. https://doi.org/10.1093/eurheartj/ehy394.
- Johnson N.P., Tóth G.G., Lai D., Zhu H., Açar G., Agostoni P. et al. Prognostic Value of Fractional Flow Reserve: Linking Physiologic Severity to Clinical Outcomes. J Am Coll Cardiol. 2014;64(16):1641-1654. https://doi.org/10.1016/j.jacc.2014.07.973.
- Thygesen K., Alpert J.S., Jaffe A.S., Chaitman B.R., Bax J.J., Morrow D.A., White H.D. Fourth Universal Definition of Myocardial Infarction (2018). Eur Heart J. 2019;40(3):237-269. https://doi.org/10.1093/eurheartj/ehy462.
- Cerqueira M.D., Weissman N.J., Dilsizian V., Jacobs A.K., Kaul S., Laskey W.K. et al. Standardized myocardial segmentation and nomenclature for tomographic imaging of the heart. A statement for healthcare professionals from the Cardiac Imaging Committee of the Council on Clinical Cardiology of the American Heart Association. Circulation. 2002;105(4):539-542. https://doi.org/10.1161/hc0402.102975.
- Balfour P.C. Jr, Gonzalez J.A., Kramer C.M. NonInvasive Assessment of Low- and Intermediate-Risk Patients with Chest Pain. Trends Cardiovasc Med. 2017;27(3):182-189. https://doi.org/10.1016/j.tcm.2016.08.006.
- Seitun S., De Lorenzi C., Cademartiri F., Buscaglia A., Travaglio N., Balbi M., Bezante G.P. CT Myocardial Perfusion Imaging: A New Frontier in Cardiac Imaging. Biomed Res Int. 2018;7295460. https://doi.org/10.1155/2018/7295460.
- Magalhães T.A., Kishi S., George R.T., Arbab-Zadeh A., Vavere A.L., Cox C. et al. Combined Coronary Angiography and Myocardial Perfusion by Computed Tomography in the Identification of Flow-Limiting Stenosis - The CORE320 Study: An Integrated Analysis of CT Coronary Angiography and Myocardial Perfusion. J Cardiovasc Comput Tomogr. 2015;9(5):438-445. https://doi.org/10.1016/j.jcct.2015.03.004.
- Cury R.C., Kitt T.M., Feaheny K., Blankstein R., Ghoshhajra B.B., Budoff M.J. et al. A Randomized, Multicenter, Multivendor Study of Myocardial Perfusion Imaging with Regadenoson CT Perfusion vs Single Photon Emission CT. J Cardiovasc Comput Tomogr. 2015;9(2):103-112.e1-2. https://doi.org/10.1016/j.jcct.2015.01.002.
- Pellikka P.A., Arruda-Olson A., Chaudhry F.A., Chen M.H., Marshall J.E., Porter T.R., Sawada S.G. Guidelines for Performance, Interpretation, and Application of Stress Echocardiography in Ischemic Heart Disease: From the American Society of Echocardiography. J Am Soc Echocardiogr. 2020;33(1):1.e8-41.e8. https://doi.org/10.1016/j.echo.2019.07.001.
- Gaibazzi N., Rigo F., Reverberi C. Detection of Coronary Artery Disease by Combined Assessment of Wall Motion, Myocardial Perfusion and Coronary Flow Reserve: A Multiparametric Contrast StressEchocardiography Study. J Am Soc Echocardiogr. 2010;23(12):1242-1250. https://doi.org/10.1016/j.echo.2010.09.003.
- Mordi I., Stanton T., Carrick D., McClure J., Oldroyd K., Berry C., Tzemos N. Comprehensive Dobutamine Stress CMR versus Echocardiography in LBBB and Suspected Coronary Artery Disease. JACC Cardiovasc Imaging. 2014;7(5):490-498. https://doi.org/10.1016/j.jcmg.2014.01.012.
- Shaikh K., Wang D.D., Saad H., Alam M., Khandelwal A., Brooks K. et al. Feasibility, Safety and Accuracy of Regadenoson-Atropine (REGAT) Stress Echocardiography for the Diagnosis of Coronary Artery Disease: An Angiographic Correlative Study. Int J Cardiovasc Imaging. 2014;30(3):515-522. https://doi.org/10.1007/s10554-014-0363-6.
- Celutkiene J., Zakarkaite D., Skorniakov V., Zvironaite V., Grabauskiene V., Burca J. et al. Quantitative Approach Using Multiple Single Parameters versus Visual Assessment in Dobutamine Stress Echocardiography. Cardiovasc Ultrasound. 2012;10:31. https://doi.org/10.1186/1476-7120-10-31.
- Rieber J., Jung P., Erhard I., Koenig A., Hacker M., Schiele T.M. et al. Comparison of Pressure Measurement, Dobutamine Contrast Stress Echocardiography and SPECT for the Evaluation of Intermediate Coronary Stenoses. The COMPRESS Trial. Int J Cardiovasc Intervent. 2004;6(3-4):142-147. https://doi.org/10.1080/14628840410030504.
- Атабаева Л.С., Саидова М.А., Шитов В.Н., Староверов И.И. Возможности контрастной стрессэхокардиографии в выявлении ишемии миокарда у больных с различным поражением коронарного русла. Терапевтический архив. 2020;92(4):45-50. https://doi.org/10.26442/00403660.2020.04.000506.
- Wu J., Barton D., Xie F., O’Leary E., Steuter J., Pavlides G., Porter T.R. Comparison of Fractional Flow Reserve Assessment with Demand Stress Myocardial Contrast Echocardiography in Angiographically Intermediate Coronary Stenoses. Circ Cardiovasc Imaging. 2016;9(8):e004129. https://doi.org/10.1161/CIRCIMAGING.116.004129.
- Wei K., Ragosta M., Thorpe J., Coggins M., Moos S., Kaul S. Noninvasive Quantification of Coronary Blood Flow Reserve in Humans Using Myocardial Contrast Echocardiography. Circulation. 2001;103(21):2560- 2565. https://doi.org/10.1161/01.cir.103.21.2560.
- Caruso D., Eid M., Schoepf U.J., Jin K.N., VargaSzemes A., Tesche C. et al. Dynamic CT Myocardial Perfusion Imaging. Eur J Radiol. 2016;85(10):1893- 1899. https://doi.org/10.1016/j.ejrad.2016.07.017.
- Danad I., Szymonifka J., Schulman-Marcus J., Min J.K. Static and Dynamic Assessment of Myocardial Perfusion by Computed Tomography. Eur Heart J Cardiovasc Imaging. 2016;17(8):836-844. https://doi.org/10.1093/ehjci/jew044.
- Giesler T., Lamprecht S., Voigt J.U., Ropers D., Pohle K., Ludwig J. et al. Long Term Follow Up after Deferral of Revascularisation in Patients with Intermediate Coronary Stenoses and Negative Dobutamine Stress Echocardiography. Heart. 2002;88(6):645-646. https://doi.org/10.1136/heart.88.6.645.
- Siontis G.C., Mavridis D., Greenwood J.P., Coles B., Nikolakopoulou A., Jüni P. et al. Outcomes of nonInvasive Diagnostic Modalities for the Detection of Coronary Artery Disease: Network Meta-Analysis of Diagnostic Randomised Controlled Trials. BMJ. 2018;360:k504. https://doi.org/10.1136/bmj.k504.
- Tanabe Y., Kurata A., Matsuda T., Yoshida K., Baruah D., Kido T. et al. Computed Tomographic Evaluation of Myocardial Ischemia. Jpn J Radiol. 2020;38(5):411- 433. https://doi.org/10.1007/s11604-020-00922-8.




 1
1 2
2 3
3 4
4


Комментарии (0)