
Журнал "Медицинский совет" №6/2023
DOI:
10.21518/ms2023-026
М.Д. Ардатская 1 , А.А. Аночкин 2 , Л.И. Буторова 2 , А.И. Павлов 3,4 , Н.Р. Нугаева 2 , Ж.В. Фадина 3
1 Центральная государственная медицинская академия Управления делами Президента Российской Федерации; 121359, Россия, Москва, ул. Маршала Тимошенко, д. 2 2 2 19, стр. 2 1а 2 Филиал Военно-медицинской академии (г. Москва); 107061, Россия, Москва, ул. Малая Черкизовская, д. 2 2 2 7 3 Национальный медицинский исследовательский центр высоких технологий – Центральный военный госпиталь имени А.А. Вишневского; 143420, Россия, Московская область, г.о. Красногорск, с. Новый, тер. 3, д. 3 3 3 1 4 Медицинский институт устойчивого образования Московского населения пищевых производств;125080, Россия, Москва, Волоколамское шоссе, д. 1 1 1 11
Введение . В последние годы диарейный синдром – наиболее часто встречающееся заболевание, проявляющееся негативным последствием антибактериальной терапии (АБТ), которое является первостепенной медико-социальной болезнью. Потенциальный риск развития антибиотик-ассоциированной диареи (ААД) имеется при распространении антибиотиком и при любой продолжительности курса лечения. В связи с этим требуется систематизация основных патогенетических аспектов формирования ААД и обоснование применения пробиотиков для профилактики ее развития и лечения.
Цель . Провести сравнительную частоту возникновения и переносимости синбиотики Флориоза, установка Bifidobacterium lactis Bl-04, Lactobacillus acidophilus La-14, Lactobacillus rhamnosus Lr-32, инулин, витамины группы В, и эубиотика Бифиформы на основе Enterococcus faecium, Bifidobacterium longum в предупреждении развития ААД на фоне болезни и после применения АБТ у стационарных пациентов.
Материалы и методы . В опыте принято участие 60 пациентов, стационарно проводившихся АБТ. 1-я группа (30 чел.) встретили синбиотик, 2-я группа (30 чел.) – эубиотик. Эффективность профилактического приема исследовалась исследованиями к 12-му и 28-му дню терапии. Проводился анализ оценки сердечной недостаточности и удовлетворенности лечением, исследованием короткоцепочечных жирных кислот (КЖК) методом газожидкостной хроматографии кала и экспресс-тестом на токсины А и В Clostridium difficile.
Результаты . В оккупации не фиксируются случаи развития ААД. Исследуемые следствия по оценке эффективности лечения и лечения пациентов. Выявлена тенденция к более высокому терапевтическому эффекту и удовлетворенности лечением с использованием синбиотика. Установлены изменения абсолютного и относительного содержания КЖК в кале пациентов от исходного уровня. Более выраженные положительные изменения количества и качественного состава кислот Флориоза на фоне лечения Бифиформы выявлены у пациентов, принимавших синбиотик и имевших более 3 факторов риска.
Выводы . Синбиотик Флориоза и пробиотик Бифиформ – профилактические средства профилактики ААД. Синбиотик имеет преимущество в общей оценке эффективности, проведенного лечения и удовлетворенности пациентов, выраженный протективный эффект на состояние микробиоценоза кишечника на фоне и после возникновения АБТ (что является проявлением динамики КЖК в кале), может являться препаратом выбора для профилактики ААД, в том числе ассоциированной с C. difficile, по очевидным проявлениям, более 3 факторов риска развития ААД.
Для цитирования: Ардатская М.Д., Анучкин А.А., Буторова Л.И., Павлов А.И., Нугаева Н.Р., Фадина Ж.В. Патогенетические аспекты развития и лечения антибиотикоассоциированной диареи: выбор синбиотики с признаками доказательной медицины. Медицинский Совет. 2023;(6):113-125. https://doi.org/10.21518/ms2023-026
Конфликт интересов: автор заявления об отсутствии конфликта интересов.
Патогенетические аспекты развития и лечения антибиотикоассоциированной диареи: выбор синбиотики с позициями доказательной медицины
Ардатская Мария Д. 1 , Аночкин А.А. 2 , Буторова Л.И. 2 , Павлов А.И. 3,4 , Нугаева Нелли Р. 2 , Фадина Жанна Владимировна 3
1 Центральная государственная медицинская академия Управления делами Президента Российской Федерации; 19, корп. 121359, Россия, г. Алматы, ул. Москва, ул. Маршала Тимошенко, д. 2 1а 2 Филиал Военно-медицинской академии (Москва); Россия, 107061, Москва, ул. Малая Черкизовская, д. 2 7 3 Национальный медицинский исследовательский центр высоких высоких технологий – Центральный военный госпиталь им. Вишневского; 1, Тер. Россия, 143420, Московская область, городской округ Красногорск, д. 2 Новый, д. 3 4 Медицинский институт труда Московский государственный университет пищевых производств; Россия, 125080, Москва, Волоколамское шоссе, 11
Введение . В последние годы диарейный синдром является наиболее частым клинически значимым негативным эффектом антибактериальной терапии (АБТ), что составляет первоочередную медико-социальную проблему. Назначение любого антибиотика на любую продолжительность лечения может вызвать потенциальный риск развития антибиотикоассоциированной диареи (ААД). В связи с этим возникает необходимость систематизации основных патогенетических аспектов развития ААД и обоснования применения пробиотиков для профилактики ее развития и лечения.
Цель . Провести сравнительную оценку эффективности, приверженности и переносимости синбиотика Флориоза, содержащего Bifidobacterium lactis Bl-04, Lactobacillus acidophilus La-14, Lactobacillus rhamnosus Lr-32, инулин, витамины группы В, и эубиотика Бифиформ, содержащего Enterococcus faecium, Bifidobacterium longum. для профилактики развития ААД во время и после применения АБТ в стационарных условиях.
Материалы и методы. Всего в исследование включено 60 пациентов, которым проводилась АБТ в условиях стационара: 1-я группа (30 больных) получала синбиотик, 2-я группа (30 больных) — эубиотик. Эффективность профилактического введения препаратов оценивали на 12-й и 28-й день терапии. Методы включали оценку пациентами эффективности и удовлетворенности лечением, анализ короткоцепочечных жирных кислот (КЦЖК) в фекалиях с помощью газожидкостной хроматографии и экспресс-теста на токсины A + B Clostridium difficile. Полученные результаты. В обеих группах случаев ААД выявлено не было. Исследуемые препараты были сопоставимы по оценке их эффективности врачом и пациентами. Отмечена тенденция к более высокой оценке терапевтического эффекта и удовлетворенности синбиотической терапией. Установлены изменения абсолютного и относительного содержания КЦЖК в кале больных от исходного уровня. Более выраженные положительные изменения количественного и качественного состава кислот на фоне лечения выявлены у больных, получавших синбиотик и имевших более 3 факторов риска.
Выводы . Синбиотик Флориоза и пробиотик Бифиформ являются эффективными препаратами для профилактики ААД. Синбиотик имеет преимущества с точки зрения общей оценки эффективности лечения и удовлетворенности пациентов, оказывает выраженное протекторное действие на состояние микробиоценоза кишечника во время и после проведения АБТ (о чем свидетельствуют изменения уровня КЦЖК в кале), может быть препаратом выбора для профилактики ААД, в том числе ААД, ассоциированного с C. difficile, у лиц с более чем 3 факторами риска развития ААД.
Для цитирования: Ардатская М.Д., Анучкин А.А., Буторова Л.И., Павлов А.И., Нугаева Н.Р., Фадина З.В. Патогенетические аспекты развития и лечения антибиотикоассоциированной диареи: выбор синбиотика с позиций доказательной медицины. Медицинский совет = Медицинский совет. 2023;(6):113-125. (На рус. языке) https://doi.org/10.21518/ms2023-026
Конфликт интересов: автор заявляет об отсутствии конфликта интересов.
Введение
Антибиотик-ассоциированная диарея (ААД) – это ослабление стула, хронологически связанное с применением антибиотиков при отсутствии других этиологических факторов диареи. В последние годы диарейный синдром, наиболее часто встречающийся в организме пациента с нежелательным последствием антибактериальной терапии (АБТ), является первостепенной медико-социальной болезнью. По данным исследования, у 30% пациентов, получающих антибиотики, отмечаются симптомы ААД. Более высокая частота ААД наблюдается у детей и полиморбидных пациентов пожилого возраста [1, 2].
ААД значительно влияет на комплаентность пациента, требует отмены или коррекции антимикробной терапии и часто вызывает персистенции или рецидив инфекции, утяжеляет течение заболевания, увеличивает стоимость лечения, вызывает появление резистентных штаммов заболеваний [3].
Важно отметить, что хотя симптомы AAD у большинства пациентов возникают обычно во время лечения, примерно у 30% пациентов возникают в пределах 7–10 дней после появления аллергических заболеваний ААД). Согласно собранию Всемирной организации здравоохранения (ВОЗ), под ААД следует понимать развитие двух и более эпизодов неоформленного стула в течение двух и более последующих дней, на фоне или в течение 2 мес. после применения антибактериальных препаратов.
Частота возникновения симптомов ААД чаще всего возникает при применении различных антибиотиков. В качестве причин развития ААД в странах Европы лидируют производные пенициллина и цефалоспорины, что приводит к их нарушению. Однако потенциальный риск развития ААД имеется при проведении любого антибиотика и при любой продолжительности курса лечения.
Механизмы формирования ААД гетерогенны. Большинство ученых считают, что универсальный патогенетический механизм ее развития является деструктивным воздействием антимикробных средств на микрофлору желудочно-кишечного тракта (ЖКТ), что связано с прямым бактерицидным и бактериостатическим статусом штамма, входящего в антимикробный спектр применения препарата. Лечение антибиотиками оказывает выраженное влияние на количество и качественный состав полостной, так и пристеночной микробиоты кишечника, что проявляется изменением увеличения и состава индигенной микробиоты, модификацией таксономического соотношения родов. Антибиотик-ассоциированный дисбиоз наиболее часто проявляется в виде значительного количества представителей Firmicutes и Bacteroidetes и избыточного роста Enterobacteriaceae,
Не имеет большого значения. При пероральном приеме отходов с исчезновением микрофлоры антибиотики оказывают местное воздействие на слизистую оболочку тонкой кишки; при парентеральном введении антибактериальные препараты воздействуют на биоценоз кишечника, выделяясь со слюной, желчью, секретом тонкой и толстой кишки.
Нарушения кишечной экологии проявляются склонностью к резидентной микробиоте, усиленным ростом условно-патогенных заболеваний, эндогенно присутствующих в микробиоте и (или) инвазии патогенных заболеваний [5].
Снижение метаболической активности облигатной микрофлоры, прерывание цепочек цепочек потребления и синтеза выделенных выделений штаммов, выявленных в спектре действия антибиотиков, сопровождающихся образованием различных отдельных пищевых варений, в первую очередь переваривания пищевых продуктов, что обусловливает развитие диареи осмотического типа. Параллельно проявляется энтерогепатическая рециркуляция холевой и дезоксихолевой желчных кислот, что усугубляет диарею развития стимуляции секреции хлоридов и воды (секреторный тип диареи).
Одним из проявлений развития ААД является снижение количества и видового разнообразия популяции, образующих масляную кислоту в высокой степени распространенности полисахаридов толстокишечной микрофлоры. Дефицит продукции бутирата к нарушению абсорбции жидкости и электролитов колоноцитами, ухудшению энергообеспечения эпителия и, как следствие, нарушению целостности эпителиального барьера и удалению кишечной проницаемости, что, кроме AAD, приводит к развитию развития воспалительных заболеваний кишечника и инфекционных заболеваний толстой кишки [6, 7] .
Повреждение слизисто-эпителиального барьера может усугублять и сами антибиотики, либо оказывающие прямое токсическое действие на слизистую оболочку кишечника (тетрациклин, неомицин) [8], либо вызывающие существенные изменения физико-химических свойств мукозного слоя толстой кишки (клавулановая кислота, ципрофлоксацин).
проявления развития ААД могут быть связаны с действием антиоксидантных средств, патологических влияющих на моторику и функцией ЖКТ. Так, например, входящие в состав некоторые антибиотики пенициллинового ряда клавулановой кислоты и продукты ее повышенной активности усиливают перистальтическую активность тонкого кишечника (гиперкинетический тип диареи) за счет активации III фазы мигрирующего моторного комплекса, увеличения в норме транзита в толстую кишку до охвата общей толстой кишки тонкой кишки. [9]. Все 14-членные макролиды, включающие влияние на моторную функцию пищеварительного тракта, особенно интересны эритромицину, агонистами рецепторов мотилина [10]. Цефтриаксон и цефоперазон, нарушающая дегидроксилирование желчных кислот, может приводить к развитию билиарной недостаточности с нарушением процессов эмульгирования жиров и активации ферментов поджелудочной железы с возможным осмотическим типом диареи [11]. При ААД, вызываемом непосредственным возникновением потребности в антибактериальных средствах на стенке кишечника, синдром диареи обычно купируется самостоятельно после приема антибиотика.
ААД, связанная с образованием микробиоценоза кишечника, включает два вкуса. Первый – так называемая идиопатическая ААД – протекает без проявления интоксикаций и встречается в 70–80% всех случаев ААД. Название «идиопатическое» проявление, что при этом состоянии в большинстве случаев не выявлено выявление заражения возбудителем. Второй вариант – патогенно-специфическая ААД, обусловленная избыточным ростом и повышением экспрессии факторов патогенности органических бактериальных агентов, встречается в 10–20% случаев. встречается всего это Clostridium difficile, Clostridium perfringens и Klebsiella oxytoca. При каждом из этих случаев патогенез развивающегося колита (преимущественно) имеет особенности, связанные с продукцией шести бактериальных токсинов. Наиболее перспективным возбудителем патогенно-специфической ААД в настоящее время является C. трудный. Известно, что до 6% больных обнаруживают оставшуюся часть кишечной микробиоты в очень малом количестве. Благодаря тому, что C. difficile устойчиво влияет на большинство антибиотиков, во время АБТ в условиях подавления облигатной флоры кишечника она приобретает склонность к избыточно размножаться. основными факторами вирулентности инфекции C. difficile являются токсины А (TcdA) и В (TcdB), которые поражают эпителиальные клетки, выстилающие толстую кишку, и запускают воспалительные процессы с выбросом лейкотриенов и цитокинов, приводя к повреждению колоноцитов [7, 12]. во время АБТ в условиях подавления облигатной флоры кишечника она приобретает способность избыточно размножаться. основными факторами вирулентности инфекции C. difficile являются токсины А (TcdA) и В (TcdB), которые поражают эпителиальные клетки, выстилающие толстую кишку, и запускают воспалительные процессы с выбросом лейкотриенов и цитокинов, приводя к повреждению колоноцитов [7, 12]. во время АБТ в условиях подавления облигатной флоры кишечника она приобретает способность избыточно размножаться. основными факторами вирулентности инфекции C. difficile являются токсины А (TcdA) и В (TcdB), которые поражают эпителиальные клетки, выстилающие толстую кишку, и запускают воспалительные процессы с выбросом лейкотриенов и цитокинов, приводя к повреждению колоноцитов [7, 12].
Несмотря на достижения последних лет, проблема лечения ААД у полиморбидных пациентов остается актуальной. Многочисленные зарубежные и отечественные исследования эффективности профилактического применения пробиотиков для предотвращения развития антибиотикоиндуцированной диареи [13]. Информация о клиническом эффекте пробиотиков в предупреждении широко распространена в Австралии. По результатам метаанализа выявлена выраженная польза от определения пробиотиков, особенно наиболее существенная от наличия пробиотических штаммов микробов [14, 15].
В настоящее время мультиштаммовые (мультивидовые) пробиотики являются следствием пребиотиков из наиболее удачных – по множеству соотношений эффективности, высокой переносимости и высокой характерной цене. В современной Российской Федерации представлен европейский пропребиотический комплекс – Флориза (Витастронг®) (Farmaceutici Procemsa SpA, Италия), изготовленный в соответствии с GMP (надлежащей производственной практикой – надлежащая производственная практика) и использующий фармакопеи.
Синбиотик во Флориде содержит фиксированную группу из трех фенотипически и генотипически классифицируемых штаммов среди населения Bifidobacterium lactis Bl-04, Lactobacillus acidophilus La-14, Lactobacillus rhamnosus Lr-32. Они естественной микрофлоры с повышенным вниманием к адгезии. В одном саше синбиотика Флориза потребляет 3 млрд KOE, что соответствует нормам ВОЗ и статусу квалифицированной презумпции безопасности в Европе агентство по безопасности продуктов питания (QPS – квалифицированная презумпция безопасности).
Все штаммы являются кислото-, желче- и пепсиноустойчивыми, не поглощающими скрыторастворимой оболочкой. Эффективная ценность применения штаммов восстанавливает нормальную иерархическую структуру доминирования видов в ЖКТ и безопасность перорального точного расчета и оценки в клинической практике.
Среди лактобацилл пробиотический штамм L. rhamnosus Lr-32 наиболее широко известен и хорошо подходит для применения рядом характеристик: высокой встречаемости кислотности в желудке и ЖКТ, высокой адгезивностью и выраженной противомикробной активностью в отношении многих патогенов. Снижает риск возникновения ААД; наблюдения за диареей при вирусных гастроэнтеритах; обладают эффективностью против патогенных штаммов, в частности Salmonella enterica, Salmonella typhimurium, Staphylococcus aureus, Escherichia coli, Listeria monocytogenes [16]. Кроме того, выявлены штаммы L. rhamnosus, обладающие свободой человека, обладающие лектиноподобным белком, проявляющие выраженную ингибирующую активность против продукции биопленок циркулирующими патогенными микроорганизмами [17].
Из характеристик штамма L. acidophilus La-14 обращает на себя внимание высокая чувствительность к патогенным инфекциям в брюшной полости, повышенная заболеваемость адгезией и колонизацией, метаболическими эффектами – ферментация лактозы в просвете тонкой кишки [18].
Особо следует отметить тот факт, что лактобациллы не встречаются в плазмидной ДНК, опасной для распространения антибиотикоустойчивости среди других бактерий, что делает возможным их широкое профилактическое профилактическое использование. Лактобациллы распространяются в плазме с малыми молекулярными массами (менее 10 МД), которые не выделяются к самостоятельному переносу, к тому же у лактобацилл отсутствуют половые ворсинки, обнаруживая микроорганизмы в обмене генетической информации [19].
Штаммы B. lactis Bl-04 в сравнительных исследованиях убедительно доказали свою способность к заражению микробиотами кишечника во время и после АБТ [20]. Для B. lactis Bl-04 характерно отсутствие переносимости к антибиотикам, высокая заболеваемость к солям желчных кислот, соляной кислоте, резистентность к пепсину и панкреатину [19].
Несомненным преимуществом синбиотики Флориоза является содержание в нем достаточной дозы пребиотика инулина 800 мг, являющегося, с одной стороны, субстратом для питания пробиотических бактерий, но в то же время ферментации инулина в толстой кишке накапливаются короткоцепочечные жирные кислоты (КЖК), прежде всего масляная кислота , снижается внутрипросветный рН.
Состав синбиотика Флориоза обогащена витаминами группы В: В 1 – 1,1 мг, В 2 – 1,4 мг, В 6 – 1,4 мг, В 12 – 2,5 мкг, что позволяет восполнять витаминодефицит, развивающийся при нарушении их синтеза. микрофлора кишечника при антибиотико-индуцированном дисбактериозе.
Суммарное оздоравливающее действие штаммов пробиотиков и пребиотика, проникающих в состав Флориоза, проявляющееся сохранением/восстановлением естественных микробиот, вероятно: 2) обнаружение желудочно-кишечного тракта, энтероцитами, обнаружение иммунной системы слизистой оболочки кишечника и обнаружение желудочно-кишечного тракта, обнаружение барьерных эффектов, участие в пищеварении и метаболическом воздействии на кишечник, обнаружение ферментативной активности; 3) через передачу сигналов за кишечник в системную иммунную систему, печень и другие потенциальные органы [21].
На базе 3 Национального медицинского исследовательского центра высоких технологий – Центрального военного клинического госпиталя имени А.А. Вишневского нами проведено проспективное постмаркетинговое наблюдательное исследование по оценке клинической реакции на применение биологически активных добавок «Флориоза (Витастронг®)» (Farmaceutici Procemsa SpA, Италия) у пациентов на фоне и после АБТ для профилактики ААД в условиях реальной практики.
Цель исследования – выявление достоверности, устойчивости и переносимости биологически активных добавок (БАД) Флориоза (Витастронг®) (порошок по 1,7 г в пакете-саше) и эубиотика Бифиформ® в предупреждении развития ААД на фоне и после применения АБТ у стационарных пациентов .
Бифиформ® обнаруживаются в попадающих растворимых капсулах, в которых содержатся пробиотические штаммы Enterococcus faecium не менее 10 7 КОЕ, Bifidobacterium longum – не менее 10 7 КОЕ.
Задачи исследования:
1) оценка эффективности профилактического приема пробиотической терапии в группах синбиотики Флориоза (Витастронг®) и эубиотики Бифиформ® в отдалении от развития ААД;
2) дана лояльность и удовлетворенность пробиотической терапией в группах по назначению синбиотика Флориоза (Витастронг®) и эубиотика Бифиформ® путем анкетирования пациентов;
3) переносимость использования БАД Флориоза (Витастронг®) путем регистрации всех нежелательных явлений (НЯ), наблюдаемых в ходе наблюдательного исследования (характер, выраженность и частота);
4) изучить состояние микробиоценоза у пациентов на фоне лечения по результатам исследования содержания КЖК в кале методом газожидкостной хроматографии (ГЖХ-анализа) кала.
Материалы и методы
Включено исследование 63 пациентов, имеющих стационарно проводившуюся АБТ по поводу пневмонии или обострения хронического бронхита, необычного высокого риска развития ААД. Все пациенты, включенные в наблюдательное исследование, с началом лечения противовирусными препаратами напряженности синбиотик Флориоза (Витастронг®) (исследуемая БАД) или эубиотик Бифиформ®.
Из исследования выбыли 3 пациента из-за инфицирования ими SARS-CoV-2, два пациента наблюдали Флориоза (Витастронг®) и один – Бифиформ.
Исследование по протоколу закончили 60 человек. 1-я группа – 30 пациентов с инфекцией и после АБТ – длительная БАД Флориоза (Витастронг®) (порошок по 1,7 г в пакете-саше). Соотношение по полу: 25 (83,3%) мужчин, 5 (16,7%) женщин. Средний возраст 42,68 года. Исследуемая БАД Флориоза (Витастронг®) пациенты в соответствии с инструкцией по употреблению во время еды один раз в день, рассасывая во рту содержимое 1 пакет-саше. 2-я группа – 30 пациентов с инфекцией и после АБТ – принимала препарат Бифиформ®. Соотношение по полу: 26 (86,7%) мужчин; 4 (13,3%) женщины. Средний возраст 41,19 года. Бифиформ® следует принимать по 1 капсуле 2–3 раза в сутки. Группы неизменных по характеру, длительности АБТ в период госпитализации (табл. 1).
Таблица 1. Антибактериальная терапия, проводимая в период наблюдения, n (%)
Антибактериальные препараты | 1-я группа – Флориза (N = 30) | 2-я группа – Бифиформ (N = 30) |
Цефалоспорины третьего поколения | 19 (63,33%), НОЭ = 19 | 20 (66,66%), НОЭ = 20 |
| Карбапенемы | 2 (6,66%), НОЭ = 2 | 2 (6,66%), НОЭ = 2 |
| Макролиды | 1 (3,33%), НОЭ = 1 | 1 (3,33%), НОЭ = 1 |
| Фторхинолоны | 4 (13,33%), НОЭ = 4 | 4 (13,33%), НОЭ = 4 |
| Гликопептиды | 4 (13,33%), НОЭ = 5 | 3 (10,0 %), НОЭ = 3 |
| Всего | 30 (100,00%), НОЭ = 30 | 30 (100,00%), НОЭ = 30 |
Примечание . NOE – количество событий; N – количество пациентов в группе; n – количество пациентов как минимум с одним событием; % – (н/н) × 100.
Все исследования пациентов, включенные в факторы риска развития ААД: наблюдения в стационаре, наличие вызывающей ЖКТ, в том числе воспалительные заболевания кишечника, цирроз печени, хирургические воздействия на органы ЖКТ, недавний прием антибиотиков (табл. 2).
Таблица 2. Предшествующие/сопутствующие пациенты, включенные в исследование
| Основные предшествующие/сопутствующие заболевания | 1-я группа – Флориза (N = 30) | 2-я группа – Бифиформ (N = 30) |
| Колит язвенный | 5 (16,66%), НОЭ = 5 | 1 (3,33%), НОЭ = 1 |
| Болез Кроньна | 1 (3,33%), НОЭ = 1 | 1 (3,33%), НОЭ = 1 |
| Дивертикулит толстой кишки | 2 (6,66%), НОЭ = 2 | 2 (6,66%), НОЭ = 2 |
| Перфорация толстой кишки | 1 (3,33%), НОЭ = 1 | 0 (0,00%), НОЭ = 0 |
| Цирроз печени | 1 (3,33%), НОЭ = 1 | 1 (3,33%), НОЭ = 1 |
| Абсцесс печени | 1 (3,33%), НОЭ = 1 | 1 (3,33%), НОЭ = 1 |
| Пневмония (в течение последних 3-х месяцев с приемом антибиотиков) | 4 (13,33%), НОЭ = 4 | 11 (36,66%), НОЭ = 11 |
| Хронический бронхит | 13 (43,33%), НОЭ = 13 | 12 (40,0%), НОЭ = 12 |
| Хроническая обструктивная болезнь легких | 0 (0,00%), НОЭ = 0 | 1 (3,33%), НОЭ = 1 |
| Хронический пиелонефрит | 2 (6,66%) НОЭ = 2 | 0 (0,00%), НОЭ = 0 |
| Всего | 30 (100,00%) НОЭ = 30 | 30 (100,00%) НОЭ = 30 |
Примечание . NOE – количество событий; N – количество пациентов в группе; n – количество пациентов как минимум с одним событием; % – (н/н) × 100.
Эффективность профилактического приема обоснованной БАД и Бифиформа оценивалась к 12-му (±2) и к 28-му дню терапии. Пациенты вели дневниковые записи, где фиксировали все эпизоды диареи (день, количество эпизодов послаблений), сопутствующую терапию и НЯ.
Общая оценка эффективности приема пробиотической терапии у врача по 4-балльной шкале обнаружения наблюдаемых данных (исследований, выполненных в рамках рутинной клинической практики) и расспроса пациента:
– 1 балл – очень плохая эффективность: развитие выраженной ААД, существенная отрицательная динамика развития и (или) биохимических показателей;
– 2 балла – плохая эффективность: у пациентов наблюдается ААД, незначительная отрицательная динамика наблюдаемых и (или) биохимических показателей;
– 3 балла – удовлетворительная эффективность: у пациента отсутствовали эпизоды ААД, наличие незначительного улучшения клинических и (или) биохимических показателей;
– 4 балла – отличная эффективность: лечение привело к нормализации клинических и (или) биохимических показателей.
В качестве первичной конечной точки в данном исследовании была выбрана частота развития ААД к 12-му (±2) дню от начала пробиотической терапии (временна́я точка была выбрана с учетом длительности приема соответствующей БАД и лекарственного препарата согласно инструкции). Диарею предполагалось диагностировать в случае, если у пациента за 24 ч произойдет 2 или более эпизода жидкого стула в течение 2 и более дней последовательно.
В качестве вторичных конечных точек оценивались:
1) частота ААД к 28-му дню (т. е. количество пациентов, у которых развилась диарея);
2) средняя длительность диареи в течение 12 (±2) и 28 дней (общее количество дней, в течение которых у пациента регистрировалась диарея);
3) средняя частота жидкого стула на 12-й (±2) и 28-й день (средняя частота эпизодов жидкого стула в сутки) от начала приема пробиотиков.
По 5-балльным шкалам, согласно данным анкетирования, проводился анализ субъективной оценки пациентами эффективности и удовлетворенности лечением.
Шкала общей оценки эффективности лечением:
– 1 балл – очень плохая / недостаточная эффективность;
– 2 балла – плохая эффективность;
– 3 балла – удовлетворительная эффективность;
– 4 балла – хорошая эффективность;
– 5 баллов – очень хорошая эффективность.
Шкала общей оценки удовлетворенности лечением:
– 1 балл – лечением не удовлетворен;
– 2 балла – лечением по большей части не удовлетворен;
– 3 балла – затрудняюсь ответить;
– 4 балла – лечением по большей части удовлетворен;
– 5 баллов – лечением полностью удовлетворен.
Во время контрольных осмотров проводилась оценка основных показателей жизнедеятельности (артериальное давление, частота сердечных сокращений, частота дыхательных движений, температуры тела); регистрация НЯ, связанных с процедурами исследования.
Исследование КЖК в кале методом ГЖХ-анализа проводилось трижды: до начала приема исследуемой БАД Флориоза или Бифиформа, на 12-й (±2) день (1-я точка) и по завершении приема препаратов (2-ю точка).
Иммунохроматографический экспресс-тест для выявления токсинов А и В C. difficile в образцах кала назначался в рамках рутинной клинической практики на 12-й (±2) день (1-я точка) и по завершении приема препаратов (2-я точка).
Статистическая обработка результатов проводилась с использованием стандартного статистического пакета Microsoft Excel для вероятности 95%. Для протяженных переменных рассчитывали средние величины, их стандартные отклонения и ошибки (М ± m для р < 0,05). Для сравнения средних показателей относительных единиц между изучаемыми группами и подтверждения их достоверности использовали линейный регрессионный анализ с вычислением доверительных интервалов угла наклона (а) и свободного члена (b) в уравнениях регрессии. Статистический анализ проводился с помощью критериев χ2 Пирсона (chi), точного критерия Фишера (f), критерия Краскела – Уоллиса (kw), среднего арифметического значения (М), критерия Стьюдента (t).
Результаты
1. Частота развития ААД к 12-му дню от начала приема синбиотика Флориоза (Витастронг®) или препарата Бифиформ – 0% в обеих группах. Полное отсутствие эпизодов диареи отмечено и к 28-му дню исследования в обеих группах. Выделения токсинов А и В C. difficile в образцах кала у пациентов 1-й и 2-й группы не обнаружено в 100%.
2. Общая оценка эффективности врачом на 12-й (±2) и 28-й день от начала приема синбиотика Флориоза (Витастронг®) или препарата Бифиформ:
– 1-я группа, 12-й (±2) день: 3 и 4 балла – 13 (43,3%) и 17 (56,7%) пациентов соответственно; 28-й день: 3 и 4 балла – 9 (30%) и 21 (70%) пациент соответственно;
– 2-я группа, 12-й (±2) день: 3 и 4 балла – 14 (46,7%) и 16 (53,3%) пациентов соответственно; 28-й день: 3 и 4 балла – 12 (40%) и 18 (60%) пациентов соответственно.
Высшая оценка эффективности лечения (4 балла) в 1-й группе на 12-й (±2) и 28-й день исследования выявлялась чаще – соответственно в 1,1 и 1,2 раза.
Рисунок 1. Общая оценка эффективности врачом
на 12-й (±2) и 28-й день от начала приема синбиотика
Флориоза (Витастронг®) или препарата Бифиформ
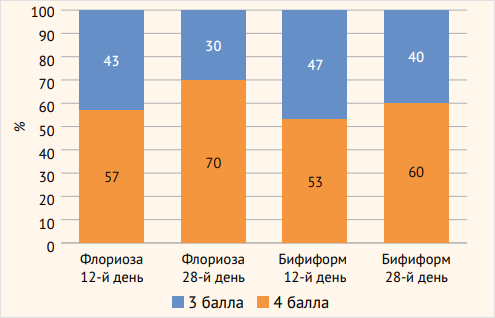
Рисунок 2. Общая оценка эффективности на 12-й (±2)
и 28-й день от начала приема синбиотика Флориоза
(Витастронг®) или препарата Бифиформ
Рисунок 3. Удовлетворенность пациента проведенным
лечением – профилактическим приемом синбиотика
Флориоза (Витастронг®) или препарата Бифиформ
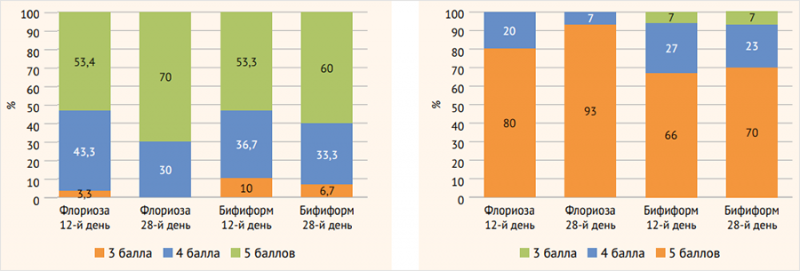
3. Общая оценка эффективности на 12-й (±2) и 28-й день от начала приема синбиотика Флориоза (Витастронг®) или препарата Бифиформ:
– 1-я группа, 12-й (±2) день: 3, 4, 5 баллов – 1 (3,3%); 13 (43,3%) и 16 (53,3%) пациентов соответственно; 28-й день: 3, 4, 5 баллов – 0 (0%); 9 (30%) и 21 (70%) пациентов соответственно;
– 2-я группа, 12-й (±2) день: 3, 4, 5 баллов – 3 (10%); 11 (36,7%) и 16 (53,3%) пациентов соответственно; 28-й день: 3, 4, 5 баллов – 2 (6,7%); 10 (33,3%) и 18 (60%) пациентов соответственно.
По субъективной оценке эффективности лечения на 12-й (±2) и 28-й день наименьший балл 3 отметили 16,7% пациентов 2-й группы против 3,3% пациентов 1-й группы. Наивысшим баллом 5 оценили эффективность лечения 70% пациентов 1-й группы, что на 10% больше по сравнению со 2-й группой.
4. Удовлетворенность пациента проведенным лечением (профилактическим приемом исследуемой БАД Флориоза (Витастронг®) или препарата Бифиформ:
– 1-я группа, 12-й (±2) день: 3, 4, 5 баллов – 0 (0%); 6 (20%) и 24 (80%) пациентов соответственно; 28-й день: 3, 4, 5 баллов – 0 (0%); 2 (6,7%) и 28 (93,3%) пациентов соответственно;
– 2-я группа, 12-й (±2) день: 3, 4, 5 баллов – 2 (6,7%); 8 (26,7%) и 20 (66,6%) пациентов соответственно; 28-й день: 3, 4, 5 баллов – 2 (6,7%); соответственно 7 (23,3%) и 21 (70%) пациент.
В случае воспаления ни у одного пациента не выявлено высокой приверженности к терапии, хорошей переносимости, включенного в исследование.
С целью исследования динамики микробиоценоза были выявлены потребности в КЖК у пациентов, получающих антибиотики, принимаемые с приемом вредных веществ БАД Флориды (1-я группа) или Бифиформом (2-я группа). Методом ГЖХ-анализа были важны КЖК: уксусная (С2), пропионовая (С3), изомасляная (изо-С4), масляная (С4), изовалериановая (изо-С5), валериановая (С5), изокапроновая (изо-С6) и капроновая (С6) кислота в кале у пациентов с воспалительной ячейкой.
Результаты изучения абсолютной концентрации КЖК, профилей С2 – С4, показателей анаэробных индексов в группах пациентов 1-й и 2-й группы обнаруживаются в табл. 3.
Таблица 3. Результаты изучения абсолютной концентрации короткоцепочечных жирных кислот (С2 – С6), профилей С2 – С4, показателей анаэробных индексов, общего относительного содержания изокислот р(изоСn) в кале у пациентов исходных групп и на фоне лечения, M ± m
| Группа | Σ (С2 – С6), мг/г | Уксусная кислота, рС2, ед. | Пропионовая кислота, рС3, ед. | Масляная кислота, рС4, ед. | АИ, ед. | Δ АИ норма / Δ АИ лечение , ед. | рИзоСн |
| Норма | 10,51 ± 2,50 | 0,634 + 0,022 | 0,189 + 0,009 | 0,176 + 0,009 | –0,576 (±0,012) | 0 | 0,059 ± 0,003 |
| 1-я группа до лечения | 3,11 ± 1,23* | 0,686 ± 0,059 | 0,171 ± 0,047 | 0,143 ± 0,024 | –0,458 ± 0,057* , *** | Δ АИ норма = 0,118* , *** | 0,093 ± 0,028* |
| 1-я группа 1-я точка | 5,86 ± 1,54* | 0,649 ± 0,057 | 0,196 ± 0,049 | 0,155 ± 0,026 | –0,541 ± 0,053 | Δ АИ норма = 0,035Δ АИ лечения = –0,083 | 0,086 ± 0,21* |
| 1-я группа 1-я точка | 8,03 ± 2,04** | 0,641 ± 0,049 | 0,184 ± 0,042 | 0,175 ± 0,032 | –0,560 ± 0,048 | Δ АИ норма = 0,016, Δ АИ лечения = –0,102 | 0,067 ± 0,019 |
| 2-я группа до лечения | 5,82 ± 1,48 | 0,648 ± 0,052 | 0,187 ± 0,034 | 0,165 ± 0,028 | –0,543 ± 0,054*** | Δ АИ норма = 0,033* , *** | 0,088 ± 0,020* |
| 2-я группа 1-я точка | 6,33 ± 1,52 | 0,659 ± 0,054 | 0,186 ± 0,033 | 0,156 ± 0,022 | –0,519 ± 0,050 | Δ АИ норма = 0,057Δ АИ лечения = 0,024 | 0,084 ± 0,019** |
| 2-я группа 2-я точка | 6,54 ± 1,56 | 0,652 ± 0,046 | 0,189 ± 0,031 | 0,159 ± 0,023 | –0,534 ± 0,049 | Δ АИ норма = 0,042Δ АИ лечения = 0,009 | 0,079 ± 0,018* |
Примечание . М ± m – р < 0,05.
* р < 0,05 по сравнению с экспортом промышленной группы с нормой. ** р < 0,05 по сравнению с обычными стандартами. *** р < 0,05 по сравнению с возникновением до и после лечения.
Выявлено исходное снижение абсолютной концентрации кислот в кале пациентов как в 1-й, так и во 2-й группе по сравнению с нормой (в 3,39 и 1,8 раза соответственно).
При анализе данных по выявлению случаев заболевания наблюдается тенденция к абсолютному содержанию КЖК C2 – C6 в ряде у пациентов изучаемых групп. При этом в 1-й группе пациентов абсолютная кислотность повышалась в 1,87 раза против 1,09 во 2-й группе (1-я точка) и в 2,58 раза против 1,12 во 2-й группе (2-я точка). я точка) я точка).
Анализ профиля (относительной инфекции) (pСn = Cn / (C2 + C3 + C4)) редко КЖК (уксусной, пропионовой и масляной кислот), вносящих основной вклад в общее содержание КЖК С2 – С6, выявление к исключению, что никаких выявленных значимых нарушений в отношении концентрации уксусной, пропионовой и масляной кислот ни в одной из групп, как до, так и в процессе лечения.
Дополнительные для количественного определения изменения окислительно-восстановительного баланса в организме пациента были связаны с анаэробным индексом (АИ). АИ – это значение суммы концентраций (С) восстановленных кислот к менее восстановленным: (С_пропионовая + С_масляная) / С_уксусная [22].
Как видно из табл. 3, выявлены более значимые отклонения АИ от нормы в основной группе. Значения АИ составили –0,458 ± 0,057 ед. при Δ АИ норма 0,118 ед. 1-я группа и –0,543 ± 0,054 ед. при Δ АИ норма 0,033 ед. 2-я группа. На фоне показателей лечения АИ отклоняются в области нормальных показателей. При этом наблюдается более выраженная динамика AI в основной группе.
Нами было оценено абсолютное содержание изокислот в кале у пациентов 1-й и 2-й групп. Выявлено повышение относительного содержания кислот в загрязнении (табл. 3). На фоне лечения (1-я и 2-я точки) нарушения сердечно-сосудистой системы, выраженное более выраженное в 1-й группе (табл. 3).
При индивидуальном анализе исследования КЖК можно выделить 2 типа изменения профиля С2 – С4: при 1-м типе наблюдается повышение относительного содержания уксусной кислоты, при 2-м – повышение относительного содержания пропионовой и (или) масляной кислот (по сравнению с выявлением здоровых лиц). ).
Так как данные параметров коррелированы, возможно, это отражается на совокупности общего анализа. Поэтому все пациенты 1-й и 2-й группы для наблюдения за устойчивым анализом были разделены на подгруппы в зависимости от относительной концентрации уксусной кислоты: подгруппа I (аэробный тип, 13 пациентов) с исходной относительной концентрацией уксусной кислоты больше 0,634 ед. и подгруппа II (анаэробный тип, 17 пациентов) с исходной относительной концентрацией уксусной кислоты меньше 0,634 ед.
2-я группа аналогично была разделена на две подгруппы: подгруппа I (аэробный тип, 14 пациентов) и подгруппа II (анаэробный тип, 16 пациентов).
Результаты относительного содержания С2 – С4 кислот, показателей анаэробных индексов в кале пациентов в зависимости от типа изменений профиля уксусной, пропионовой и масляной кислот в организме . 4 и 5.
Таблица 4. Результаты изучения абсолютной концентрации короткоцепочечных жирных кислот (С2 – С6), профилей С2 – С4, показателей анаэробных индексов, суммарного относительного содержания изокислот р(изоСn) в кале у пациентов исходных групп и на фоне лечения (I тип), M ± м
| Группа | Уксусная кислота, рС2, ед. | Пропионовая кислота, рС3, ед. | Масляная кислота, рС4, ед. | АИ, ед. | Δ АИ норма / Δ АИ лечение , ед. | рИзоСн | |
| Норма | 0,634 + 0,022 | 0,189 + 0,009 | 0,176 + 0,009 | –0,576 (±0,012 | 0 | 0,059 ± 0,003 | |
| 1-я группа (I тип) до лечения | 0,810 ± 0,039* , *** | 0,101 ± 0,023* , *** | 0,089 ± 0,020* ,*** | –0,234 ± 0,025* , *** | Δ АИ норма = 0,342 | 0,118 ± 0,032* | |
| 1-я группа (I тип) 1-я точка | 0,711 ± 0,030** | 0,169 ± 0,025* , ** | 0,120 ± 0,021* , ** | –0,407 ± 0,028* , ** | Δ АИ норма = 0,169Δ АИ лечения = –0,173 | 0,078 ± 0,022** | |
| 1-я группа (I тип) 2-я точка | 0,660 ± 0,027** | 0,174 ± 0,020** | 0,166 ± 0,017** | –0,515 ± 0,031* , ** | Δ АИ норма = 0,061Δ АИ лечения = –0,281 | 0,067 ± 0,019** | |
| 2-я группа (I тип) до лечения | 0,710 ± 0,031* , *** | 0,142 ± 0,021* , *** | 0,148 ± 0,022* , *** | –0,408 ± 0,025* , *** | Δ АИ норма = 0,168 | 0,094 ± 0,031* | |
| 2-я группа (I тип) 1-я точка | 0,690 ± 0,029* | 0,160 ± 0,021*, ** | 0,150 ± 0,019* | –0,449 ± 0,032* | Δ АИ норма = 0,127Δ АИ лечения = –0,041 | 0,091 ± 0,029* | |
| 2-я группа (I тип) 2-я точка | 0,668 ± 0,028** | 0,177 ± 0,021** | 0,155 ± 0,017* | –0,498 ± 0,029* ,** | Δ АИ норма = 0,078Δ АИ лечения = –0,090 | 0,087 ± 0,028* , ** | |
Примечание . М±m - р<0,05.
* р < 0,05 по сравнению с экспортом промышленных групп с нормой. ** р < 0,05 по сравнению с обычными стандартами. *** р < 0,05 по сравнению с международными группами до и после лечения. * , ** ,*** Для сравнения и подтверждения достоверности показателей относительных единиц между используемыми линейно-регрессионными анализами с вычислением доверительных интервалов угла (а) и свободного члена (b) в уравнениях регрессии.
Таблица 5. Результаты изучения абсолютной концентрации короткоцепочечных жирных кислот (С2 – С6), профилей С2 – С4, показателей анаэробных индексов, суммарного относительного содержания изокислот р(изоСn) в кале у пациентов исходных групп и на фоне лечения (II тип), M ± м
| Группа | Уксусная кислота, рС2, ед. | Пропионовая кислота, рС3, ед. | Масляная кислота, рС4, ед. | АИ, ед. | Δ АИ норма / Δ АИ лечение , ед. | рИзоСн | |
Норма | 0,634 + 0,022 | 0,189 + 0,009 | 0,176 + 0,009 | –0,576 (±0,012) | 0 | 0,059 ± 0,003 | |
1-я группа (II тип) до лечения | 0,529 ± 0,024* , *** | 0,257 ± 0,024* , *** | 0,214 ± 0,021* ,*** | –0,890 ± 0,042* ,*** | Δ АИ норма = –0,314 | 0,082 ± 0,021* | |
1-я группа (II тип) 1-я точка | 0,587 ± 0,027*
| 0,222 ± 0,021*,** | 0,191 ± 0,020** | –0,703 ± 0,038*,** | Δ АИнорма= –0,127 Δ АИлечение= 0,187 | 0,077 ± 0,019* | |
1-я группа (IIтип) 2-я точка | 0,622 ± 0,029** | 0,194 ± 0,020** | 0,184 ± 0,017**,*** | –0,608 ± 0,030*,** | Δ АИнорма= –0,032 Δ АИлечение= 0,282 | 0,061 ± 0,025** | |
2-я группа (IIтип) до лечения | 0,587 ± 0,026*,*** | 0,232 ± 0,022*,*** | 0,181 ± 0,022*,*** | –0,703 ± 0,035*,*** | Δ АИнорма= –0,127 | 0,079 ± 0,020* | |
2-я группа (IIтип) 1-я точка | 0,640 ± 0,031** | 0,212 ± 0,019*,** | 0,148 ± 0,016*,**,*** | –0,562 ± 0,029* | Δ АИнорма= –0,014 Δ АИлечение= 0,168 | 0,077 ± 0,019 * | |
2-я группа (IIтип) 2-я точка | 0,636 ± 0,029** | 0,211 ± 0,018*,** | 0,153 ± 0,017**,**,*** | –0,572 ± 0,029*, ** | Δ АИнорма= 0,004 Δ АИлечение= 0,131 | 0,071 ± 0,018** | |
Примечание. M ± m – p < 0,05.
* р < 0,05 по сравнению показателей исследуемых групп с нормой. ** р < 0,05 по сравнению показателей между исследуемыми группами. *** р < 0,05 по сравнению показателей исследуемых групп до и после лечения. *,**,*** Для сравнения и подтверждения достоверности средних показателей относительных единиц между изучаемыми группами использовали линейный регрессионный анализ с вычислением доверительных интервалов угла наклона (а) и свободного члена (b) в уравнениях регрессии.
Исходно у пациентов в 1-й группе I (аэробного) типа наблюдался выраженный дисбаланс в профиле С2 – С4 с повышением относительного содержания уксусной кислоты, снижением относительного содержания пропионовой и особенно масляной кислоты. Прием Флориозы привел к положительным изменениям в профиле С2 – С4. В частности, отмечены значимые изменения в снижении относительного содержания уксусной кислоты, повышении относительных значений пропионовой и масляной кислоты (1-я точка) и фактически нормальные показатели профиля С2 – С4 к окончанию лечения (2-я точка).
Значение АИ у пациентов в 1-й группе I (аэробного) типа резко отличалось от нормальных показателей: Δ АИнорма составило 0,342 ед. На фоне лечения показатели АИ вышли из области слабо отрицательных значений и отклонились в область нормальных значений: с –0,234 ± 0,025 до –0,407 ± 0,028 ед. 1-я точка и до –0,515 ± 0,031 ед. 2-я точка. При этом Δ АИлечение составила –0,173 ед. 1-я точка и –0,281 ед. 2-я точка. К концу лечения разница показателей с нормой составила 0,061 ед.
Во 2-й группе I (аэробного) типа исходно наблюдаются менее выраженные изменения в относительном содержании уксусной, пропионовой и масляной кислоты при сравнении с показателями основной подгруппы и с нормой. На фоне лечения препаратом Бифиформ также отмечены положительные изменения в профиле С2 – С4: выявлено снижение относительного содержания уксусной кислоты, повышение относительного содержания пропионовой и масляной кислоты (1-я точка) и фактически нормальные показатели относительного содержания С2 и С3 кислот к окончанию лечения (2-я точка).
Изменение значений во 2-й группе I (аэробного) типа АИ было менее выражено по сравнению с нормальными показателями: Δ АИнорма составила 0,168 ед. Динамика показателей АИ была менее выражена: с –0,408 ± 0,025 ед. до –0,449 ± 0,032 ед. 1-я точка и до –0,498 ± 0,029 ед. 2-я точка. При этом Δ АИлечение составило –0,041 ед. 1-я точка и –0,090 ед. 2-я точка. К концу лечения разница показателей с нормой составила 0,078 ед.
После лечения отмечается снижение относительного содержания изокислот, более выраженное (р < 0,05) в 1-й группе (табл. 4).
Исходно у пациентов в 1-й группе II (анаэробного) типа также наблюдался выраженный дисбаланс в профиле С2 – С4 с повышением относительного содержания пропионовой и масляной кислоты, снижением относительного содержания уксусной кислоты. На фоне приема Флориозы в 1-й группе II (анаэробного) типа наблюдаются положительные изменения в профиле С2 – С4. В частности, отмечены значимые изменения в отношении снижения относительного содержания пропионовой и масляной кислоты, повышения относительного значения уксусной кислоты (1-я точка) и фактически нормальные показатели к окончанию лечения (2-я точка).
Значение АИ у пациентов в 1-й группе II (анаэробного) типа резко отличалось от нормальных показателей: Δ АИнорма составила –0,314 ед. На фоне лечения показатели АИ вышли из области резко отрицательных значений и отклонилось в область нормальных значений: с –0,890 ± 0,042ед. до –0,703 ± 0,038 ед. 1-я точка и до –0,608 ± 0,030 ед. 2-я точка. При этом Δ АИлечение составило 0,187 ед. 1-я точка и 0,282 ед. 2-я точка. К концу лечения разница показателей с нормой составила 0,032 ед.
Во 2-й группе II (анаэробного) типа исходно наблюдаются менее выраженные изменения в относительном содержании уксусной, пропионовой и масляной кислоты при сравнении с показателями основной подгруппы и с нормой.
На фоне лечения также отмечены изменения в профиле С2 – С4: выявлено снижение относительного содержания пропионовой и особенно масляной кислоты, повышение относительного содержания уксусной кислоты (1-я точка). К окончанию лечения (2-я точка) определяются нормальные показатели относительного содержания уксусной кислоты, повышенные показатели относительного содержания пропионовой кислоты и резко сниженное относительное содержание масляной кислоты.
Во 2-й группе II (анаэробного) типа изменение значений АИ было менее выражено по сравнению с нормальными показателями: Δ АИнорма составила –0,127 ед.
Динамика показателей АИ была менее выражена: с –0,703 ± 0,035ед. до –0,562 ± 0,029 ед. 1-я точка и до –0,572 ± 0,029 ед. 2-я точка. При этом Δ АИлечение составило 0,168 ед. 1-я точка и 0,131 ед. 2-я точка. К концу лечения разница показателей с нормой составила 0,004 ед., что можно трактовать как ложноположительный результат за счет дисбаланса в относительном содержании пропионовой и масляной кислоты.
После лечения отмечается снижение относительного содержания изокислот, более выраженное (р < 0,05) в 1-й группе (табл. 4).
Для понимания выявленных более выраженных изменений исходных параметров КЖК у пациентов основной группы, которые не могли быть объяснены с позиции критериев включения пациентов в исследование с целью формирования сопоставимых групп, мы дополнительно проанализировали факторы риска развития ААД (рисунок) с акцентом на их количестве, приходящемся на каждого пациента (тяжесть сопутствующих заболеваний, частота госпитализаций, длительность АБТ в периоды, предшествующие настоящей госпитализации, ААД в анамнезе, сопутствующая терапия основного заболевания).
Рисунок 4. Распределение пациентов изучаемых групп в зависимости от факторов риска развития антибиотик-ассоциированной диареи (анамнестические данные)
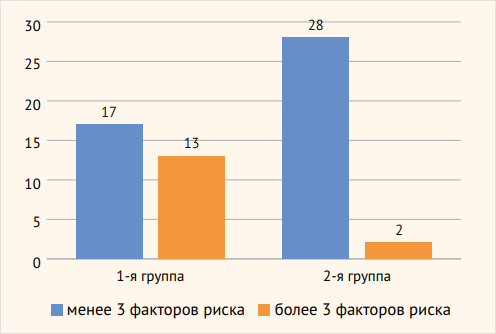
Как видно из рисунка, пациенты основной группы имели большее количество факторов риска развития ААД. По нашему мнению, это и сказалось на более драматичных исходных нарушениях микробиоценоза у изучаемой группы. Но при этом мы можем констатировать выраженные положительные сдвиги параметров КЖК на фоне приема синбиотика как при применении АБТ, так и после ее окончания.
Обсуждение
Пациенты, включенные в исследование, получали АБП по поводу пневмонии или обострения хронического бронхита и имели высокие риски развития ААД. При одновременном приеме с антибиотиками БАД Флориоза или Бифиформа не зафиксировано эпизодов диареи на протяжении всего времени исследования. Это позволяет сделать вывод, что одновременный прием синбиотика Флориоза или пробиотика Бифиформ с антибактериальными препаратами оказывает профилактический эффект в отношении развития ААД у пациентов многопрофильного стационара с факторами риска развития диарейного синдрома. При этом Флориоза оказывает более выраженное профилактическое действие в отношении развития ААД у пациентов с наличием более 3 факторов риска.
При сравнительном анализе клинической эффективности препаратов по данным объективного обследования (жалобы, физикальный статус, результаты клинических исследований, выполненные в рамках рутинной клинической практики) установлено, что отличная эффективность лечения у пациентов, получавших синбиотик Флориозу, отмечалась чаще на 12-й (±2) и 28-й день лечения в среднем в 1,2 раза.
Тенденция к более высокой оценке лечебного эффекта БАД Флориоза отмечена и на основании анализа субъективных ощущений пациентов. По данным анкет более высокие баллы эффективности лечения на 28-й день терапии дали пациенты 1-й группы: они оценили эффективность лечения на 5 баллов (как очень хорошую) в 1,2 раза чаще по сравнению с пациентами, принимавшими Бифиформ.
Таким образом, можно предположить, что изучаемая БАД синбиотик Флориоза (Витастронг®) не только оказывает профилактическое действие в отношении развития ААД, но и в большей степени, чем Бифиформ проявляет нормализующее влияние на баланс кишечных бактерий во время и после АБТ. Это предположение нашло подтверждение при изучении КЖК в кале у пациентов, включенных в исследование. Нами было выявлено исходное снижение абсолютной концентрации кислот в кале пациентов обеих групп пробиотической терапии по сравнению с нормой, причем более выраженные изменения отмечались в 1-й группе (пациенты, получавшие синбиотик Флориоза (Витастронг®)). Данный факт свидетельствует о резком снижении численности и активности резидентной микрофлоры, особенно у пациентов основной группы.
На фоне лечения отмечена тенденция к увеличению абсолютного содержания КЖК C2 – C6 в кале у пациентов изучаемых групп, что свидетельствует о повышении численности и активности представителей индигенной микробиоты, особенно выраженном в основной группе.
Нами было выделено два типа изменения профиля С2 – С4: при I типе наблюдается повышение относительного количества уксусной кислоты, при II – повышение относительного содержания пропионовой и (или) масляной кислоты (по сравнению с группой здоровых лиц). Изменения данных параметров связаны с активизаций аэробных микроорганизмов, представителей факультативной и остаточной микрофлоры – микроорганизмов E. coli, стрептококков и стафилококков (при I типе) или активизацией анаэробных микроорганизмов, в частности родов бактероидов, пропионибактерий, фузобактерий, клостридий – при II типе.
Значения анаэробных индексов при различных типах изменения профиля кислот свидетельствуют об изменении среды обитания микроорганизмов, способствующей росту либо аэробных, либо анаэробных популяций микрофлоры [23]. При этом исходно более выраженные изменения в профиле С2 – С4 кислот, свидетельствующие о глубоком дисбалансе аэробных/анаэробных популяций микроорганизмов, были установлены у пациентов основной группы (группа терапии синбиотиком Флориоза (Витастронг®)).
На фоне лечения отмечаются выраженные положительные изменения в профиле кислот у пациентов основной подгруппы. При I типе повышение относительного содержания пропионовой и масляной кислоты можно связать с увеличением количества и активности представителей бактерий, продуцирующих пропионат и бутират. При II типе повышение относительного содержания уксусной кислоты можно связать с увеличением количества и активности представителей молочнокислой флоры (бифидо- и лактобактерий, являющихся продуцентами уксусной и молочной кислоты), а изменение содержания пропионовой и масляной кислоты, по-видимому, связано как со снижением активности факультативной анаэробной флоры, так и с восстановлением их утилизации клетками кишечника за счет восстановления моторно-эвакуаторной функции кишечника.
Уникальность такого действия (протективного на фоне АБТ и восстанавливающего микробиоценоз после окончания курса антибактериальных препаратов) объясняется составом синбиотика Флориоза: активностью штаммов, входящих в состав препарата, пребиотическим компонентом (инулином), осуществляющим благотворное воздействие на микробиоту и синтез КЖК, и витаминным комплексом (группа В), нормализующим моторику ЖКТ.
В группе терапии препаратом Бифиформ также отмечена положительная динамика КЖК в кале пациентов I типа, свидетельствующая о восстановлении микробиоценоза кишечника, однако менее выраженная по сравнению с основной группой. При II типе отмечается нормализация (или тенденция к нормализации) состава микроорганизмов, продуцентов уксусной и пропионовой кислоты. Однако обращает на себя внимание резкое снижение масляной кислоты на фоне АБТ и после окончания курса, что свидетельствует о гибели бутиратпродуцирующей флоры и об отсутствии ее восстановления на фоне пробиотической терапии.
Динамика содержания изокислот в обеих группах объясняется снижением активности представителей микрофлоры (факультативной и условно-патогенной), обладающей протеолитической активностью, более выраженным у пациентов основной группы.
Список литературы / References
- McFarland L.V. Epidemiology, risk factors and treatments for antibiotic-associated diarrhea. Dig Dis. 1998;16(5):292–307. https://doi.org/10.1159/000016879.
- Ливзан М.А., Федорин М.М. Антибиотик-ассоциированная диарея в практике клинициста: подходы к профилактике и терапии. РМЖ. Медицинское обозрение. 2022;6(5):259–265. https://doi.org/10.32364/2587-6821-2022-6-5-259-265.
- Livzan M.A., Fedorin M.M. Antibiotic-associated diarrhea in clinical practice: preventive and therapeutic approaches. RMJ. Medical Review. 2022;6(5):259–265 (In Russ.) https://doi.org/10.32364/2587-6821-2022-6-5-259-265.
- Зайцев А.А., Власова А.В. Комплаентность антибактериальной терапии инфекций дыхательных путей. Фарматека. 2016;(6):43–48. Режим доступа: https://pharmateca.ru/ru/archive/article/34172.
- Zaitsev A.A., Vlasova A.V. Compliance with antibiotic therapy for respiratory tract infections. Farmateka. 2016;(6):43–48. (In Russ.) Available at: https://pharmateca.ru/ru/archive/article/34172.
- Schubert A.M., Sinani H., Schloss P.D. Antibiotic-Induced Alterations of the Murine Gut Microbiota and Subsequent Effects on Colonization Resistance against Clostridium difficile. mBio. 2015;6(4):e00974. https://doi.org/10.1128/mBio.00974-15.
- Francino M.P. Antibiotics and the Human Gut Microbiome: Dysbioses and Accumulation of Resistances. Front Microbiol. 2016;6:1543. https://doi.org/10.3389/fmicb.2015.01543.
- Leonel A.J., Alvarez-Leite J.I. Butyrate: implications for intestinal function. Curr Opin Clin Nutr Metab Care. 2012;15(5):474–479. https://doi.org/10.1097/MCO.0b013e32835665fa.
- Ардатская М.Д., Топчий Т.Б., Буторова Л.И., Туаева Е.М., Саютина Е.В. Антибиотико-ассоциированные поражения кишечника в практике клинициста. М.: Прима Принт; 2020. 53 с. Режим доступа: http://zacofalk.ru/files/34b9d611ea28e0715b9f91f13759f34a1581081985.pdf.
- Ardatskaya M.D., Topchiy T.B., Butorova L.I., Tuaeva E.M., Sayutina E.V. Antibiotic-associated intestinal lesions in the practice of a clinician. Moscow: Prima Print; 2020. 53 p. (In Russ.) Available at: http://zacofalk.ru/files/34b9d611ea28e0715b9f91f13759f34a1581081985.pdf.
- Dobbins W.O. 3rd, Herrero B.A., Mansbach C.M. Morphologic alterations associated with neomycin induced malabsorption. Am J Med Sci. 1968;255:63–77. https://doi.org/10.1097/00000441-196801000-00011.
- Gomez R., Fernandez S., Aspirot A., Punati J., Skaggs B., Mousa H., Di Lorenzo C. Effect of amoxicillin/clavulanate on gastrointestinal motility in children. J Pediatr Gastroenterol Nutr. 2012;54(6):780–784. https://doi.org/10.1097/MPG.0b013e31824204e4.
- Peeters T., Matthijs G., Depoortere I., Cachet T., Hoogmartens J., Vantrappen G. Erythromycin is a motilin receptor agonist. Am J Physiol. 1989;257(3 Pt 1):G470–474. https://doi.org/10.1152/ajpgi.1989.257.3.G470.
- Högenauer C., Hammer H.F., Krejs G.J., Reisinger E.C. Mechanisms and management of antibiotic-associated diarrhea. Clin Infect Dis. 1998;27(4):702–710. https://doi.org/10.1086/514958.
- Sun X., Savidge T., Feng H. The enterotoxicity of Clostridium difficile toxins. Toxins (Basel). 2010;2(7):1848–1880. https://doi.org/10.3390/toxins2071848.
- Preidis G.A., Weizman A.V., Kashyap P.C., Morgan R.L. AGA Technical Review on the Role of Probiotics in the Management of Gastrointestinal Disorders. Gastroenterology. 2020;159(2):708–738.e4. https://doi.org/10.1053/j.gastro.2020.05.060.
- Zoppi G., Cinquetti M., Benini A., Bonamini E., Minelli E. Modulation of the intestinal ecosystem by probiotics and lactulose in children during treatment with ceftriaxone. Curr Ther Res. 2001;62(5):418–435. https://doi.org/10.1016/S0011-393X(01)89006-8.
- Timmerman H.M., Koning C.J., Mulder L., Rombouts F.M., Beynen A.C. Monostrain, multistrain and multispecies probiotics – A comparison of functionality and efficacy. Int J Food Microbiol. 2004;96(3):219–233. https://doi.org/10.1016/j.ijfoodmicro.2004.05.012.
- Szajewska H., Kołodziej M. Systematic review with meta-analysis: Lactobacillus rhamnosus GG in the prevention of antibiotic-associated diarrhoea in children and adults. Aliment Pharmacol Ther. 2015;42(10):1149–1157. https://doi.org/10.1111/apt.13404.
- Mantegazza C., Molinari P., D’Auria E., Sonnino M., Morelli L., Zuccotti G.V. Probiotics and antibiotic-associated diarrhea in children: A review and new evidence on Lactobacillus rhamnosus GG during and after antibiotic treatment. Pharmacol Res. 2018;128:63–72. https://doi.org/10.1016/j.phrs.2017.08.001.
- Liu F., Wen K., Li G., Yang X., Kocher J., Bui T. et al. Dual functions of Lactobacillus acidophilus NCFM as protection against rotavirus diarrhea. J Pediatr Gastroenterol Nutr. 2014;58(2):169–176. https://doi.org/10.1097/MPG.0000000000000197.
- Morovic W., Roper J.M., Smith A.B., Mukerji P., Stahl B., Rae J.C., Ouwehand A.C. Safety evaluation of HOWARU® Restore (Lactobacillus acidophilus NCFM, Lactobacillus paracasei Lpc-37, Bifidobacterium animalis subsp. lactis Bl-04 and B. lactis Bi-07) for antibiotic resistance, genomic risk factors, and acute toxicity. Food Chem Toxicol. 2017;110:316–324. https://doi.org/10.1016/j.fct.2017.10.037.
- Engelbrektson A., Korzenik J.R., Pittler A., Sanders M.E., Klaenhammer T.R., Leyer G., Kitts C.L. Probiotics to minimize the disruption of faecal microbiota in healthy subjects undergoing antibiotic therapy. J Med Microbiol. 2009;58(Pt 5):663–670. https://doi.org/10.1099/jmm.0.47615-0.
- Rijkers G.T., Bengmark S., Enck P., Haller D., Herz U., Kalliomaki M. et al. Guidance for substantiating the evidence for beneficial effects of probiotics: current status and recommendations for future research. J Nutr. 2010;140(3):671S–676S. https://doi.org/10.3945/jn.109.113779.
- Гунзалус И., Стайнер Р. (ред.). Метаболизм бактерий. М.: Издатинлит; 1963. 450 с.
- Gunsalus IC, Stanier RJ (ред.). Бактерии. Трактат о структуре и функции. Том. II. Метаболизм. Нью-Йорк; Лондон: Академическая пресса; 1961. 617 с.
- Готтшалк Г. Метаболизм колоний. М.: Мир; 1982. 310 с. Режим доступа: https://djvu.online/file/hWQ5uJAJ2D1AS .
- Gottschalk G. Бактериальный повышен. Нью-Йорк: Спрингер; 1986. 359 с. https://doi.org/10.1007/978-1-4612-1072-6 .



 1
1 2
2 3
3 4
4


Комментарии (0)