Журнал "Медицинский совет" №12/2022
DOI: 10.21518/2079-701X-2022-16-12-152-159
И.Н. Захарова1*, Д.К. Дмитриева1, И.В. Бережная1, Л.С. Серикова2, Н.Г. Сугян1, А.Д. Гостюхина1
1 Российская медицинская академия непрерывного профессионального образования; 125993, Россия, Москва, ул. Баррикадная, д. 2/1, стр. 1
2 Национальный медицинский исследовательский центр высоких медицинских технологий – центральный военный клинический госпиталь имени А.А. Вишневского; 143420, Россия, Московская обл., Красногорск, п. Новый, д. 1
Микробиота кишечника представляет собой сложную совокупность бактерий, вирусов, простейших, архей и грибов, населяющих желудочно-кишечный тракт (ЖКТ) человека. Микробиота играет фундаментальную роль в сохранении здоровья человека и в развитии различных заболеваний, в т. ч. психических. Клинические исследования доказали существование двунаправленной связи между кишечником, микробиотой и мозгом в рамках «оси мозг - кишечник - микробиом». Предполагается, что кишечные микробы играют роль во многих психических расстройствах и могут быть потенциальной терапевтической мишенью. Нервная система и ЖКТ сообщаются через двунаправленную сеть сигнальных путей, которая состоит из множества соединений, включая блуждающий нерв, иммунную систему, гипоталамо-гипофизарно-надпочечниковую ось, некоторые трансмиттеры и бактериальные метаболиты. Имеющиеся данные свидетельствуют о взаимном влиянии микробиоты и активации воспалительных процессов в головном мозге. В случае повреждения этой связи для коррекции микробиоты в последнее время все чаще используют психобиотики. Впервые использованный в 2013 г. термин определял психобиотики как пробиотики, которые при приеме внутрь в адекватных количествах оказывают положительное влияние на психическое здоровье. В дальнейшем, учитывая продемонстрированную пользу пребиотиков, они были включены в определение. Таким образом, психобиотики - полезные бактерии (пробиотики) или вспомогательные вещества для таких бактерий (пребиотики), которые влияют на взаимоотношения между бактериями и мозгом. Пробиотические бактерии после приема внутрь концентрируются в основном в эпителии кишечника, обеспечивая хозяина питательными веществами и оказывая влияние на иммунную систему, а также производя нейроактивные вещества, которые действуют на «ось мозг - кишечник». Данный обзор посвящен новой интересной области, которая связывает микробиоту кишечника с заболеваниями нервной системы и ее возможным лечением с помощью психобиотиков.
Для цитирования: Захарова И.Н., Дмитриева Д.К., Бережная И.В., Серикова Л.С., Сугян Н.Г., Гостюхина А.Д. Клинические эффекты влияния пробиотиков на функционирование «оси кишечник - головной мозг» у детей. Медицинский Совет. 2022;(12):152-159. https://doi.org/10.21518/2079-701X-2022-16-12-152-159
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Clinical effects of probiotics on the functioning of the gut-brain axis in children
Irina N. Zakharova1*, Diana K. Dmitrieva1, Irina V. Berezhnaya1, Lyudmila S. Serikova2, Narine G. Sugyan1, Anastasiya D. Gostyukhina1
1 Russian Medical Academy of Continuous Professional Education; 2/1, Bldg. 1, Barrikadnaya St., Moscow, 125993, Russia
2 National Medical Research Center of High Medical Technologies – Central Military Clinical Hospital named after A.A. Vishnevsky; 1, Novy, Krasnogorsk, Moscow Region, 143420, Russia
The gut microbiota is a complex collection of bacteria, viruses, protozoa, archaea, and fungi colonising the human gastrointestinal (GI) tract. The microbiota plays a fundamental role in keeping the body healthy and the development of various diseases, including mental ones. Clinical studies have showed that there exists a bidirectional communication between the gut, microbiota and brain within the brain-gut-microbiome axis. It is understood that gut microbes play a role in many mental disorders and may be a potential therapeutic target. The nervous system and GI tract communicate through a bidirectional signalling network that includes multiple pathways, among which are the vagus nerve, the immune system, the hypothalamic-pituitary-adrenal axis, some transmitters, and bacterial metabolites. The available data indicate the mutual influence of the microbiota and the activation of inflammatory processes in the brain. Psychobiotics have been increasingly used for the management of the microbiota in case of injury of this pathway. The term that was used for the first time in 2013 defined psychobiotics as probiotics, which have a positive effect on mental health provided that they are taken orally at adequate doses.
Afterwards they were included in the definition, given the proven benefit of prebiotics. Thus, psychobiotics are beneficial bacteria (probiotics) or auxiliary substances for such bacteria (prebiotics) that affect the communication and interactions between bacteria and the brain. Following ingestion, probiotic bacteria concentrate mainly in the intestinal epithelium, providing the host with nutrients and influencing the immune system, as well as producing neuroactive substances that act on the brain-gut axis. This review is devoted to the new interesting area that correlates the gut microbiota with nervous system diseases and its possible treatment with psychobiotics.
For citation: Zakharova I.N., Dmitrieva D.K., Berezhnaya I.V., Serikova L.S., Sugian N.G., Gostyukhina A.D. Clinical effects of probiotics on the functioning of the gut-brain axis in children. Meditsinskiy sovet = Medical Council. 2022;(12):152-159. (In Russ.) https://doi.org/10.21518/2079-701X-2022-16-12-152-159
Conflict of interest: the authors declare no conflict of interest.
Введение
Более 2000 лет назад «отец медицины», античный врачеватель Гиппократ говорил: «Все болезни начинаются в кишечнике». Современные исследования, признающие микробиоту кишечника новым специальным органом, взаимодействующим с целым рядом органов и систем, подтверждают это высказывание. Органом кишечную микробиоту признали лишь в последние десятилетия, до этого врачи-исследователи высказывали диаметрально противоположные мнения. Так, великий российский ученый И.И. Мечников, один из самых известных первых исследователей микробиоты начала ХХ в., даже высказывал следующее мнение: чтобы предотвратить «кишечное гниение», обусловленное воздействием кишечных бактерий, с целью продления жизни имеет смысл просто удалить из организма толстую кишку. Но благодаря современным возможностям новых технологий (развитие молекулярно-генетических методов исследований, протеомных, метаболомных исследований) сейчас мы знаем, какое влияние оказывает микробиота кишечника на здоровье человека.
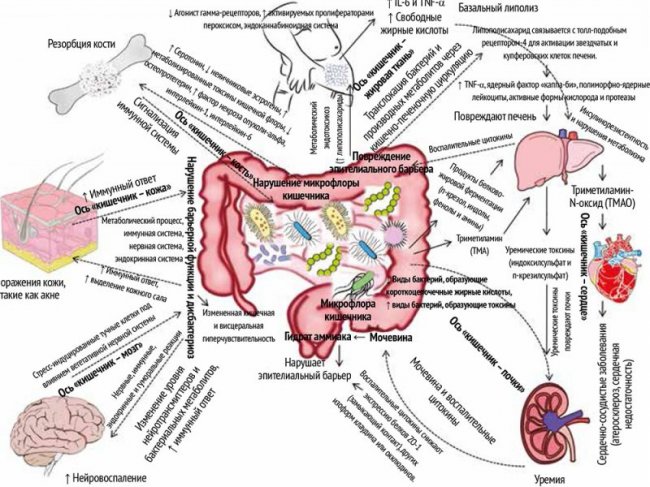
Микроорганизмы, входящие в состав микробиома, выделены со всех участков кожи и слизистых, находящихся в постоянном контакте с внешней средой (кожа, верхние дыхательные пути, урогенитальный тракт и т. д.). Больше всего их в желудочно-кишечном тракте (ЖКТ). Эти эффекты взаимодействия микробиоты и ЖКТ наблюдаются не только локально, но и в отдаленных органах благодаря системному распределению веществ и клеток, продуцируемых в кишке. Это явление называется «ось кишка – орган». Выделяют такие оси, как «кишка – мозг», «кишка – легкое», «кишка – почки», «кишка – кожа», «кишка – генитальный тракт», «кишка – сердце», «кишка – печень», «кишка – кость», «кишка – жировая ткань» и т. д. Миллионы лет происходила совместная эволюция, которая привела к взаимному симбиозу между микробиотой и организмом-хозяином, благодаря чему сформировались сложные оси отношений между микробиотой и органами (рис.).
Рисунок. Оси кишка и другие органы (адаптировано [1])
Исследователями было обнаружено, что митохондрии – клеточные органеллы, выполняющие функции «энергетических станций» организма за счет генерации аденозинотрифосфата (АТФ) – имеют бактериальное происхождение и родственные связи с протеобактериями [1]. Этот факт дополнительно подчеркивает важность бактерий и бактериального микробиома в функционировании организма, как в сохранении здоровья, так и во время болезни. В настоящее время хорошо известно, что в составе кишечной микробиоты преобладают филотипы Firmicutes и Bacteroidetes, однако микробные сообщества каждого человека настолько индивидуальны, что по уникальности вполне могут сравнится с отпечатками пальцев [2]: как не бывает двух людей с одинаковыми отпечатками, так и не бывает двух людей с одинаковым составом микробиоты.
В настоящее время мы знаем, что колонизация кишечника бактериями начинается еще в утробе матери и активно продолжается после рождения до трех лет жизни. Это очень хрупкий процесс, словно настройка музыкального инструмента, который может быть нарушен различными внешними воздействиями: начиная с пути появления на свет (при кесаревом сечении новорожденный не получает элементы микробиоты матери, т. к. не проходит по родовым путям), заканчивая нарушением питания и применением антибактериальной терапии. Деликатный механизм развития и воздействия микробиоты легко нарушить, но сложно восстановить. Именно с целью восстановления нарушенного баланса еще столетие назад (с болгарской палочки И.И. Мечникова) начали изучаться пробиотики. В течение последних лет сформировался термин «психобиотики» – «про- и пребиотики, которые при приеме внутрь в адекватных количествах оказывают положительное влияние на психическое здоровье» [3]. Наблюдая за воздействием психобиотиков на различные «оси кишечник – орган», преимущественно «ось кишечник – мозг», был продемонстрирован значительный потенциал для лечения не только болезней ЖКТ, как считалось ранее, но и для лечения широкого спектра психических и неврологических расстройств: болезни Паркинсона, расстройств аутистического спектра (РАС), синдрома гиперактивности с дефицитом внимания (СДВГ), тревожных и депрессивных расстройств, шизофрении [4].
«Ось кишечник – мозг»
Кишечник человека населяет сложная экосистема, состоящая из 1013–1014 микроорганизмов, что в 10 раз превышает количество эукариотических клеток в организме [5, 6]. Микробиота взрослого человека включает в себя бактерии, археи, грибы, простейшие и вирусы. Она состоит из 500–1000 различных видов бактерий, принадлежащих к четырем доминирующим бактериальным типам: Firmicutes, Bacteroidetes, Actinobacteria и Proteobacteria.
Еще в Древней Греции античные врачи и философы (Гиппократ, Платон, Аристотель) высказывали идеи о неразрывной связи мозга и остальных органов [7]. С развитием медицины постепенно сформировалась концепция, согласно которой организм рассматривался как единое целое, а не разделялся на органы, которые могли быть подвержены заболеваниям. Впервые термин «ось кишечник – мозг» в упрощенном понимании возник в 1840-х гг. Уильям Бомонт, американский гастроэнтеролог, экспериментально продемонстрировал взаимосвязь эмоционального статуса и скорости пищеварения [8]. Далее только в середине XX в. продолжились научные наблюдения, выполненные простыми методами, в которых отмечалась корреляция между изменениями физиологии кишечника и эмоциональными состояниями [9]. Официально термин «ось кишечник – мозг» был введен в 60–70-х гг. прошлого столетия, когда было обнаружено, что некоторые пептиды встречаются как в головном мозге, так и ЖКТ. Это стало частью APUD-гипотезы, в которой утверждалось следующее: амино- и пептид-продуцирующие клетки нервной системы, кишечника и других органов имеют общее происхождение в нервном гребне. Данная гипотеза позднее была опровергнута, однако внесла большой вклад в современное понимание координирующей функции нейропептидов во многих системах органов [10].
«Ось кишечник – мозг» – это двунаправленный путь передачи сообщений между мозгом и кишечником у млекопитающих. Важно обратить внимание на двунаправленность: не только кишечник влияет на мозг, но и мозг – на кишечник. Для того, чтобы подчеркнуть важность вклада, вносимого микробиотой кишечника, в механизм этой оси, появилось расширенное название «ось микробиота – кишечник – мозг». Эпигенетические изменения под влиянием микробиоты кишечника происходят как в кишечнике, так и в головном мозге [11]. Прямая связь по «оси микробиота – кишечник – мозг» происходит через нервную систему. Нервная система организма млекопитающих ответственна за сохранение состояния гомеостаза с помощью модуляции функций других систем через гипоталамо-гипофизарно-надпочечниковую ось (ГГНО), энтеральную нервную систему и, собственно, «ось кишечник – мозг» [12]. Последняя включает в себя центральную нервную систему (ЦНС), нейроэндокринную и нейроиммунную системы, симпатическую и парасимпатическую части вегетативной системы, энтеральную нервную систему и кишечную микробиоту [13]. Эти компоненты взаимодействуют и образуют сложнейшую рефлекторную сеть с афферентными волокнами, которые проецируются на интегративные структуры ЦНС, и с эфферентными волокнами с проекциями на гладкую мускулатуру кишечника. Эта двунаправленная коммуникация позволяет посылать сигналы из мозга и влиять на моторную, сенсорную и секреторную часть кишечника, и наоборот, сигналы из кишечника могут влиять на функции мозга, особенно в областях, ответственных за регуляцию стресса на уровне гипоталамуса [14, 15]. Микробиота ЖКТ синтезирует нейротрансмиттеры, нейроэндокринные гормоны, короткоцепочечные жирные кислоты (КЖК).
Самым прямым и быстрым путем связи между кишечником и мозгом является блуждающий нерв, иннервирующий печеночной ветвью кишечник. Ганглии блуждающего нерва образуют различные типы связей в кишечнике и в зависимости от расположения и типа способны обнаруживать растяжение, давление и побочные продукты жизнедеятельности бактерий, гормоны и нейротрансмиттеры. Снижение парасимпатически контролируемого кишечного транзита было связано с увеличением бактериального роста в тонкой кишке и бактериальной транслокацией. С изменением парасимпатической активности также связывают болевые реакции при функциональных расстройствах «оси кишечник – мозг» (например, при синдроме раздраженного кишечника (СРК)) [16]. Итак, прямая нейронная связь по «оси кишечник – мозг» осуществляется преимущественно через блуждающий нерв. Бактерии и следы их жизнедеятельности способны стимулировать афферентные нейроны энтеральной нервной системы. В свою очередь, вагальный сигнал из кишечника продуцирует противовоспалительный ответ [17]. Углубленные исследования обнаружили, что от вагальной активации зависят не все эффекты микробиоты, оказываемой на функции мозга, здесь роль первой скрипки отдана нейроактивным молекулам. Такие нейротрансмиттеры, как ацетилхолин, гамма-аминомасляная кислота (ГАМК) и серотонин, вырабатываются бактериями видов Lactobacillus, Bifidobacteria, Enterococcus, Streptococcus и оказывают прямое и косвенное влияние на физиологию клеток мозга [18]. Удивительно, но именно в кишечнике вырабатывается 90% серотонина, определяющего общее качество жизни человека в отношении настроения, поведения и сна. Предшественник серотонина – триптофан – влияет на активность клеток микроглии: полученные из пищевого триптофана бактериальные метаболиты способны контролировать воспаление ЦНС через опосредованный арилуглеводородным рецептором (AhR) механизм, действующий на активацию клеток микроглии и транскрипционную программу астроцитов [19].
Еще один немаловажный продукт бактериальной ферментации неперевариваемых пищевых волокон в толстой кишке – КЖК (бутират, пропионат и ацетат). КЖК способствуют сохранению целостности кишечного барьера, выработке слизи в достаточном количестве и поддержанию толерогенного ответа при воспалении, могут являться биохимическими маркерами изменения кишечного баланса [20]. Активность КЖК не ограничивается только ЖКТ, некоторая часть обнаруживается в мозге: с помощью транспортеров, расположенных на эпителиальных клетках сосудов головного мозга, КЖК способны пересекать гематоэнцефалический барьер (ГЭБ) [21]. На стерильных мышиных моделях обнаружено, что КЖК способны влиять как на ГЭБ, так и на стенки кишечника, восстанавливая их целостность. Пропионат и бутират влияют на сигнальную систему клетки через изменение внутриклеточного уровня калия. Также обнаружено влияние на регулирование уровня экспрессии триптофан-5-гидроксилазы, участвующей в синтезе серотонина, и тирозингидроксилазы, участвующей в биосинтезе дофамина, адреналина и норадреналина [22, 23].
Нарушения на любом этапе двунаправленного пути «оси кишечник – мозг» приводят к повреждениям состава и функционирования кишечной микробиоты, и, следовательно, оказывают влияние как на кишечник, так и на мозг, участвуя в развитии и течении психических заболеваний. Возможности балансировки «оси кишечник – мозг» обсуждалась давно, и в последние годы сформировалась концепция психобиотиков – пробиотиков, оказывающих положительное влияние на психическое здоровье.
Психобиотики
Различные бактерии не только живут в организме человека, но и при употреблении внутрь они проходят «транзитом», взаимодействуя с пищевыми продуктами, микробиотой кишечника и собственными клетками организма, оказывая как благоприятное, так и патологическое воздействие [24]. Некоторые подобные микроорганизмы, оказывающие благоприятное влияние, получили название «пробиотики» – «живые микроорганизмы, которые при введении внутрь в адекватных количествах приносят пользу организму». Концепция пробиотиков была основана на наблюдениях И.И. Мечникова и изучении молочнокислой палочки.
Не только полезные бактерии при попадании в организм способны оказывать благоприятный эффект. Так, в 1995 г. появилась концепция «пребиотиков», как «неперевариваемого пищевого компонента, избирательно стимулирующего рост и/или активность некоторого числа бактерий, уже живущих в организме» [25]. Отдельно отмечается способность пребиотиков не только выживать в агрессивной среде ЖКТ, но и проявлять уникальную активность при контакте с микробиотой кишечника. Постепенно исследователи выяснили, что пребиотики можно применять не только по отношению к ЖКТ, но и на других обильно населенных микробиотой частях тела, например, на коже или на влагалище. Таким образом, определение пребиотиков трансформировалось в «субстрат, который избирательно используется микроорганизмами, принося пользу для организма» [26]. Этому определению соответствуют такие субстраты как инулин, олигосахариды грудного молока, фрукто-, маннано-, галакто- и ксилоолигосахариды. На мышиных моделях продемонстрировано, что употребление пробиотиков в раннем возрасте может быть связано с положительными неврологическими эффектами в более старшем возрасте: добавив новорожденным мышам олигосахарид грудного молока (2'-фукозиллактоза), исследователи получили результат в виде значительных изменений у подрощенных мышей в тестах на когнитивные способности и усиление синаптической пластичности [26].
Достоверно продемонстрировано благотворное влияние про- и пребиотиков на ЖКТ, иммунную систему, кости, липидный обмен, а также на психическое здоровье. Впервые пробиотики использовались для лечения депрессии в 1910-х гг. [27], а в 2005 г. этот метод был глобально пересмотрен [28]. В 2013 г. в отдельный класс были выделены «психобиотики» – «про- и пребиотики, оказывающие положительное влияние на психическое здоровье при приеме внутрь в адекватных количествах» [3, 29]. Эффект психобиотиков не ограничивается регуляцией нейроиммунных систем: они также связаны с когнитивными функциями, способностью к обучению и восприятию информации, памятью и поведенческими реакциями. Например, два провоспалительных цитокина – фактор некроза опухоли-альфа (ФНОα) и интерлейкин-6 (IL-6) – не в последнюю очередь являются триггерами развития депрессивных расстройств. Некоторые пробиотики способны вызывать опосредованные IL-10 противовоспалительные реакции и подавлять развитие подобных расстройств [30]. Пробиотик Lactobacillus helveticus способен участвовать в восстановлении кишечного барьера за счет снижения воспалительной реакции при остром стрессе [31]. Продемонстрировано превращение нитратов в оксид азота (регулятор некоторых реакций иммунной и нервной систем) под воздействием штаммов Lactobacillus. Также отмечено повышение активности фермента индоламин-2,3-диоксигеназы, участвующего в катаболизме триптофана и в образовании некоторых нейроактивных соединений [32].
Влияние стресса на состав кишечной микробиоты, реакцию кишечника и мозга не стоит недооценивать. Стресс – это сложный динамический процесс, при котором изменяется состояние гомеостаза организма. Пережитый на ранних этапах развития острый стресс является одним из факторов развития большого депрессивного расстройства за счет дисрегуляции ГГНО [33]. Хронический стресс приводит к повреждению барьерной функции кишечника, а при дисрегуляции ГГНО становится неспособной устранить пагубные последствия переносимого стресса [34]. При исследовании данного процесса на крысиных моделях и при стресс-тестах группа крыс демонстрировала высокий уровень IL-6 и высокий уровень экспрессии гена CFR в миндалевидном теле. При введении данной группе L. rhamnosus R011 и L. helveticus R0052 животные подавляли реакции на ГГНО, и происходила нормализация уровня кортикостерона (основной глюкокортикостероид (ГКС) у крыс аналогичен кортизолу человека) [35]. При введении L. rhamnosus мышам, подвергнутым принудительному плаванию, наблюдались меньшие признаки тревоги и депрессии по сравнению с контрольной группой, а также более низкая экспрессия ГАМК в гиппокампе – доказательство влияния пробиотиков на ГГНО [35]. ГАМК – основной тормозной нейротрансмиттер нервной системы. Изменение его под влиянием психобиотика демонстрирует способность психобиотиков модулировать баланс торможения и возбуждения при реакции на стресс, депрессию и тревогу. Введение лакто- и бифидобактерий in vitro приводит к метаболизации глутамата с образованием ГАМК [36].
Прием некоторых штаммов Lactobacillus способствует индукции опиоидных-μ-рецепторов и способствует развитию обезболивающего эффекта, схожего с влиянием морфина. Психобиотики, воздействуя на микробиоту кишечника, способны даже влиять на висцеральное и соматическое восприятие боли [37].
Производство таких неперевариваемых метаболитов как КЖК (бутират, ацетат и пропионат) может быть усилено употреблением пребиотиков. КЖК регулируют метаболизм свободных жирных кислот, глюкозы и холестерина, а также влияют на ЦНС, изменяя экспрессию нейротрофического фактора головного мозга (brain-derived neurotrophic factor (BDNF)) [38]. Введение некоторых КЖК извне способно вызывать изменение поведенческих реакций у пациентов с РАС. Бутират преодолевает ГЭБ и оказывает нейропротекторное, когнитивное и антидепрессивное действие [39]. Таким образом, микробиота кишечника, влияя на ГГНО, определяет реакцию на стресс, а прием психобиотиков изменяет некоторые механизмы воздействия кортизола.
Воздействие психобиотиков на «ось кишечник – мозг»
Большинство исследований изучают влияние таких штаммов пробиотиков, как Lactobacillus и Bifidobacteria, а также дрожжей Saccharomyces boulardii [40]. Исследовано влияние психобиотических препаратов на пациентах с депрессией, тревогой, синдромом раздраженного кишечника (СРК), шизофренией, болезнью Паркинсона, болезнью Альцгеймера, РАС, СДВГ и бессонницей [41, 42]. Использование в течение 8 нед. психобиотиков с содержанием Lactobacillus и Bifidobacterium у пациентов с депрессией достоверно снижало показатели большого депрессивного расстройства по сравнению с группой плацебо [43]. В другом исследовании введение Bifidobacterium longum значительно снижало уровень депрессии, но не тревоги [44]. Использование штамма Bifidobacterium infantis 35624 эффективно при депрессивном поведении [45]. Пробиотические добавки снижали риск заболеваний кишечника у пациентов с умеренными и тяжелыми симптомами шизофрении [46]. Отмечается, что разные штаммы одного и того же вида бактерий могут демонстрировать противоположные эффекты: например, при употреблении Lactobacillus rhamnosus JB-1 здоровыми мужчинами не было отмечено влияния на их настроение, тогда как применение Lactobacillus casei Shirota улучшало настроение у пациентов с исходно низкими показателями [47, 48].
Выбор подходящего психобиотика, учитывая перечисленную выше информацию, может представляться трудной задачей. Для пациентов с признаками СРК на российском рынке доступен пробиотик-психобиотик Примадофилус® Бифидус, в состав одной капсулы которого входят 3,9 млрд лиофилизированных пробиотических микроорганизмов Bifidobacterium infantis, Bifidobacterium longum, Lactobacillus rhamnosus, Lactobacillus acidophilus, доказавших свою эффективность в качестве психобиотиков [49]. Прием препарата в виде одной капсулы в сутки в течение стандартного курса продолжительностью 2–4 нед. устраняет боль и вздутие живота, а также способствует нормализации частоты дефекаций как при запорах, так и при диарее у взрослых. В педиатрической практике применяется Примадофилус® Детский, в состав которого входят Bifidobacterium infantis, Bifidobacterium longum, Lactobacillus rhamnosus, Lactobacillus acidophilus. Детям с рождения до 1 года рекомендуется употреблять по 0,5 чайной ложки (1,5 г), детям от 1 года до 5 лет – по 1 чайной ложке (3,0 г) 1 раз в день во время еды в течение 2–4 нед. Стоит отметить удобство применения препарата: достаточно развести пробиотик в кипяченой воде, смеси, грудном молоке, либо в другой жидкости.
Начало XXI в. ознаменовалось разработкой и внедрением в клиническую практику современного протокола ведения пациентов с ВГИ, включающего вышеописанные диагностические и терапевтические этапы. Внедрение данного протокола в процессы оказания помощи детям с ВГИ в ряде стран мира позволило значительно повысить качество диагностики, персонифицировать терапию и, таким образом, значимо повлиять на исходы заболевания в долгосрочной перспективе, что в особенности затронуло пациентов с фокальной формой заболевания, для которых стало возможным полное выздоровление [10, 11].
Колоссальные успехи, достигнутые в отношении диагностических и терапевтических возможностей ведения пациентов с ВГИ, привели к значимому сокращению неблагоприятных неврологических исходов заболевания, тем не менее по результатам публикаций последних лет, посвященных изучению психомоторного развития пациентов с ВГИ, проблема нейрокогнитивного статуса данной категории пациентов по-прежнему остается актуальной [10, 11]. Поиск наиболее значимых факторов, ассоциированных как с самим заболеванием (морфологическая форма – фокальная, диффузная либо атипичная), так и с факторами, имеющими отношение к организации оказания медицинской помощи (возраст манифестации, верификации заболевания, возраст старта терапии, сочетание с др. коморбидностями, минимальные значения гликемии и т.д.), а также изучение особенностей реагирования центральной нервной системы на эпизоды гипогликемии являются очень важными и в перспективе способны определить протективные факторы в отношении наиболее благоприятного исхода заболевания с точки зрения неврологических последствий.
Заключение
Появляется все больше сообщений, свидетельствующих о положительном влиянии психобиотиков на психические состояния пациентов. Некоторые штаммы доказали свое влияние на улучшение функций ЦНС, в т. ч. на настроение и на реакции на стресс, и при лечении депрессивных расстройств. Методы лечения с использованием психобиотиков показывают многообещающие результаты при применении у взрослых пациентов с нейродегенеративными заболеваниями. Доказано, что при применении в детской практике психобиотики благоприятно воздействуют при СРК, устраняя боль, вздутие живота и нормализуя частоту дефекаций. Однако требуется дальнейшее изучение влияния психобиотиков на психические расстройства в педиатрической популяции. Необходимо помнить о важности соблюдения здоровой диеты, а также о том, что многие психотропные препараты (антидепрессанты и нейролептики) имеют свое собственное влияние на кишечный микробиом. Психобиотики – многообещающий элемент поддержки психофармакологического подхода в терапии психических расстройств. Тем не менее требуются дальнейшие исследования для более точного изучения механизмов действия и эффективности психобиотиков, выделение конкретных штаммов и распознавание их влияния на различные психические процессы.
Список литературы / References
- Ahlawat S., Asha, Sharma K.K. Gutorgan axis: a microbial outreach and networking. Lett App Microbiol. 2020;72(6):636-668. https://doi.org/10.1111/lam.13333.
- Roger AJ., Munoz-Gomez S.A., Kamikawa R. The origin and diversification of mitochondria. Curr Biol. 2017;27(21):R1177-R1R92. https://doi.org/10.1016/j.cub.2017.09.015.
- Moloney R.D., Desbonnet L., Clarke G., Dinan T.G., Cryan J.F. The microbiome: stress, health and disease. Mamm Genome. 2014;25(1-2):49-74. https://doi.org/10.1007/s00335-013-9488-5.
- Dinan T.G., Stanton C., Cryan J.F. Psychobiotics: A novel class of psychotropic. Biol Psychiatry. 2013;74(10):720-726. https://doi.org/10.1016/j.bio-psych.2013.05.001.
- Sampson T.R., Debelius J.W., Thron T., Janssen S., Shastri G.G., Ilhan Z.E. et al. Gut microbiota regulate motor deficits and neuroinflammation in a model of Parkinson's disease. Cell. 2016;167(6):1469-1480.e12. https://doi.org/10.1016/j.cell.2016.11.018.
- Leung K., Thuret S. Gut microbiota: a modulator of brain plasticity and cognitive function in ageing. Healthcare (Basel). 2015;3(4):898-916. https://doi.org/10.3390/healthcare3040898.
- Qin J., Li R., Raes J., Arumugam M., Burgdorf K.S., Manichanh C. et al. A human gut microbial gene catalogue established by metagenomic sequencing. Nature. 2010;464(7285):59-65. https://doi.org/10.1038/nature08821.
- Drossman D.A. Functional gastrointestinal disorders: history, pathophysiology, clinical features and rome IV. Gastroenterology. 2016;150(6):1262-1279.E2. https://doi.org/10.1053/j.gastro.2016.02.032.
- Margolis K.G., Cryan J.F., Mayer E.A. The Microbiota-gut-brain axis: from motility to mood. Gastroenterology. 2021;160(5):1486-1501. https://doi.org/10.1053/j.gastro.2020.10.066.
- Mayer E.A. Gut feelings: the emerging biology of gut-brain communication. Nat Rev Neurosci. 2011;12(8):453-466. https://doi.org/10.1038/nrn3071.
- Pearse A.G. The cytochemistry and ultrastructure of polypeptide hormone-producing cells of the APUD series and the embryologic, physiologic and pathologic implications of the concept. J Histochem Cytochem. 1969;17(5):303-313. https://doi.org/10.1177/17.5.303.
- Furness J.B., Callaghan B.P., Rivera L.R., Cho H.-J. The enteric nervous system and gastrointestinal innervation: integrated local and central control. Adv Exp Med Biol. 2014;817:39-71. https://doi.org/10.1007/978-1-4939-0897-4_3.
- Sundman E., Olofsson P.S. Neural control of the immune system. Adv Physiol Educ. 2014;38(2):135-139. https://doi.org/10.1152/advan.00094.2013.
- Dinan T.G., Cryan J.F. Regulation of the stress response by the gut microbiota: Implications for psychoneuroendocrinology. Psychoneuroendocrinology. 2012;37(9):1369-1378. https://doi.org/10.1016/j.psyneuen.2012.03.007.
- Carabotti M., Scirocco A., Maselli M.A., Severi C. The gut-brain axis: Interactions between enteric microbiota, central and enteric nervous systems. Ann Gastroenterol. 2015;28(2):203-209. Available at: https://pubmed.ncbi.nlm.nih.gov/25830558.
- Bermudez-Humaran L.G., Salinas E., Ortiz G.G., Ramirez-Jirano LJ., Morales J.A., Bitzer-Quintero O.K. From probiotics to psychobiotics: live beneficial bacteria which act on the brain-gut axis. Nutrients. 2019;11(4):890. https://doi.org/10.3390/nu11040890.
- Cryan J.F., O'Riordan K.J., Cowan C.S.M., Sandhu K.V., Bastiaanssen T.F.S., Boehme M. et al. The Microbiota-Gut-Brain Axis. Physiol Rev. 2019;99(4):1877-2013. https://doi.org/10.1152/physrev.00018.2018.
- Borre Y.E., O'Keeffe G.W., Clarke G., Stanton C., Dinan T.G., Cryan J.F. Microbiota and neurodevelopmental windows: implications for brain disorders. Trends Mol Med. 2014;20(9):509-518. https://doi.org/10.1016/j.molmed.2014.05.002.
- Yano J.M., Yu K., Donaldson G.P., Shastri G.G., Ann P., Ma L. et al. Indigenous bacteria from the gut microbiota regulate host serotonin biosynthesis. Cell. 2015;161(2):264-276. https://doi.org/10.1016/j.cell.2015.02.047.
- Gershon M.D. 5-Hydroxytryptamine (serotonin) in the gastrointestinal tract. Curr Opin Endocrinol Diabetes Obes. 2013;20(1):14-21. https://doi.org/10.1097/MED.0b013e32835bc703.
- Dissanayake D., Hall H., Berg-Brown N., Elford A.R., Hamilton S.R., Murakami K. et al. Nuclear factor-kB1 controls the functional maturation of dendritic cells and prevents the activation of autoreactive T cells. Nat Med. 2011;17(12):1663-1667. https://doi.org/10.1038/nm.2556.
- Wishart D.S., Feunang Y.D., Marcu A., Guo A.C., Liang K., Vazquez-Fresno R. et al. HMDB 4.0: the human metabolome database for 2018. Nucleic Acids Res. 2018;46(D1):D608-D617. https://doi.org/10.1093/nar/gkx1089.
- Oleskin A.V., Shenderov B.A. Neuromodulatory effects and targets of the SCFAs and gasotransmitters produced by the human symbiotic microbiota. Microb Ecol Health Dis. 2016;27:30971. https://doi.org/10.3402/mehd.v27.30971.
- Nankova B.B., Agarwal R., MacFabe D.F., La Gamma E.F. Enteric bacterial metabolites propionic and butyric acid modulate gene expression, including CREB-dependent catecholaminergic neurotransmission, in PC12 cells -possible relevance to autism spectrum disorders. PloS ONE. 2014;9(8):e103740. https://doi.org/10.1371/journal.pone.0103740.
- Hill C., Guarner F., Reid G., Gibson G.R., Merenstein D.J., Pot B. et al. Expert consensus document. The International Scientific Association for Probiotics and Prebiotics consensus statement on the scope and appropriate use of the term probiotic. Nat Rev Gastroenterol Hepatol. 2014;11(8):506-514. https://doi.org/10.1038/nrgastro.2014.66.
- Gibson G.R., Roberfroid M.B. Dietary modulation of the human colonic microbiota: Introducing the concept of prebiotics. J Nutr. 1995;125(6):1401-1412. https://doi.org/10.1093/jn/125.6.1401.
- Gibson G.R., Hutkins R., Sanders M.E., Prescott S.L., Reimer R.A., Salminen S.J. et al. Expert consensus document: The International Scientific Association for Probiotics and Prebiotics (ISAPP) consensus statement on the definition and scope of prebiotics. Nat Rev Gastroenterol Hepatol. 2017;14(8):491-502. https://doi.org/10.1038/nrgastro.2017.75.
- Phillips J.G.P. The treatment of melancholia by the lactic acid bacillus. J Ment Sci. 1910;56(234):422-430. https://doi.org/10.1192/bjp.56.234.422.
- Logan A.C., Katzman M. Major depressive disorder: probiotics may be an adjuvant therapy. Med Hypotheses. 2005;64(3):533-538. https://doi.org/10.1016/j.mehy.2004.08.019.
- Burnet P.W.J., Cowen P.J. Psychobiotics highlight the pathways to happiness. Biol Psychiatry. 2013;74(10):708-709. https://doi.org/10.1016/j.bio-psych.2013.08.002.
- Matcovitch-Natan O., Winter D.R., Giladi A., Vargas Aguilar S., Spinrad A., Sarrazin S. et al. Microglia development follows a stepwise program to regulate brain homeostasis. Science. 2016;353(6301):aad8670. https://doi.org/10.1126/science.aad8670.
- Bambury A., Sandhu K., Cryan J.F., Dinan T.G. Finding the needle in the haystack: Systematic identification of psychobiotics. Br J Pharmacol. 2018;175(24):4430-4438. https://doi.org/10.1111/bph.14127.
- Forsythe P., Sudo N., Dinan T., Taylor V.H., Bienenstock J. Mood and gut feelings. Brain Behav Immun. 2010;24(1):9-16. https://doi.org/10.1016/j.bbi.2009.05.058.
- Mayer E.A. The neurobiology of stress and gastrointestinal disease. Gut. 2000;47(6):861-869. https://doi.org/10.1136/gut.47.6.861.
- Eyre H., Baune B.T. Neuroplastic changes in depression: A role for the immune system. Psychoneuroendocrinology. 2012;37(9):1397-1416. https://doi.org/10.1016/j.psyneuen.2012.03.019.
- Gareau M.G., Jury J., MacQueen G., Sherman P.M., Perdue M.H. Probiotic treatment of rat pups normalises corticosterone release and ameliorates colonic dysfunction induced by maternal separation. Gut. 2007;56(11):1522-1528. https://doi.org/10.1136/gut.2006.117176.
- Foster J.A., McVey Neufeld K.-A. Gut-brain axis: How the microbiome influences anxiety and depression. Trends Neurosci. 2013;36(5):305-312. https://doi.org/10.1016/j.tins.2013.01.005.
- Amaral F.A., Sachs D., Costa V.V., Fagundes C.T., Cisalpino D., Cunha T.M. et al. Commensal microbiota is fundamental for the development of inflammatory pain. Proc Natl Acad Sci U S A. 2008;105(6):2193-2197. https://doi.org/10.1073/pnas.0711891105.
- Lv F., Chen S., Wang L., Jiang R., Tian H., Li J. et al. The role of microbiota in the pathogenesis of schizophrenia and major depressive disorder and the possibility of targeting microbiota as a treatment option. Oncotarget. 2017;8(59):100899-100907. https://doi.org/10.18632/oncotarget.21284.
- Han A., Sung Y.-B., Chung S.-Y., Kwon M.-S. Possible additional antidepressant-like mechanism of sodium butyrate: targeting the hippocampus. Neuropharmacology. 2014;81:292-302. https://doi.org/10.1016/j.neuro-pharm.2014.02.017.
- Surawicz C.M., Elmer G.W., Speelman P., McFarland L.V., Chinn J., Van Belle G. Prevention of antibiotic-associated diarrhea by Saccharomyces boulardii: a prospective study. Gastroenterology. 1989;96(4):981-988. https://doi.org/10.1016/0016-5085(89)91613-2.
- Chalmers J.A., Quintana D.S., Abbott M.J.-A., Kemp A.H. Anxiety disorders are associated with reduced heart rate variability: a meta-analysis. Front Psychiatry. 2014;5:80. https://doi.org/10.3389/fpsyt.2014.00080.
- Clamor A., Lincoln T.M., Thayer J.F., Koenig J. Resting vagal activity in schizophrenia: meta-analysis of heart rate variability as a potential endophenotype. Br J Psychiatry. 2016;208(1):9-16. https://doi.org/10.1192/bjp.bp.114.160762.
- Akkasheh G., Kashani-Poor Z., Tajabadi-Ebrahimi M., Jafari P., Akbari H., Taghizadeh M. et al. Clinical and metabolic response to probiotic administration in patients with major depressive disorder: a randomized, doubleblind, placebo-controlled trial. Nutrition. 2016;32(3):315-320. https://doi.org/10.1016/j.nut.2015.09.003.
- Pinto-Sanchez M.I., Hall G.B., Ghajar K., Nardelli A., Bolino C., Lau J.T. et al. Probiotic Bifidobacterium longum NCC3001 reduces depression scores and alters brain activity: a pilot study in patients with irritable bowel syndrome. Gastroenterology. 2017;153(2):448-459.e8. https://doi.org/10.1053/j.gastro.2017.05.003.
- Bravo J.A., Forsythe P., Chew M.V., Escaravage E., Savignac H.M., Dinan T.G. et al. Ingestion of Lactobacillus strain regulates emotional behavior and central GABA receptor expression in a mouse via the vagus nerve. Proc Natl Acad Sci U S A. 2011;108(38):16050-16055. https://doi.org/10.1073/pnas.1102999108.
- Dickerson F.B., Stallings C., Origoni A., Katsafanas E., Savage C.L.G., Schweinfurth L.A.B. et al. Effect of probiotic supplementation on schizophrenia symptoms and association with gastrointestinal functioning: a randomized, placebo-controlled trial. Prim Care Companion CNS Disord. 2014;16(1):PCC.13m01579. https://doi.org/10.4088/PCC.13m01579.
- Kelly J.R., Allen A.P., Temko A., Hutch W., Kennedy P.J., Farid N. et al. Lost in translation? The potential psychobiotic Lactobacillus rhamnosus (JB-1) fails to modulate stress or cognitive performance in healthy male subjects. Brain Behav Immun. 2017;61:50-59. https://doi.org/10.1016/j.bbi.2016.11.018.
- Benton D., Williams C., Brown A. Impact of consuming a milk drink containing a probiotic on mood and cognition. Eur J Clin Nutr. 2007;61(3):355-361. https://doi.org/10.1038/sj.ejcn.1602546.
- Дармов И.В., Чичерин И.Ю., Ердякова А.С., Погорельский И.П., Лундовских И.А. Сравнительная оценка выживаемости микроорганизмов пробиотиков в составе коммерческих препаратов в условиях in vitro. Гастроэнтерология. 2011;(9):96-101. Режим доступа: https://cyberleninka.ru/article/n/sravnitelnaya-otsenka-vyzhivaemosti-mikroorganizmov-probiotikov-v-sostave-kommercheskih-preparatov-v-usloviyah-in-vitro.




 1
1 2
2 3
3 4
4


Комментарии (0)