Журнал "Амбулаторная хирургия" №1/2023
DOI: 10.21518/akh2022-005
Б.В. Болдин1, В.Ю. Богачев1,2, П.Ю. Голосницкий1,3, П.Ю. Туркин1,3, Варич Г.А.1,4, И.М. Дизенгоф3
1 Российский национальный исследовательский медицинский университет имени Н.И. Пирогова; 117997, Россия, Москва, ул. Островитянова, д. 1
2 Первый флебологический центр; 117447, Россия, Москва, ул. Дмитрия Ульянова, д. 31
3 Центральная клиническая больница Святителя Алексия Митрополита Московского Московской Патриархии Русской Православной Церкви; 119071, Россия, Москва, Ленинский проспект, д. 27
4 Химкинская областная больница; 141407, Россия, Московская обл., Химки, Куркинское шоссе, д. 11
Стремительное развитие инновационных медицинских технологий, расширение показаний к оперативному лечению, значительное увеличение числа выполняемых операций при варикозной болезни вен нижних конечностей, анализ литературы и данных крупных обсервационных исследований последних 20 лет позволяют констатировать неуклонный рост частоты ятрогенных повреждений сосудисто-нервного пучка и лимфатических коллекторов нижней конечности в хирургии варикозной болезни, что и явилось поводом для публикации данного обзора. Это может приводить к тяжелым осложнениям, требующим хирургического вмешательства, вызывает социальные и экономические последствия, связанные с необходимостью длительного амбулаторного и стационарного лечения, расходами на социальное обеспечение и выраженное снижение качества жизни. Сообщения о встречаемости данной патологии в медицинской литературе немногочисленны и, как правило, описывают исключительно редкие клинические случаи. Своевременная диагностика осложнений, тактика хирургического лечения пациентов с ятрогенными повреждениями при хирургическом лечении варикозной болезни и возможные варианты коррекции возникающих осложнений продолжают вызывать дискуссии и остаются одной из обсуждаемых проблем современной ангиохирургии. В статье проведен обзор литературы, посвященной анализу возможных причин ятрогении в хирургии варикозной болезни: повреждение сосудисто-нервного пучка и лимфатических сосудов бедренного треугольника, бедренной вены, большой подкожной вены, бедренной артерии, сочетанные повреждения артерии и вены, лимфатических узлов и коллекторов, подкожного нерва при флебэктомии. Рассмотрены вопросы диагностики и варианты коррекции возникших осложнений. Проблема ошибок и осложнений в хирургии вен должна решаться на основе комплексной подготовки хирургов-флебологов, включая обязательное обучение навыкам сосудистой хирургии, а также оснащения клиник специальным оборудованием и инструментарием.
Для цитирования: Болдин Б.В., Богачев В.Ю., Голосницкий П.Ю., Туркин П.Ю., Варич Г.А., Дизенгоф И.М. Ятрогенные повреждения сосудисто-нервного пучка и лимфатических коллекторов бедренного треугольника при флебэктомии. Амбулаторная хирургия. 2023;20(1):16-36. https://doi.org/10.21518/akh2022-005
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Iatrogenic damage to the vascular-nerve bundle and lymphatic collectors of the femoral triangle during phlebectomy
Boris V. Boldin1, Vadim Yu. Bogachev1,2, Pavel Yu. Golosnitskiy1,3, Pavel Yu. Turkin1, Georgу A. Varich1,4, Igor M. Dizengof1,3
1 Pirogov Russian National Research Medical University; 1, Ostrovityanov St., Moscow, 117997, Russia
2 First Phlebological Center; 31, Dmitry Ulyanov St., Moscow, 117447, Russia
3 Central Clinical Hospital of St. Alexis Metropolitan of Moscow of the Moscow Patriarchy of the Russian Orthodox Church;
27, Leninsky Ave., Moscow, 119071, Russia
4 Khimki Regional Hospital; 11, Kurkinskoe Shosse, Khimki, Moscow Region, 141407, Russia
The rapid development of innovative medical technologies, the expansion of indications for surgical treatment, a significant increase in the number of operations performed for varicose veins entails a steady increase in the frequency of iatrogenic damage to the vascular-nerve bundle andlymphatic collectors of thelowerlimb. This canlead to severe complications requiring surgery, social and economic consequences associated with the need for long-term outpatient and inpatient treatment, social security costs and a marked decrease in quality of life. Reports on the occurrence of this pathology in the medical literature are few and, as a rule, describe extremely rare clinical cases. Timely diagnosis of complications, tactics of surgical treatment of patients with iatrogenic injuries in the surgical treatment of varicose veins and possible options for correcting emerging complications continue to cause discussion and remain one of the discussed problems of modern angiosurgery. The article provides a review of the literature devoted to the analysis of possible causes of iatrogenesis in varicose vein surgery: damage to the neurovascular bundle and lymphatic vessels of the femoral triangle, femoral vein, great saphenous vein, femoral artery, concomitant damage to the artery and vein, lymph nodes and basins, saphenous nerve during phlebectomy. The issues of diagnosis and options for correcting the complications that have arisen. The problem of mistakes and complications in the vein surgery should be resolved through comprehensive training of phlebologists, including compulsory teaching of vascular surgery skills, as well as supplying special equipment and instruments to the clinics.
For citation: Boldin B.V., Bogachev V.Yu., Golosnitskiy P.Yu., Turkin P.Yu., Varich G.A., Dizengof I.M. Iatrogenic damage to the vascular-nerve bundle and lymphatic collectors of the femoral triangle during phlebectomy. Ambulatornaya khirurgiya = Ambulatory Surgery (Russia). 2023;20(1):16-36. (In Russ.) https://doi.org/10.21518/akh2022-005
Conflict of interest: the authors declare no conflict of interest.
Введение
Варикозная
болезнь нижних конечностей продолжает оставаться одним из самых
распространенных заболеваний в человеческой популяции, которым страдает до 40%
населения развитых стран. Согласно эпидемиологическим исследованиям,
заболеваемость варикозным расширением вен составляет в среднем 13,5 на 1000 чел.
в год (8,5 для мужчин и 19,2 для женщин) [1]. Это заболевание может значительно
снижать качество жизни, а на поздних стадиях приводить как к развитию выраженных
трофических изменений кожи нижних конечностей, так и к инвалидизации пациента
[2].
Лечение
эластической компрессией отдельно или в сочетании с приемом веноактивных
препаратов оказалось менее эффективным, чем хирургическое вмешательство. Несмотря
на постоянно растущую популярность эндоваскулярных вмешательств, во многих
странах открытая хирургическая операция продолжает оставаться золотым стандартом
лечения [3]. Типичная операция при варикозном расширении вен включает этапы кроссэктомии,
стриппинга с последующим иссечением варикозно трансформированных подкожных притоков
[4]. Нередко это хирургическое вмешательство расценивается пациентами и
практикующими врачами как относительно безопасное, часто проводится только из
эстетических соображений и обычно считается несложной процедурой, подходящей
для стационара одного дня [5]. Во многих больницах операции подобного рода часто
поручают менее опытным хирургам и хирургам-стажерам. В реальности же,
возникающие интраоперационные осложнения несут в себе серьезные риски не только
потери конечности и возможной инвалидизации, но и утраты жизни пациента [6].
Анализ
литературы и данных крупных обсервационных исследований последних 20 лет позволяет
констатировать неуклонный рост частоты ятрогенных повреждений
сосудисто-нервного пучка и лимфатических коллекторов нижней конечности в
хирургии варикозной болезни, что и явилось поводом для публикации данного обзора.
Обзор литературы
Несмотря на стремительное развитие и совершенствование хирургической помощи
при поражении периферических сосудов, некоторые аспекты диагностики и варианты лечения
сосудистых повреждений до настоящего времени сохраняют свою актуальность [1] [7, 8]. При этом
хирургическое лечение ятрогенной травмы сосудов является наиболее сложным и
дискутабельным разделом медицины и продолжает вызывать много вопросов [2] [9]. Истинная частота
ятрогенной травмы в хирургии сосудов является недостаточно изученной, что
связано со сложностью ее систематизации и подсчета в числе выполненных операций
при различной сосудистой патологии [3] [10]. Большинство
наблюдений ятрогенного повреждения сосудов носят казуистический характер,
вместе с тем некоторые случаи по известным причинам заведомо не публикуются, а их
ранние и отдаленные последствия зачастую замалчиваются [11, 12].
Многие авторы в своих публикациях отмечают неуклонную тенденцию к росту
частоты встречаемости ятрогенных повреждений сосудов, которая в настоящее время
варьирует от 20 до 48%, а в европейских странах не опускается ниже уровня 40% в
общей структуре всех сосудистых повреждений [9, 13]. Это может быть напрямую
связано со значительным увеличением числа выполняемых эндоваскулярных
вмешательств и обоснованным расширением показаний к выполнению радикальных
операций на артериальных и венозных сосудах [14–16]. Летальность при
повреждениях магистральных артерий и вен в настоящее время продолжает
оставаться высокой и колеблется в пределах 8–26,4%, а частота ампутаций
конечности составляет 10,8–26% и не имеет тенденции к снижению [17, 18].
Публикации,
посвященные осложнениям хирургии варикозного расширения вен, как правило,
концентрируются на конкретных аспектах, таких как повреждение артериальных и
венозных сосудов, периферических нервов и лимфатических коллекторов. Сообщения
о серьезных повреждениях сосудов могут вызвать у практикующего хирурга ужас или
изумление, но они не дают оценки риска, так как основаны лишь на описании конкретных
случаев [19, 20]. Статьи о неврологических последствиях были основаны
на проспективных исследованиях, посвященных повреждению нервов в связи с
удалением подкожных вен, но они не содержат информации о более серьезных
осложнениях, таких как паралич стопы, которые, несомненно, происходят время от
времени [21, 22].
При этом осложнения (большие и
малые) отмечаются примерно у 18–20% пациентов, перенесших стандартную операцию
по поводу варикозного расширения вен. Частота малых осложнений варьирует от 3
до 10% и включает раневые осложнения, инфекции, образование гематом бедра и
абсцессов. О серьезных же ятрогенных осложнениях, таких как повреждение нерва,
бедренной артерии и бедренной вены в бедренном треугольнике сообщается примерно
у 0,03–0,08% пациентов с неуклонной тенденцией к росту [23, 24].
Анализ
возможных причин повреждения сосудисто-нервного пучка бедренного треугольника в
хирургии варикозной болезни
В связи со
стремительным увеличением в последние годы числа пациентов с варикозной
болезнью, значительным расширением показаний к радикальному оперативному
лечению неуклонно отмечается пропорциональный рост числа ятрогенных травм
сосудов во время выполнения стандартной флебэктомии, при этом наиболее часто
происходит повреждение бедренной вены или бедренной артерии. На первый план при
этом в качестве возможных причин ятрогении выходят погрешности хирургической
техники при выполнении оперативного вмешательства, особенности строения сафено-феморального
соустья и вариабельность анатомического взаимоотношения сосудистого пучка бедренного
треугольника [25, 26].
Главными
причинами погрешностей хирургической техники являются:
– невысокая
квалификация хирурга, выражающаяся в отсутствии определенной настороженности
при манипуляциях вблизи крупных сосудов;
– неадекватный
доступ в паховой области, затрудняющий действия в ране;
– недостаточные
знания нормальной анатомии овальной ямки;
– отказ от
полного выделения сафено-феморального соустья с визуализацией места впадения
большой подкожной вены и притоков в бедренную вену;
– недоучет
возможного спазма артерий в ответ на механическое воздействие;
– грубое продвижение
головки зонда Бэбкока;
– не
полностью осуществленный гемостаз в результате грубого отношения к тканям и бесконтрольного
наложения зажимов при небольшом кровотечении;
– отсутствие
должного контроля за прооперированной конечностью в первые сутки после операции
[6, 27].
По мнению
ряда авторов, частой причиной ятрогенного повреждения бедренных сосудов
является их ошибочное принятие за ствол большой подкожной вены, обусловленное анатомическими
особенностями строения сафено-феморального соустья и большой вариабельностью
впадения формирующих его притоков. Так, сообщается о достаточно частом наличии
дополнительного
соединения поверхностных и глубоких вен в зоне бедренного треугольника [28, 29].
М. Lefebvre-Vilardebo
приводит результаты собственных исследований, согласно которым изолированное сафено-феморальное
соустье встречается только у 57% людей. У остальных имеются различные варианты
соединений поверхностных и глубоких вен в зоне бедренного треугольника, которые
не обнаруживаются и не легируются во время кроссэктомии. Эти вены могут стать
как источником послеоперационного рецидива, так и объектом ятрогенного
повреждения, сопровождающегося трудно останавливаемым кровотечением [30]. Именно поэтому тщательное выделение и визуализация общей
бедренной вены необходимы не только для идентификации и лигирования всех
проксимальных притоков, но и как предохранительный механизм для предотвращения
отрывной травмы прямых притоков [31–33].
Вариабельность
анатомии притоков, формирующих сафено-феморальное соустье, при их неправильной до-
и интраоперационной интерпретации, может служить причиной тяжелых ятрогенных
повреждений [34, 35]. Так, при F-образном строении формируется сразу два ствола большой подкожной вены,
каждый из которых самостоятельно впадает в стенку бедренной вены. Во
время операции одно из соустий, как правило, остается незамеченным и может быть
надорвано при тракции за культю большой подкожной вены, что приводит к
возникновению значительного кровотечения [36] (рис. 1).
Рисунок 1. F-образное соустье
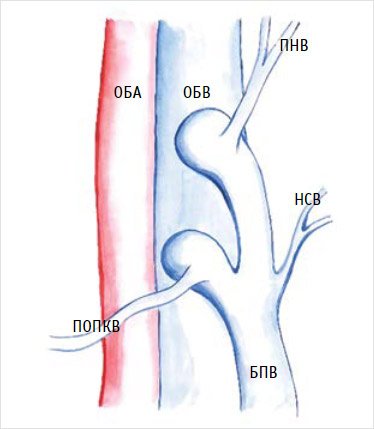
БПВ – большая подкожная вена; НСВ –
наружная срамная вена; ОБА – общая бедренная артерия; ОБВ – общая бедренная вена;
ПНВ – поверхностная надчревная вена; ПОПКВ – поверхностная, окружающая
подвздошную кость вена.
span src="file:///C:/Users/1/AppData/Local/Temp/msohtmlclip1/01/clip_image001.png">
Приустьевое расширение
ствола большой подкожной вены в области соустья может быть причиной повреждения
стенки бедренной вены и кровотечения при затягивании лигатуры в области
проксимальной культи. При этом образуется довольно широкое повреждение стенки
бедренной вены, требующее восстановления путем ушивания дефекта [37] (рис. 2).
Рисунок
2. Эктазия сафено-феморального соустья
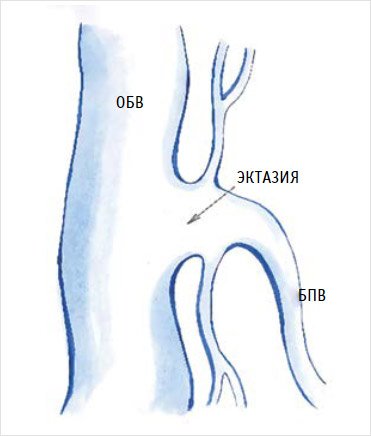
БПВ – большая подкожная вена; ОБВ – общая
бедренная вена.
Множественное впадение
притоков без формирования единого ствола, т. е. плексиформная конфигурация
проксимального отдела большой подкожной вены наиболее сложна для хирургического
лечения, так как существует высокий риск повреждения множественных извитых тонкостенных
вен при их выделении, а некоторые притоки и вовсе остаются незамеченными и могут являться источником кровотечения [38] (рис. 3).
Рисунок 3. Плексиформное
соустье
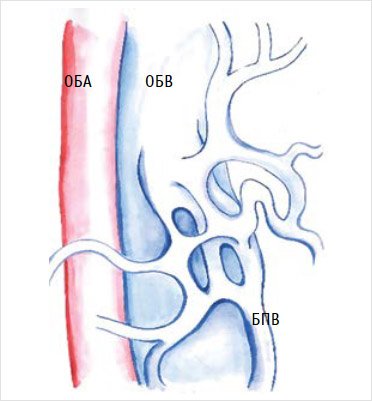
БПВ – большая подкожная вена; ОБА – общая
бедренная артерия; ОБВ – общая бедренная вена.
При С-образном варианте впадения
большая подкожная вена изгибается в терминальном отделе, пересекая стенку
бедренной артерии и образуя соустье с бедренной веной на латеральной стороне от
бедренной артерии. При таком варианте впадения сохраняется высокий риск
повреждения бедренной артерии с развитием массивного кровотечения [39] (рис. 4).
Рисунок 4. С-образное
соустье
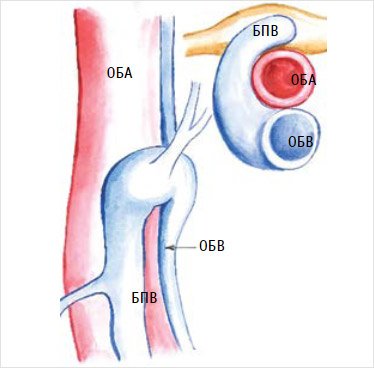
БПВ – большая подкожная вена; ОБА – общая
бедренная артерия; ОБВ – общая бедренная вена.
Еще одной
немаловажной причиной, приводящей к серьезным интраоперационным осложнениям,
является полная и неполная транспозиция сосудов бедренного треугольника и,
соответственно, вариантов впадения большой подкожной вены и глубокой артерии
бедра, в корне меняющие анатомические взаимоотношения и влекущие за собой
возможные ятрогенные повреждения [40, 41] (рис.
5).
Седалищная, или осевая, артерия отходит от
дорсальной стороны пупочной артерии у эмбриона размером 6 мм и кровоснабжает
зачаток нижней конечности. Пупочная артерия, которая со временем становится
общей подвздошной артерией, дает начало наружной подвздошной артерии. У
эмбриона размером 10 мм бедренная артерия начинает формироваться как ветвь
наружной подвздошной артерии [42].
На момент достижения размера в 14 мм седалищная и бедренная артерии
полностью развиты, сообщаются друг с другом на уровне подколенной артерии, что
приводит к двойному кровоснабжению. Именно на этом этапе развития
эмбриона могут возникать вариации взаимоотношений между бедренными сосудами [43, 44] (рис. 6).
Рисунок 5. Полная транспозиция бедренных сосудов
Рисунок 6. Неполная транспозиция бедренных сосудов
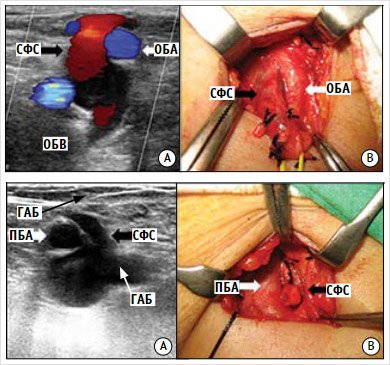
А – ультразвуковое ангиосканирование вен нижних конечностей; B – интраоперационная картина в правой паховой области. ОБВ – общая бедренная вена, СФС – сафено – феморальное соустье, ОБА – общая бедренная артерия.
А – ультразвуковое ангиосканирование вен нижних конечностей; B – интраоперационная картина в левой паховой области. ГАБ – глубокая артерия бедра; ПБА – поверхностная бедренная артерия; СФС – сафено-феморальное соустье.
У эмбриона размером от 14 до 24 мм происходит
прогрессивное развитие бедренной системы по мере того, как седалищная артерия
регрессирует и становится прерывистой. На 6-й неделе развития (24 мм) остатки
седалищной артерии дают начало нижней ягодичной артерии, третьей и четвертой перфорирующей
ветви глубокой бедренной, подколенной, малоберцовой и проксимальной части
передней большеберцовой артерии. Гуморальные события, которые стимулируют это
развитие, неизвестны. В конечном счете в норме бедренная вена лежит медиальнее
бедренной артерии в бедренном канале и верхней части треугольника Скарпа и
постепенно выходит на латеральную сторону артерии на вершине треугольника,
проходящего кзади от нее [45].
Анатомические аномалии расположения бедренных
сосудов в проекции треугольника Скарпа встречаются в среднем в 0,02% случаев,
являются клинически бессимптомными и обнаруживаются во время либо операции по
поводу несвязанных заболеваний, либо вскрытия [46]. Нормальные варианты отхождения глубокой артерии бедра хорошо описаны, но о
транспозиции бедренных сосудов с раздельным вхождением ствола большой подкожной
вены и ее ветвей сообщается редко [47, 48].
К настоящему времени в литературе описано 7 случаев
транспозиции бедренного сосуда и 2 случая раздельного входа. Пять случаев
транспозиции бедренного сосуда выявлено при операциях по поводу варикозной
болезни, один случай при трупной дисекции, один случай при проведении операции
по пластике глубоких вен. При операциях по поводу варикозной болезни выявлено 2
случая раздельного входа ствола большой подкожной вены и ее ветвей [49, 50] (рис. 7).
Рисунок 7. Отдельный вход с неполной транспозицией
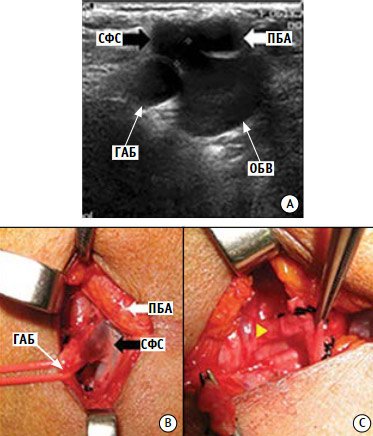
А – ультразвуковое ангиосканирование вен нижних конечностей; В – интраоперационная
картина в правой паховой области; С – сафено-феморальное
соустье между поверхностной бедренной артерией и глубокой артерией бедра. ГАБ – глубокая артерия бедра; ОБВ – общая бедренная вена; ПБА –
поверхностная бедренная артерия; СФС – сафено-феморальное соустье.
В настоящее время не существует четких критериев
полной или неполной транспозиции сосудов бедренного треугольника. В большинстве
исследований приблизительно в 50% или более случаев авторы определили расположение
поверхностной бедренной артерии медиальнее общей бедренной вены как полную
транспозицию. В случаях неполной транспозиции поверхностную бедренную артерию
располагали непосредственно над общей бедренной веной с перекрытием
приблизительно от 60 до 100% площади [51, 52] (таблица).
Таблица. Виды и места транспозиции бедренной артерии и вены
| Тип транспозиции и расположения | Схема сафено-феморального перехода |
Полная транспозиция в правом паху | 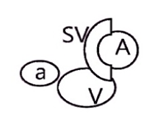 |
Полная транспозиция в левом паху | 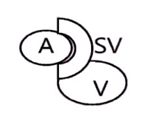 |
Неполная транспозиция со 100%-м перекрытием в правом паху | 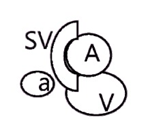 |
Неполная транспозиция со 100%-м перекрытием в левом паху | 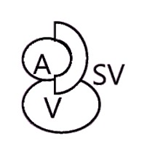 |
Неполная транспозиция с 60%-м перекрытием в левом паху | 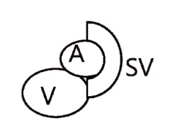 |
Примечание. А –
поверхностная бедренная артерия; а – глубокая артерия бедра; SV – большая
подкожная вена; V – бедренная вена.
Таким образом, наличие возможных вариантов
транспозиции сосудов бедренного треугольника настоятельно диктует необходимость
проведения превентивного ультразвукового ангиосканирования в предоперационном
периоде для установления топографо-анатомических взаимоотношений. Знание
хирургом не только типичной анатомии сосудистой системы, но и возможных
вариантов изменчивости, а также тщательное хирургическое выделение сосудов с
определением их синтопии позволит уменьшить вероятность ятрогенных повреждений при
оперативном вмешательстве [53].
Диагностика и хирургическая тактика при ятрогенном
повреждении сосудисто-нервного пучка и лимфатических сосудов бедренного
треугольника
Проблема хирургического лечения пациентов при
возникновении ятрогенной травмы сосудов продолжает оставаться крайне сложной.
По мнению большинства авторов, это обусловлено внезапностью развития данного
осложнения, общим коморбидным фоном пациента, объемом возникшей интраоперационной
кровопотери и недостаточной подготовкой хирурга по вопросам экстренной
сосудистой хирургии [54].
Хирургическое лечение ятрогенных повреждений
сосудов во время флебэктомии, по данным разных авторов, характеризуется противоречивыми
результатами, так как при этом наиболее часто повреждаются бедренные и
формирующие сафено-феморальное соустье сосуды. Диагностика этого вида осложнения редко представляет трудности, так как
оно сопровождается развитием массивного острого кровотечения из зоны
оперативного вмешательства [55, 56]. С точки зрения хирургов, имеющих опыт хирургического лечения ятрогенной
травмы сосудов, нельзя ограничиваться только констатацией факта возникновения
сосудистого осложнения и остановкой кровотечения, а необходимо стремиться к
восстановлению целостности поврежденного сосуда [57].
В развитии
последствий ятрогенных повреждений тяжесть ранения в меньшей степени опасна,
чем неадекватные действия оперирующего хирурга в стрессовой ситуации. Так, при
возникновении массивного кровотечения вследствие
повреждения магистральных сосудов опасно не столько само кровотечение, сколько
неправильные действия хирурга, направленные на его остановку. При этом
остановка венозного кровотечения является более сложной манипуляцией, чем
артериального, так как возникает единовременная массивная потеря крови сплошным
потоком, что затрудняет ориентацию хирурга в ране. Обычно слепое захватывание
зажимом кровоточащего сосуда в ране или его прошивание вместе с окружающими
тканями приводит к еще более тяжелому повреждению сосуда и его последующему тромбированию
[58, 59].
Повреждение
большой подкожной вены
Грозным осложнением является надрыв или полный отрыв большой подкожной вены
в области сафено-феморального соустья. Это осложнение обычно возникает в тех
случаях, когда стенка большой подкожной вены аневризматически расширена либо резко
истончена и склерозирована. Иногда развитию осложнения способствуют грубые
приемы при выделении сосуда из окружающих тканей, а также натяжение культи при его
перевязке и прошивании. Отсутствие пульсирующей волны, мгновенное появление в
ране значительного количества крови свидетельствуют об усилении кровотечения,
которое может стоить пациенту жизни. Как правило, надрыв или отрыв ствола
большой подкожной вены от бедренной сопровождается значительным и опасным
кровотечением. При возникновении осложнения необходимо в глубине раны плотным
тампоном прижать разорванную кровоточащую вену, по возможности произвести
ревизию раны и, если повреждение не распространяется на стенку бедренной вены,
перевязать и прошить культю большой подкожной вены. В более сложной ситуации
при повреждении стенки бедренной вены для достаточного обнажения сосудов разрез
продлевают в дистальном и проксимальном направлении. Бедренную вену берут на
резиновые турникеты и производят ревизию поврежденного участка. Операцию
заканчивают восстановлением целости бедренной вены. В этих целях накладывают
пристеночный шов или заплату из трансплантата большой подкожной вены (рис. 8).
Рисунок 8. Варианты восстановления целостности стенки бедренной
вены
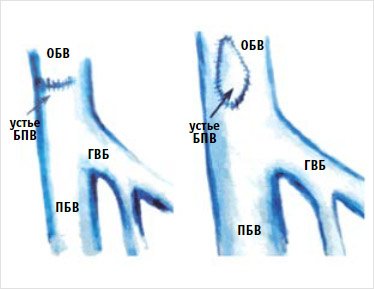
БПВ – большая подкожная вена; ГВБ – глубокая
вена бедра; ОБВ – общая бедренная вена; ПБВ – поверхностная бедренная вена.
Является необоснованной попытка общих хирургов наложить шов на поврежденный
сосуд без соответствующего для этого опыта, специального инструмента и шовного
материала. Часто она заканчивается тромбозом или необходимостью проведения
повторной сложной реконструктивной операции [60]. Артериальные и венозные
осложнения после операции по устранению варикозного расширения вен редки, но
катастрофичны как для заболеваемости и смертности, так и для последующих медико-правовых
последствий. В крупнейших обсервационных исследованиях сообщалось о частоте
серьезных артериальных и венозных повреждений при флебэктомии в диапазоне
0,01–0,06% [61, 62].
Повреждение
бедренной вены
Хирургическая коррекция венозной травмы продолжает оставаться
темой, вызывающей значительный практический интерес. Первая зарегистрированная
боковая веноррафия, выполненная у людей, была проведена Шеде для лечения
венозной травмы еще в 1870-х гг. В 1879 г. русский хирург Н.В. Экк впервые
выполнил анастомоз между двумя кровеносными сосудами, соединив анастомозом
воротную и нижнюю полую вену у лабораторной собаки (экковский свищ) [63]. Впоследствии
в 1880-х гг. Куммель и Дорфлер выполнили первый венозный анастомоз у человека. Однако,
несмотря на достижения в лечении венозных повреждений, восстановление проходимости
магистральных вен не было обычным явлением даже во время войн XX в.
[64].
Лигирование вен считалось наиболее распространенным
методом лечения гемодинамически нестабильных пациентов в экстремальной ситуации
и позволяло хирургам успешно устранять другие травмы и повреждения у пациентов
с вероятностью развития смертельной триады – гипотермии, коагулопатии и метаболического
ацидоза. Сторонники лигирования выказывали определенное беспокойство по поводу вероятного
развития тромбоза с последующей тромбоэмболией легочной артерии в
восстановленных магистральных венах, хотя эти осложнения до сих пор не
задокументированы [65, 66]. Перевязка
же вен была напрямую связана с развитием и прогрессированием острой венозной
гипертензии в нижней конечности с развитием компартмент-синдрома,
необходимостью выполнения декомпрессионной фасциотомии и напрямую способствовала
увеличению частоты ампутаций. Долгосрочные проблемы уже были напрямую связаны с
возникновением и прогрессированием хронической венозной недостаточности [67, 68].
Только во второй половине XX в.
в лечении венозных повреждений стал использоваться аутовенозный вставной
анастомоз конец в конец (патч-пластика),
временные интравенозные шунты и композитные синтетические трансплантаты. Данные
авторов о венозной проходимости различались, но последующие исследования
показали, что первичное венозное восстановление, включающее латеральную
веноррафию и первичный венозный анастомоз, имело приемлемый уровень ранней
проходимости почти в 80% случаев, а сложная венозная пластика сопровождалась ранней
проходимостью минимум в 40%. Когда для реконструкции требовался промежуточный
трансплантат, подкожная вена, взятая из контралатеральной нижней конечности,
была вариантом выбора, если вена была доступна, а ее диаметр был достаточным [69, 70]. Даже при развитии раннего тромбоза реконструируемого
участка вены последующая реканализация достоверно предотвращала дистальный
венозный отек. Кроме того, проходимость венозной реконструкции, даже если она
длилась от 24 до 72 ч, могла достоверно ослабить периферический венозный спазм
и открыть венозные коллатерали [71, 72].
Все последующие боевые и гражданские травмы военного
времени и ятрогенные повреждения мирного периода только подтвердили
необходимость первичного восстановления вен по сравнению с их лигированием,
хотя проходимость восстановленных вен, особенно после сложной реконструкции, продолжает
вызывать обеспокоенность хирургов [73, 74].
Это было обусловлено риском развития стеноза с последующей тромботической
окклюзией и возможными тромбоэмболическими осложнениями, высокой частотой
развития хронических отеков конечности, а при установке трансплантата из политетрафторэтилена
(ПТФЭ) еще и возрастал риск присоединения инфекции [75, 76].
Положительными же факторами венозной реконструкции продолжают оставаться
усиление венозного оттока, приводящего к более успешному восстановлению артериального
кровоснабжения, снижение вероятности послеоперационного отека, венозного застоя
и посттромбофлебитического синдрома и даже лимфатическая коллатерализация [77].
Опубликованы исследования краткосрочной проходимости ПТФЭ-протезов
при венозной реконструкции, но долгосрочные исследования немногочисленны и
обычно включают только небольшую когорту пациентов. Авторами было выявлено, что
сложная венозная реконструкция напрямую зависит от типа венозной пластики и
имеет показатель 30-дневной проходимости от 50 до 93% при использовании
аутовены и 47% – при использовании ПТФЭ-протеза [78, 79].
C.J. Jost и P. Gloviczki показали,
что трансплантаты из ПТФЭ имели 45%-ю проходимость в течение двух лет при
выполнении хирургической реконструкции подвздошно-бедренного и кавального
сегментов при посттромбофлебитической болезни [80].
Хотя окклюзия в основном происходит в течение первых недель после операции,
частота последующей отсроченной окклюзии ПТФЭ-протеза очень низка. Правильно
подобранная антикоагулянтная и дезагрегантная терапия, комбинация возвышенного
положения поврежденной конечности в первые 4–6 нед. после восстановления и
ежедневной дозированной ходьбы, а также использование в раннем
послеоперационном периоде устройства для переменной пневматической компрессии способствуют
удивительно долгой проходимости многих из этих трансплантатов, несмотря на непульсирующий
кровоток [81].
В настоящее время при невозможности выполнения венозного восстановления
методом аутовенозной пластики (отсутствие контралатеральной большой подкожной
вены, несоответствие диаметра просвета большой подкожной вены, основной и головной
вены плеча) реконструктивная операция с использованием ПТФЭ-протеза продолжает
оставаться операцией выбора при последующем правильном лекарственном и
физиотерапевтическом сопровождении [72, 82]. Наиболее частым осложнением
флебэктомии является ошибочная перевязка, полное или частичное пересечение
бедренной вены при выполнении этапа кроссэктомии. Принято считать, что такое
осложнение обычно обусловлено низкой квалификацией хирурга, его неумением
ориентироваться в хирургической анатомии магистральных сосудов в области
овальной ямки, выполнением нетипичного разреза в паховой области, что порой
затрудняет поиск большой подкожной вены и выделение сафено-феморального
соустья. Однако, как показывает практика, это далеко не так. Зачастую именно
такие ятрогенные повреждения допускают весьма опытные хирурги с многолетним
стажем работы в этой области хирургии. Это обусловлено снижением чувства
настороженности при работе с органными структурами с учетом опыта подобных ранее
выполненных многочисленных рутинных операций, желанием минимизировать время
оперативного вмешательства, грубое и бесцеремонное отношение к тканям и отказ
многих опытных хирургов при возникновении нестандартной ситуации «потерять
лицо» при обращении за помощью к коллегам по отделению.
Самым частым симптомом как частичного, так и полного пересечения бедренной
вены является обильное кровотечение в паху, которое диагностируется сразу на
операционном столе и устраняется после тщательной ревизии путем ушивания
поврежденной стенки вены непрерывным сосудистым швом атравматической нитью 6-0.
При полном пересечении вены выполняется тщательная мобилизация ее проксимального
и дистального сегментов с остановкой кровотечения и их последующим сшиванием
край в край. При иссечении сегмента бедренной вены с формированием диастаза
краев возможно выполнение аутовенозного протезирования фрагментом перевернутой
большой подкожной вены (интерпозиционное шунтирование), взятой с
контралатеральной нижней конечности, при условии соответствия диаметра сосудов.
Использование же ипсилатеральной вены нежелательно, так как это может нарушить
венозный отток в поврежденной конечности. При этом результаты интерпозиционной
пластики продолжают оставаться несколько разочаровывающими: показатели
30-дневной проходимости составляют всего от 40 до 75% [83, 84]. Перевязка
бедренной вены проявляется резким нарушением венозного оттока уже на
операционном столе. Как правило, у таких пациентов появляется синюшность кожи и
отек всей конечности. Однако эти признаки острого нарушения венозного оттока
иногда остаются незамеченными, что приводит к тяжелым последствиям – развитию
острого венозного тромбоза и в последующем посттромбофлебитического синдрома.
Как свидетельствуют данные литературы и клинические наблюдения, в
выполнении реконструктивной операции при повреждении бедренной вены должен
участвовать ангиохирург. Это обусловлено следующими обстоятельствами.
Во-первых, стенка бедренной вены сравнительно тонкая, и часто при наложении
сосудистого шва наблюдается кровоточивость в области прокола атравматической
иглой, поэтому необходимо наложение дополнительных швов. Во-вторых,
сравнительно невысокая скорость кровотока и травматизация стенки вены являются
предрасполагающими факторами к тромбообразованию [85, 86].
Необходимо отметить, что далеко не всегда при ятрогенных повреждениях
бедренной вены флебэктомия оказывается эффективной. Сложные ситуации,
запоздалая диагностика нередко требуют выполнения реконструктивных операций.
Некоторыми ангиохирургами предложены различные варианты реконструктивных
операций с использованием в качестве трансплантата большой подкожной вены, а
также вшивание проксимального конца бедренной вены в глубокую вену бедра [87] (рис. 9).
Рисунок 9. Варианты реконструкции повреждений бедренной вены
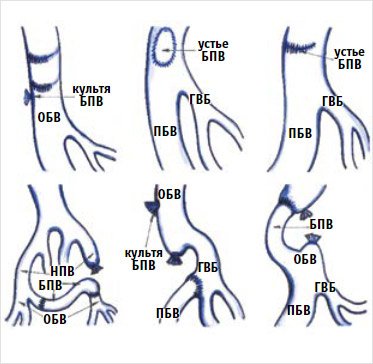
БПВ – большая подкожная вена; ГВБ – глубокая
вена бедра; НПВ – нижняя полая вена; ОБВ – общая бедренная вена; ПБВ –
поверхностная бедренная вена.
Повреждение
бедренной артерии
Очень
тяжелым осложнением при оперативном лечении варикозной болезни является
повреждение бедренной артерии, что приводит к развитию наружного кровотечения и
острой ишемии тканей оперированной нижней конечности. Полностью перерезанная
артерия часто спазмируется и втягивается с развитием последующего тромбоза, что сводит к минимуму подозрение на серьезное повреждение сосудов [88, 89]. Не
полностью рассеченный кровеносный сосуд может быть более подвержен массивному
кровотечению, нежели полностью перерезанный. Уже на операционном столе появляется
резкая бледность кожи, похолодание конечности, а впоследствии и незначительная
кровоточивость операционных разрезов. Однако, как свидетельствуют данные
литературы и клинические наблюдения, в настоящее время остаются нередкими случаи
поздней диагностики возникшего осложнения.
Существует повышенная вероятность пропущенных сосудистых
повреждений при отсутствии явных признаков сосудистой травмы. Пациенты с
ранними пропущенными травмами сосудов имеют рецидивирующие кровотечения, а
поздние пропущенные травмы могут осложниться образованием псевдоаневризм,
артериовенозных свищей и острой артериальной окклюзией [90, 91].
Признаки и симптомы повреждения бедренной артерии можно условно
разделить на жесткие и мягкие. Жесткие признаки повреждения включают дефицит
пульса, дистальную ишемию, расширяющуюся и пульсирующую гематому, пульсирующее
артериальное кровотечение, наличие дрожания и систолического шума над артерией.
Классический клинический синдром «6Р» определяется как парестезия, отсутствие
пульса, паралич, боль (pain), бледность (paleness) и
пойкилотермия, а симптомы могут использоваться для диагностики повреждения
артерий. Разумная оценка этих признаков может иметь решающее значение при
спасении конечности, при этом целесообразным считается проведение реконструктивного
хирургического лечения по экстренным показаниям [88]. При
наличии мягких признаков (стабильная гематома, близость раны к крупному сосуду,
необъяснимая гипотензия, ипсилатеральный неврологический дефицит) лечение может
быть затруднено, и скрытое повреждение сосудов может быть пропущено. Осложнения
пропущенных сосудистых травм могут привести к пожизненной функциональной
нетрудоспособности или даже потере конечности [92].
Методы диагностики повреждения артерий
Ультразвуковое
дуплексное ангиосканирование, компьютерная томографическая ангиография (КТА) и
магнитно-резонансная ангиография в настоящее время являются наиболее значимыми
методами верификации повреждений периферических сосудов, учитывая их
неинвазивный характер и возможность быстрого выполнения [93, 94].
Артериальная
ангиография продолжает оставаться золотым стандартом диагностики сосудистых травм,
хотя ее роль в диагностике сосудистых повреждений противоречива. Поскольку
раннее восстановление сосудистых повреждений ишемизированной конечности
необходимо для поддержания функции, такое диагностическое исследование, как
ангиография, может способствовать задержке оперативного восстановления и
противопоказано, когда наличие и местоположение повреждения очевидны.
Ангиография рекомендуется только у стабильных пациентов, чтобы определить
место, характер и степень повреждения [95].
Повышенная
доступность, короткое время сбора данных и высокая диагностическая точность
сделали КТА нижних конечностей предпочтительным методом первичной визуализации
для диагностики сосудистого повреждения. Время сканирования менее 1 мин
позволяет врачам добавлять КТА нижних конечностей в алгоритм диагностической
визуализации, не откладывая лечение пациента. КТА может также предоставить
дополнительную релевантную информацию о повреждениях костей и мягких тканей и
их связи с поврежденным сосудом. Исследования, сравнивающие КТА конечностей с
традиционной ангиографией, показали, что КТА сопоставима по точности, более
эффективна по времени, менее инвазивна и менее дорогостояща при диагностике
травматических повреждений артерий [96, 97].
Артериальная реконструкция и восстановление кровотока
Немедленная
остановка кровотечения и быстрое восстановление проходимости сосуда являются
первоочередными задачами лечения повреждения бедренной артерии. Время ишемии,
которое могут выдержать мышцы и нервы, составляет всего 6–8 ч, следовательно,
хирургическое вмешательство должно быть произведено немедленно для достижения
функционального восстановления и спасения конечности [98].
Повреждения бедренной артерии можно восстанавливать с помощью
первичного ремонта, включая боковую артериографию, анастомоз конец в конец,
интерпозиционную вставку (патч-пластика) фрагмента большой подкожной вены или
трансплантата из ПТФЭ, наложения аутовенозной заплаты или формирования
бедренно-бедренного обходного анастомоза с обращенной подкожной веной или шунта
из ПТФЭ (рис. 10).
Рисунок
10. Иссечение
общей бедренной артерии на протяжении с восстановлением проходимости с
использованием синтетического политетрафторэтиленового протеза
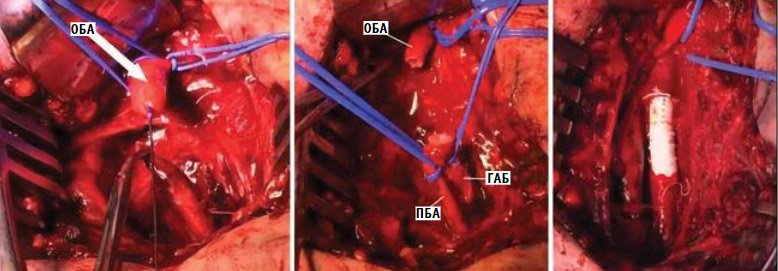
ГАБ –
глубокая артерия бедра; ПБА – поверхностная
бедренная артерия; ОБА – общая бедренная артерия.
Все артериальные повреждения лечат с помощью хирургической
обработки краев поврежденного сосуда (удаление растрескавшейся интимы,
интрамуральной гематомы и поврежденной адвентиции), удаления тромба с помощью
катетера Фогарти с последующей окончательной пластикой. Целью первичной реваскуляризации
является восстановление целостности стенки артерии или наложение анастомоза без
натяжения [99] (рис. 11).
Рисунок 11.
Формирование первичного анастомоза бедренной
артерии
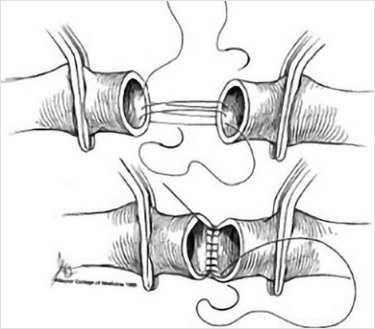
Если дефект стенки артерии
может быть закрыт поперечным способом, у детей это выполняется прерывистыми полипропиленовыми
швами на всю толщину 6-0. У взрослых можно использовать как прерывистый, так и
непрерывный шов. При описанном быстром восстановлении, выполняемом вскоре после
травмы, и явном активном ретроградном кровотоке из дистального конца поврежденной
артерии перед наложением зажимов не показано ни прохождение баллонных катетеров
Фогарти, ни региональное или системное введение гепарина [100].
Для интрапозиционной пластики (патч-пластика) подходит выбор
аутологичной подкожной вены с контралатеральной стороны. Большая
подкожная вена остается идеальным заменителем сосудистого канала по следующим
причинам: хорошая анатомическая доступность; размер, подходящий для замены
большинства крупных артерий и некоторых вен на конечностях; устойчивость к
инфекции, когда она покрыта здоровой мягкой тканью; отличная долговременная
проходимость [101].
Противопоказания к использованию
подкожной вены очевидны и включают стенотически измененную вену, слишком малый
диаметр просвета, несоответствие размера в сравнении с поврежденным сосудом,
или вена становится единственным венозным оттоком для поврежденной нижней
конечности (тяжелое повреждение бедренной вены на той же конечности).
Кроме этого, авторы отмечают наличие технических сложностей при формировании
интерпозиционного вставного венозного анастомоза даже подходящего размера с
пережатой поврежденной артерией. По этой причине редко применяемая техника венозной пластики с
использованием сегмента большой подкожной вены обычно ограничивается
восстановлением крупных вен конечностей – подколенной, бедренной, общей
бедренной и подмышечной. Поэтому в настоящее время предпочтение отдается использованию синтетических трансплантатов. Первый
синтетический протез кровеносного сосуда был применен в 1952 г. На этом
основании доля ампутаций конечности снизилась с 51,4 до 13% [102, 103].
Сочетанное
повреждение бедренной артерии и вены
Открытое полное пересечение бедренной артерии и бедренной вены в хирургии
варикозной болезни встречается крайне редко и является чрезвычайно грозным
осложнением, имеющим высокий показатель инвалидизации и смертности, особенно у
гемодинамически нестабильных пациентов [104, 105]. Восстановление вен продолжает
оставаться одной из самых спорных тем, связанных с лечением сочетанных
повреждений артерий и вен и по-прежнему зависит от характера и величины
повреждения сосудов, гемодинамического статуса пациента, а также подготовки и
опыта хирурга. M. Kochuba et al. опубликовали обзорную статью о лечении
поврежденных вен, в которой предположили, что сочетание крупных артериальных и
венозных повреждений одной нижней конечности является одним из сценариев, когда
необходимо проводить реконструкцию вен, чтобы избежать потенциально пагубных
последствий перевязки [106].
Комбинированные травмы бедренной артерии и вены могут быть
чрезвычайно сложными для лечения из-за трудности контроля над веной и ее
притоками в бедренном треугольнике. В случае повреждения вен нижних конечностей
перевязка переносится лучше и чаще, чем перевязка артерий. Однако при комбинированном
повреждении двух сосудов наблюдается повышенная потеря конечностей при
недостаточном венозном оттоке. Таким образом, восстановление вен
предпочтительнее лигирования. Восстановление вен имеет несколько преимуществ. Во-первых,
улучшается проходимость ассоциированного восстановления артерий, поскольку
сохраненная проходимость вен поддерживает нормальное периферическое сопротивление
сосудов, оптимизируя при этом кровоток и уменьшая застойные явления. Во-вторых,
снижается частота хронической венозной недостаточности и посттромбофлебитического
синдрома [107,
108].
Реконструкция
артерий и вен должна соответствовать основным принципам сосудистой хирургии
после того, как будет достигнут контроль над проксимальным и дистальным концом сосудов.
Сложные или протяженные повреждения требуют резекции и первичного анастомоза,
если нет значительного натяжения, или введения венозных и артериальных
промежуточных трансплантатов. Если есть сочетанное повреждение, сначала
реконструируется вена в зависимости от времени артериальной ишемии, чтобы
устранить любую обструкцию оттока и улучшить исходную проходимость артерии. При значительных артериальных и венозных повреждениях и
обильной кровопотере вследствие повреждения сосудов уместно наложение
артериальных и венозных шунтов. Было показано, что временное внутрисосудистое
шунтирование у таких пациентов с сосудистыми повреждениями конечностей снижает
частоту ампутаций по сравнению с пациентами, которым шунтирование не
проводилось [109].
Временные внутрисосудистые шунты при сочетанном повреждении артерии и вены
Помимо сосудистых трансплантатов, временный внутрисосудистый шунт (temporary
intravascular shunt – TIVS) может сыграть важную роль в борьбе с повреждениями до окончательной реконструкции
и восстановления проходимости сосудов. В случаях,
когда временные шунтированные повреждения затем хирургически восстанавливались
с помощью промежуточных внутрисосудистых трансплантатов, сообщалось о 92%-й
жизнеспособности этих конечностей, при этом по сравнению с перевязкой сосуда
шунт доказал свое превосходство [110, 111].
Основная ошибка при ведении пациентов с
повреждениями периферических сосудов – неспособность распознать избранные
группы пациентов, которым следует установить временный внутрипросветный шунт, а
не выполнить окончательное восстановление сосудов. Показания к установке
временного внутрипросветного сосудистого шунта конечности со значительным
повреждением сосудов бедренного треугольника – необходимость дистальной
перфузии при выполнении сложной реваскуляризации (например, внеанатомического
обхода), контроль повреждений для пациента с массивной интраоперационной
кровопотерей [112, 113].
Чтобы
избежать возникновения временного тромбоза внутрипросветного шунта после
введения, необходимо обратить внимание на некоторые технические моменты:
– должен быть вставлен максимально возможный по
диаметру соответствующего сосуда внутрипросветный шунт;
– шунт должен быть на 4 см длиннее, чем зазор между
двумя концами сосуда;
– для последующей фиксации шунта используют шелковую
лигатуру диаметра 2-0 для фиксации стенки сосуда к шунту на расстоянии 1 см от проксимального
конца и 1,5 см – от дистального [114, 115] (рис. 12).
Рисунок 12. Временные внутрисосудистые шунты в бедренной
артерии и бедренной вене
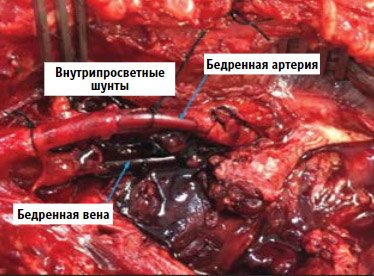
При внутрипросветном шунтировании только
поврежденной бедренной артерии перевязка бедренной вены на этой конечности
может оказать пагубное влияние на кровоток через шунт и не должна быть
перевязана из-за высокого риска нарастания периферического сосудистого
сопротивления в дистальных отделах конечности, что неизбежно приведет к
тромбозу шунта. Исключение может заключаться в том, что пациент находится в
состоянии сильного физиологического истощения со вторичной сердечной аритмией
или сердечно-сосудистой недостаточностью [116].
Роль системной гепаринизации для минимизации
тромбоза внутрипросветных шунтов у пациентов без коагулопатии не ясна на
основании имеющихся данных. Частота тромбозов для шунтов, вставленных в
периферические артерии при гражданских повреждениях, варьировала от 4 до 5%,
что, безусловно, является приемлемым показателем, учитывая степень
физиологического истощения или повреждений конечности, требующих шунтирования [117].
Одним из основных недостатков введения
внутрипросветного шунта в периферический сосуд является необходимость более
позднего окончательного восстановления. Это связано с величиной исходного
повреждения, обработкой поврежденных концов и дальнейшей обработкой,
необходимой для удаления раздавленного сосуда при удалении шунта. Второй
недостаток заключается в том, что дефекты мягких тканей, связанные с
расширенным интраоперационным доступом, часто приводят к обнажению
поврежденного сосуда с шунтом после процедуры шунтирования для контроля
повреждений. Следует предпринять все возможные попытки закрыть поврежденный
сосуд временным сближением соседней мышцы [118].
Эндоваскулярный методы лечения повреждений сосудов
Открытое хирургическое вмешательство было
стандартным методом лечения повреждений периферических сосудов. Однако по мере
того, как эндоваскулярное лечение становилось все более совершенным, оно все
чаще использовалось для лечения пациентов с травмами сосудов [119].
Существуют различные методы эндоваскулярных
вмешательств, включая временный контроль сосудов с помощью баллона, эмболизацию
кровоточащего сосуда и пластику травмы покрытым стентом.
Эндоваскулярное лечение имеет несколько
преимуществ. Во-первых, оно помогает обеспечить доступ к поврежденным сосудам в
труднодоступных анатомических областях. Во-вторых, снижает риск повреждения
близлежащих нервов и устраняет необходимость в хирургическом обходе уже
поврежденных или иногда некротизированных тканей. Наконец, сокращается время
операции, у пациентов уменьшается кровопотеря и снижается смертность по
сравнению с открытым хирургическим лечением подобных травм [120, 121]. В
частности, покрытые стенты являются привлекательным вариантом для лечения
повреждений периферических артерий в областях, которые трудно обнажить
хирургическим путем. О серии из 62 пациентов с артериальной травмой верхних и
нижних конечностей, получавших покрытый стент, сообщили R. White et al. Показатели первичной проходимости стентов в
подвздошной и бедренной артериях в течение 1 года составили 76 и 86%
соответственно. Исследователи обнаружили, что использование покрытых стентов
значительно сокращает ишемию и время операции [122]. Однако имеется несколько
недостатков. Необходимо подбирать такие устройства, как стент-графты,
подходящие для анатомии пациента; острая почечная недостаточность из-за
гиповолемии может усугубляться использованием контрастного вещества. Если
эндоваскулярная процедура не удалась, могут потребоваться дополнительные
процедуры или хирургическое вмешательство, и, кроме этого, существует высокий
риск инфицирования протезного трансплантата
[108].
Повреждение лимфатических узлов и коллекторов
Повреждение
лимфатических сосудов и подкожных нервов во время операции по поводу варикозной
болезни является довольно частым осложнением. Чаще повреждается лимфатический
коллектор в паховой области. Этому способствует выполнение поперечных или косых
разрезов, или травмирование подкожной основы лимфатических протоков и узлов при
поиске ствола большой подкожной вены. На голени чаще повреждаются лимфатические
протоки по медиальной поверхности (в верхней или средней трети), а также в
области тыла стопы.
Лимфорея обычно наблюдается при пересечении магистральных лимфатических
коллекторов или их множественном повреждении. Такие осложнения отмечаются при
иссечении конгломератов расширенных и нередко тромбированных вен,
локализующихся в этих областях. Лимфорея из раны, как правило, прекращается
самостоятельно и не требует специального оперативного вмешательства [123]. Для предупреждения повреждения лимфатических
протоков при выделении большой подкожной вены в паховой области необходимо
проводить продольный разрез. Ориентиром для его выполнения является пульсация
на бедренной артерии. Разрез ведут от паховой связки в дистальном направлении
длиной 3–5 см на 1–1,5 см медиальнее бедренной артерии. Такой разрез позволяет
достаточно широко обнажить устье большой подкожной вены, не повредив
лимфатический узел и его протоки, которые располагаются в этой области. При
удалении расширенных подкожных вен в области голени и стопы необходимо
проводить только продольные разрезы и тщательно препарировать поврежденные
сосуды, сохраняя окружающую подкожную основу, где локализуются лимфатические
протоки [124].
Лимфатические осложнения, такие как лимфоцеле, лимфатическая фистула и лимфедема, являются
одними из наиболее частых осложнений после операции по поводу варикозного
расширения вен, хотя их частота и риск долгосрочных последствий относительно
низки [125, 126]. Однако было высказано предположение, что
хирургическое лечение варикозного расширения вен может нормализовать
лимфатическую функцию. Более того, динамика вен и лимфы может взаимодействовать
как неразрывная и взаимозависимая система двойного оттока, а варикозное
расширение вен – влиять на лимфатическую функцию и вызывать замедление
лимфотока в нижних конечностях. Следовательно, хирургическое лечение венозной
недостаточности может обратить нарушение лимфотока [127].
Патогенез
хронической венозной недостаточности, связанной с лимфатической дисфункцией,
остается неизвестным. Требуется более глубокое понимание концепции
флеболимфологии. Флеболимфедема – это состояние, при котором сочетаются
венозная и лимфатическая недостаточность [128, 129]. Венозная
гипертензия, вызванная венозной недостаточностью, включая варикозное расширение
вен, увеличивает поток лимфы в 3 раза и концентрацию фибриногена в 2 раза, тем
самым увеличивая чистый транспорт фибриногена через интерстициальное
пространство на 600%. Однако значительного изменения фибринолитической
активности лимфы не наблюдается. Количество фибриногена, проходящего через
интерстициальное пространство, увеличивается, но фибринолиз не увеличивается. Оба
эти изменения увеличивают риск отложения фибрина в тканях, включая вены и
лимфатические сосуды. Когда фибрин откладывается вокруг капилляров, он
блокирует диффузию кислорода и приводит к фиброзу тканей, который проявляется
как липодерматосклероз и некроз, т. е. к венозной язве [130].
Лимфатический
застой, вызванный венозной гипертензией, приводит к воспалению стенки вены,
вызывая дегенерацию адипоцитов в этом месте. Такое воспаление вызывает
разрастание медиальных гладкомышечных клеток и чрезмерное производство
фиброзного вещества, что приводит к гиперплазии, которая, в свою очередь,
снижает эластичность венозной стенки [131]. Следовательно,
структурное ухудшение микролимфатической сети может способствовать венозной
недостаточности. Кроме того, было высказано предположение, что устойчивое
воспаление может привести к апоптозу лимфатической сосудистой сети. Функции
венозной и лимфатической системы тесно связаны, поэтому считается, что многие
сосудистые заболевания – это не просто заболевания венозной системы или
лимфатических протоков, и если функция одной ухудшается, это также влияет на
другую. Следовательно, возникает порочный круг между лимфатическим застоем и
венозной недостаточностью. Динамика венозной и лимфатической системы может
взаимодействовать как неразрывная и взаимозависимая система двойного оттока в
тканях; механизм сложен, и между двумя системами может поддерживаться
гомеостаз. Для разрыва порочного круга между лимфатическим застоем и венозной
недостаточностью могут быть полезны методы лечения вен, включая такое хирургическое
вмешательство, как стриппинг [132].
Повреждение подкожного нерва при флебэктомии
Повреждение подкожного нерва является частым осложнением
после оперативного лечения варикозной болезни. Возможны аномалии общего
анатомического прохождения подкожного нерва в большую подкожную вену. При
экстракции варикозных вен следует учитывать и то, что может способствовать
ятрогенным повреждениям в зонах повышенного риска [133].
По ходу подкожного нерва можно выделить бедренную и голеностопные части. Нерв проходит субфасциально в пределах бедренной части, тогда как в
части голени он прободает фасцию голени и, проходя эпифасциально вместе с
большой подкожной веной, достигает медиального края стопы. Нерв обеспечивает
сенсорную иннервацию медиальной стороны голени, переднемедиальной стороны
коленного сустава и голени до медиальной стороны стопы и большого пальца. При
вскрытии большой подкожной вены чаще всего поражается нервный ствол в области
медиальной лодыжки и ее поднадколенниковой ветви вместе с медиальными кожными
ветвями голени, что проявляется нечетким ощущением (парестезиями) в виде
покалывания, онемения, ощущения прохождения электрического тока, гипестезии, гиперестезии
[134].
Близость вены и нерва, особенно на уровне голени, приводит к
травмам при резекции вены, особенно у пациентов с выраженным варикозным
расширением вен в этой области, вызванным большим количеством недостаточных
перфораторов. Кроме того, у пациентов, страдающих длительно существующим
варикозным расширением вен, это может привести к срастанию расширенной вены,
обеспечивая нейропраксию подкожного нерва. Данная патология также способствует
травмированию нервных волокон во время операции. Нарушения чувствительности,
связанные с повреждением нервного ствола или его ветвей, возникающие после
хирургического лечения варикозной болезни, могут носить как временный, так и
постоянный характер [135]. Многие авторы пытались определить частоту
этого осложнения. Она колеблется от 5,9 до 72% и в значительной степени зависит
от применяемого метода удаления вены [6, 136]. Наиболее многочисленные повреждения
подкожного нерва наблюдались после операции длинного стриппинга без инвагинации
вены (метод Бэбкока). О таких осложнениях сообщается у 20–50% пациентов. Это
обусловлено наличием анатомической связи подкожной вены и подкожного нерва. Анатомически
веточки нерва образуют обращенную V-образную форму, что облегчает их
травмирование головкой зонда, особенно при проксимальном натяжении вены [137, 138].
Инвагинация
вены, а также изменение направления ее отведения с проксимального на дистальное
обусловило снижение числа неврологических осложнений, связанных с повреждением
подкожного нерва. Проксимальное удаление с инвагинацией сосуда и дистальное
удаление без инвагинации оказалось сопоставимым по количеству послеоперационных
чувствительных нарушений в области иннервации подкожного нерва. Наилучшие
эффекты были достигнуты при дистальном стриппинге с инвагинацией вены. Результаты
многочисленных нейрофизиологических исследований установили, что наилучшее
сохранение подкожного нерва при флебэктомии дает компиляция дистального
стриппинга с инвагинацией вены. Преходящие изменения в нервной проводимости,
наблюдаемые через 2 нед. после операции, могут быть обусловлены временной
нейропраксией, вызванной отеком, гематомой, и имеют обратимый характер [139].
неврологических осложнений после операций по поводу варикозной болезни нижних
конечностей с применением стриппинга подкожных вен обусловливает необходимость
рассмотрения альтернативных способов лечения недостаточности подкожных вен. Одним
из таких альтернативных методов является короткое иссечение до уровня коленного
сустава с дополнительной флебэктомией варикозно расширенных вен ниже этого
уровня. Однако следует помнить, что, несмотря на все более инновационные методы
лечения варикозного расширения вен, длинный стриппинг по-прежнему является
наиболее распространенной операцией при несостоятельности подкожных вен [140]. Даже если сенсорные нарушения, развившиеся
после хирургического удаления целой вены, могут сохраняться у некоторых пациентов,
преимущества резекции варикозных вен намного превышают неудобства, связанные с
потенциальными неврологическими осложнениями [141].
Методы
профилактики ятрогенного повреждения сосудов бедренного треугольника
Вопросы профилактики развития ятрогенных повреждений сосудов
бедренного треугольника при флебэктомии крайне скудно освещены в современной литературе.
Большинство работ относительно сосудистых травм, возникающих во время операций,
носят казуистический характер с рассмотрением одного или нескольких случаев, не
позволяющих рационально выбрать основные меры профилактики ятрогении [142].
Ряд авторов, имеющих клинический опыт реконструктивных
операций у данной категории пациентов, приходят к выводу о целесообразности включения
в операционную бригаду сосудистого хирурга. Однако, учитывая неуклонно возрастающее
число оперативных вмешательств, при которых может возникать ятрогенная травма, присутствие
сосудистого хирурга на всех флебологических операциях является экономически и
практически нецелесообразным. В свою очередь, это диктует настоятельную необходимость
улучшения практической подготовки общих хирургов, онкологов, гинекологов,
эндоскопических хирургов по основам экстренной сосудистой хирургии [143].
Зачастую сами сосудистые хирурги являются причиной
ятрогенных повреждений при оперативном лечении варикозной болезни, что связано
с широким внедрением эндоваскулярных технологий, требующих катетеризации
поверхностных вен. Основные профилактические мероприятия, направленные на
предупреждение сосудистых осложнений при эндоваскулярном лечении, заключаются в
соблюдении технических моментов при производстве пункции сосудов, учете
факторов риска возможных осложнений, а также использовании рациональной
послеоперационной антикоагулянтной терапии и эластической компрессии. Кроме
того, в раннем послеоперационном периоде необходимо проведение динамического
наблюдения за пациентами с применением дуплексного ангиосканирования, что
позволяет диагностировать возможные осложнения на ранних стадиях [144]. Большинство авторов, занимающихся проблемой
ятрогении в сосудистой хирургии, сходятся во мнении, что повреждения сосудов
при флебэктомии являются результатом низкой квалификации хирурга и незнания основных
топографо-анатомических взаимоотношениях в зоне операции [145]. К мерам предосторожности, помимо
профессионализма оперирующих хирургов, следует отнести необходимость овладения
ими методами ультразвуковой диагностики, что позволит увидеть анатомическую
картину бедренного треугольника перед операцией и свести к минимуму вероятность
ятрогенных повреждений [146].
Заключение
Таким
образом, проблема ошибок и осложнений в хирургии вен должна решаться на основе
комплексной подготовки хирургов-флебологов, включая обязательное обучение
навыкам сосудистой хирургии, а также оснащения клиник специальным оборудованием
и инструментарием.
Регулярное повышение профессиональной квалификации, посещение конференций,
симпозиумов, мастер – классов, а также постоянный анализ периодической
медицинской литературы и собственных ошибок позволит значительно минимизировать
количество ятрогенных повреждений в хирургической флебологии.
[1] Шарипов М.А. Профилактика и лечение ятрогенных повреждений сосудов: дис. … канд.
мед. наук. Душанбе; 2010.
[2] Рева
В.А. Травмы и ранения кровеносных сосудов: открытые, эндоваскулярные и
гибридные методы лечения: дис. … д-ра мед. наук. СПб.; 2020.
[3] Вардак
А.В. Анализ ошибок диагностики и тактики лечения изолированной и сочетанной
сосудистой травмы конечностей с целью улучшения хирургической помощи: дис. …
канд. мед. наук. Тверь; 2017.
Список литературы / References
- Balzer K. Komplikationen bei Varizenoperationen. Zentralbl Chir. 2001;126(7):537-542. https://doi.org/10.1055/s-2001-16267.
- Mäkivaara L.A., Jukkola T.M., Sisto T., Luukkaala T., Hakama M., Laurikka J.O. Incidence of varicose veins in Finland. Vasa. 2004;33(3):159-63. https://doi.org/10.1024/0301-1526.33.3.159.
- Oliveira R.Á., Mazzucca A.C.P., Pachito D.V., Riera R., Baptista-S ilva J.C.D.C. Evidence for varicose vein treatment: an overview of systematic reviews. Sao Paulo Med J. 2018;136(4):324-332. https://doi.org/10.1590/1516-3180.2018.0003240418.
- Milone M., Salvatore G., Maietta P., Sosa Fernandez L.M., Milone F. Recurrent varicose veins of the lower limbs after surgery. Role of surgical technique (stripping vs. CHIVA) and surgeon’s experience. G Chir. 2011;32(11-12):460-463. Available at: https://pubmed.ncbi.nlm.nih.gov/22217371.
- Critchley G., Handa A., Maw A., Harvey A., Harvey M.R., Corbett C.R. Complications of varicose vein surgery. Ann R Coll Surg Engl. 1997;79(2):105-110. Available at: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2502792.
- Frings N., Glowacki P., Kohajda J. Major-Komplikationen am Gefäss- und Nervensystem in der Varicenchirurgie. Prospektive Dokumentation des Operationsrisikos bei der V. saphena magna- und V. saphena parva-Operation. Chirurg. 2001;72(9):1032-1035. https://doi.org/10.1007/s001040170069.
- Larsen D.W. Traumatic vascular injuries and their management. Neuroimaging Clin N Am. 2002;12(2):249-269. https://doi.org/10.1016/s1052-5149(02)00006-0.
- Davison B.D., Polak J.F. Arterial injuries: a sonographic approach. Radiol Clin North Am. 2004;42(2):383-396. https://doi.org/10.1016/j.rcl.2004.01.007.
- Fingerhut A., Leppäniemi A.K., Androulakis G.A., Archodovassilis F., Bouillon B., Cavina E., et al. The European experience with vascular injuries. Surg Clin North Am. 2002;82(1):175-188. https://doi.org/10.1016/s0039-6109(03)00147-6.
- Роговой Н.А., Янушко В.А., Турлюк Д.В., Климчук И.П., Комиссаров В.В., Кульбеда Д.С. Поздние осложнения после классической флебэктомии в системе малой подкожной вены. Медицина неотложных состояний. 2018;(4):110-114. https://doi.org/10.22141/22240586.4.91.2018.137867.
- Sadhasivam S., Kaynar A.M. Iatrogenic arteriovenous fistula during lumbar microdiscectomy. Anesth Analg. 2004;99(6):1815-1817. https://doi.org/10.1213/01.ANE.0000137391.55836.56.
- Mussa F.F., Towfigh S., Rowe V.L., Major K., Hood D.B., Weaver F.A. Current trends in the management of iatrogenic cervical carotid artery injuries. Vasc Endovascular Surg. 2006;40(5):354-361. https://doi.org/10.1177/1538574406290844.
- Iriz E., Kolbakir F., Sarac A., Akar H., Keçeligil H.T., Demirağ M.K. Retrospective assessment of vascular injuries: 23 years of experience. Ann Thorac Cardiovasc Surg. 2004;10(6):373-378. Available at: https://www.atcs.jp/pdf/2004_10_6/373.pdf.
- Rudström H., Bergqvist D., Ogren M., Björck M. Iatrogenic vascular injuries in Sweden. A nationwide study 1987-2005. Eur J Vasc Endovasc Surg. 2008;35(2):131-138. https://doi.org/10.1016/j.ejvs.2007.09.010.
- Giswold M.E., Landry G.J., Taylor L.M., Moneta G.L. Iatrogenic arterial injury is an increasingly important cause of arterial trauma. Am J Surg. 2004;187(5):590-592. https://doi.org/10.1016/j.amjsurg.2004.01.013.
- Pongratz J., Reeps C., Eckstein H.H. Häufigkeit und Ursachen operationsbedürftiger vaskulärer Komplikationen bei nicht gefäßchirurgischen Patienten. Zentralbl Chir. 2011;136(5):485-490. https://doi.org/10.1055/s-0030-1247472.
- Карим-Заде Г.Д., Маликов М.Х., Неъматзода О., Давлатов А.А., Хайруллои Н., Махмадкулова Н.А. К вопросам диагностики и лечения повреждений сосудов верхних конечностей. Вестник Авиценны. 2019;21(2):305-313. https://doi.org/10.25005/2074-0581-2019-21-2-305-313.
- Усманов Б.С., Махмудов Н.И., Исмаилов Ж.Т., Дадабаев Х.Р. Тактика лечения больных с повреждениями магистральных сосудов нижних конечностей. Вестник экстренной медицины. 2009;(3):49-51. Режим доступа: https://cyberleninka.ru/article/n/taktika-lecheniya-bolnyh-s-povrezhdeniyami-magistralnyh-sosudov-nizhnih-konechnostey.
- Mildner A., Hilbe G. Komplikationen bei der Varizenchirurgie. Zentralbl Chir. 2001;126(7):543-545. https://doi.org/10.1055/s-2001-16268.
- Rudström H., Björck M., Bergqvist D. Iatrogenic vascular injuries in varicose vein surgery: a systematic review. World J Surg. 2007;31(1):228-233. https://doi.org/10.1007/s00268-006-0492-8.
- De Mik S.M., Stubenrouch F.E., Legemate D.A., Balm R., Ubbink D.T. Treatment of varicose veins, international consensus on which major complications to discuss with the patient: A Delphi study. Phlebology. 2019;34(3):201-207. https://doi.org/10.1177/0268355518785482.
- De Mik S.M.L., Stubenrouch F.E., Legemate D.A., Balm R., Ubbink D.T. Delphi Study to Reach International Consensus Among Vascular Surgeons on Major Arterial Vascular Surgical Complications. World J Surg. 2019;43(9):2328-2336. https://doi.org/10.1007/s00268-019-05038-3.
- Defty C., Eardley N., Taylor M., Jones D.R., Mason P.F. A comparison of the complication rates following unilateral and bilateral varicose vein surgery. Eur J Vasc Endovasc Surg. 2008;35(6):745-749. https://doi.org/10.1016/j.ejvs.2008.01.009.
- Michaels J.A., Campbell W.B., Brazier J.E., Macintyre J.B., Palfreyman S.J., Ratcliffe J., Rigby K. Randomised clinical trial, observational study and assessment of cost-effectiveness of the treatment of varicose veins (REACTIV trial). Health Technol Assess. 2006;10(13):1-196. https://doi.org/10.3310/hta10130.
- Hobson R.W. 2nd, Yeager R.A., Lynch T.G., Lee B.C., Jain K., Jamil Z., Padberg F.T. Jr. Femoral venous trauma: techniques for surgical management and early results. Am J Surg. 1983;146(2):220-224. https://doi.org/10.1016/0002-9610(83)90377-x.
- Lozano F.S., Estevan M.C., Gónzalez-Porras J.R. Femoral vein injury and transposition techniques: a new approach to venous reconstruction in the setting of trauma. J Trauma. 2009;67(4):E118-120. https://doi.org/10.1097/TA.0b013e31817d0557.
- Flis V. Reconstruction of venous outflow after inadvertent stripping of the femoral vein. Eur J Vasc Endovasc Surg. 1995;10(2):253-255. https://doi.org/10.1016/s1078-5884(05)80123-6.
- Мазайшвили К.В., Хлевтова Т.В., Акимов С.С., Цыплящук А.В. Ультразвуковая анатомия вен нижних конечностей. М.: Медпрактика-М; 2016. 72 с.
- Шевченко Ю.Л., Стойко Ю.М., Мазайшвили К.В. Анатомическая классификация вариантов строения сафено-ф еморального соустья. Вестник Национального медико-хирургического Центра им. Н.И. Пирогова. 2010;5(1):3-15. Режим доступа: https://www.pirogov-vestnik.ru/upload/uf/256/magazine_2010_1.pdf.
- Lefebvre-Vilardebo M. Le carrefour saphéno-fémoral: étude anatomique et concepts de prévention des récidives variqueuses. J Mal Vasc. 1991;16(4):355-258. Available at: https://pubmed.ncbi.nlm.nih.gov/1791371.
- Souroullas P., Barnes R., Smith G., Nandhra S., Carradice D., Chetter I. The classic saphenofemoral junction and its anatomical variations. Phlebology. 2017;32(3):172-178. https://doi.org/10.1177/0268355516635960.
- Donnelly M., Tierney S., Feeley T.M. Anatomical variation at the saphenofemoral junction. Br J Surg. 2005;92(3):322-325. https://doi.org/10.1002/bjs.4822.
- Anwar M.A., Idrees M., Aswini M., Theivacumar N.S. Fate of the tributaries of sapheno femoral junction following endovenous thermal ablation of incompetent axial vein - A review article. Phlebology. 2019;34(3):151-155. https://doi.org/10.1177/0268355518783635.
- Padavinangadi A., Kumar N., Swamy R.S., Satheesha N.B., Mohandas Rao K.G. Unilateral Double Great Saphenous Vein: A Clinically Significant Case Report. J Cardiovasc Echogr. 2015;25(4):116-118. https://doi.org/10.4103/2211-4122.172491.
- Cirocchi R., Henry B.M., Rambotti M., Tomaszewski K.A., Cappelli M., Vettorello G. et al. Systematic review and meta-analysis of the anatomic variants of the saphenofemoral junction. J Vasc Surg Venous Lymphat Disord. 2019;7(1):128-138.e7. https://doi.org/10.1016/j.jvsv.2018.06.006.
- Шевченко Ю.Л., Стойко Ю.М. (ред.). Клиническая флебология. М.: ДПК Пресс; 2016. 256 с.
- Gaye M., Ndiaye A., Dieng P.A., Ndiaye A., Ba P.S., Diatta S. et al. Bases anatomiques des lésions de l’artère pudendale externe lors de la chirurgie des varices du membre pelvien. Pan Afr Med J. 2016;24:199. https://doi.org/10.11604/pamj.2016.24.199.7874.
- Mühlberger D., Mumme A., Stücker M., Brenner E., Hummel T. Minor tributary veins of the common femoral vein near the saphenofemoral junction - A postmortem study. Phlebology. 2020;35(10):792-798. https://doi.org/10.1177/0268355520939774.
- Idilman I.S. Inter-arterial saphenofemoral junction: A rare anatomical variation. J Clin Ultrasound. 2019;47(7):439-441. https://doi.org/10.1002/jcu.22726.
- Калинин Р.Е., Сучков И.А., Климентова Э.А., Шанаев И.Н. Клиническая анатомия глубоких сосудов бедра области бедренного треугольника. Ангиология и сосудистая хирургия. 2021;27(1):17-23. https://doi.org/10.33529/ANGIO2021107.
- Калинин Р.Е., Сучков И.А., Климентова Э.А., Шанаев И.Н. Редкий вариант топографии глубокой артерии бедра. Наука молодых (Eruditio Juvenium). 2020;8(4):591-598. https://doi.org/10.23888/HMJ202084591-598.
- Rajagopala Y., Royb R., Sharmab V., Singhb S., Sharmab R.G. Complete bilateral transposition of femoral vessels: A rare case report. J Anat Soc India. 2013;62(2):182e183. https://doi.org/10.1016/j.jasi.2013.12.006.
- Touré T., Ba B., Kanté A., Koné M., Issa-Touré A.L., Guissé F. et al. Incomplete Transposition of Femorale Artery and Vein Associated with a Rare Variation of the Large Saphenous Vein. Ann Clin Anat. 2019;2(1):1008. Available at: https://www.remedypublications.com/annalsof-clinical-anatomy-abstract.php?aid=5287.
- George J.M., Ilonzo N., Choinski K.N., Grossi R.J. Congenital absence of bilateral common iliac arteries. J Vasc Surg Cases Innov Tech. 2021;7(2):266. https://doi.org/10.1016/j.jvscit.2021.01.003.
- Kim D.S., Kim S.W., Lee H.S., Byun K.H., Choe M.S. Rare Vascular Anomalies in the Femoral Triangle During Varicose Vein Surgery. Korean J Thorac Cardiovasc Surg. 2017;50(2):99-104. https://doi.org/10.5090/kjtcs.2017.50.2.99.
- Marcucci G., Antonelli R., Accrocca F., Siani A. A rare anomaly of the femoral vessels: complete transposition of the femoral artery and vein. Interact Cardiovasc Thorac Surg. 2010;11(6):838-839. https://doi.org/10.1510/icvts.2010.250423.
- Massoud T.F., Fletcher E.W. Anatomical variants of the profunda femoris artery: an angiographic study. Surg Radiol Anat. 1997;19(2):99-103. https://doi.org/10.1007/BF01628133.
- Rossi U.G., Ierardi A.M., Cariati M. Congenital Anatomical Variant with Cranial Origin of Internal Iliac Arteries. Aorta (Stamford). 2021;9(2):86-87. https://doi.org/10.1055/s-0041-1725089.
- Smith R.A., Dimitri S.K. Case report: a rare orientation of femoral artery and vein. EJVES Extra. 2006;12(5):66-67. https://doi.org/10.1016/j.ejvsextra.2006.09.001.
- Lekich C., Campbell W., Walton S., Hannah P. Anomalous high bifurcation of the common femoral artery at the groin: management of GSV incompetence with endovenous laser ablation. Phlebology. 2013;28(5):264-267. https://doi.org/10.1258/phleb.2012.012047.
- Forty J. Anomalous relationship between femoral artery and vein: a case report. Clin Anat. 1990;3(3):195-197. https://doi.org/10.1002/ca.980030304.
- Baum P.A., Matsumoto A.H., Teitelbaum G.P., Zuurbier R.A., Barth K.H. Anatomic relationship between the common femoral artery and vein: CT evaluation and clinical significance. Radiology. 1989;173(3):775-777. https://doi.org/10.1148/radiology.173.3.2813785.
- Калинин Н.Е., Сучков И.А., Пучкова Г.А., Пащенко В.М., Шанаев И.Н. Варианты топографии сосудов зоны trigonum femorale Sc. Вестник Авиценны. 2017;19(3):431-435. Режим доступа: https://vestnik-avicenna.tj/ru/arkhiv-nomerov/2017/2017-3/varianty-topografii-sosudov-zony-trigonum-femorale-sc.
- Oktar G.L. Iatrogenic major venous injuries incurred during cancer surgery. Surg Today. 2007;37(5):366-369. https://doi.org/10.1007/s00595-006-3416-1.
- Perkins J.M. Standard varicose vein surgery. Phlebology. 2009;24(Suppl. 1):34-41. https://doi.org/10.1258/phleb.2009.09s004.
- Widmer M.K., Hakki H., Reber P.U., Kniemeyer H.W. Seltene, aber folgenschwere Komplikation der Varizenchirurgie. Das Kompartment-Syndrom. Zentralbl Chir. 2000;125(6):543-546. Available at: https://pubmed.ncbi.nlm.nih.gov/10919249.
- Aleksic I., Busch T., Sîrbu H., Tirilomis T., Bensch M., Dalichau H. Successful reconstruction of stripped superficial femoral vein. J Vasc Surg. 2001;33(5):1111-1113. https://doi.org/10.1067/mva.2001.113977.
- Marcucci G., Accrocca F., Antonelli R., Siani A. The management of arterial and venous injuries during saphenous vein surgery. Interact Cardiovasc Thorac Surg. 2008;7(3):432-433. https://doi.org/10.1510/icvts.2007.171942.
- Hans S.S., Vang S., Sachwani-D aswani G. Iatrogenic Major Venous Injury Is Associated with Increased Morbidity of Aortic Reconstruction. Ann Vasc Surg. 2018;47:200-204. https://doi.org/10.1016/j.avsg.2017.08.004.
- Basbug H.S., Gocer H., Gunerhan Y., Ozisik K. An Unusual Case of Isolated Femoral Vein Injury After Bull Gore. AMAJ. 2016;1(3):75-77. https://doi.org/10.5455/amaj.2016.03.023.
- Nitecki S.S., Bass A. Inadvertent arterial injury secondary to treatment of venous insufficiency. Vascular. 2007;15(1):49-52. https://doi.org/10.2310/6670.2007.00009.
- Tennant W.G., Ruckley C.V. Medicolegal action following treatment for varicose veins. Br J Surg. 1996;83(3):291-292. https://doi.org/10.1002/bjs.1800830304.
- Rich N.M., Hobson R.W., Wright C.B. Historical aspects of direct venous reconstruction. In: Bergan J.J., Yao J.T.S. (eds.). Symposium on venous problems in honor of Geza de Takats. Chicago: Year Book Medical Publishers; 1978, pp. 441-449.
- MacNeill B.D., Pomerantseva I., Lowe H.C., Oesterle S.N., Vacanti J.P. Toward a new blood vessel. Vasc Med. 2002;7(3):241-246. https://doi.org/10.1191/1358863x02vm433ra.
- Bermudez K.M., Knudson M.M., Nelken N.A., Shackleford S., Dean C.L. Long-term results of lower-extremity venous injuries. Arch Surg. 1997;132(9):963-967. https://doi.org/10.1001/archsurg.1997.01430330029004.
- Rich N.M. Vascular trauma historical notes. Perspect Vasc Surg Endovasc Ther. 2011;23(1):7-12. https://doi.org/10.1177/1531003511403496.
- Walmsley D., Axelrod T., Rodriguez-Elizalde S. Compartment Syndrome following Open Femoral Fracture with an Isolated Femoral Vein Injury Treated with Acute Repair. Case Rep Orthop. 2014:502657. https://doi.org/10.1155/2014/502657.
- Percival T.J., White J.M., Ricci M.A. Compartment syndrome in the setting of vascular injury. Perspect Vasc Surg Endovasc Ther. 2011;23(2):119-124. https://doi.org/10.1177/1531003511401422.
- Hafez H.M., Woolgar J., Robbs J.V. Lower extremity arterial injury: results of 550 cases and review of risk factors associated with limb loss. J Vasc Surg. 2001;33(6):1212-1219. https://doi.org/10.1067/mva.2001.113982.
- Meyer J., Walsh J., Schuler J., Barrett J., Durham J., Eldrup-J orgensen J. et al. The early fate of venous repair after civilian vascular trauma. A clinical, hemodynamic, and venographic assessment. Ann Surg. 1987;206(4):458-464. https://doi.org/10.1097/00000658198710000-00006.
- Rich N.M., Sullivan W.G. Clinical recanalization of an autogenous vein graft in the popliteal vein. J Trauma. 1972;12(10):919-920. https://doi.org/10.1097/00005373-197210000-00016.
- Parry N.G., Feliciano D.V., Burke R.M., Cava R.A., Nicholas J.M., Dente C.J., Rozycki G.S. Management and short-term patency of lower extremity venous injuries with various repairs. Am J Surg. 2003;186(6):631-635. https://doi.org/10.1016/j.amjsurg.2003.08.006.
- Rich N.M., Collins G.J. Jr, Andersen C.A., McDonald P.T. Autogenous venous interposition grafts in repair of major venous injuries. J Trauma. 1977;17(7):512-520. https://doi.org/10.1097/00005373-197707000-00005.
- Mahapatra S., Ramakrishna P., Gupta B., Shetty N., Para M.A. Management of Iatrogenic Injury to the Inferior Vena Cava and Right Common Iliac Artery for Drainage of Psoas Abscess. Aorta (Stamford). 2017;5(2):64-67. https://doi.org/10.12945/j.aorta.2017.16.024.
- Timberlake G.A., O’Connell R.C., Kerstein M.D. Venous injury: to repair or ligate, the dilemma. J Vasc Surg. 1986;4(6):553-558. https://doi.org/10.1016/0741-5214(86)90168-0.
- Tchorz K., Rozycki G., Feliciano D.V. Prosthetic graft infection after vascular trauma. Trauma Surg Acute Care Open. 2020;5(1):e000547. https://doi.org/10.1136/tsaco-2020-000547.
- Williams T.K., Clouse W.D. Current concepts in repair of extremity venous injury. J Vasc Surg Venous Lymphat Disord. 2016;4(2):238-247. https://doi.org/10.1016/j.jvsv.2015.07.003.
- Quan R.W., Gillespie D.L., Stuart R.P., Chang A.S., Whittaker D.R., Fox C.J. The effect of vein repair on the risk of venous thromboembolic events: a review of more than 100 traumatic military venous injuries. J Vasc Surg. 2008;47(3):571-577. https://doi.org/10.1016/j.jvs.2007.10.056.
- Son K.H., Lee S.Y., Kang J.M., Choi C.H., Park K.Y., Park C.H. Prosthetic Grafting and Arteriovenous Fistula for the Surgical Management of a Common Femoral Vein Injury Using a Staged Approach. Korean J Thorac Cardiovasc Surg. 2017;50(2):133-136. https://doi.org/10.5090/kjtcs.2017.50.2.133.
- Jost C.J., Gloviczki P., Cherry K.J. Jr, McKusick M.A., Harmsen W.S., Jenkins G.D., Bower T.C. Surgical reconstruction of iliofemoral veins and the inferior vena cava for nonmalignant occlusive disease. J Vasc Surg. 2001;33(2):320-327. https://doi.org/10.1067/mva.2001.112805.
- Zamir G., Berlatzky Y., Rivkind A., Anner H., Wolf Y.G. Results of reconstruction in major pelvic and extremity venous injuries. J Vasc Surg. 1998;28(5):901-908. https://doi.org/10.1016/s0741-5214(98)70068-0.
- Gloviczki P. (ed.). Handbook of Venous Disorders: Guidelines of the American Venous Forum. 3rd ed. London: Hodder Education Publishers; 2008. 752 p.
- uan R.W., Adams E.D., Cox M.W., Eagleton M.J., Weber M.A., Fox C.J., Gillespie D.L. The management of trauma venous injury: civilian and wartime experiences. Perspect Vasc Surg Endovasc Ther. 2006;18(2):149-156. https://doi.org/10.1177/1531003506293452.
- Meissner M.H., Wakefield T.W., Ascher E., Caprini J.A., Comerota A.J., Eklof B. et al. Acute venous disease: venous thrombosis and venous trauma. J Vasc Surg. 2007;46(Suppl.):25S-53S. https://doi.org/10.1016/j.jvs.2007.08.037.
- Nypaver T.J., Schuler J.J., McDonnell P., Ellenby M.I., Montalvo J., Baraniewski H., Piano G. Long-term results of venous reconstruction after vascular trauma in civilian practice. J Vasc Surg. 1992;16(5):762-768. https://doi.org/10.1016/0741-5214(92)90231-V.
- Giannakopoulos T.G., Avgerinos E.D. Management of Peripheral and Truncal Venous Injuries. Front Surg. 2017;4:46. https://doi.org/10.3389/fsurg.2017.00046.
- Шевченко Ю.Л., Стойко Ю.М., Батрашов В.А., Сабельников В.В., Мазайшвили К.В., Сучков А.С. Ятрогенные повреждения проксимальных отделов магистральных вен в хирургии варикозной болезни. Вестник Национального медико-х ирургического Центра им. Н.И. Пирогова. 2012;7(2):9-13. Режим доступа: https://www.pirogov-vestnik.ru/upload/uf/50d/magazine_2012_2.pdf.
- Taneva Zaryanova G.T., Arribas Díaz A.B., Baeza Bermejillo C., Aparicio Martínez C., González García A. Complete femoral artery transection following handlebar trauma. Trauma Case Rep. 2017;9:1-4. https://doi.org/10.1016/j.tcr.2017.01.003.
- An S., Shen H., Feng M., Li Z., Wang Y., Cao G. Femoral artery injury during total hip arthroplasty. Arthroplast Today. 2018;4(4):459-463. https://doi.org/10.1016/j.artd.2018.03.003.
- Ramsheyi A., Soury P., Saliou C., Gigou F., Laurian C. Inadvertent arterial injury during saphenous vein stripping: three cases and therapeutic strategies. Arch Surg. 1998;133(10):1120-1123. https://doi.org/10.1001/archsurg.133.10.1120.
- Siddique M.K., Majeed S., Irfan M., Ahmad N. Missed vascular injuries: presentation and outcome. J Coll Physicians Surg Pak. 2014;24(6):428-431. Available at: https://pubmed.ncbi.nlm.nih.gov/24953919.
- Ariyoshi H., Miyaso S., Aono Y., Kawasaki T., Sakon M., Monden M. Delayed presentation of superficial femoral artery injury: report of a case. Surg Today. 2001;31(5):471-473. https://doi.org/10.1007/s005950170145.
- Gakhal M.S., Sartip K.A. CT angiography signs of lower extremity vascular trauma. AJR Am J Roentgenol. 2009;193(1):W49-57. https://doi.org/10.2214/AJR.08.2011.
- Gaitini D., Razi N.B., Ghersin E., Ofer A., Soudack M. Sonographic evaluation of vascular injuries. J Ultrasound Med. 2008;27(1):95-107. https://doi.org/10.7863/jum.2008.27.1.95.
- Ekim H., Odabasi D. Management of combined femoral artery and vein injuries. Pak J Med Sci. 2010;26(1):96-101. Available at: https://www.pjms.com.pk/issues/janmar2010/abstract/article21.html.
- Walkoff L., Nagpal P., Khandelwal A. Imaging primer for CT angiography in peripheral vascular trauma. Emerg Radiol. 2021;28(1):143-152. https://doi.org/10.1007/s10140-020-01826-w.
- Joseph T.I., Ratnakanthan P.J., Paul E., Clements W. Utility of computed tomography angiography in traumatic lower limb injury: Review of clinical impact in level 1 trauma centre. Injury. 2021;52(10):3064-3067. https://doi.org/10.1016/j.injury.2021.02.047.
- Dharia R., Perinjelil V., Nallani R., Daoud F.A., Sachwani-Daswani G., Mercer L., Wong K. Superficial femoral artery transection following penetrating trauma. J Surg Case Rep. 2018;2018(6):rjy137. https://doi.org/10.1093/jscr/rjy137.
- Ball C.G., Feliciano D.V. A simple and rapid vascular anastomosis for emergency surgery: a technical case report. World J Emerg Surg. 2009;4:30. https://doi.org/10.1186/1749-7922-4-30.
- Feliciano D.V. Pitfalls in the management of peripheral vascular injuries. Trauma Surg Acute Care Open. 2017;2(1):e000110. https://doi.org/10.1136/tsaco-2017-000110.
- Mitchell F.L. 3rd, Thal E.R. Results of venous interposition grafts in arterial injuries. J Trauma. 1990;30(3):336-339. https://doi.org/10.1097/00005373-199003000-00014.
- Feliciano D.V., Moore E.E., West M.A., Moore F.A., Davis J.W., Cocanour C.S. et al. Western Trauma Association critical decisions in trauma: evaluation and management of peripheral vascular injury, part II. J Trauma Acute Care Surg. 2013;75(3):391-397. https://doi.org/10.1097/TA.0b013e3182994b48.
- Rich N.M., Baugh J.H., Hughes C.W. Acute arterial injuries in Vietnam: 1,000 cases. J Trauma. 1970;10(5):359-369. https://doi.org/10.1097/00005373-197005000-00001.
- Kauvar D.S., Sarfati M.R., Kraiss L.W. National trauma databank analysis of mortality and limb loss in isolated lower extremity vascular trauma. J Vasc Surg. 2011;53(6):1598-1603. https://doi.org/10.1016/j.jvs.2011.01.056.
- Himura H., Uchida K., Miyashita M., Mizobata Y. Successfull imb salvage beyond the golden time following blunt traumatic open complete transection of the femoral artery and vein in a patient with cardiac arrest: a case report. Surg Case Rep. 2021;7(1):177. https://doi.org/10.1186/s40792-021-01264-x.
- Kochuba M., Rozycki G.F., Feliciano D. Outcome after ligation of major veins for trauma. J Trauma Acute Care Surg. 2021;90(2):e40-e49. https://doi.org/10.1097/TA.0000000000003014.
- Carrillo E.H., Spain D.A., Miller F.B., Richardson J.D. Femoral vessel injuries. Surg Clin North Am. 2002;82(1):49-65. https://doi.org/10.1016/S0039-6109(03)00140-3.
- Mun J.H., Kwon S.K., Kim D.H., Chu W.G., Park J.H., Lee S.S. Endovascular Stenting for a Crush Injury of the Common Femoral Artery Followed by Open Repair of Unveiled External Iliac Vein Injury after a Horse Fall. Vasc Specialist Int. 2020;36(3):180-185. https://doi.org/10.5758/vsi.200044.
- Skarupa D.J., Kochuba M.P., Feliciano D.V. Arterial and venous injuries: the combined injury conundrum. Trauma Surg Acute Care Open. 2021;6(1):e000746. https://doi.org/10.1136/tsaco-2021-000746.
- Inaba K., Aksoy H., Seamon M.J., Marks J.A., Duchesne J., Schroll R. et al. Multicenter evaluation of temporary intravascular shunt use in vascular trauma. J Trauma Acute Care Surg. 2016;80(3):359-364. https://doi.org/10.1097/TA.0000000000000949.
- Liu J.L., Li J.Y., Jiang P., Jia W., Tian X., Cheng Z.Y., Zhang Y.X. Literature review of peripheral vascular trauma: Is the era of intervention coming? Chin J Traumatol. 2020;23(1):5-9. https://doi.org/10.1016/j.cjtee.2019.11.003.
- Feliciano D.V., Subramanian A. Temporary vascular shunts. Eur J Trauma Emerg Surg. 2013;39(6):553-560. https://doi.org/10.1007/s00068-011-0171-9.
- Rasmussen T.E., Clouse W.D., Jenkins D.H., Peck M.A., Eliason J.L., Smith D.L. The use of temporary vascular shunts as a damage control adjunct in the management of wartime vascular injury. J Trauma. 2006;61(1):8-12. https://doi.org/10.1097/01.ta.0000220668.84405.17.
- Hasde A.I., Baran Ç., Gümüş F., Kış M., Ozcinar E., Cakici M. et al. Effect of temporary vascular shunting as a previous intervention on lower extremity arterial injury: Single center experiences in the Syrian Civil War. Ulus Travma Acil Cerrahi Derg. 2019;25(4):389-395. https://doi.org/10.5505/tjtes.2018.29302.
- Polcz J.E., White J.M., Ronaldi A.E., Dubose J.J., Grey S., Bell D. et al. Temporary intravascular shunt use improves early limb salvage after extremity vascular injury. J Vasc Surg. 2021;73(4):1304-1313. https://doi.org/10.1016/j.jvs.2020.08.137.
- Yu L., Deng L., Zhu S., Deng K., Yu G., Zhu C. et al. Limb-S alvage Outcomes of Arterial Repair Beyond Time Limit at Different Lower-Extremity Injury Sites. Med Sci Monit. 2021;27:e927652. https://doi.org/10.12659/MSM.927652.
- Subramanian A., Vercruysse G., Dente C., Wyrzykowski A., King E., Feliciano D.V. A decade’s experience with temporary intravascular shunts at a civilian level I trauma center. J Trauma. 2008;65(2):316-324. https://doi.org/10.1097/TA.0b013e31817e5132.
- Usman R., Jamil M., Anwer M.F. Evaluation, Surgical Management and Outcome of Traumatic Extremity Vascular Injuries: A 5-year Level-1 Trauma Centres Experience. Ann Vasc Dis. 2018;11(3):312-317. https://doi.org/10.3400/avd.oa.18-00068.
- Doody O., Given M.F., Lyon S.M. Extremities - indications and techniques for treatment of extremity vascular injuries. Injury. 2008;39(11):1295-1303. https://doi.org/10.1016/j.injury.2008.02.043.
- Branco B.C., DuBose J.J., Zhan L.X., Hughes J.D., Goshima K.R., Rhee P., Mills J.L. Sr. Trends and outcomes of endovascular therapy in the management of civilian vascular injuries. J Vasc Surg. 2014;60(5):1297-1307.e1. https://doi.org/10.1016/j.jvs.2014.05.028.
- Alam H.B., DiMusto P.D. Management of Lower Extremity Vascular Trauma. Curr Trauma Rep. 2015;1(1):61-68. https://doi.org/10.1007/s40719-014-0007-2.
- White R., Krajcer Z., Johnson M., Williams D., Bacharach M., O’Malley E. Results of a multicenter trial for the treatment of traumatic vascular injury with a covered stent. J Trauma. 2006;60(6):1189-1195. https://doi.org/10.1097/01.ta.0000220372.85575.e2.
- Oderich G.S., Panneton J.M., Hofer J., Bower T.C., Cherry K.J. Jr, Sullivan T. et al. Iatrogenic operative injuries of abdominal and pelvic veins: a potentially lethal complication. J Vasc Surg. 2004;39(5):931-936. https://doi.org/10.1016/j.jvs.2003.11.040.
- Pittaluga P., Chastanet S. Lymphatic complications after varicose veins surgery: risk factors and how to avoid them. Phlebology. 2012;27(Suppl. 1):139-142. https://doi.org/10.1258/phleb.2012.012s12.
- Sandmann W. How to Avoid Lymphatic Wound Complications After Vascular Groin Surgery. Eur J Vasc Endovasc Surg. 2016;52(2):263. https://doi.org/10.1016/j.ejvs.2016.04.026.
- Hara H., Mihara M., Hasegawa K., Yamanaka K. Lymphatic dysfunction after ligation surgery for varicose vein. SAGE Open Med Case Rep. 2016;4:2050313X16672154. https://doi.org/10.1177/2050313X16672154.
- Suzuki M., Unno N., Yamamoto N., Nishiyama M., Sagara D., Tanaka H. et al. Impaired lymphatic function recovered after great saphenous vein stripping in patients with varicose vein: venodynamic and lymphodynamic results. J Vasc Surg. 2009;50(5):1085-1091. https://doi.org/10.1016/j.jvs.2009.06.003.
- Piller N. Phlebolymphoedema/chronic venous lymphatic insufficiency: an introduction to strategies for detection, differentiation and treatment. Phlebology. 2009;24(2):51-55. https://doi.org/10.1258/phleb.2009.009003.
- Tanaka H., Yamamoto N., Suzuki M., Mano Y., Sano M., Zaima N. et al. Insufficient Lymph Drainage Causes Abnormal Lipid Accumulation and Vein Wall Degeneration. Ann Vasc Dis. 2016;9(4):277-284. https://doi.org/10.3400/avd.oa.16-00122.
- Elsharawy M.A., Naim M.M., Abdelmaguid E.M., Al-Mulhim A.A. Role of saphenous vein wall in the pathogenesis of primary varicose veins. Interact Cardiovasc Thorac Surg. 2007;6(2):219-224. https://doi.org/10.1510/icvts.2006.136937.
- Ducasse E., Giannakakis K., Speziale F., Midy D., Sbarigia E., Baste J.C., Faraggiana T. Association of primary varicose veins with dysregulated vein wall apoptosis. Eur J Vasc Endovasc Surg. 2008;35(2):224-229. https://doi.org/10.1016/j.ejvs.2007.08.015.
- Pereira de Godoy J.M., Guerreiro Godoy M.F., Pereira de Godoy H.J., De Santi Neto D. Stimulation of Synthesis and Lysis of Extracellular Matrix Proteins in Fibrosis Associated with Lymphedema. Dermatopathology (Basel). 2021;9(1):1-10. https://doi.org/10.3390/dermatopathology9010001.
- Jaworucka-Kaczorowska A., Oszkinis G., Huber J., Wiertel-Krawczuk A., Gabor E., Kaczorowski P. Saphenous vein stripping surgical technique and frequency of saphenous nerve injury. Phlebology. 2015;30(3):210-216. https://doi.org/10.1177/0268355514539316.
- Uhl J.F., Gillot C. Anatomy and embryology of the small saphenous vein: nerve relationships and implications for treatment. Phlebology. 2013;28(1):4-15. https://doi.org/10.1258/phleb.2012.012j08.
- Papakostas J.C., Douitsis E., Sarmas I., Avgos S., Kyritsis A., Matsagkas M. The impact of direction of great saphenous vein total stripping on saphenous nerve injury. Phlebology. 2014;29(1):52-57. https://doi.org/10.1258/phleb.2012.012061.
- Morrison C., Dalsing M.C. Signs and symptoms of saphenous nerve injury after greater saphenous vein stripping: prevalence, severity, and relevance for modern practice. J Vasc Surg. 2003;38(5):886-890. https://doi.org/10.1016/s0741-5214(03)00790-0.
- Sam R.C., Silverman S.H., Bradbury A.W. Nerve injuries and varicose vein surgery. Eur J Vasc Endovasc Surg. 2004;27(2):113-120. https://doi.org/10.1016/j.ejvs.2003.11.007.
- Fullarton G.M., Calvert M.H. Intraluminal long saphenous vein stripping: a technique minimizing perivenous tissue trauma. Br J Surg. 1987;74(4):255. https://doi.org/10.1002/bjs.1800740410.
- Subramonia S., Lees T. Sensory abnormalities and bruising after long saphenous vein stripping: impact on short-term quality of life. J Vasc Surg. 2005;42(3):510-514. https://doi.org/10.1016/j.jvs.2005.05.021.
- Michaels J.A., Brazier J.E., Campbell W.B., MacIntyre J.B., Palfreyman S.J., Ratcliffe J. Randomized clinical trial comparing surgery with conservative treatment for uncomplicated varicose veins. Br J Surg. 2006;93(2):175-181. https://doi.org/10.1002/bjs.5264.
- Wood J.J., Chant H., Laugharne M., Chant T., Mitchell D.C. A prospective study of cutaneous nerve injury following long saphenous vein surgery. Eur J Vasc Endovasc Surg. 2005;30(6):654-658. https://doi.org/10.1016/j.ejvs.2005.06.009.
- Orcutt M.B., Levine B.A., Gaskill H.V. 3rd, Sirinek K.R. Iatrogenic vascular injury. A reducible problem. Arch Surg. 1985;120(3):384-385. https://doi.org/10.1001/archsurg.1985.01390270122021.
- Hatakeyama T., Shigematsu H., Muto T. Results of surgical treatment for vascular injuries. Surg Today. 2000;30(3):235-240. https://doi.org/10.1007/s005950050051.
- Van Hensbroek P.B., Ponsen K.J., Reekers J.A., Goslings J.C. Endovascular treatment of anterior tibial artery pseudoaneurysm following locking compression plating of the tibia. J Orthop Trauma. 2007;21(4):279-282. https://doi.org/10.1097/BOT.0b013e3180500371.
- Palmer U., Olofsson P., Wahlberg E. Iatrogena kärlskador ställer stora krav på operatören. Bättre förebygga - misstag och okunskap kan få allvarliga följder för patienten. Lakartidningen. 2000;97(12):1382-1387. Available at: https://lakartidningen.se/wp-content/uploads/OldPdfFiles/2000/20899.pdf.
- Turgut M., Akhaddar A., Turgut A.T., Hall W.A. Iatrogenic Vascular Injury Associated with Cervical Spine Surgery: A Systematic Literature Review. World Neurosurg. 2022;159:83-106. https://doi.org/10.1016/j.wneu.2021.12.068.



 1
1 2
2 3
3 4
4


Комментарии (0)