Журнал "Медицинский совет" № 23/2024
DOI: 10.21518/ms2024-522
Г.Г. Тарадин1, Н.Ф. Яровая1, И.В. Ракитская1, И.Н. Цыба1, Л.В. Кононенко1, К.Э. Могилевская1, Е.В. Середенко2, А.А. Калуга1
1 Донецкий государственный медицинский университет имени М. Горького; 283003, Россия, Донецк, проспект Ильича, д. 16
2 Институт неотложной и восстановительной хирургии имени В.К. Гусака; 283045, Россия, Донецк, Ленинский проспект, д. 47
Гранулематоз с полиангиитом (ГПА) представляет собой гранулематозно-некротизирующий васкулит, ассоциирующийся с антинейтрофильными цитоплазматическими антителами. Клиническая картина ГПА характеризуется широким спектром проявлений, включая неспецифические симптомы, поражения верхних, нижних дыхательных путей и гломерулонефрит. В статье представлено наблюдение за пациентом в течение 12,5 лет, у которого в начале заболевания, наряду с жалобами на недомогание, слабость, снижение аппетита и потерю массы тела, отмечались сыпь геморрагического характера, протеинурия, эритроцитурия, снижение скорости клубочковой фильтрации и повышение уровней креатинина и мочевины. После положительного результата на определение антинейтрофильных цитоплазматических антител и результатов нефробиопсии с картиной гломерулонефрита с развитием гломерулосклероза и фиброза полулуний (олигоиммунный вариант) пациенту выставлен диагноз «ГПА» и начата иммуносупрессивная терапия. Спустя почти 8 лет после манифестации ГПА на фоне постоянной патогенетической терапии у больного появились жалобы на припухлость левого глаза, увеличение его в объеме и двоение в глазах. При компьютерной томографии головы диагностировано объемное образование левой орбиты. При морфологическом исследовании иссеченного образования установлено, что оно имеет воспалительную природу на фоне васкулита. Особенность представленного случая состоит в том, что глазные проявления развились у пациента спустя 8 лет от момента манифестации заболевания на фоне постоянно проводимой иммуносупрессивной терапии в условиях лабораторной ремиссии ГПА.
Для цитирования: Тарадин ГГ, Яровая НФ, Ракитская ИВ, Цыба ИН, Кононенко ЛВ, Могилевская КЭ, Середенко ЕВ, Калуга АА. Течение гранулематоза с полиангиитом (гранулематоз Вегенера) с поздними глазными и орбитальными проявлениями (клиническое наблюдение). Медицинский Совет. 2024;(23):256-265. https://doi.org/10.21518/ms2024-522
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
The course of granulomatosis with polyangiitis (Wegener’s granulomatosis) with late ocular and orbital manifestations (clinical observation)
Gennadiy G. Taradin1, Natalya F. Yarovaya1, Irina V. Rakitskaya1, Irina N. Tsyba1, Lyudmila V. Kononenko1, Kristina E. Mogilevskaya1, Elena V. Seredenko2, Alexander A. Kaluga1
1 Donetsk State Medical University named after M. Gorky; 16, Ilyich Ave., Donetsk, 283003, Russia
2 Gusak Institute of Emergency and Reconstructive Surgery; 47, Leninsky Ave., Donetsk, 283045, Russia
Granulomatosis with polyangiitis (GPA) is a granulomatous necrotizing vasculitis associated with antineutrophil cytoplasmic antibodies. The clinical picture of GPA is characterized by a wide range of manifestations, including nonspecific symptoms, signs of damage to the upper and lower respiratory tract and glomerulonephritis. The article presents the observation of a patient for 12.5 years, who at the beginning of the disease, along with complaints of malaise, weakness, decreased appetite and weight loss, had a hemorrhagic rash, proteinuria, erythrocyturia, decreased glomerular filtration rate and increased creatinine and urea levels. After a positive result for antineutrophil cytoplasmic antibodies and the results of nephrobiopsy with evidences of glomerulonephritis with the development of glomerulosclerosis and fibrosis of the crescents (pauci-immune variant) with a moderately pronounced tubulointerstitial component, the patient was diagnosed with GPA and immunosuppressive therapy was initiated. Almost 8 years after the manifestation of GPA during continuous pathogenetic therapy, the patient complained of swelling of the left eye and its increase in volume, diplopia. Computed tomography of the head revealed a mass of the left orbit. Morphological examination of the excised mass revealed its inflammatory origin as consequence of vasculitis. The special aspect of the presented case is that ocular and orbital pathologies of GPA developed in the patient 8 years after the initial manifestation of the disease against the background of ongoing immunosuppressive therapy in conditions of laboratory remission of GPA.
For citation: Taradin GG, Yarovaya NF, Rakitskaya IV, Tsyba IN, Kononenko LV, Mogilevskaya KE, Seredenko EV, Kaluga AA. The course of granulomatosis with polyangiitis (Wegener’s granulomatosis) with late ocular and orbital manifestations (clinical observation). Meditsinskiy sovet = Medical Council. 2024;(23):256-265. (In Russ.) https://doi.org/10.21518/ms2024-522
Conflict of interest: the authors declare no conflict of interest.
Введение
Гранулематоз с полиангиитом (ГПА), ранее обозначаемый термином «гранулематоз Вегенера», редкое хроническое воспалительное заболевание, которое характеризуется сосудистым воспалением аутоиммунной природы [1–5]. ГПА ассоциируется с антинейтрофильными цитоплазматическими антителами (АНЦА) против специфических цитоплазматических компонентов нейтрофилов – сериновой протеиназы 3 и реже миелопероксидазы [2, 6–9]. Патоморфологически васкулит характеризуется некротизирующим гранулематозным воспалением преимущественно сосудов мелкого и среднего калибра [6].
При ГПА может наблюдаться поражение практически любого органа или системы в виде васкулитического или гранулематозного процесса [10]. Наиболее часто заболевание проявляется поражением верхних дыхательных путей (ринорея, синуситы, заложенность носа) и нижних дыхательных путей (кашель, одышка, кровохарканье) [10, 11]. У большинства пациентов с ГПА развивается поражение почек, нередко проявляющееся в виде нефритического синдрома с протеинурией не нефротического уровня, минимальной эритроцитурией и цилиндрурией [6, 8, 10]. Реже развивается поражение центральной нервной системы, органа слуха, кожи, сердечно-сосудистой системы, желудочно-кишечного тракта [10–12]. Частота глазной патологии при ГПА составляет 40–50%, при этом в 8–16% случаев офтальмопатия выступает в качестве первичного проявления заболевания [13–15].
Мы представляем длительное наблюдение за пациентом с ГПА, у которого поражения глаза и орбиты проявились спустя 8 лет после начала заболевания.
Клинический случай
Пациент Х. 48 лет поступил в нефрологическое отделение Центральной городской клинической больницы №1 г. Донецка 25.03.2024 г. с жалобами на общую слабость, снижение зрения на левый глаз, головную боль, головокружение.
Считает себя больным с февраля 2009 г., когда впервые повысилось артериальное давление (АД) до 150/100 мм рт. ст., отмечалось небольшое носовое кровотечение. Обследовался и лечился амбулаторно, в общих анализах крови и мочи – без патологических изменений. В январе 2011 г. (в возрасте 35 лет) лечился у оториноларинголога по поводу гайморита. В августе 2011 г. через 2 нед. после инсоляции отметил недомогание, общую слабость, повышенную утомляемость, снижение аппетита и массы тела (похудел на 17 кг за 4 мес.), бледность кожных покровов. 07.09.11 г. появилась геморрагическая сыпь на коже голеней, по поводу чего пациент обратился к участковому терапевту. Назначен преднизолон (30 мг/сут), и в течение 3 дней сыпь частично регрессировала. Через несколько дней отметил появление головокружения, мелькания «мушек» перед глазами, одышки при незначительной физической нагрузке, учащенное сердцебиение, боль и отечность правого голеностопного, локтевого, левого лучезапястного, межфаланговых суставов кисти, рецидивировала сыпь геморрагического характера на коже голеней, которая распространялась также на бедра. Для обследования и уточнения диагноза 13.09.2011 г. больной госпитализирован в нефрологическое отделение Центральной городской клинической больницы №1 г. Донецка. При поступлении в общем анализе крови: нормохромная анемия (гемоглобин 55 г/л, эритроциты 2,41 × 1012), тромбоцитоз (585 × 109), ускоренная СОЭ (61 мм/ч), в общем анализе мочи: протеинурия (0,35 г/л), измененные эритроциты (до 15 в п/зр) и цилиндрурия. Результаты исследований, выполненных в момент поступления и в течение всего периода наблюдения, представлены в таблице и на рис. 1.
Рисунок 1. Динамика основных клинико-лабораторных показателей за период наблюдения
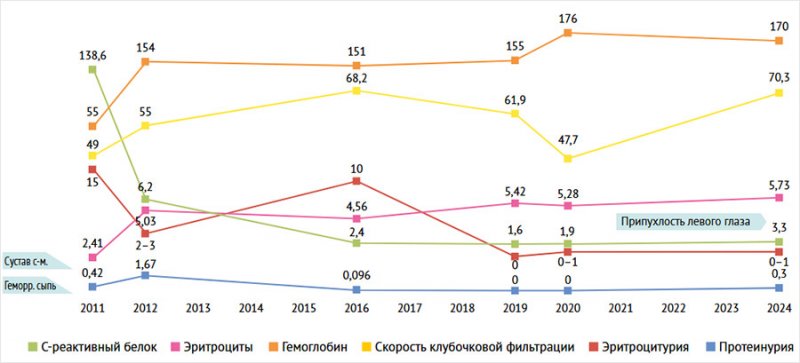
Таблица. Динамика лабораторных показателей и результатов спиральной компьютерной томографии головы на фоне лечения у пациента в период наблюдения с 2011 по 2024 г.
Показатели, единица измерения | 14.09.2011 | 03.07.2012 | 22.03.2016 | 23.12.2019 | 16.03.2020 | 25.03.2024 |
Общий анализ крови: - эритроциты, ×1012/л - цветовой показатель - гемоглобин, г/л - тромбоциты, ×109/л - гематокрит, % - СОЭ, мм/ч - лейкоциты, ×109/л - эозинофилы, % - палочкоядерные, % -сегментоядерные, % -лимфоциты, % -моноциты, % | 2,41 1,0 55 585 22,4 61 8,0 2 6 63 21 8 | 5,03 1,0 154 255 45,6 2 9,3 1 5 62 25 7 | 4,56 0,9 151 290 н/д 7 7,9 1 1 59 26 13 | 5,42 0,9 155 226 н/д 3 7,47 1 2 60 27 10 | 5,28 1,0 176 153 н/д 7 7,8 1 1 56 31 11 | 5,73 1,0 170 260 47 2 9,4 1 1 60 30 8 |
Общий анализ мочи: - относительная плотность - белок, г/л - глюкоза, г/л - лейкоциты, п/зр - эритроциты, п/зр - цилиндры, п/зр | 1007 0,35 нет до 5 изм.до 15 гиалиновые 10–12 | 1016 0,83 нет 2–3 изм. 2–3 гиалиновые, зернистые до 10 | 1018 0,08 нет 0–3 изм. до 10 0–1 | 1015 0,00 нет 0–3 нет нет | 1018 0,00 нет до 5 0–1 0–1 | 1025 0,22 нет 0–1 0–1 нет |
Суточный анализ мочи: -суточный диурез, л - глюкоза, г/л - белок, г/л -суточные потери белка, г/сут | 1,4 нет 0,3 0,42 | 0,740 нет 0,9 1,67 | 1,365 нет 0,07 0,096 | 1,2 нет нет 0,00 | 1,1 нет нет 0,00 | 1,5 нет 0,2 0,3 |
Проба Зимницкого: - суточный диурез, мл - колебания относительной плотности | 1,4 1005–1012 | 0,740 1010–1016 | 1,365 1002–1018 | 1,2 1010–1016 | 1,1 1011–1018 | 1,5 1012–1025 |
Биохимический анализ крови: -С-реактивный белок, мг/л -глюкоза, ммоль/л -общий белок, г/л -мочевина, ммоль/л -креатинин, мкмоль/л -СКФ, мл/мин (CKD-EPI) -общий билирубин, мкмоль/л -АЛТ, Ед/л - АСТ, Ед/л | 138,6 6,1 66 18,31 207 49 11,8 1,75 0,48 | 6,2 5,3 63 4,79 140 55 5,6 0,7 0,32 | 2,4 5,8 78 3,74 115 68,2 14,9 0,38 0,18 | 1,6 4,7 74 5,58 122,39 61,9 13,6 0,42 0,22 | 1,9 4,4 66 5,68 151 47,7 17,1 0,50 0,15 | 3,3 4,2 69 7,28 107 70,3 12,1 0,36 0,54 |
КТ головы, заключение | Объемное образование левой орбиты с распространением в мягкие ткани по ходу латеральной стенки левой гайморовой пазухи. Экзофтальм слева. Изменения клеток пирамидки и сосцевидного отростка левой височной кости, вероятнее всего, имеют воспалительный характер | Состояние после оперативного лечения удаления образования левой орбиты. Индуративные изменения ретробульбарной клетчатки левой орбиты с учетом наличия участков накопления контрастного вещества, нельзя исключить prolongatio morbi. Снижение пневматизации ячеек височных костей слева. Полиповидное утолщение слизистой левой верхнечелюстной пазухи | КТ-признаков ишемического нарушения мозгового кровообращения, геморрагического содержимого и объемных образований вещества мозга не выявлено. Левосторонний экссудативный синусит, средний отит. Структурные изменения левой орбиты с наличием утолщения нерва, утолщения мышечных структур, повышением плотности ретробульбарной жировой клетчатки. В левой верхнечелюстной пазухе небольшой уровень жидкости на фоне утолщения слизистой, тотальное снижение пневматизации левого сосцевидного отростка и барабанной полости | |||
Лечение | с 14.09.2011 г. пульс-терапия (МП 1000 мг №3, ЦФ 400 мг №1); с 17.09.2011 г. МП 32 мг/сут, ЦФ 400 мг 1 р/нед | с 16.07.2012 г. МП 4–8 мг/сут; ЦФ 200 мг 1 раз в 2–3 нед. | МП 8–4 мг/сут; ЦФ 200 мг 1 раз в 2–3 нед. | 25.12.2019 г. транстимпанальное шунтирование; МП 4–8 мг/сут; ЦФ 200 мг 1 раз в 2–3 нед. | с 16.03.2020 г. МП 8 мг/сут; ЦФ 25 мг через день | с 25.03.2024 г. МП 8 мг/сут; ЦФ 50 мг через день |
Примечание. СОЭ – скорость оседания эритроцитов; СКФ – скорость клубочковой фильтрации; АЛТ – аланинаминотрансфераза; АСТ – аспартатаминотрансфераза; CKD-EPI – оценка СКФ по Chronic Kidney Desease Epidemiology Collaboration; КТ – компьютерная томография, МП – метилпреднизолон; ЦФ – циклофосфамид, п/зр – поле зрения; н/д – нет данных.
Во время пребывания в стационаре больному выполнены иммунологические исследования (16.09.2011 г.): обнаружены АНЦА, тип свечения – цитоплазматический, антитела к нативной ДНК – в пределах референсных значений. На основании клинической картины, анамнеза, результатов лабораторных исследований выставлен диагноз «АНЦА-ассоциированный системный васкулит с поражением почек, анемия средней степени тяжести, артериальная гипертензия».
Учитывая высокую клинико-лабораторную активность заболевания, с 14.09.2011 г. назначена сочетанная пульс-терапия метилпреднизолоном (МП) 1000 мг №3 и циклофосфамидом (ЦФ) 400 мг №1. Также пациент получал дексаметазон 24 мг/сут, препараты железа, антигипертензивные препараты (эналаприл, амлодипин), ингибиторы протонной помпы (омепразол). С 17.09.2011 г. дополнительно к лечению назначен МП 32 мг/сут per os. С 19.09.2011 г. ЦФ – 400 мг в/м 1 раз в неделю №2, через 2 нед., с 04.10.2011 г., ЦФ – 200 мг в/м 1 раз в неделю. В отделении пациент осматривался оториноларингологом: видимой патологии со стороны лор-органов выявлено не было. Выписан 14.10.2011 г.
С ноября 2011 г. по апрель 2012 г. было проведено еще 4 сеанса пульс-терапии МП и ЦФ. Между сеансами пациент получал ЦФ 200 мг в/м 1 раз в 7 дней. Доза МП в течение 6 мес. снижена с 32 до 8 мг.
На фоне проводимой терапии через 9 мес. наблюдалась существенная положительная динамика: уменьшилась общая слабость, стабилизировалась масса тела, купирован суставной синдром, сыпь полностью регрессировала. Улучшились гематологические показатели (повысились уровни эритроцитов, гемоглобина, снизилась СОЭ). Однако сохранялись изменения в анализах мочи (микрогематурия, цилиндрурия, снижение относительной плотности мочи в пробе Зимницкого 1010–1016). При этом наросла протеинурия с минимальной до умеренной (с 0,42 до 1,67 г/сут). Сохранялось повышение показателей азотистого обмена (табл.) и сниженная скорость клубочковой фильтрации (55 мл/мин).
В июле 2012 г. больному была выполнена мини-инвазивная чрескожная нефробиопсия левой почки под контролем сонографии. Заключение: АНЦА-ассоциированный васкулит с развитием быстропрогрессирующего гломерулонефрита с развитием гломерулосклероза и фиброза полулуний (олигоиммунный вариант, pauci-immune) с умеренно выраженным тубулоинтерстициальным компонентом (с преобладанием атрофии канальцев и началом интерстициального фиброза).
Таким образом, на основании клинической картины, анамнеза заболевания, результатов инструментальных, лабораторных и гистологических исследований выставлен диагноз «ГПА, АНЦА-ассоциированный, хроническое течение, минимальная степень активности с поражением почек: вторичный гломерулонефрит, изолированный мочевой синдром (олигоиммунный вариант), с умеренно выраженным тубулоинтерстициальным компонентом, с преобладанием атрофии канальцев и началом интерстициального фиброза (нефробиопсия от 09.07.12 г.), хроническая болезнь почек, стадия С3а; с артериальной гипертензией, поражением суставов, анемией и астеновегетативным синдромом».
Пациент продолжал получать иммуносупрессивную терапию: МП 4–8 мг/сут, ЦФ 200 мг в/м 1 раз в 2–3 недели, антигипертензивные препараты, выполнял амбулаторно анализы мочи, крови, измерял АД. Самочувствие оставалось удовлетворительным, цифры АД в пределах 140/95–130/80 мм рт. ст. На фоне проводимой терапии состояние оставалось стабильным с клинико-лабораторной ремиссией. Переносимость проводимой терапии была удовлетворительная, пациент вернулся к трудовой деятельности.
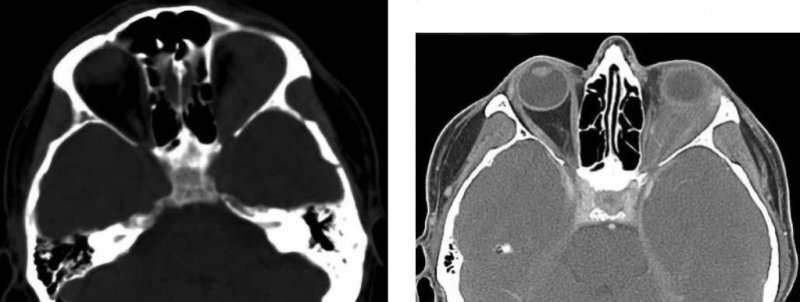
С января 2019 г. пациент отметил припухлость левого глаза, увеличение его в объеме, появилось двоение в глазах (рис. 2). Периодически отмечал головокружение, снижение слуха на левое ухо. В марте 2019 г. выполнена компьютерная томография (КТ) головы (рис. 3–6). Заключение: объемное образование левой орбиты с распространением в мягкие ткани по ходу латеральной стенки левой гайморовой пазухи. Экзофтальм слева. Изменения клеток пирамидки и сосцевидного отростка левой височной кости, вероятнее всего, имеют воспалительный характер.
Рисунок 2. Проптоз, отек и гиперемия век левого глаза 21.03.2019 г.
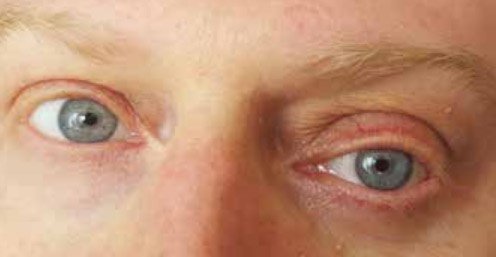
Фотографирование, сохранение и передача снимка для публикации в научном журнале произведены с письменного согласия пациента (имеется в редакции)
На рис. 3–6 представлены снимки спиральной компьютерной томографии (СКТ) головы, выполненной в марте 2019 г.
Рисунок 3. СКТ головы, аксиальная проекция. Мягкотканое образование левой орбиты, распространяющееся на латеральную прямую мышцу глазного яблока. Экзофтальм
Рисунок 4. СКТ головы, аксиальная проекция. Мягкотканое образование левой орбиты, распространяющееся на верхнюю прямую мышцу глазного яблока
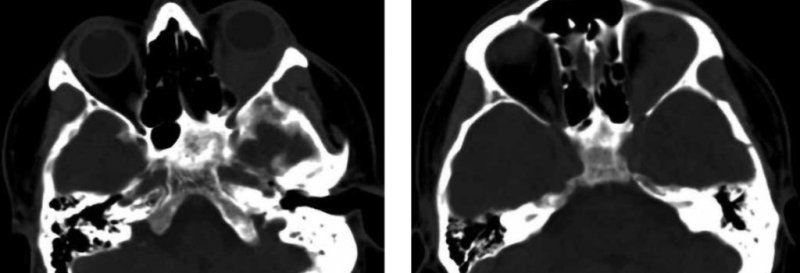
Рисунок 5. СКТ, аксиальная проекция. Мягкотканое образование левой орбиты, распространяющееся на глазничную часть левого зрительного нерва
Рисунок 6. СКТ головы с внутривенным контрастированием, аксиальная проекция. В левой орбите визуализируется мягко-
тканое образование, неравномерно накапливающее контрастное вещество
31.07.2019 г. проведена операция – микрохирургическое удаление новообразования левой орбиты субконъюнктивальным доступом с последующим морфологическим исследованием удаленного образования. Гистологический ответ: воспалительная псевдоопухоль орбиты на фоне экссудативно-продуктивного васкулита.
КТ головы в динамике (12.08.2019 г., 14.10.2019 г.): изменений в орбите слева не выявлено. Изменения во внутреннем слуховом проходе, среднем ухе, а также в сосцевидном отростке височной кости слева неясного генеза, возможно, воспалительного. Данных за объемную и очаговую патологию головного мозга не выявлено. Пациент продолжал принимать поддерживающую патогенетическую терапию ЦФ и МП. В декабре 2019 г. находился на стационарном лечении в оториноларингологическом отделении. Диагноз «Левосторонний экссудативный средний отит, предположительно в результате распространения новообразования в мягкие ткани по ходу латеральной стенки левой гайморовой пазухи». 25.12.19 г. выполнена операция: транстимпанальное шунтирование с дренированием экссудата из барабанной полости в наружный слуховой проход. После лечения в оториноларингологическом отделении перестало беспокоить головокружение, однако сохранялось снижение слуха на левое ухо.
В марте 2020 г. выполнен контроль КТ орбит, придаточных пазух носа. На серии компьютерных томограмм, выполненных в аксиальной плоскости, очаговых изменений, дополнительных образований, скопления крови в видимой паренхиме головного мозга не выявлено. Дифференцировка белого и серого вещества сохранена. Скопления крови в видимых ликворных пространствах не выявлено. Отмечаются кальцинаты в сосудистых сплетениях желудочков и шишковидном теле. Сохраняется полиповидное утолщение слизистой левой верхнечелюстной пазухи по задненижней стенке до 4 мм, по сравнению с исследованием от 23.01.2020 г. имеет место уменьшение толщины измененных стенок. Отмечается снижение пневматизации ячеек височных костей слева. Пневматизация других придаточных пазух носа, ячеек височных костей справа не нарушена. Воронки верхнечелюстных пазух, полулунные каналы свободны. Носовые раковины не изменены. Слизистая оболочка носовых раковин с обеих сторон не утолщена, носовые ходы с обеих сторон не сужены, проходимы. Определяется левосторонний экзофтальм. Ретробульбарное пространство тотально выполнено уплотненной клетчаткой, в которой определяются участки накопления контрастного вещества без четких контуров, в нижнебоковых отделах левой орбиты сохраняется участок уплотнения солидной плотности, тесно прилежащий к нижней прямой мышце глаза и к зрительному нерву, с условными размерами 22 × 19 × 23 мм. Мягкие ткани задней стенки носоглотки не утолщены. Носовая перегородка не искривлена. Слуховые косточки сохранены с обеих сторон. Канал слухового нерва с обеих сторон не расширен. Травматических и деструктивных изменений в костях черепа не выявлено. Заключение КТ головы представлено в таблице.
С марта 2020 г. наблюдался нефрологом по месту жительства, продолжал принимать ЦФ 25 мг через день, МП 4 мг/сут, антигипертензивные препараты (рамиприл, амлодипин).
Объективно (25.03.2024 г.): общее состояние удовлетворительное, кожные покровы телесного цвета, обычной влажности, без патологических высыпаний, отеков нет, видимые слизистые розовые, без патологических высыпаний, периферические лимфатические узлы не пальпируются, суставы внешне не изменены, движение в общем объеме. Над легкими дыхание везикулярное, хрипов нет. Аускультативно тоны сердца ясные, ритмичные, патологических шумов не определяется. Пальпация живота безболезненна, печень по краю реберной дуги, селезенка не пальпируется. Температура 36,6 ℃, ЧСС: 80 мин-1, АД 140/85 мм рт. ст., частота дыхательных движений: 17 мин-1, насыщение крови кислородом 98%.
Данные лабораторного обследования, КТ головы представлены в таблице.
Электрокардиограмма (25.03.2024 г.) – ритм синусовый регулярный, частота 66 мин-1. Нормальное положение электрической оси (угол α: +45ᵒ), электрокардиографическая картина без особенностей.
Мультиспиральная КТ органов грудной клетки (25.03.2024 г.): дополнительных образований, инфильтратов в легких с обеих сторон не выявлено. Легочный рисунок с обеих сторон неизменен. Бронхи проходимы на всем протяжении. Корни легких структурны, не расширены. Плевральные полости с обеих сторон свободны. В средостении дополнительные образования и увеличенные лимфатические узлы не определяются. Деструктивных изменений в костных структурах на уровне исследования не выявлено. Заключение: данных за объемную и очаговую патологию в легких не выявлено.
Осмотр окулиста (08.04.2024 г.): частичная атрофия зрительных нервов, выраженная ангиопатия сосудов сетчатки. Начальная заднекапсулярная катаракта.
За время пребывания в стационаре самочувствие пациента улучшилось: головокружение и головные боли не беспокоят, уменьшилась слабость, сохраняется снижение зрения на левый глаз. Рекомендовано наблюдение у нефролога, окулиста, оториноларинголога, нейрохирурга. Контроль анализов крови и мочи, АД. Продолжить прием МП 8 мг/сут, ЦФ 50 мг через день, рамиприл 5 мг/сут, амлодипин 10 мг/сут.
Обсуждение
ГПА является тяжелым аутоиммунным заболеванием неизвестной природы, поражающим сосуды среднего и малого калибра. Несмотря на встречающиеся лимитированные формы, ГПА, как правило, характеризуется мультисистемным поражением и неблагоприятным прогнозом. При отсутствии своевременной иммуносупрессивной терапии отмечается высокий уровень летальности в течение первого года заболевания, достигая 80% [9, 16].
Уровни заболеваемости ГПА несколько разнятся в разных странах, составляя от 2,1 до 14,4 случая на 1 млн населения в год, а распространенность – 100–137 случаев на 1 млн [4, 17–19]. Не отмечено половой предрасположенности к заболеванию, хотя у женщин чаще наблюдаются лимитированные формы [20]. Диагноз «ГПА» устанавливается обычно в среднем и пожилом возрасте (40–70 лет) [19–25]. Гораздо реже ГПА встречается у молодых людей и детей с частотой 8–15% случаев среди больных 19 лет и младше [26]. Нашему пациенту на момент первых клинических проявлений ГПА было 35 лет, что в целом характерно для срока дебюта этого заболевания.
В патогенезе ГПА ведущая роль отводится нейтрофилам, продуцирующим аутоантиген протеиназы-3 (ПР3), с нарушением их регуляции [1]. У больных с ГПА выявляются аутоантитела, направленные против ПР3 нейтрофилов. Аутоантиген ПР3, экспрессируемый на мембране апоптотических нейтрофилов, нарушает их узнавание и элиминацию макрофагами. Экспрессия ПР3 на мембране активированных нейтрофилов предотвращает разрешение воспаления и является основным фактором в патогенезе ГПА. В то время как фагоцитоз апоптотической клетки в физиологических условиях оказывает противовоспалительное действие, ПР3 воспринимается макрофагами как сигнал опасности, который активирует иммунную систему и запускает воспалительный каскад [22, 27].
Генерализованная форма ГПА, впервые описанная Friedrich Wegener в 1934 г., гистопатологически характеризуется следующей триадой [28]:
- некротизирующий васкулит мелких сосудов (артериол, венул, капилляров),
- олигоиммунный фокальный некротизирующий гломерулонефрит,
- некротизирующее гранулематозное воспаление верхних и нижних дыхательных путей.
Клинические проявления при ГПА довольно разнообразны. В активную фазу заболевания у большинства больных отмечаются неспецифические симптомы, такие как недомогание, слабость, артралгии, анорексия, потеря веса, лихорадка, потливость по ночам. Конституциональные симптомы могут сохраняться недели и месяцы без признаков специфической органной патологии [29]. В представленном случае пациент в начале заболевания жаловался на недомогание, слабость, повышенную утомляемость, снижение аппетита и массы тела.
Одними из наиболее частых проявлений ГПА являются поражения уха, носа и глотки (до 95% случаев). Кстати, хронический синусит выступает в роли наиболее частого изначального проявления заболевания (67% случаев) [29]. Наш больной за 8 мес. до развернутой клинической картины наблюдался у оториноларинголога по поводу гайморита. Вполне вероятно, что воспаление верхнечелюстной пазухи было манифестацией ГПА.
Поражение легких, наблюдаемое примерно в 50–85% случаев, протекает в виде асимптомных диффузных легочных инфильтратов, узелков, ателектаза, уплотнения плевры или наличия плеврального выпота, что клинически проявляется кашлем, кровохарканьем, одышкой [10, 16, 30].
Одно из наиболее частых проявлений ГПА – поражение почек в виде гломерулонефрита (70–85% случаев). Почечная патология является одним из важнейших клинических и прогностических признаков ГПА [31]. Поражение почек характеризуется развитием диффузного олигоиммунного некротизирующего гломерулонферита. У нашего больного поражение почек отмечалось на раннем этапе заболевания и клинически проявлялось минимально умеренной протеинурией (0,42–1,67 г/л), эритроцитурией (до 15 в п/зр), цилиндрурией, высокими уровнями мочевины (18,31 ммоль/л), креатинина (207 мкмоль/л), снижением скорости клубочковой фильтрации (49 мл/мин). При выполнении пункционной биопсии на фоне морфологических признаков васкулита обнаружена картина гломерулонефрита с развитием гломерулосклероза и фиброза полулуний (олигоиммунный вариант) с умеренно выраженным тубулоинтерстициальным компонентом.
При ГПА патология органа зрения представлена в чрезвычайно широком спектре. Возможно поражение всех структур глаза – от век и до зрительного нерва различной степени тяжести [32, 33]. Частота поражений органа зрения составляет, по разным данным, 28,6–60% [12, 34–36]. Офтальмологические проявления системного васкулита многообразны и могут быть представлены симптомами воспаления: болью в глазнице, слезотечением, отеком век, проптозом (экзофтальмом), диплопией и другими жалобами [4, 37, 38].
Одним из наиболее частых проявлений ГПА является поражение орбиты, наблюдающееся у 45–50% пациентов [32, 36, 39]. Поражение орбиты может быть результатом патологического процесса в расположенных рядом придаточных пазухах или возникать как локальная патология с образованием орбитальной гранулемы. Клинически патология орбиты может проявляться в виде трех вариантов: дакриоаденита, миозита экстраокулярных мышц (орбитальный миозит) или поражения мягких тканей (орбитальная псевдоопухоль) [39, 40].
В представленном клиническом случае особый интерес вызывает то, что патология левого глаза и орбиты развилась не в начале заболевания при генерализованном поражении, а спустя 8 лет после диагностики ГПА на фоне патогенетической терапии. Необходимо отметить, что в 2019 г. отмечалась низкая активность заболевания по клиническим и лабораторным данным (табл., рис. 1) и больной продолжал получать иммуносупрессивную терапию.
Общие признаки орбитопатии при ГПА включают проптоз, слезотечение, диплопию, внезапное появление боли, эритему, отек век и снижение зрения. Проптоз и разрушение века могут спровоцировать экспозиционную кератопатию, которая может привести к изъязвлению роговицы, перфорации глаза и слепоте [32]. Иногда после экзофтальма наступает энофтальм как следствие хронического воспаления глазницы из-за фиброзных изменений в орбите [32]. Диплопия возникает в результате воспаления экстраокулярных мышц, самого васкулита местной сосудистой сети и сдавления зрительного нерва образованием орбиты, что может привести к ишемии зрительного нерва и даже слепоте.
Сочетанное поражение различных систем при ГПА усложняет его своевременную диагностику и требует знаний о самом заболевании и его проявлениях у врачей самых разных специальностей. Следует отметить, что постановка диагноза в нашем случае вызывала определенные сложности, учитывая синусит в анамнезе, наличие кожных проявлений в виде геморрагической сыпи, суставного синдрома, анемии и поражение почек.
Описанный случай интересен также с позиции оценки динамики клинико-лабораторных данных на фоне патогенетической терапии в течение довольно длительного периода наблюдения – 12,5 лет.
Среди особенностей данного случая можно отметить отсутствие легочной патологии и поражения сердца. Решающее значение в постановке диагноза имело морфологическое исследование почек и выявление АНЦА. Высокая активность заболевания, полиорганность патологии и быстропрогрессирующий гломерулонефрит потребовали проведения пульс-терапии глюкокортикоидами и цитостатиками, что позволило достигнуть клинико-лабораторной ремиссии.
Заключение
Своевременная диагностика ГПА часто вызывает сложности в связи с неспецифичностью ранних проявлений васкулита и обсуждением вероятности других заболеваний, которые могли бы объяснить те или иные клинические признаки и изменения лабораторных показателей. Для точной диагностики и своевременного лечения ГПА необходим мультидисциплинарный подход с участием ревматолога, нефролога, оториноларинголога, морфолога и в нашем случае окулиста. В представленном случае ГПА протекал с поражением не только верхних дыхательных путей, но и кожи, почек, глаз.
Представленный клинический случай демонстрирует длительное наблюдение пациента с ГПА. Несмотря на длительную клинико-лабораторную ремиссию и постоянный прием патогенетической терапии, у пациента спустя почти 8 лет от начала заболевания развилось поражение левой орбиты в виде псевдоопухоли.
Список литературы / References
Развернуть
- Csernok E, Gross WL. Current understanding of the pathogenesis of granulomatosis with polyangiitis (Wegener’s). Expert Rev Clin Immunol. 2013;9(7):641-648. https://doi.org/10.1586/1744666X.2013.811052.
- Singer O, McCune WJ. Update on maintenance therapy for granulomatosis with polyangiitis and microscopic polyangiitis. Curr Opin Rheumatol. 2017;29(3):248-253. https://doi.org/10.1097/BOR.0000000000000382.
- Robson JC, Grayson PC, Ponte C, Suppiah R, Craven A, Judge A et al. DCVAS Investigators. 2022 American College of Rheumatology/European Alliance of Associations for Rheumatology classification criteria for granulomatosis with polyangiitis. Ann Rheum Dis. 2022;81(3):315-320. https://doi.org/10.1136/annrheumdis-2021-221795.
- Moin KA, Yeakle MM, Parrill AM, Garofalo VA, Tsiyer AR, Bishev D et al. Ocular and orbital manifestations of granulomatosis with polyangiitis: a systematic review of published cases. Rom J Ophthalmol. 2023;67(3):214-221. https://doi.org/10.22336/rjo.2023.38.
- Chung SA, Langford CA, Maz M, Abril A, Gorelik M, Guyatt G et al. 2021 American College of Rheumatology/Vasculitis Foundation Guideline for the management of antineutrophil cytoplasmic antibody-associated vasculitis. Arthritis Rheumatol. 2021;73(8):1366-1383. https://doi.org/10.1002/art.41773.
- Lynch JP 3rd, Derhovanessian A, Tazelaar H, Belperio JA. Granulomatosis with polyangiitis (Wegener’s Granulomatosis): evolving concepts in treatment. Semin Respir Crit Care Med. 2018;39(4):434-458. https://doi.org/10.1055/s-0038-1660874.
- Spanuchart I, Zungsontiporn N, O-charoen P, Changcharoen B, Bolger DT Jr. Granulomatosis with polyangiitis: a case of nasal mass, necrotic lung, and normal kidneys. Hawaii J Med Public Health. 2015;74(9 Suppl. 2):27-29. Available at: https://pubmed.ncbi.nlm.nih.gov/26793412.
- Binda V, Moroni G, Messa P. ANCA-associated vasculitis with renal involvement. J Nephrol. 2018;31(2):197-208. https://doi.org/10.1007/s40620-017-0412-z.
- Banerjee P, Jain A, Kumar U, Senapati S. Epidemiology and genetics of granulomatosis with polyangiitis. Rheumatol Int. 2021;41(12):2069-2089. https://doi.org/10.1007/s00296-021-05011-1.
- Tee QX, Wong A, Nambiar M, Lau KK. Granulomatosis with polyangiitis: common and uncommon presentations. J Med Imaging Radiat Oncol. 2022;66(8):1089-1096. https://doi.org/10.1111/1754-9485.13471.
- Greco A, Marinelli C, Fusconi M, Macri GF, Gallo A, De Virgilio A et al. Clinic manifestations in granulomatosis with polyangiitis. Int J Immunopathol Pharmacol. 2016;29(2):151-159. https://doi.org/10.1177/0394632015617063.
- Grygiel-Górniak B, Limphaibool N, Perkowska K, Puszczewicz M. Clinical manifestations of granulomatosis with polyangiitis: key considerations and major features. Postgrad Med. 2018;130(7):581-596. https://doi.org/10.1080/00325481.2018.1503920.
- Byszewska A, Skrzypiec I, Rymarz A, Niemczyk S, Rękas M. Ocular involvement of granulomatosis with polyangiitis. J Clin Med. 2023;12(13):4448. https://doi.org/10.3390/jcm12134448.
- Ismailova DS, Abramova JV, Novikov PI, Grusha YO. Clinical features of different orbital manifestations of granulomatosis with polyangiitis. Graefes Arch Clin Exp Ophthalmol. 2018;256(9):1751-1756. https://doi.org/10.1007/s00417-018-4014-9.
- Sattui SE, Lally L. Localized granulomatous with polyangiitis (GPA): varied clinical presentations and update on treatment. Curr Allergy Asthma Rep. 2020;20(10):56. https://doi.org/10.1007/s11882-020-00953-1.
- Monteiro M, Domingos R, Rocha S, Miranda I. Granulomatosis with polyangiitis: the complexity of clinical manifestations, therapeutic challenges, and complications of a severe multisystemic case. Cureus. 2023;15(10):e47031. https://doi.org/10.7759/cureus.47031.
- Redondo-Rodriguez R, Mena-Vázquez N, Cabezas-Lucena AM, Manrique-Arija S, Mucientes A, Fernández-Nebro A. Systematic review and metaanalysis of worldwide incidence and prevalence of antineutrophil cytoplasmic antibody (ANCA) associated vasculitis. J Clin Med. 2022;11(9):2573. https://doi.org/10.3390/jcm11092573.
- Bataille PM, Durel CA, Chauveau D, Panes A, Thervet ÉS, Terrier B. Epidemiology of granulomatosis with polyangiitis and microscopic polyangiitis in adults in France. J Autoimmun. 2022;133:102910. https://doi.org/10.1016/j.jaut.2022.102910.
- Lutalo PM, D’Cruz DP. Diagnosis and classification of granulomatosis with polyangiitis (aka Wegener’s granulomatosis). J Autoimmun. 2014;48-49:94-98. https://doi.org/10.1016/j.jaut.2014.01.028.
- Comarmond C, Cacoub P. Granulomatosis with polyangiitis (Wegener): clinical aspects and treatment. Autoimmun Rev. 2014;13(11):1121-1125. https://doi.org/10.1016/j.autrev.2014.08.017.
- Puéchal X. Granulomatosis with polyangiitis (Wegener’s). Joint Bone Spine. 2020;87(6):572-578. https://doi.org/10.1016/j.jbspin.2020.06.005.
- Новикова АВ, Правдюк НГ, Шмидт ЕИ, Ракша АП, Мазра МР, Юняев АР, Жулина ЮС. Гранулематоз с полиангиитом: оптимальные возможности быстрой диагностики в многопрофильном стационаре. Клиницист. 2022;16(4):45-55. https://doi.org/10.17650/1818-8338-2022-16-3-К673.
- Catanoso M, Macchioni P, Boiardi L, Manenti L, Tumiati B, Cavazza A, et al. Epidemiology of granulomatosis with polyangiitis (Wegener’s granulomatosis) in Northern Italy: a 15-year population-based study. Semin Arthritis Rheum. 2014;44(2):202-207. https://doi.org/10.1016/j.semarthrit.2014.05.005.
- Gonzalez-Gay MA, Garcia-Porrua C, Guerrero J, Rodriguez-Ledo P, Llorca J. The epidemiology of the primary systemic vasculitides in northwest Spain: implications of the Chapel Hill Consensus Conference definitions. Arthritis Rheum. 2003;49(3):388-393. https://doi.org/10.1002/art.11115.
- Reinhold-Keller E, Herlyn K, Wagner-Bastmeyer R, Gross WL. Stable incidence of primary systemic vasculitides over five years: results from the German vasculitis register. Arthritis Rheum. 2005;53(1):93-99. https://doi.org/10.1002/art.20928.
- Gajic-Veljic M, Nikolic M, Peco-Antic A, Bogdanovic R, Andrejevic S, Bonaci-Nikolic B. Granulomatosis with polyangiitis (Wegener’s granulomatosis) in children: report of three cases with cutaneous manifestations and literature review. Pediatr Dermatol. 2013;30(4):e37-е42. https://doi.org/10.1111/pde.12034.
- Fouka E, Drakopanagiotakis F, Steiropoulos P. Pathogenesis of pulmonary manifestations in ANCA-associated vasculitis and Goodpasture syndrome. Int J Mol Sci. 2024;25(10):5278. https://doi.org/10.3390/ijms25105278.
- Wegener F. Wegener’s granulomatosis. Thoughts and observations of a pathologist. Eur Arch Otorhinolaryngol. 1990;247(3):133-142. https://doi.org/10.1007/BF00175962.
- Peixoto L, Aguiar P, Veloso F, Espirito J, Marques N, Jesus I et al. Wegener’s granulomatosis. Advances in the etiology, pathogenesis and pathology of vasculitis. InTech. 2011;11:225-234. https://doi.org/10.5772/20014.
- Баранова ЮР, Романова ИА, Стешенко РН, Мелехина ИФ, Никитина НМ, Кароли НА. Гранулематоз Вегенера: трудности диагностики и лечения. Южно-Российский журнал терапевтической практики. 2023;4(4):95-100. https://doi.org/10.21886/2712-8156-2023-4-4-95-100.
- Iorio L, Pizzi M, Cecchin D, Davanzo F, Ghirardello A, Dei Tos AP et al. Cutting-edge strategies for renal tumour-like lesions in granulomatosis with polyangiitis: a systematic review. Diagnostics. 2024;14(5):566. https://doi.org/10.3390/diagnostics14050566.
- Sfiniadaki E, Tsiara I, Theodossiadis P, Chatziralli I. Ocular manifestations of granulomatosis with polyangiitis: a review of the literature. Ophthalmol Ther. 2019;8(2):227-234. https://doi.org/10.1007/s40123-019-0176-8.
- Tarabishy AB, Schulte M, Papaliodis GN, Hoffman GS. Wegener’s granulomatosis: clinical manifestations, differential diagnosis, and management of ocular and systemic disease. Surv Ophthalmol. 2010;55(5):429-444. https://doi.org/10.1016/j.survophthal.2009.12.003.
- Лазарчук АВ, Исмаилова ДС. Современные подходы к лечению поражения органа зрения при гранулематозе с полиангиитом (Вегенера). Вестник Совета молодых ученых и специалистов Челябинской области. 2022;1(3):23-30. Режим доступа: https://www.elibrary.ru/sakdqa.
- Andrada-Elena M, Ioana TT, Mihaela FM, Irina-Elena C, Andrei TI, Florian B. Wegener’s granulomatosis with orbital involvement: case report and literature review. Rom J Ophthalmol. 2021;65(1):93-97. https://doi.org/10.22336/rjo.2021.19.
- Толстов ПВ, Жукова СИ, Калягин АН, Александрова ЮВ, Максикова ТМ, Рыжкова ОВ, Синьков АВ. Гранулематоз с полиангиитом, осложненный поражением придаточного аппарата глаза и сосудистыми изменениями сетчатки и хориоидеи (обзор литературы с клиническим случаем). Acta Biomedica Scientifica. 2024;9(2):172-182. https://doi.org/10.29413/ABS.2024-9.2.17.
- Tugal-Tutkun I. Systemic vasculitis and the eye. Curr Opin Rheumatol. 2017;29(1):24-32. https://doi.org/10.1097/BOR.0000000000000345.
- Hibino M, Kondo T. Dacryoadenitis with ptosis and diplopia as the initial presentation of granulomatosis with polyangiitis. Intern Med. 2017;56(19):2649-2653. https://doi.org/10.2169/internalmedicine.
- Исмаилова ДС, Абрамова ЮВ, Новиков ПИ, Груша ЯО, Лазарчук АВ. Методика ранней диагностики рецидивов у пациентов с поражением орбиты при гранулематозе с полиангиитом (Вегенера). Офтальмология. Восточная Европа. 2023;13(2):141-150. https://doi.org/10.34883/PI.2023.13.2.016.
- Егорова ОН, Харламова ЕН, Тарасова ГМ. Дифференциальная диагностика локальной формы гранулематоза с полиангиитом: поражение органа зрения и органа слуха (часть 2). Современная ревматология. 2023;17(2):7-15. https://doi.org/10.14412/1996-7012-2023-2-7-15.



 1
1 2
2 3
3 4
4


Комментарии (0)